新型葡萄糖型-寡聚糖氨基酸的合成
王兆亚,王晓丽,田光宗,尹健
(江南大学 生物工程学院,江苏 无锡,214122)
新型葡萄糖型-寡聚糖氨基酸的合成
王兆亚,王晓丽,田光宗,尹健*
(江南大学 生物工程学院,江苏 无锡,214122)
糖氨基酸(sugar amino acids,SAAs)是一类广泛存在于自然界中的同时具有羧基和氨基的多功能骨架分子,其末端功能性基团的多样性为研究者提供了构建结构多样性天然类似物的可能。该文以一种简单、高效的方法合成了新型葡萄糖型-寡聚糖氨基酸。首先从葡萄糖型糖氨基酸1为起始原料,通过选择性正交保护氨基和羧基,合成了2种糖氨基酸砌块2和3。然后,利用液相肽偶联方法合成了以酰胺键连接的新型葡萄糖型-二聚糖氨基酸OSAA-1(产率67%)、三聚糖氨基酸OSAA-2(产率59%)和四聚糖氨基酸OSAA-3(产率46%)。所有合成的新化合物均经过IR、1H NMR、13C NMR和HRMS的表征。化学方法合成的寡聚糖氨基酸,是一种短肽模拟物,可用于制备纯度较高、稳定性较好的短链保健型肽制品。此外,经过调整合成策略可以合成抗氧化类的短肽,可作为功能性食品添加剂的潜在模拟物。
葡萄糖;寡聚糖氨基酸;肽偶联法;保健肽制品;食品添加剂
糖氨基酸(sugar amino acids, SAAs)是一类同时含有氨基和羧基官能团的糖类衍生物[1],具有糖和氨基酸的结构特征和化学反应特性,常作为多功能合成砌块用于组合化学的研究、糖模拟物和多肽模拟物的构建等[2]。
自然界中存在多种类型的SAAs及其衍生物,如唾液酸、氨基糖苷类抗生素等[3]。然而获得大量且比较纯的天然SAAs是相当困难的,因此,需要通过化学合成的方法合成一些天然类似物用于科学研究。对于SAAs的合成研究,最初是根据天然存在的SAAs分子结构信息,利用化学或生物方法合成相应的分子,然后根据其功能进行相应的应用。第一个合成SAA是2-氨基-2-脱氧-葡萄糖醛酸,由HEYNS和PAULSEN在1955年合成的,主要用于多肽的构建与合成[4]。随后,许多研究人员投入到非天然SAAs的合成研究中,并用它们来创建结构新颖的寡糖模拟物和多肽模拟物[5-6]。例如,FUCHS和LEHMANN报道了第1个合成的寡聚糖氨基酸,即以吡喃型糖氨基酸为砌块,采用液相肽偶联方法以酰胺键替换糖苷键获得的寡糖模拟物,并将其应用于抑制糖和蛋白质的相互作用,如糖基转移酶、糖苷酶和凝集素的抑制剂[7]。糖氨基酸类化合物同时含有氨基、羧基和羟基,而且糖环的种类和大小也具有多样性,因此,可以作为一类多功能基团的结构分子寡糖库,用于设计和修饰生物活性分子。如保护或脱保护糖环上的羟基可以改变天然活性肽类化合物的亲水性和疏水性的特性;通过糖环多羟基的修饰可以增加其亲脂性,使此类化合物更容易透过细胞膜。
寡糖作为一类重要的聚合物分子,其独特的生物学性能一直是科学家追求的方向,虽然化学合成法和酶法对寡糖的合成取得了一些进展[8-10],但寡糖合成中对糖苷键的控制仍然是一件非常困难的事情。而SAAs作为一类独特的构建砌块,相互之间以酰胺键聚合,所以我们可以利用液相合成的方法来制备预先设计的结构分子。由于SAAs寡聚物同时具有寡糖和多肽的某些特性,所以这类分子可能具有与寡糖相当或优于寡糖的特性,例如由于多肽骨架的改变,它们对糖苷酶比较敏感;由于与糖相似,因此可以抵抗一些蛋白酶的水解作用。鉴于此,目前国内外许多课题组正在利用SAAs作为合成单体来构建寡聚物分子库。
课题组前期设计合成了一种新型葡萄糖型-糖氨基酸化合物1(图1),因此,本文作者以1为合成基础,通过一种简单、高效的合成方法,设计合成了一类经酰胺键连接而成的寡糖模拟物分子。由于其不仅具有糖的相关性质而且具有多肽的某些特性,我们预测这类分子可能具有某些重要的生物学性能。
1 材料与方法
1.1 主要仪器与试验材料
1H NMR和13C NMR分别由AVANCE Ш 400型核磁共振仪在400 MHz和101 MHz测定,TMS为内标,高分辨质谱由MALDI SYNAPT MS型质谱仪测定。红外谱图由NICOLET NEXUS 470型红外光谱仪,KBr压片法测定。薄层层析(TLC)和柱层析分别使用山东青岛海洋化工厂生产的薄层层析硅胶GF254型硅胶和200~300目的柱层析硅胶。实验中所用原料均为商品试剂,未经进一步纯化。
1.2 寡聚糖氨基酸的合成方法
寡聚糖氨基酸的合成方法如图1所示,首先以1为起始原料,通过选择性正交保护氨基和羧基,合成了2种糖氨基酸砌块2和3。然后,采用“1+1”的策略,利用液相肽偶联方法合成以酰胺键连接的新型葡萄糖型-二聚糖氨基酸OSAA-1,然后对其反应条件进行优化以得到最优实验条件。最后,在最优反应条件下,采用“1+2”和“2+2”策略,获得三聚糖氨基酸OSAA-2和四聚糖氨基酸OSAA-3。
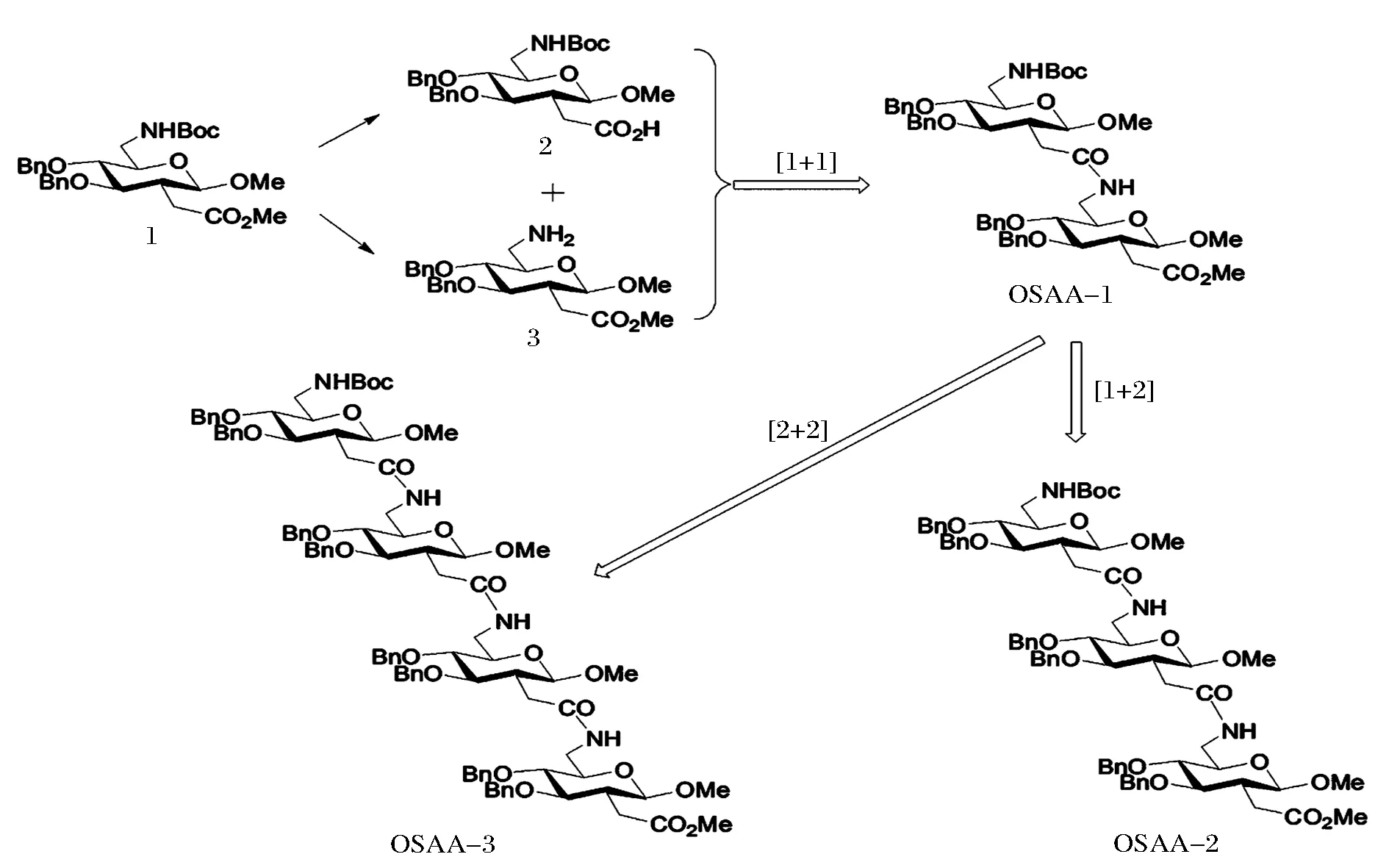
图1 新型寡聚糖氨基酸的设计思想Fig.1 Design idea of novel glucose-typeoligo-SAAs
2 新型葡萄糖型-寡聚糖氨基酸的合成
2.1 二聚糖氨基酸的合成及优化
新型葡萄糖型-二聚糖氨基酸的合成路线如图2所示。首先以先前得到的葡萄糖型糖氨基酸1为合成原料,取一部分1在一水合氢氧化锂(LiOH·H2O)碱性条件下脱除羧基保护基,得到未经纯化的粗品化合物2;取另一部分1在(三氟乙酸)(TFA)酸性条件下脱除氨基上的保护基团叔丁氧羰基(Boc)得到未经纯化的粗品化合物3;然后,2和3在c1反应条件[11]:焦碳酸二乙酯(DEPC),三乙胺(Et3N),N,N-二甲基甲酰胺(DMF)下反应,得到二聚糖氨基酸OSAA-1,产率较低,仅为35%。接下来,为了提高反应产率,我们经过文献调研,采用c2反应条件[12],1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI),Et3N, DMF,结果经TLC监测,没有产物生成。最后利用另外一种偶联试剂叠氮磷酸二苯酯(DPPA),在c3反应条件(DPPA, Et3N, DMF)下,以较高的产率(67%)得到二聚糖氨基酸OSAA-1(表1)。
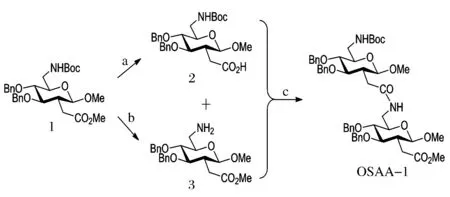
反应试剂和条件:(a) TFA/CH2Cl2(体积比3∶7), 0 ℃-RT; (b) LiOH·H2O, MeOH/H2O(体积比4∶1), reflux; (c) DPPA, Et3N, DMF, 0 ℃-RT图2 二聚糖氨基酸的合成路线Fig.2 Synthesis routes of dimer-SAA

编号反应条件实验结果(产率)c1DEPC,Et3N,DMF,12h35%c2EDCI,Et3N,DMF,12h不反应c3DPPA,Et3N,DMF,12h67%
2.2 三聚、四聚糖氨基酸的合成
三聚、四聚糖氨基酸的合成路线如图3所示。在最优反应条件c3下,采用“1+2”和“2+2”策略,获得三聚糖氨基酸OSAA-2和四聚糖氨基酸OSAA-3。以OSAA-1为合成原料,采用相同的反应条件a和b,得到脱除羧基保护基的化合物4和脱除氨基上的保护基的化合物5。最后,以3和4为合成砌块,通过“1+2”策略,获得三聚糖氨基酸OSAA-2(产率59%);以4和5为合成砌块,通过“2+2” 策略,获得四聚糖氨基酸OSAA-3(产率46%)。

反应试剂和条件:(a) LiOH·H2O, MeOH/H2O 体积比4∶1, 0 ℃-RT;(b) TFA/CH2Cl2 体积比3∶7, 0 ℃-RT; (c) DPPA, Et3N, DMF, 0 ℃-RT图3 葡萄糖型-三聚、四聚糖氨基酸的合成Fig.3 Synthesis of glucose-typeoligo-SAAs
3 实验部分
3.1 葡萄糖型-二聚糖氨基酸 (OSAA-1) 的合成
将化合物1 (588 mg, 1.1 mmol) 溶于MeOH和H2O的混合溶液 (MeOH 8 mL∶H2O 2 mL) 中,加入LiOH·H2O (465 mg, 11.1 mmol),回流搅拌反应2 h。TLC监测原料反应完全后,加H2O (10 mL) 稀释,用1 mol/L HCl溶液调节混合液pH至2,二氯甲烷(CH2Cl2) (3×50 mL) 萃取,合并有机相,H2O洗1遍,无水Na2SO4干燥,抽滤,滤液旋干后,高真空干燥,所得化合物2不需经过分离纯化,直接进行下一步反应。
将化合物1 (530 mg, 1.0 mmol) 溶于无水的CH2Cl2(10 mL) 中,反应温度降至0 ℃,然后加入TFA (3 mL),缓慢升至室温,搅拌反应2 h。TLC监测原料反应完全后,减压蒸馏,高真空干燥,所得化合物3不需经过分离纯化,直接进行下一步反应。
将上述脱除甲酯保护的2化合物溶于无水的DMF (5 mL) 中,反应温度降至0 ℃,依次加入Et3N (0.42 mL, 3.0 mmol) 和DPPA (0.32 mL, 1.5 mmol),搅拌反应10 min后,将上述脱除Boc保护的3化合物溶于无水的DMF (5 mL) 中,滴加入反应体系中,室温下搅拌反应12 h。TLC监测原料反应完全后,CH2Cl2(50 mL) 稀释溶解,经1 mol/L HCl溶液、饱和NaHCO3溶液、H2O以及饱和NaCl溶液洗涤,无水Na2SO4干燥,抽滤,滤液旋干后,所得粗品用硅胶柱层析纯化(V(PE)∶V(EA)=5∶1→2∶1)得到白色固体OSAA-1 (620 mg, 0.67 mmol, 67%)。Rf= 0.31 (V(PE)∶V(EA)=1∶1).1H NMR (600 MHz, Chloroform-d): δ 1.44 (s, 9H, Boc), 2.07 (ddq,J=12.6, 9.1, 7.2, 6.4, 2H, 2-H, 2’-H), 2.41 (dd,J=20.4, 5.3, 3H, 7-H, 7’-H, 7’’-H), 2.52 (dd,J=15.5, 5.2, 1H, 7’’’-H), 3.3-3.44 (m, 4H, 3-H, 4-H, 5-H), 3.45 (s, 3H, OMe), 3.49 (s, 3H, OMe), 3.56 (s, 3H, COOMe), 3.57-3.79 (m, 2H, 6-H, 6’-H), 4.27 (d,J=8.8, 1H, 1-H), 4.33 (d,J=8.7, 1H, 1’-H), 4.61 (d,J=11.0, 1H, Ph-CH2), 4.63-4.68 (m, 2H, Ph-CH2), 4.74 (d,J=10.5, 2H, Ph-CH), 4.77 (d,J=10.0, 1H, Ph-CH2), 4.96 (d,J=10.4, 2H, Ph-CH2), 5.93 (dd,J=7.3, 4.1, 1H, -NH), 7.2-7.41 (m, 20H, arom. H);13C NMR (151 MHz, Chloroform-d): δ 28.4, 31.7, 33.1, 39.4, 40.9, 44.9, 49.3, 51.5, 56.9, 57.1, 73.4, 73.8, 74.7, 74.9, 74.9, 75.0, 75.3, 79.3, 80.2, 80.2, 81.5, 81.7, 101.9, 103.4, 127.6, 127.7, 127.7, 127.9, 128.0, 128.3, 128.4, 128.4, 128.5, 128.5, 137.6, 137.8, 138.0, 138.2, 155.8, 171.1, 172.5; IR (KBr): ν = 3351, 2931, 1729, 1689, 1645, 1079, 740 cm-1; HRMS ESI-TOF:[M+Na]+calcd for C52H66N2O13Na, 949.4457; found, 949.4447。
3.2 葡萄糖型-三聚糖氨基酸 (OSAA-2) 的合成
将化合物OSAA-1 (210 mg, 0.27 mmol) 溶于MeOH和H2O的混合溶液 (MeOH 2.1 mL : H2O 0.7 mL) 中,加入LiOH·H2O (113 mg, 2.7 mmol),回流搅拌反应4 h。TLC监测原料反应完全后,加H2O (2 mL) 稀释,用1 mol/L HCl溶液调节混合液pH至2,CH2Cl2(3×10 mL) 萃取,合并有机相,水洗1遍,无水Na2SO4干燥,抽滤,滤液旋干后,高真空干燥,所得化合物4不需经过分离纯化,直接进行下一步反应。
将脱除Boc保护的化合物3溶于无水的DMF (1.5 mL) 中,反应温度降至0 ℃,依次加入Et3N (113 μL, 0.8 mmol) 和DPPA (90 μL,0.4 mmol),搅拌反应10 min后,将脱除甲酯保护的化合物4溶于无水的DMF (1.5 mL) 中,滴加入反应体系中,室温下搅拌反应15 h。TLC监测原料反应完全后,DCM (10 mL) 稀释溶解,经1 mol/L HCl溶液、饱和NaHCO3溶液、H2O以及饱和NaCl溶液洗涤,无水Na2SO4干燥,抽滤,滤液旋干后,所得粗品用硅胶柱层析纯化(V(CH2Cl2)∶V(MeOH)=200∶1→50∶1)得到白色固体OSAA-2 (218 mg, 0.16 mmol, 59%)。Rf= 0.64 (V(CH2Cl2)∶V(MeOH)=50∶1).1H NMR (400 MHz, Chloroform-d) δ 1.41 (s, 9H, Boc), 2.02 (dddt,J=14.9, 10.1, 8.1, 4.8, 3H, 2-H, 2’-H, 2’’-H), 2.50 (d,J=5.2, 6H, 7-H, 7’-H, 7’’-H), 3.30-3.39 (m, 7H, 3-H, 4-H, 5-H), 3.41 (s, 3H, OMe), 3.44 (s, 6H, OMe), 3.45-3.51 (m, 2H, 5-H, 6-H), 3.53 (s, 3H, COOMe), 3.57 (d,J=14.1, 1H, 6-H), 3.63-3.79 (m, 4H, 6-H), 4.24 (d,J=8.8, 1H, 1-H), 4.29 (d,J=9.7, 1H, 1’-H), 4.31 (d,J=8.7, 1H, 1’’-H), 4.54-4.65 (m, 4H, Ph-CH2), 4.67-4.72 (m, 4H, Ph-CH2), 4.84-4.94 (m, 4H, Ph-CH2), 5.86 (td,J=6.9, 4.0, 2H, -NH), 7.26 (s, 30H, arom.H).13C NMR (101 MHz, Chloroform-d) δ 28.4, 31.7, 33.0, 39.5, 39.7, 41.1, 44.8, 44.9, 44.9, 51.5, 56.8, 57.0, 73.5, 73.9, 74.7, 74.7, 74.8, 75.0, 75.0, 77.2, 79.3, 80.3, 80.4, 81.5, 81.6, 81.8, 103.4, 103.5, 127.6, 127.6, 127.7, 127.7, 127.8, 127.8, 127.9, 128.0, 128.3, 128.4, 128.5, 128.5, 128.5, 137.7, 137.8, 138.0, 138.1, 138.3, 138.4, 171.0, 171.1, 172.4; IR (KBr): ν = 3453, 2932, 1649, 1076, 697 cm-1; HRMS ESI-TOF:[M+Na]+calcd for C75H93N3O18Na, 1346.6352; found, 1346.6393。
3.3 葡萄糖型-四聚糖氨基酸 (OSAA-3) 的合成
将化合物OSAA-1 (330 mg, 0.36 mmol) 溶于MeOH和H2O的混合溶液 (MeOH 2.8 mL : H2O 0.7 mL) 中,加入LiOH·H2O (149 mg, 3.56 mmol),回流搅拌反应6 h。TLC监测原料反应完全后,加H2O (5 mL) 稀释,用1 M HCl溶液调节混合液pH至2,CH2Cl2(3×30 mL) 萃取,合并有机相,H2O洗1遍,无水Na2SO4干燥,抽滤,滤液旋干后,高真空干燥,所得产物不需经过分离纯化,直接进行下一步反应。
将脱除Boc保护的化合物5溶于无水的DMF (2 mL) 中,反应温度降至0 ℃,依次加入Et3N (0.15 mL, 1.0 mmol) 和DPPA (0.11 mL, 0.52 mmol),搅拌反应10 min后,将脱除甲酯保护的4化合物溶于无水的DMF (2 mL) 中,滴加入反应体系中,室温下搅拌反应18 h。TLC监测原料反应完全后,DCM (30 mL) 稀释溶解,经1 mol/L HCl溶液、饱和NaHCO3溶液、H2O以及饱和NaCl溶液洗涤,无水Na2SO4干燥,抽滤,滤液旋干后,所得的粗品用硅胶柱层析纯化(V(CH2Cl2)∶V(MeOH)=300∶1→10∶1)得到白色固体OSAA-3 (279 mg, 0.16 mmol, 46%)。Rf= 0.36 (V(CH2Cl2)∶V(MeOH)=50∶1). 1H NMR (600 MHz, Chloroform-d): δ 1.44 (s, 9H, Boc), 1.86 (s, 1H, 2-H), 2.05 (ddtt,J=22.7, 13.3, 8.8, 4.8, 3H, 2’-H, 2’’-H, 2’’’-H), 2.38 (pd,J=15.8, 5.4, 7H, 7-H), 2.51 (dd,J=15.5, 5.2, 1H, 7’-H), 3.25 (s, 4H, 3-H), 3.36 (d,J=3.6, 4H, 4-H), 3.44 (s, 3H, OMe), 3.46 (s, 3H, OMe), 3.47 (s, 9H, OMe, COOMe), 3.56 (s, 4H, 5-H), 3.65-3.80 (m, 6H, 6-H), 4.27 (d,J=8.6, 1H, 1-H), 4.33 (td,J=8.7, 4.9, 3H, 1’-H, 1’’-H, 1’’’-H), 4.61 (d,J=11.3, 1H, Ph-CH2), 4.65 (d,J=11.9, 3H, Ph-CH2), 4.69-4.80 (m, 5H, Ph-CH2), 4.93 (td,J=8.8, 4.6, 3H, Ph-CH2), 5.80-5.98 (m, 3H, -NH-), 7.22-7.40 (m, 40H, arom. H);13C NMR (151 MHz, Chloroform-d): δ 28.4, 31.6, 31.9, 32.9, 32.9, 39.3, 39.5, 40.9, 43.0, 44.8, 44.9, 51.5, 56.9, 57.1, 73.4, 73.8, 74.7, 74.7, 74.9, 75.0, 79.3, 80.1, 80.2, 80.4, 81.4, 81.5, 81.7, 99.7, 103.4, 103.4, 103.5, 127.5, 127.6, 127.7, 127.7, 127.7, 127.7, 127.8, 127.8, 127.9, 127.9, 128.0, 128.2, 128.3, 128.4, 128.4, 128.5, 128.5, 128.6, 128.6, 128.7, 137.6, 137.7, 137.8, 137.9, 138.0, 138.2, 138.2, 138.3, 155.8, 170.1, 171.1, 172.5, 172.9; IR (KBr): ν = 3280, 2971, 1645, 1079, 696 cm-1; HRMS ESI-TOF:[M+H]+calcd for C98H120N4O23H, 1721.8422; found, 1721.8550。
4 结论和讨论
通过用不同的偶联试剂分别实验,本文给出了一种简单、高效新型葡萄糖型-寡聚糖氨基酸的合成方法。后将获得的新型糖氨基酸通过正交保护的方法选择性保护其氨基和羧基,运用液相肽偶联方法得到二聚、三聚和四聚线型寡聚糖氨基酸。为进一步进行寡糖和糖肽的研究奠定了基础。现代营养学家认为人体摄入的蛋白质进入体内,经过消化道中的酶分解,大部分是以寡肽的形式被机体吸收,而最简单的氨基酸只占很少一部分,而且蛋白质以多肽的形式被机体吸收,也可以保证其生物学功能得到最大限度的体现,对于消化功能受损的人群尤其重要。我们合成的新型寡聚糖氨基酸的肽链经过合成策略的优化,可以制备纯度较高、稳定性较好的短链至中链的保健型肽制品,具有很大的发展前景。此外,经过调整合成策略可以合成抗氧化类的短肽,是抗氧化多肽和功能性食品添加剂的潜在良好模拟物。
[1] SOENGAS R G, FONTANELLA M, SANTOS J I, et al. Synthesis and conformational analysis of heterogeneous cyclic oligomers of 6-amino-6-deoxygalactonic acid and phenylalanine[J]. Eur J Org Chem, 2012, 2012(29): 5 701-5 711.
[2] DONDONI A, MARRA A. Methods for anomeric carbon-linked and fused sugar amino acid synthesis: the gateway to artificial glycopeptides[J]. Chem Rev, 2000, 100(12): 4 395-4 422.
[3] CHEN X, VARKI A. Advances in the biology and chemistry of sialic acids[J]. ACS Chem Biol, 2010, 5(2): 163-176.
[4] HEYNS K, PAULSEN H. Synthese der D-glucosaminuronsäure (2-amino-2-desoxy-D-glucuronsäure) und einigeihrer derivate[J]. Chem Ber, 1955, 88(2): 188-195.
[5] HER-VOELGER A, BORGES-GONZALLERZ J, CARRILLO R, et al. Synthesis and conformational analysis of cyclic homooligomers from pyranoid ε-sugar amino acids[J].Chem Eur J, 2014, 20(14): 4 007-4 022.
[6] GAJENDRS S, UTTAM G, SUDIP P, et al. βγ-fused turn structures in sugar amino acid (SAA) containing cyclic tetrapeptides with α3δ architecture[J].Tetrahedron, 2014, 70(42): 7 681-7 685.
[7] FUCHS E F, LEHMANN J. The synthesis of 5-amino-2, 6-anhydro-5-deoxy-D-glycero-D-gulo-heptonic acid and its polycondensation to oligomers[J]. J Carbohydr Res, 1976, 49: 267-273.
[8] SONG Z, HE X P, CHEN,G R, et al. 6-O-Amino-2-O-carboxymethyl glucopyranoside as novel glycoaminoxy acid building block for the construction of oligosaccharide mimetics[J]. Synthesis, 2011, 17: 2 761-2 766.
[9] SIMONE M I, EDWARDS A A, TRANTER G E, et al. C-3 branched δ-3, 5-cis- and trans-THF sugar amino acids: synthesis of the first generation of branched homooligomers[J]. Amino Acids, 2011, 41(3): 643-661.
[10] OVERKLEEFT H S, VERHELST S H L, PIETERMAN E, et al. Design and synthesis of a protein: Farnesyltransferase inhibitor based on sugar amino acids[J]. Tetrahedron Lett, 1999, 40(21): 4 103-4 106.
[11] SUHARA Y, KURIHARA M, KITTAKA A, et al. Efficient synthesis of carbopeptoid oligomers: insight into mimicry of β-peptide[J]. Tetrahedron, 2006, 62(34): 8 207-8 217.
[12] SIRIWARDENA A, PULUKURI K K, KANDIYAL P S, et al. Sugar-modified foldamers as conformationally defined and biologically distinct glycopeptide mimics[J]. Angew Chem Int Ed, 2013, 52(39): 10 221-10 226.
The synthesis of novel glucose-type oligo-(sugar amino acids)
WANG Zhao-ya, WANG Xiao-li, TIAN Guang-zong,YIN Jian*
(Jiangnan University, School of Biotechnology, Wuxi 214122, China)
Sugar amino acids (SAAs) are carbohydrate derivatives with amino groups, carboxylic acids as well as hydroxyl groups. These three functional groups provide an excellent opportunity for researchers to create structural diversities. We developed a convenient method for the synthesis of novel oligo-SAAs. First, SAAs building blocks 2 and 3 were obtained by simple reaction through selective orthogonally protecting amino and carboxylic acid functional groups of SAA 1. Then, three oligo-SAAs dimer-SAA (OSAA-1), trimer-SAA (OSAA-2) and tetramer-SAA (OSAA-3) were synthesized in solution using peptide coupling methods with 67%, 59% and 46% yield, respectively. All the new compounds were characterized by IR, 1H NMR, 13C NMR and HRMS data. The three oligo-SAAs are mimics of oligopeptides, which can produce high purity and good stability of short chain health peptides. Moreover, antioxidative oligopeptides could be prepared by changing the synthesis strategy, and they can be used as potential mimics of food additives.
glucose; oligo-(sugar amino acids); peptide coupling method; health peptides; food additives.
10.13995/j.cnki.11-1802/ts.201612012
硕士研究生(尹健教授为通讯作者,E-mail:jianyin@jiangnan.edu.cn)。
国家自然科学基金(21502071);江苏省自然科学基金青年基金(BK20140154)
2016-02-15,改回日期:2016-03-29

