带鱼肠道中抑菌性乳酸菌的筛选和抑菌效应分析
董韩博,谢晶,钱韻芳,刘永吉
(上海海洋大学 食品学院,上海水产品加工及贮藏工程技术研究中心,上海,201306)
带鱼肠道中抑菌性乳酸菌的筛选和抑菌效应分析
董韩博,谢晶*,钱韻芳,刘永吉
(上海海洋大学 食品学院,上海水产品加工及贮藏工程技术研究中心,上海,201306)
为寻找海产品源生理性状优良、抑菌效果明显的乳酸菌,采用牛津杯法以荧光假单胞菌(Pseudomonas fluorescens)和金黄色葡萄球菌(Staphyloccocus aureus)为指示菌,研究从带鱼肠道中初筛出的18株乳酸菌的抑菌效果,其中有6株乳酸菌抑菌效果明显,LB4、LB10、LB18、LBb1、LBb3属于肉食杆菌属,为Carnobacterium maltaromaticm,而LB1和Carnobacterium gallinarum有较高的同源性。以水产品中常见的腐败菌和致病菌检测这6株菌的抑菌谱,研究发现这6株菌对荧光假单胞菌(Pseudomonas fluorescens)、金黄色葡萄球菌(Staphyloccocus aureus)、肉食杆菌(Caronbacterium sp.)有明显的抑菌效果,但对腐败希瓦氏菌(Shewanella putrefaciens)、腐生葡萄球菌(Staphylococcus saprophytics)和大肠杆菌(Escherichia coli)的抑制效果不显著。研究中筛选到的带鱼肠道肉食杆菌属乳酸菌对水产品中部分常见的腐败菌和致病菌有明显的抑菌效果,可作为一种潜在的生物拮抗保鲜菌剂应用于水产品低温贮运过程中。
带鱼;肠道;抑菌活性;肉食杆菌;筛选
乳酸菌是目前广泛应用于食品,被普遍认为安全的一类微生物(generally recognized as safety, GRAS)。近几年来作为一种新颖的微生物源生物保鲜剂,乳酸菌的应用价值引起公众广泛的关注,其在代谢过程中能够产生乳酸、苯乳酸、环二肽、H2O2、抗菌肽等物质,能明显抑制铜绿假单胞菌(Pseudomonas aeruginosa)、单增李斯特菌(Listeria monocytogenes)、金黄色葡萄球菌(Staphyloccocus aureus)等水产品中常见腐败菌和致病菌的生长繁殖[1-2]。鉴于乳酸菌产生的抗菌物质天然、强抗菌性、安全等特点[3],开发其为微生物源生物保鲜菌剂具有潜在优势。目前国内乳酸菌的筛选来源主要为陆生生物、腌菜、牛奶等,从海生生物中筛选乳酸菌的研究较少,SOLTANI等[4]通过生理生化和16S rRNA分子生物学分析从波斯鲟肠道中分离得到的47株乳酸菌,其中乳球菌属是优势乳酸菌,包括格式乳球菌和乳酸乳球菌,其他还有戊糖片球菌、粪肠球菌等。海生生物与陆生生物相比,由于生活环境的差异,两者具有许多不同的生理特性,进而其肠道内微生物的代谢途径不同,因此探索和发现海生生物肠道中作用独特、效果良好的产抗菌物质的乳酸菌源,以应用于水产品低温贮藏运输方面,具有很广阔的市场应用前景[5]。
带鱼(Trichiurus haumela)是中国最重要的海洋经济鱼种之一,肉质细腻、味道鲜美,具有很高的营养价值[6]。由于营养丰富,在运输和贮藏加工过程中,很容易引起腐败变质。其中腐败希瓦氏菌、荧光假单胞菌和腐生葡萄球菌等是引起带鱼腐败变质的主要腐败菌[7]。目前,添加食品防腐剂是降低微生物和酶活性、延长水产品保质期的重要途径之一,但是人工合成的防腐剂不仅对水产品的风味、品质带来不良影响,并且可能随水产品一起被人体摄取,而过量摄入可能会对人体健康产生不良影响。乳酸菌是一类国际公认安全微生物及欧盟认定的具有安全推广资质微生物,具有潜在的抑菌保鲜功能,在天然防腐的商业领域具有巨大的开发潜力[1,2,8]。然而以乳酸菌作为生物拮抗保鲜剂应用在水产品保鲜中的研究还鲜有报道。本实验以带鱼肠道为来源筛选乳酸菌,并研究其抑菌效果和抑菌谱,为开发新型耐低温乳酸菌保鲜剂提供研究思路和理论依据。
1 材料和方法
1.1 材料
1.1.1 样品和菌株
鲜带鱼:2015年7月、10月购于上海市浦东新区芦潮港码头水产市场,捕获后立即冰藏条件下30 min内送到实验室进行实验。解剖时体表完好,肠道完整,无明显食糜。
指示菌株:革兰氏阳性菌:金黄色葡萄球菌(Staphyloccocus aureus)、肉食杆菌(Caronbacterium sp.);革兰氏阴性菌:腐败希瓦氏菌(Shewanellu putrefaciens)、荧光假单胞菌(Pseudomonas fluorescens)、大肠杆菌(Escherichia coli),均为本实验室保存。
培养基:MRS固体培养基、MRS肉汤、TSB培养基、TSA培养基、TSB-YE培养基。
1.1.2 主要试剂和药品
革兰氏染色液试剂盒,青岛海博生物技术有限公司;细菌DNA基因组提取试剂盒,青岛海博生物技术有限公司;过氧化氢,青岛海博生物技术有限公司;常规生化鉴定管,青岛海博生物技术有限公司;溴甲酚紫;引物由上海生物工程有限公司合成。
1.2 实验方法
1.2.1 乳酸菌的分离
带鱼肠道的处理:无菌取带鱼肠道,用无菌手术剪刀充分剪碎,加入含有5 mL的生理盐水和玻璃珠的50 mL的锥形瓶中,摇床振荡30 min混匀,静止一段时间,制成原液,吸取1 mL用作梯度稀释。
乳酸菌的分离:取原液和10-1,10-2二个稀释梯度涂布于添加了溴甲酚紫的MRS固体培养基中,每个稀释度涂布4个平板,分别在有氧和无氧条件下,30 ℃培养72 h,挑取能够使平板由紫色变为黄色的单菌落,在MRS平板和TSA平板上划线分离,传代划线培养3~4次直至纯化。对每株菌进行革兰氏染色和过氧化氢酶试验后,选择革兰氏阳性、过氧化氢酶阴性菌株,-20 ℃保存。
1.2.2 抑菌性乳酸菌的初筛
采用牛津杯法初步筛选具有抑菌活性的乳酸菌[9-10]。将活化后菌种以2%接种量接种于TSB-YE液体培养基中,在30 ℃下静止培养32 h。接2 mL发酵液12 000 r/min离心10 min,取上清液4 ℃保存,备用。在TSB液体培养基中分别接种荧光假单胞菌、金黄色葡萄球菌,30 ℃过夜培养。取1 mL培养液梯度稀释,取500 μL稀释度为10-3的菌液均匀涂布在TSA平板中,再在无菌条件下将牛津杯(内径为6 mm,外径为8 mm)均匀放置在平板上,稍微轻轻下压,使其与平板培养基接触面无空隙,然后吸取0.2 mL发酵液于杯中,30 ℃培养24 h,观察其是否有抑菌圈,明确其抑菌能力。
1.2.3 活性菌株的抗菌谱作用
以水产品中常见的致病菌和腐败菌:腐败希瓦氏菌、荧光假单胞菌、大肠杆菌、金黄色葡萄球菌等为指示菌,通过牛津杯法检测活性菌株的抑菌作用,方法参考1.2.2。
1.2.4 活性菌株的生理生化鉴定
参照凌代文[11]主编的《乳酸菌分类鉴定和实验方法》中的生理生化实验,对所获得的活性菌株进行生理生化实验以鉴定其种属。
1.2.5 活性菌株的分子生物学鉴定和分析
DNA的提取:将活性菌株用TSB液体培养基活化两次,用液体培养基培养到对数期。用细菌基因组DNA提取试剂盒提取纯化菌种的DNA,提出后的DNA,放置-20 ℃备用。
乳酸菌16S rDNA的PCR扩增与测序:以提取的细菌基因组DNA为模板,利用扩增细菌16S rDNA的通用引物27f(5′-AGAGTTTGATCCTGGCTCAG)和1492r(5′-CTACGGCTACCTTGTTACGA),对乳酸菌的16S rDNA进行PCR扩增程序为:94 ℃预变性4 min;然后94 ℃变性45 s、56 ℃退火1 min、72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR产物经过琼脂糖凝胶电泳检测验证后,将目标条带进行纯化后送生物生工工程(上海)有限公司进行测序[11]。
活性菌株的同源性分析:将所得序列在GenBank数据库中进行BLAST同源性比对分析。
2 结果和分析
2.1 乳酸菌的分离与纯化
从带鱼肠道中共分离得到26株乳酸菌疑似菌株(如图1所示),然后分别采用MRS平板和TSA平板对26株菌进行划线分离纯化,获得纯化的乳酸菌疑似菌株。对分离得到的疑似乳酸菌进行编号:LB1~LB18,LBb1~LBb9。经过革兰氏染色和过氧化氢酶试验,其中18株疑似乳酸菌接触酶实验阴性、革兰氏染色实验呈现阳性,其中革兰氏染色结果:16株杆菌(88.9%),2株球菌(11.1%),杆菌占主导地位,排列方式为单个、成对或短链(表1)。为进一步地筛选活性菌株,对这18株菌进行下一步抑菌活性筛选实验。

图1 含溴甲酚紫MRS平板筛选疑似乳酸菌Fig.1 Screening and isolating the suspected lactic acid bacteria by the method of the MRS plate with bromocresol purple

菌株编号菌落形态镜检结果LB1白色光滑、扁平、边缘整齐、圆形φ=1~3mmG+杆菌LB3乳白色、边缘整齐、凸起有光泽、圆形φ=1~2mmG+杆菌LB4白色透明、有光泽、圆形φ=1~3mmG+杆菌LB9黄色光滑凸起、有光泽、圆形φ=1~2mmG+杆菌LB10灰白色光滑凸起、有光泽、圆形φ=1~25mmG+杆菌LB11乳白色光滑、边缘整齐、有光泽、圆形φ=3~4mmG+杆菌LB12乳白色光滑、有光泽、圆形φ=2~3mmG+杆菌LB13白色光滑凸起、有光泽、透明、不规则圆形φ=2~3mmG+杆菌LB16灰白色凸起、边缘整齐、圆形φ=1~2mmG+杆菌LB17白色光滑凸起、有光泽、边缘整齐φ=4~5mmG+杆菌LB18白色圆形、有光泽、透明、边缘整齐φ=1~25mmG+杆菌LBb1白色光滑凸起、整齐、透明、不规则圆形φ=1~3mmG+杆菌LBb2灰白色光滑、透明、边缘整齐φ=1~2mmG+杆菌LBb3乳白色光滑、边缘整齐、有光泽φ=1~3mmG+杆菌
2.2 抑菌活性疑似乳酸菌的筛选
从18株乳酸菌中初步筛选有抑菌活性的菌株。如图2所示。18株菌中大部分疑似乳酸菌对金黄色葡萄球菌(S. aureu)有明显的抑菌效果,对荧光假单胞菌(P. fluorescens)的抑菌效果微弱。其中6株乳酸菌株LB1、LB4、LB10、LB18、LBb1、LBb3对荧光假单胞菌(P. fluorescens)和金黄色葡萄球菌(S. aureu)都具有明显的抑制效果,其中以LB1的抑制效果最为明显。
2.3 具有抑菌活力疑似乳酸菌的鉴定
2.3.1 生理生化鉴定
根据凌代文的《乳酸菌分类鉴定和实验方法》,确定对水产品中常见腐败菌有明显抑菌效果的LB1、LB4、LB10、LB18、LBb2、LBb3这6株乳酸菌的种属关系。这6株菌在MRS平板上菌落微小,生长不良,在TSB平板上生长良好,结合部分生理生化实验初步判定这6株菌属于肉食杆菌属,LB10为游动肉食杆菌(Caronbacterium mobile),其他5种菌株为鱼肉食杆菌(Caronbacterium piscicola),见表2。
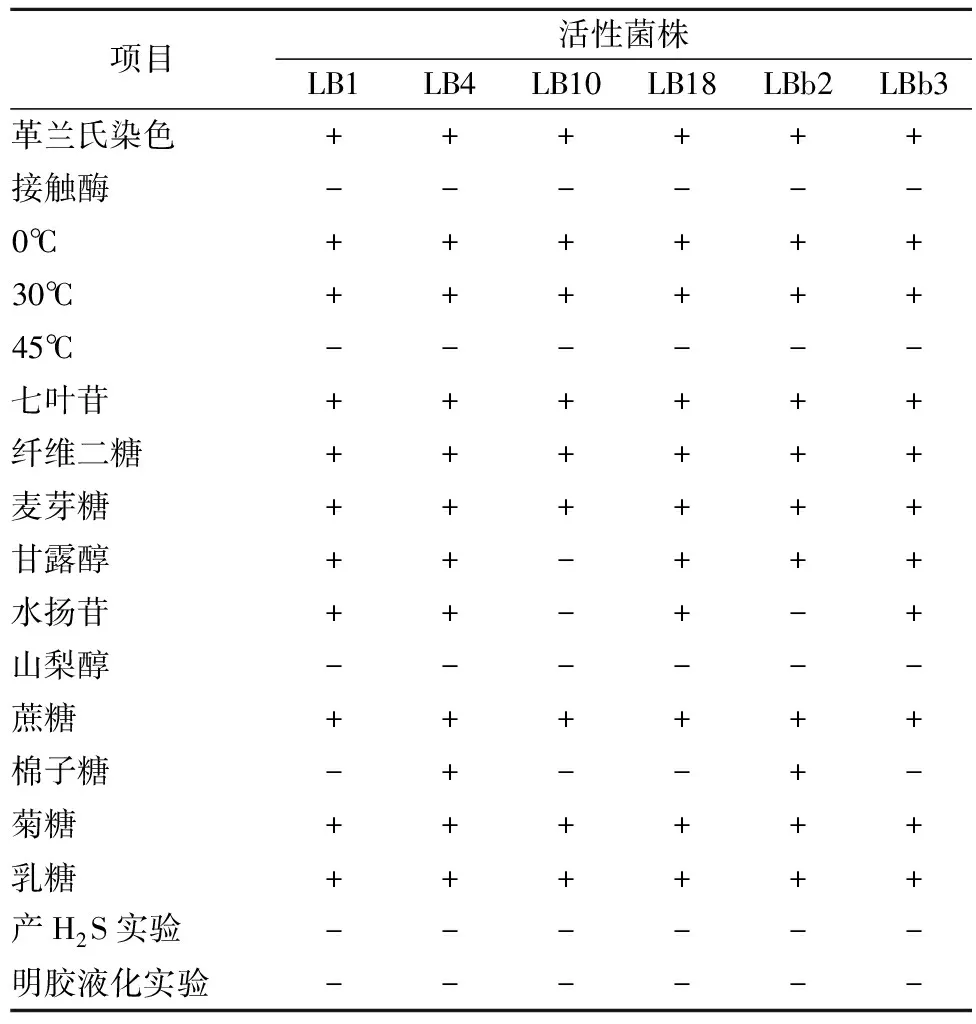
表2 生理生化鉴定结果
2.3.2 16S rRNA分子生物学鉴定和同源性分析
根据以上抑菌活性菌株初筛结果,选取对水产品中腐败菌有明显抑菌能力的疑似乳酸菌株LB1、LB4、LB10、LB18、LBb1、LBb3等进行16S rRNA分子鉴定。图3为6株疑似菌株的16S rDNA扩增产物经琼脂糖凝胶电泳检测结果。从图3中可以观察到,该6株菌在1 500 bp均出现了1条荧光亮带,并且无明显拖尾现象,符合测序要求。
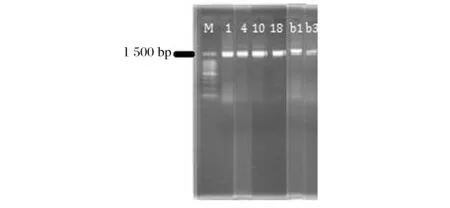
图3 部分疑似乳酸菌株16S rRNA PCR扩增图谱Fig.3 16S rRNA amplification patterns of the suspected Lactic acid bacteria
测序结果及相似性观察。登录NCBI(http://www.ncbi.nlm.nih.gov/)官网,选取明显抑菌效果的LB1、LB4、LB10、LB18、LBb1、LBb3等6种菌株的16S rRNA测序结果与数据库进行BLAST同源性相似分析,比对结果显示LB4、LB10、LB18、LBb1、LBb3和Carnobacterium maltaromaticm有99%的同源性,而LBb1和Carnobacterium gallinarum有99%的同源性。从GenBank中选取有代表菌株的16S rDNA序列,用N-J法进行系统发育树分析(图4),确定这6株具有明显抑菌效果的菌属分类。LB4和Carnobacterium maltaromaticm LMA28处于同一个分支上面,LB4、LB10、LB18、LBb1、LBb3和Carnobacterium maltaromaticm有较高的相似性,因此这5株菌可能是同一种菌株。赵鸭美等[13]研究水产品肠道中乳酸菌的抑菌特性时,采用牛津杯法以金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌等为指示菌,抑菌活性菌株中乳球菌属、肠球菌属占主导地位,分别占41.9%、27.9%。但是本研究筛选出的抑菌性菌株主要为肉食杆菌属。
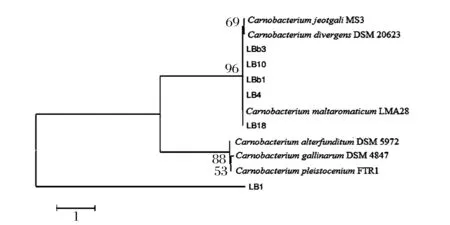
图4 菌株LB1、LB4、LB10、LB18、LBb2、LBb3依据16S rDNA序列构建的系统发育树Fig.4 Phylogenetic tree of LB1,LB4,LB10,LB18,LBb2,LBb3 constructed based on 16S rDNA sequence analysis
2.4 活性菌株的抑菌谱作用
本研究又进一步检测了从带鱼肠道中得到的6株抑菌活性菌株对水产品中部分主要腐败菌的抑制效果。由下表3可知,乳酸菌对不同的指示菌有不同程度的抑制效果。6株属于肉食杆菌属的LB1、LB4、LB10、LB18、LBb2、LBb3对水产品中的常见腐败菌荧光假单胞菌(P. fluorescens)、金黄色葡萄球菌(S. aureus)、肉食杆菌(Caronbacterium sp.)等具有明显的抑制效果,LB1的抑菌活性最为显著,而对腐败希瓦氏菌(S. putrefaciens)、大肠杆菌(E. coli)、腐生葡萄球菌(Staph. saprophytics)抑制效果不明显,与RING等[14]的研究结果相似。
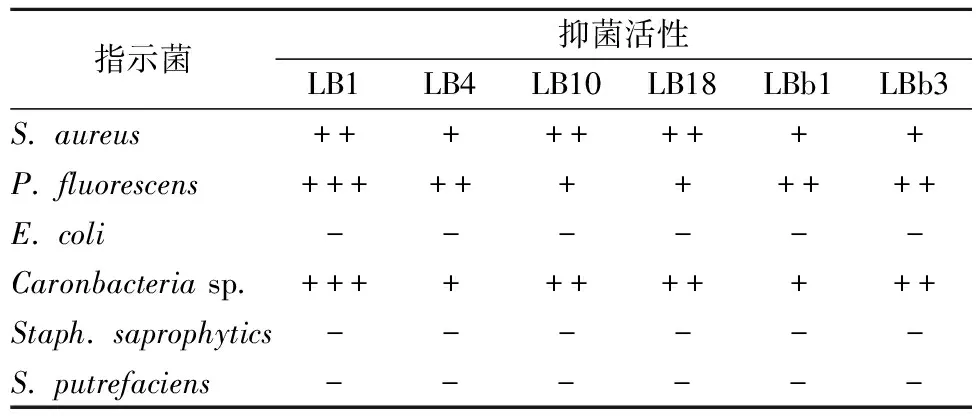
表3 株疑似乳酸菌的抗菌活性
注:牛津杯内径 6.0 mm外径 8.0 mm; +++:抑菌圈直径﹥20 mm;++:抑菌圈直径:14~20 mm;+:抑菌圈直径:<14 mm;-:无抑菌活性
3 讨论
3.1 水产品肠道肉食杆菌的分离
乳酸菌往往被认为是水产品的亚优势种群,种类丰富。从水产品肠道中分离乳酸菌,国内外有很多报道,缪璐欢等[15]从鲤鱼、草鱼等6种淡水鱼肠道中分离到44株乳酸菌,采用牛津杯打孔法以大肠杆菌为指示菌筛选出两株拮抗活性较强的2株乳酸菌,经生理生化和分子生物学鉴定为清酒乳杆菌(Lb. sakei)和植物乳杆菌(Lb. Plantarum)。邓梅等[16]研究新疆冷水鱼肠道耐低温乳酸菌的多样性时,从新疆冷水鱼中筛选出43株疑似乳酸菌株,经过16S rRNA分子生物学分析,其中肠球菌属是优势菌属占总菌数比例最大。RING等[14]从大西洋鲑鱼、嘉鱼等四种鱼肠道中筛选出11株乳酸菌株,经过表型分析和16S rRNA分析鉴定,其中7株为肉食杆菌属中的C. piscicola,3株为C. divergens,并且分析了它们对水产品致病菌的抗菌特性。肉食杆菌能够产生许多有效拮抗水产品中腐败菌和致病菌的I-类抗菌肽和II-抗菌肽。但国内关于水产品中分离筛选有抑菌效果的肉食杆菌的研究还较少。本实验2次从带鱼肠道中共筛选出26株疑似乳酸菌株,以荧光假单胞菌和金黄色葡萄球菌为指示菌初筛出18株有一定抑制效果的疑似乳酸菌,根据16S rRNA分子鉴定结果,其中肉食杆菌属占主导,还包括乳球菌属、肠球菌属等。不同水产品中分离到的优势乳酸菌菌属存在差异,这可能与品种及目标鱼种生长环境(带鱼)有关[14-15]。
3.2 肉食杆菌的抗菌特性
耐低温的乳酸菌在低温储藏条件下有更好的生长活性,能够产生有明显抑菌效果的抗菌肽,在食品的低温保藏中具有很广的应用前景[17-19]。MARTIN等[20]研究表明,Carnobacterium maltaromaticum UAL307的发酵液对一些革兰氏阳性菌如金黄色葡萄球菌、李斯特菌属等有不同程度的抑制,试验中表示其主要有效成分为IIa类细菌素,其中2种被称为piscicolin 126和carnobacteriocin BM1。TULINI等[21]研究从鱼中筛选出的Carnobacterium maltaromaticum C2所产的抗菌肽的提纯和特征描述时,所获得的肉食杆菌素和肉食细菌溶素能够有效地抑制Pseudomonas aeruginosa ATCC 14502、Staphylococcus aureus ATCC 29213和Listeria innocua ATCC 33090等腐败菌和致病菌的生长。
本文研究了带鱼肠道源乳酸菌的抑菌活性和抑菌谱,从筛选出的26株疑似乳酸菌中共分离到6株具有明显抑菌活性的菌株: LB1、LB4、LB10、LB18、LBb2、LBb3。通过部分生理生化实验可以初步判断LB10为游动肉食杆菌(Caronbacterium mobile),其他5种菌株为鱼肉食杆菌(Caronbacterium piscicola)。经16S rRNA分子鉴定和同源性相似分析结果,LB4、LB10、LB18、LBb1、LBb3和Carnobacterium maltaromaticm有99%的同源性,而LBb1和Carnobacterium gallinarum有99%的同源性。分子鉴定结果和生理生化结果存在一定的差异,根据细菌鉴定原则,当分类鉴定出现差异时,以分子鉴定结果为主,形态、生理生化鉴定结果为辅[22]。6株菌对荧光假单胞菌(P. fluorescens)、金黄色葡萄球菌(S. aureus)、肉食杆菌(Caronbacterium sp.)有明显的抑菌效果;对腐败希瓦氏菌(S. Putrefaciens)、腐生葡萄球菌(Staph. saprophytics)等没有明显的抑菌效果,其中LB1的抑菌效果更好。因此筛选出能够具有明显抑菌效果的耐低温乳酸菌应用于生物保鲜是一种必要。肉食杆菌能够在0 ℃生长,最适宜的生长温度为25~30 ℃,能够产生抑制水产品中常见致病菌和腐败菌的抑菌物质,可作为潜在有效的乳酸菌拮抗保鲜剂。
[1] CHAHAD O B, BOUR M E, CALOl-MATA P, et al. Discovery of novel biopreservation agents with inhibitory effects on growth of food-borne pathogens and their application to seafood products[J]. Research in Microbiology, 2012, 163(1): 44-54.
[2] GAO Y R, Li D P, LIN S, ZHANG L Y. Garviecin LG34, a novel bacteriocin produced byLactococcusgarvieaeisolated from traditional Chinese fermented cucumber[J]. Food Control, 2015, 50: 896-900.
[3] 吴渊. 乳酸菌发酵应用于水产防腐[D]. 杭州:浙江大学, 2014:10-16.
[4] SOLTANI M, POURKAZENI M, AHMADI M R, et al. Genetic diversity of lactic acid bacteria in the intestine of Persian sturgeon fingerlings[J]. Journal of Applied Ichthyology, 2013, 29(3) : 494-498.
[5] 张明月.DGGE用于两种不同类型生境的微生物群落结构的研究[D]. 上海:上海海洋大学, 2012:1-16.
[6] 鲁珺. 液氮深冷速冻对带鱼和银鲳品质及其肌肉组织的影响[D].杭州:浙江大学,2015:7-8.
[7] 蓝蔚青,谢晶. 冷藏带鱼贮藏期间主要微生物动态变化的PCR-DGGE分析[J]. 食品工业科技,2012, 33(17): 118-122.
[8] 方芳. 产细菌素乳酸菌的筛选、细菌素的纯化及其特性研究[D].呼和浩特:内蒙古农业大学,2008:7-12.
[9] CASABURI A, MARTINO V D, FERRANTI P , et al. Technological properties and bacteriocins production byLactobacilluscurvatus54M16 and its use as starter culture for fermented sausage manufacture[J]. Food Control, 2016, 59: 31-45.
[10] 乔彬. 产抗菌肽乳源乳酸菌的筛选及定向培养[D].哈尔滨:东北农业大学,2012:17-18.
[11] 凌代文主编. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1998: 1-5.
[12] 杨吉霞,张利玲,蒋厚阳,贺稚非. 眉山泡菜中乳酸菌的分离鉴定[J]. 食品科学,2015,36(17):158-163.
[13] 赵鸭美,刘林,安静莹,等. 1株海洋乳酸菌的鉴定及生物学特性的初步研究[J]. 北京联合大学学报,2013,27(2):59-63.
[14] RING E, WESMAJERVI M S, BENDIKSEN H R, et al. Identification and characterization of carnobacteria isolated from fish intestine[J]. Systematic AND Applied Microbiology, 2001, 24 :183-191.
[15] 缪璐欢,杜静芳,马欢欢,吕欣然,等. 淡水鱼肠道中抗大肠杆菌O157:H7乳酸菌的筛选及抑菌作用研究[J]. 食品与发酵工业, 2015,41(10):7-13.
[16] 邓梅,王俊钢,高阳,倪永清. 耐低温肠球菌Enterococcussp.MB2-1产细菌素的生物学特性[J]. 食品科学,2013,34(19):170-175.
[17] 高阳. 新疆冷水鱼肠道耐低温乳酸菌分离鉴定及系统发育研究[D].石河子:石河子大学,2013:8-9.
[18] 马媛. 新疆冷水鱼肠道肠球菌、乳杆菌的分离筛选及生理学特性的研究[D].石河子:石河子大学,2014:1-8.
[19] 任士菊. 冷水鱼肠道乳酸菌多样性及产细菌素乳酸菌特性研究[D].石河子:石河子大学,2014:7-12.
[20] MARTIN-VISSCHER L A, BELKUM M J, Tsodikova S J, et al. Isolation and characterization of Carnocyclin A, a novel circular bacteriocin produced byCarnobacteriummaltaromaticumUAL307[J]. Applied and Environmental Microbiology, 2008,74((5):4 756-4 763.
[21] TULINI F L, LOHANS C T, BORDON K C F, et al. Purification and characterization of antimicrobial peptides from fish isolateCarnobacteriummaltaromaticumC2: Carnobacteriocin X and carnolysins A1 and A2[J]. International Journal of Food Microbiology, 2014, 173 :81-83.
[22] 樊哲新,李宝坤,李开雄,等. 传统分离培养结合DGGE技术研究新疆传统发酵酸驼乳中乳酸菌的多样性[J]. 中国食品学报,2015,15(4): 208-217.
Screening and identification of lactic acid bacteria with antibacterial activity derived fromTrichiurushaumelaintestine
DONG Han-bo, XIE Jing*, QIAN Yun-fang, LIU Yong-ji
(Shanghai Engineering Research Center of Aquatic Product Processing and Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
In order to obtain Lactic acid bacteria which may display antibacterial effects against the spoilage and pathogenic bacteria and can be used as preservatives for the preservation of aquatic products, six strains with significant antagonistic effects againstPseudomonasfluorescensandStaphyloccocusaureuswere isolated from eighteen suspected strains of lactic acid bacteria. Strains LB1, LB4 and LB18 were identified asCaronbacteriummaltaromaticm, while strains LB10, LBb1 and LBb3 had high similarities withCarnobacteriumgallinarumvia the physiological and biochemical analysis and 16S rRNA sequencing. The results of antibacterial spectrum showed that the six bacterial strains had obvious antagonistic effects against Pseudomonas fluorescens, Staphyloccocus aureus and Caronbacterium sp., but their antagonistic effect against Shewanella putrefaciens, Staphylococcus saprophytics and Escherichia coli were not obvious. Therefore, theCarnobacteriumspp. from theTrichiurushaumelaintestine has obvious antagonistic effects against the spoilage and pathogenic bacteria in aquatic products, which may be used as potential biological-source antagonistic preservatives during low-temperature storage and transportation of aquatic products.
Trichiurushaumela; intestine; antibacterial activity;Caronbacteriumsp.; screening
10.13995/j.cnki.11-1802/ts.201612006
硕士研究生(谢晶教授为通讯作者,E-mail:jxie@shou.edu.cn)。
2014年国家农业成果转化资金项目(2014GB2C000081);上海市科委平台能力提升项目(16DZ2280300)
2016-05-10,改回日期:2016-08-05

