酒精-沼气双发酵耦联工艺中酒精发酵生酸原因解析与控制
王柯,杨圣乾,张建华,毛忠贵
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
酒精-沼气双发酵耦联工艺中酒精发酵生酸原因解析与控制
王柯1, 2,杨圣乾1, 2,张建华1, 2,毛忠贵1, 2
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
在酒精-沼气双发酵耦联工艺中,将沼液和酒糟的混合水回用于酒精发酵过程,可有效解决传统酒精生产工艺存在的能耗大、废水处理成本高的问题。但是产业化应用中,该工艺会引起酒精发酵生酸较高。本文对造成这一问题的原因进行了研究,并探索了相应的解决方案。结果表明,沼液和酒糟混合、储存过程中,沼液中的产酸菌能够吸收利用酒糟中的营养物质快速生长并生成大量挥发性有机酸。产酸菌会对酿酒酵母产生竞争性抑制作用,而挥发性有机酸则会对酿酒酵母产生毒害作用。通过向沼液中加入适量的克菌灵可有效杀灭产酸菌,延缓混合水的酸化,从而消除对酒精发酵的影响。
酒精发酵;酿酒酵母;厌氧消化;挥发性有机酸;克菌灵
燃料乙醇作为一种可再生和环境友好型的生物质燃料,其产业在近几十年来得到了迅猛的发展[1]。但是燃料乙醇产业也面临着废水处理成本高的严峻挑战[2]。针对废水的处理,学者们展开了广泛的研究,其主要目标是同时实现废水中能量的回收和水的再利用,如废水直接回用、单细胞蛋白(SCP)/生物制品生产、耕地灌溉等等,但是这些技术存在着能耗大、处理不彻底等问题[3-6]。因此,目前生产上仍然主要采用“固液分离-厌氧消化-好氧消化-深度处理-排放”的处理工艺(图1a)。该工艺存在投资大、占地面积多、能耗高、浪费水资源且难以达到国家排放标准等问题,不仅影响了企业的经济效益,同时造成了严重的环境污染。为了解决废水处理这一难题,我们提出了“酒精-沼气双发酵耦联工艺”[7-8]。在该工艺中,首先利用厌氧消化工艺处理酒糟废水,该过程可将酒糟废水中的大部分有机物降解,降低废水化学需氧量(chemical oxygen demand,COD)并产生沼气。沼气供给高压锅炉替代煤炭,通过“热电联产”技术获得蒸汽和电力,回供于生产中的各个工序;处理后的沼液回用于酒精发酵过程,整体技术构成一个闭路循环工艺圈。该工艺可显著降低生产过程能源和水资源的消耗,避免废水的排放,消除污染。但是,沼液成分非常复杂,其中含有较多的有机物和无机盐,当其回用于酒精发酵时,可能会对酒精发酵产生负面影响。研究中发现,当沼液中含有较高浓度的丙酸时,酒精发酵受到明显的抑制[9]。因此,对于耦联工艺,需要保证厌氧消化的稳定高效运行,使沼液中丙酸的含量处于较低的水平。另外,由于沼液含有较高的碱度,即具有较强的缓冲能力。当其回用配料时,就需要添加硫酸以调节料液的pH至6.0(液化酶的最适pH),这就向酒精发酵培养基及后续的酒糟中引入了硫酸根离子。厌氧消化过程中硫酸盐会被硫酸盐还原菌还原为硫化氢,腐蚀反应器且增加沼气纯化成本,高浓度硫化氢还会毒害酿酒酵母,抑制酒精发酵[10]。为了解决这个问题,我们将部分酒糟(含有较低pH)与沼液混合,从而降低回用水的pH,避免了硫酸的使用(图1b)[11]。
该耦联工艺的可行性已在小试和中试水平上得到了验证,目前正在实际生产中试用。在实际应用中发现,酒精发酵的生酸幅度明显高于传统工艺(新鲜水配料),且酒精产率也有所降低。本研究对造成这一现象的原因进行了解析,并提出了相应的解决方案。
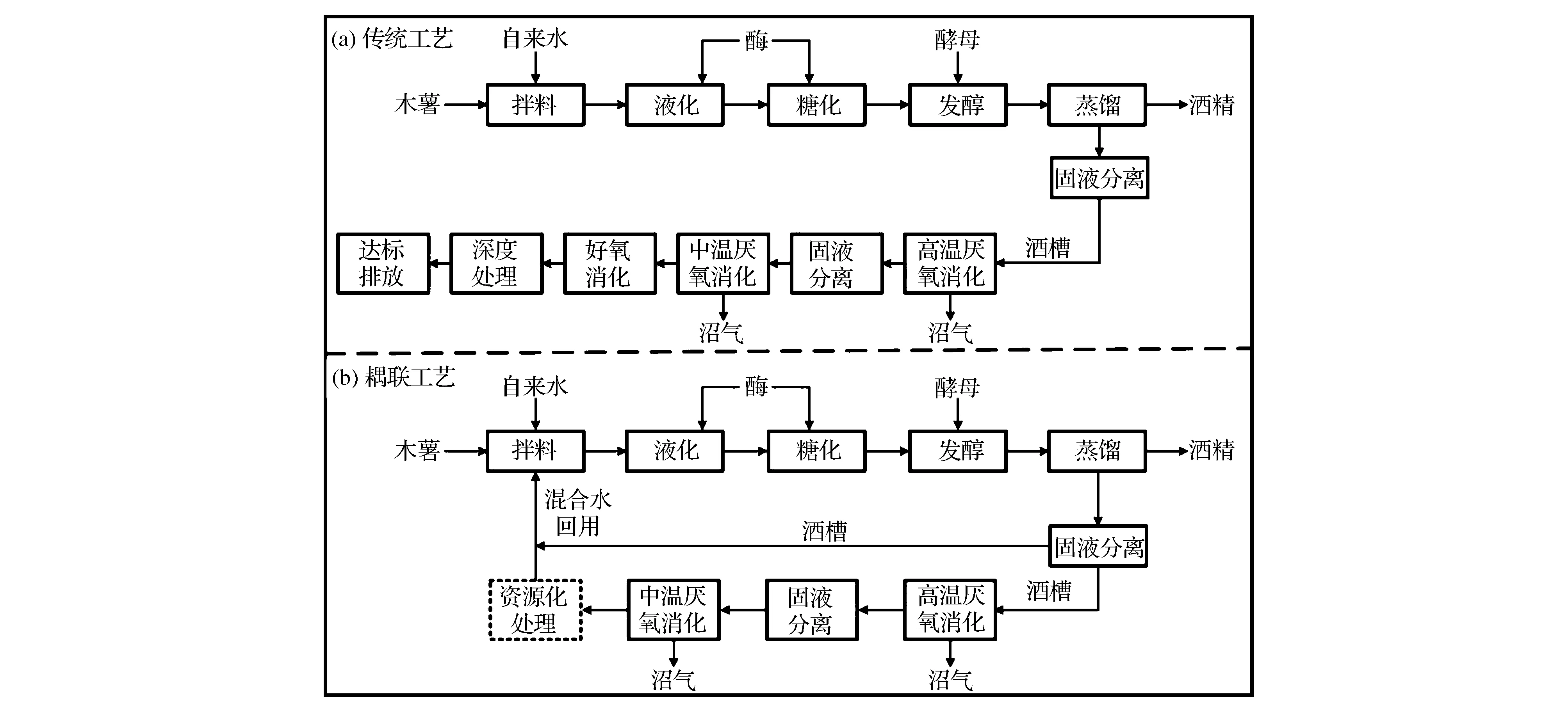
图1 传统木薯酒精干磨工艺(a)与酒精-沼气双发酵耦联生态系统(b)流程图Fig.1 Process diagrams of conventional cassava ethanol process(a) and integrated ethanol-methane fermentation ecosystem (b)
1 材料与方法
1.1 实验材料
酿酒酵母(S.cerevisiae),湖北宜昌安琪酵母有限公司;木薯,河南天冠企业集团有限公司;沼液和酒糟,河南天冠企业集团有限公司;α-淀粉酶(100 000 IU/mL)和糖化酶(10 000 IU/mL),无锡杰能科有限公司;其它试剂均为分析纯或优级纯市售商品。
1.2 实验方法
1.2.1 酒精发酵种子培养
种子培养基组成:葡萄糖(20 g/L),酵母膏(8.5 g/L),NH4Cl (1.3 g/L),MgSO4·7H2O (0.1 g/L),CaCl2(0.06 g/L),pH自然,0.08 MPa灭菌15 min。将酵母接种于含有200 mL种子培养基的500 mL三角瓶中,放于摇床上,100 r/min和30 ℃条件下培养18 h。
1.2.2 液化液制备与酒精发酵
将木薯粉(平均粒径约0.4 mm)和配料水按1∶3(g∶mL)的比例混合,用NaOH或H2SO4溶液调节料液pH至6.0,加入耐高温α-淀粉酶(10 IU/g木薯粉)后,将料液加热至95 ℃并维持1 h。然后降温至室温,添加去离子水弥补液化过程水分损失。121 ℃灭菌15 min。降温后加入尿素(0.05%,w/v)、糖化酶(130 IU/g木薯粉)和种子培养液(10%,v/v),启动发酵。发酵温在度控制30 ℃,发酵周期为48 h。定期测定CO2生成量(该方法用于丁酸对酒精发酵影响的研究)。
1.2.3 分析方法
乙酸、丙酸、丁酸、甘油、乳酸、乙醇采用高效液相色谱法(HPLC,Dionex,U-3000,USA)测定。色谱条件:Aminex HPX-87H色谱柱(300 mm×7.8 mm,9 μm,Hercules,CA);RI检测器(Shodex RI-101,Japan)和UV检测器(Dionex,USA);流动相为5 mmol/L H2SO4;柱温65 ℃;流速0.6 mL/min;进样量20 μL。样品预处理:发酵液离心(10 000×g,10 min)后,上清液经0.2 μm膜过滤,取滤液用于HPLC分析。酵母细胞数采用血球板计数法测定。采用SPSS Statistics 19(IBM,USA)进行方差分析(Fisher’s least significant difference,LSD),当P<0.05时认为差异显著。
2 结果与讨论
2.1 产业化中耦联工艺与传统工艺中酒精发酵生酸及酒精浓度对比
分别比较了传统工艺和耦联工艺条件下连续20批次的酒精发酵的酸度和酒精度。结果表明,与传统工艺比较,耦联工艺中酒精发酵结束后酸度较高,并且随着耦联工艺的进行酸度逐渐升高,而平均酒精度相对较低(图2)。通过对混合水储罐中混合水中挥发性有机酸(volatile fatty acids,VFAs)的跟踪监测发现,其浓度处于较高水平(图3)。这可能是由于混合水在储罐中存留的时间内,其中所含产酸菌(沼液和酒糟中都含有产酸菌)利用混合水中的营养物质进行生长繁殖,并产生VFAs。另外,随着工艺的持续进行,储罐的罐壁上会黏附产酸菌并不断增殖,使得混合水中VFAs的浓度不断增加。当这样的混合水用作酒精发酵配料水,其中的产酸菌就会对酿酒酵母产生竞争性抑制作用,而VFAs则会对酿酒酵母产生毒害作用。具体表现为,在低pH条件下,乙酸、丙酸等挥发性有机酸以未解离状态存在,他们通过细胞膜上Fps1p(一种水-甘油跨膜输送蛋白)介导的协助扩散方式进入酵母细胞[12]。在胞内高pH(接近中性)环境下,解离为相应的盐和质子,造成细胞质酸化,从而抑制胞内代谢反应[13]。另外致死浓度下,乙酸会引起胞内ROS积累,线粒体中细胞色素c释放,线粒体功能紊乱和细胞凋亡蛋白质活力增加,并最终导致细胞死亡(程序性细胞死亡)[14]。所以这些VFAs会进一步造成发酵污染杂菌、酸度升高及酒精度下降。
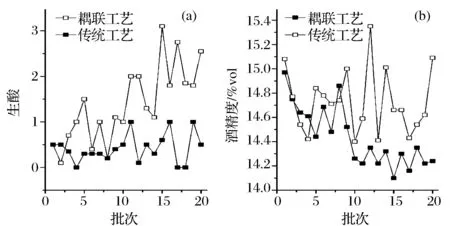
图2 不同工艺对酒精发酵生酸和酒精度的影响Fig.2 Effect of different process on the acidity and ethanol concentration in the ethanol fermentation
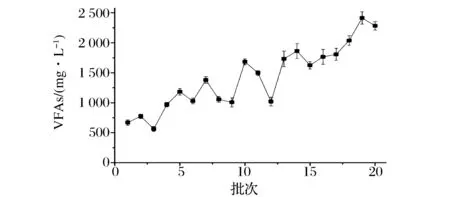
图3 耦联工艺运行过程中混合水中VFAs变化趋势Fig.3 VFAs concentrationsof the mixture in the integrated process
为了证明上述推测,分别取沼液和酒糟进行混合(60%沼液+40%酒糟,pH6.10),并将混合水在55 ℃水浴中保温(储罐内混合水温度约50~60 ℃),每隔2 h取样测定VFAs浓度。结果如图4所示。随着保温时间的延长,混合水中VFAs浓度呈现明显的上升趋势并在14 h时达到最大值(3 200 mg/L),是初始浓度的10倍以上。这一结果说明,混合水在储罐中存留的时间内,确实会有产酸菌的生长繁殖,并产生大量VFAs。

图4 保温过程混合水中VFAs变化趋势Fig.4 VFAs concentrations in the mixture during the heat preservation process
2.2 混合水酸化原因的探究
为了探究混合水酸化的原因,需要对产酸菌的来源以及其生长所需的营养来源进行检测。因此分别将沼液、酒糟和混合水置于55 ℃水浴中保温,每隔4 h取样检测,观察不同水样甘油和有机酸随时间变化趋势,结果如图5所示。在55 ℃水浴保温过程中,单独的沼液和酒糟不会产生VFAs,而对于混合水,在较短的时间内所含VFAs浓度迅速升高,平均生成速率达到了116.5 mg/(L·h),出现了明显的酸化现象(图5e)。造成这种现象的原因可能是沼液中含有产酸菌,但是缺乏其生长繁殖所需要的营养物质,而与酒糟混合后,酒糟为产酸菌提供了生长所需的营养物质。同时接近中性的pH以及50~60 ℃的环境条件有利于微生物的快速繁殖;另外也有可能是酒糟中含有杂菌(酒精发酵过程中不可避免会污染杂菌),但是酒糟较低的pH以及缺少氮源等条件抑制了杂菌的生长,当与沼液混合后为杂菌生长提供了适宜的条件,从而导致混合水酸化现象。当然,也有可能是两类菌共同作用的结果。从图5a和图5d可以看出,在混合水保温过程中,来源于酒糟中的甘油和乳酸浓度不断下降,说明酒糟中的甘油、乳酸等有机物可作为产酸菌生长所需的营养物质被消耗;另外在酒糟保温过程中乳酸浓度有所增加,说明酒糟仍然含有具有活性的产乳酸菌。由图5b和图5c可知,混合水酸化过程中主要的挥发性有机酸是乙酸和丁酸,在水浴保温4 h后乙酸和丁酸浓度开始增加,在16~28 h时丁酸占总挥发性有机酸含量的80%以上,说明丁酸是产生的最主要的挥发性有机酸。
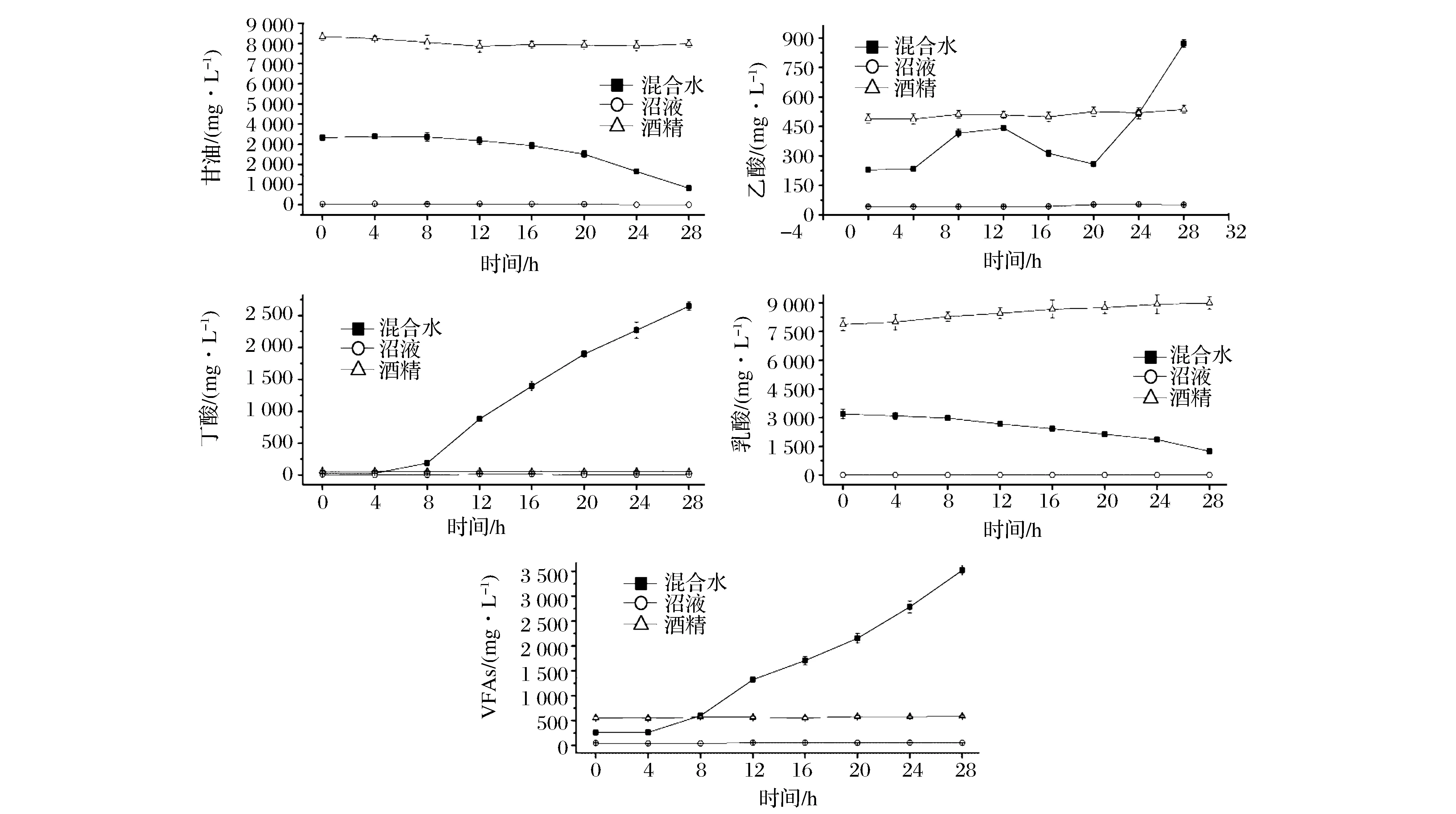
图5 保温过程混合水、沼液和酒糟中甘油和有机酸的变化Fig.5 Change of the glycerol and organic acids of the mixture, digestate and stillage during the heat preservation process
为了深入了解混合水酸化对酒精发酵的影响,研究了丁酸对酿酒酵母生长和代谢的影响。实验中,向配料水(自来水)中添加不同浓度的丁酸(0~2 000 mg/L),配制酒精发酵培养基,接种后进行酒精发酵。从图6可以看出,当丁酸浓度高于500 mg/L时,发酵速率和酵母细胞数都有明显下降,且随着丁酸浓度的增加,发酵结束后的酵母细胞数呈现出不断下降的趋势。
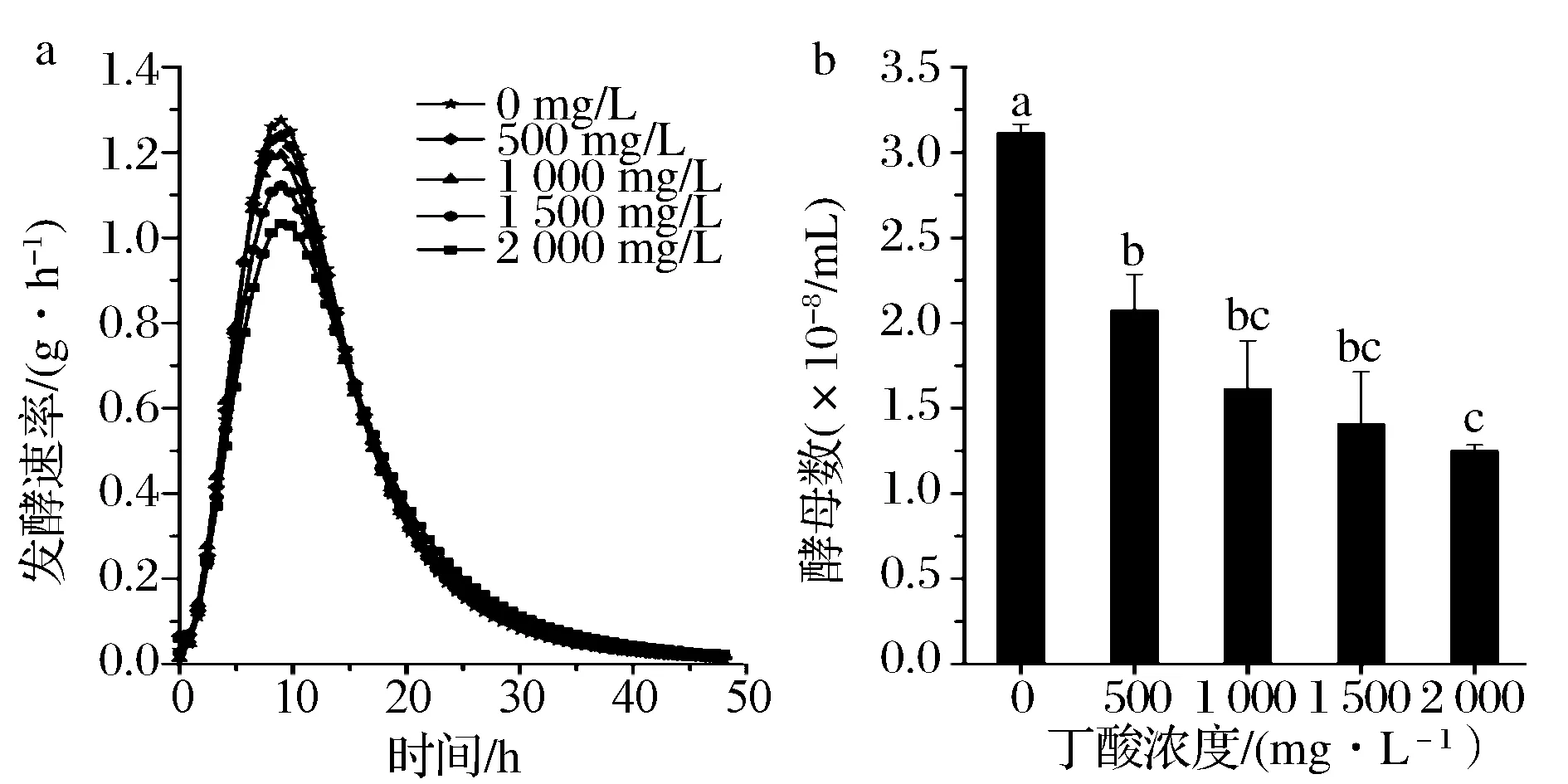
图6 丁酸对酒精发酵的影响(图b中不同的字母表示数值间有显著性差异)Fig.6 Effect of butyric acid on the ethanol fermentation (Different letters in Fig.b for the same indicator meant significant difference)
这说明丁酸可以显著抑制酿酒酵母的生长代谢,当然混合水中产生的乙酸也会对酿酒酵母产生一定的毒害作用。这也就说明酸化的混合水回用时,会抑制酿酒酵母的生长代谢,使得发酵液中杂菌表现出更强的生长优势,从而导致酒精发酵酸度升高,酒精产量下降。
为了查明产酸菌的来源,实验中分别将沼液和酒糟彻底灭菌(121 ℃,30 min),并配置不同的混合水(60%沼液+40%酒糟),即沼液+酒糟、灭菌沼液+酒糟、沼液+灭菌酒糟,将这些混合水在55 ℃水浴中保温,每隔4 h取样检测,观察不同水样中VFAs随时间变化趋势,实验结果如图7所示。由图7可以看出,在沼液未灭菌条件下混合水在保温过程中出现了VFAs浓度大幅度升高现象;沼液经灭菌后,混合水在水浴保温过程中没有出现VFAs累积现象,说明导致混合水酸化的产酸菌主要来源于沼液,而酒糟为这些产酸菌长提供了充足的营养物质。
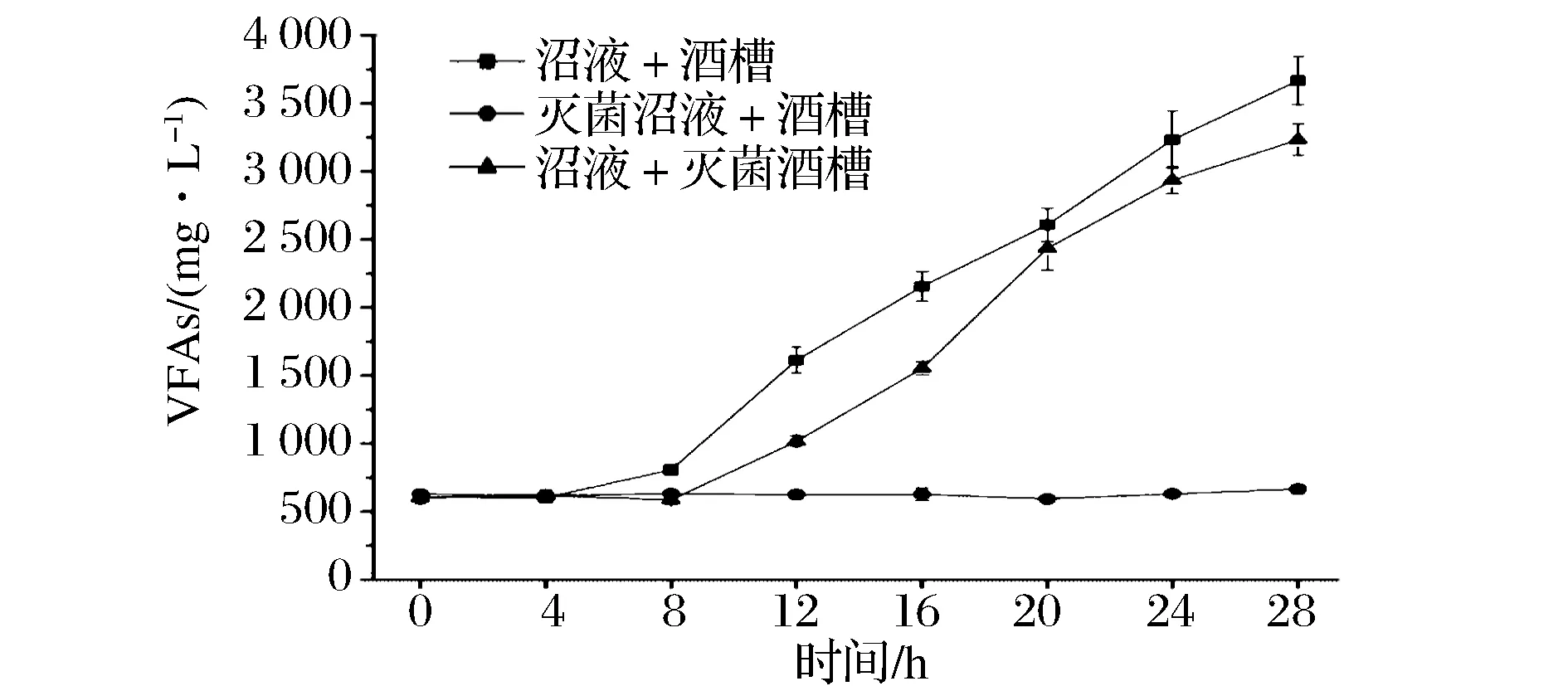
图7 不同配料水中VFAs在保温过程中的变化Fig.7 Change of theVFAs of different mixture during the heat preservation process
2.3 克菌灵对混合水酸化的抑制
在酒精生产过程中,克菌灵是常用的杀菌或抑菌剂。它是通过抑制细菌细胞壁的合成来发挥抑菌作用。细菌细胞壁的结构成分主要是胞壁粘肽,由N-乙酰葡萄糖胺和与五肽相连的N-乙酰胞壁酸重复交替联结而成。胞壁粘肽的合成分为胞浆内、胞浆膜与胞浆外3个阶段。克菌灵能阻碍直链十肽二糖聚合物在胞浆外的交叉联接过程。它的作用靶位是胞浆膜上的结合蛋白,通过抑制转肽酶的转太作用,从而阻碍交叉联接,阻碍细胞壁合成,导致细菌细胞壁缺损[15]。酵母细胞壁的主要成分是甘露聚糖、葡聚糖、蛋白质和几丁质,因而克菌灵不会抑制酵母细胞。所以实验中选择克菌灵来抑制混合水的酸化。
分别向沼液中加入0、3、6和9 mg/L的克菌灵,然后将沼液与酒糟(60%沼液+40%酒糟),混合水置于55 ℃水浴中保温,每隔4 h取样进行检测,观察混合水中VFAs变化情况,结果如图8所示。
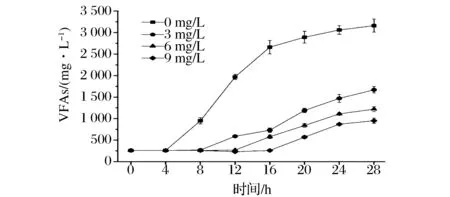
图8 克菌灵对混合水酸化的影响Fig.8 Effects of the Kejunling on the acidification of the mixture
克菌灵可延缓混合水酸化的时间,并且随着克菌灵浓度的增加,酸化的时间也不断增加。当克菌灵浓度为9 mg/L时,混合水出现酸化的时间已延长到16 h。说明克菌灵在一定时间内可有效抑制混合水中的酸化菌,防止混合水的酸化。但是超过一定时间后,混合水的酸化仍然不可避免的发生。因此,在实际生产中,在添加适量克菌灵的前提下,需要合理控制混合水在储罐中的停留时间,并定期对储罐及管道进行清洗消毒,以防止混合水的酸化。
3 结论
酒精-沼气双发酵耦联工艺在产业化应用中会造成酒精发酵生酸较高,酒精产率下降。造成这一问题的原因是沼液和酒糟在混合、储存的过程中,沼液中的产酸菌能够吸收利用酒糟中的营养物质(甘油、乳酸等)快速生长繁殖,并产生大量挥发性有机酸,这些有机酸以丁酸为主,而丁酸会显著抑制酿酒酵母的生长代谢。另外,产酸菌也会对酿酒酵母产生竞争性抑制作用。通过向沼液中添加适量的克菌灵可有效延缓混合水的酸化,通过控制混合水在储罐中的停留时间,并定期对储罐和管道进行清洗消毒,可防止混合水的酸化,并达到缓解酒精发酵升酸的目的。
[1] MUSSATTO S I, DRAGONE G, GUIMARES P M R, et al. Technological trends, global market, and challenges of bio-ethanol production[J]. Biotechnology Advances, 2010, 28(6): 817-830.
[2] HICKEY B, MOTYLEWSKI M.Sustainable alternatives for whole stillage management[M]. St. Louis: Fuel Ethanol Workshop, 2007.
[3] SZYMANOWSKA-POWALOWSKA D, LEWANDOWICZ G, KUBIAK P, et al.Stability of the process of simultaneous saccharification and fermentation of corn flour. The effect of structural changes of starch by stillage recycling and scaling up of the process[J]. Fuel, 2014, 119(119):328-334.
[5] BHATTACHARYYA A, SAHA J, HALDAR S, et al.Production of poly-3-(hydroxybutyrate-co-hydroxyvalerate) byHaloferaxmediterraneiusing rice-based ethanol stillage with simultaneous recovery and re-use of medium salts[J]. Extremophiles, 2014, 18(2): 463-470.
[6] WILKIE A C, RIEDESEL K J, OWENS J M. Stillage characterization and anaerobic treatment of ethanolstillage from conventional and cellulosic feedstocks[J]. Biomass and Bioenergy, 2000, 19:63-102.
[7] 毛忠贵, 张建华. 燃料乙醇制造的“零能耗零污染”趋势[J].生物工程学报, 2008, 24(6): 946-949.
[8] ZHANG C M, MAO Z G, WANG X, et al. Effective ethanol production by reutilizing waste distillage anaerobic digestion effluent in an integrated fermentation process coupled with both ethanol and methane fermentations[J]. Bioprocess Biosystem Engineering, 2010, 33(9):1 067-1 075.
[9] ZHANG C M, DU F G, WANG X, et al. Effect of propanoic acid on ethanol fermentation bySaccharomycescerevisiaein an ethanol-methane coupled fermentation process[J]. Chinese Journal of Chemical Engineering, 2012, 20(5):942-949.
[10] 刘慧慧, 姜立, 张成明, 等. “酒精沼气双发酵耦联工艺”中硫化物对酒精发酵的影响[J]. 食品与发酵工业, 2012, 38(5): 22-26.
[11] WANG K, ZHANG J H, LIU P, et al. Reusing a mixture of anaerobic digestion effluent and thin stillage for cassava ethanol production[J]. Journal of Cleaner Production, 2014, 75(14):57-63.
[12] MOLLAPOUR M, PIPER P W. Hog1 mitogen-activated protein kinase phosphorylation targets the yeast Fps1 aquaglyceroporin for endocytosis, thereby rendering cells resistant to acetic acid[J]. Molecular and Cellular Biology, 2007, 27(18): 6 446-6 456.
[13] ARNEBORG N, JESPERSEN L, JAKOBSEN M. Individual cells ofSaccharomycescerevisiaeandZygosaccharomycesbailiiexhibit different short-term intracellular pH responses to acetic acid[J].Archives of Microbiology, 2000, 174(1-2): 125-128.
[14] GIANNATTASIO S, GUARAGNELLA N, ZDRALEVIC M, et al. Molecular mechanisms ofSaccharomycescerevisiaestress adaptation and programmed cell death in response to acetic acid[J]. Frontiers in Microbiology, 2013(4): 33.
[15] 张强, 陆军, 侯霖, 等. “克菌灵”在玉米酒精生产中的应用研究[J]. 酿酒科技, 2006(1): 53-55.
Analysis and control of acidity production in ethanol fermentation during integrated ethanol and methane fermentation process
WANG Ke1,2, YANG Sheng-qian1,2, ZHANG Jian-hua1,2, MAO Zhong-gui1,2
1 (Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China) 2 (School of Biotechnology, Jiangnan University, Wuxi 214122, China)
In the integrated ethanol and methane fermentation process, the mixture of digestate and stillage was reused as process water for the ethanol fermentation, thereby the problems of massive energy consumption and high cost for wastewater treatment faced by ethanol production process was resolved. However, in the industrial application, this integrated process caused high level of acidity production in the ethanol fermentation. In this study, reasons for this problem were explored and corresponding strategies were chosen. Results showed that in the mixing and storing process of digestate and stillage, the acidogenic bacteria in digestate could utilize the nutrient substances contained in stillage to grow and produce a mountain of volatile fatty acids (VFAs). These acidogenic bacteria could out-competeSaccharomycescerevisiaefor substrates, and the VFA could cause toxicity toS.cerevisiaeas well. Adding moderate amount of Kejunling to digestate could kill acidogenic bacteria and delay acidification of the mixture of digestate and stillage, thereby eliminating their effect on the ethanol fermentation.
ethanol fermentation;Saccharomycescerevisiae; anaerobic digestion; volatile fatty acids; Kejunling
10.13995/j.cnki.11-1802/ts.201612002
博士研究生,讲师(王柯为通讯作者,E-mail: kewang@jiangnan.edu.cn)。
工业生物技术教育部重点实验室“现代工业生物技术高效开发与应用”专项科研项目子项目(JUSRP51504);生物燃料技术国家重点实验室开放课题(KFKT2014001)
2016-08-24,改回日期:2016-09-14

