双歧杆菌的分子生物学鉴定方法的比较
熊强,王延斌,韩浩
(南京工业大学 食品与轻工学院,江苏 南京,210009)
双歧杆菌的分子生物学鉴定方法的比较
熊强*,王延斌,韩浩
(南京工业大学 食品与轻工学院,江苏 南京,210009)
利用实验室设计的双歧杆菌特异性引物,采用降落聚合酶链式反应(Polymerase Chain Reaction,PCR)的方法对供试菌株的16S rDNA进行扩增,比较细菌分别通用引物和双歧杆菌特异性引物对双歧杆菌属不同菌株及参考菌株扩增效果的影响。实验结果表明,细菌通用引物对不同双歧杆菌进行扩增,扩增出来的条带不清晰,而用双歧杆菌特异性引物进行扩增,扩增出来的条带清晰。因此,该方法可以准确地鉴定双歧杆菌,为双岐杆菌的鉴定提供了理论依据。
双歧杆菌;聚合酶链式反应;分子生物学;鉴定
双歧杆菌是1899年巴斯德研究院的TISSIER博士首先在以母乳喂养的婴儿粪便中发现并分离出来的[1]。它是常见的人体肠道菌群中的重要成员[2],作为一类重要的益生菌,双歧杆菌在人体内可以维持肠道内正常微生物的菌群平衡,防止致病菌的入侵与定植;作为B类维生素的良好来源,可以在肠道中合成VB1、VB2、VB6、VK等多种维生素和各种氨基酸;其的生理和代谢特征可以在癌症肠道疾病、糖尿病、肥胖病以及其他疾病的治疗方面起到良好的效果[3-7]。
以微生物的形态结构和生理生化特征等表型特征为依据的传统微生物分类鉴定方法存在步骤繁琐、耗时且准确度不高的问题。20世纪90年代出现了聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增16S rRNA分析的技术,16S rRNA中有多个区段具有保守性,可以根据这些保守区设计细菌通用引物,此外16S rRNA具有适宜的长度、良好的进化保守性,所以成为了细菌分子鉴定的标准标识序列[8-11]。
本研究利用实验室自主设计的双歧杆菌特异性引物,采用降落聚合酶链式反应的方法对供试菌株的16S rDNA进行扩增,比较了细菌通用引物和双歧杆菌特异性引物对双歧杆菌属不同菌株及参考菌株扩增效果的影响,为双岐杆菌分子生物学鉴定提供了依据。
1 材料与方法
1.1 实验材料
长双歧杆菌(CICC6068)、短双歧杆菌(CICC6079)、两歧双歧杆菌(CICC6168)、青春双歧杆菌(CICC6070),购于中国工业微生物菌种保藏管理中心;双歧杆菌B4,B13,B17,B21,B23,B24及大肠杆菌、枯草芽孢杆菌、乳酸菌、放线菌、乳双歧杆菌为实验室保存;细菌通用引物购自南京金斯瑞生物技术有限公司;ExTaqDNA聚合酶,DNA Marker,基因组抽提试剂盒,胶回收试剂盒,质粒提取试剂盒均购自大连宝生物(TaKaRa)有限公司。
1.2 实验方法
1.2.1 PCR反应体系(25 μL)
基因组模板2 μL,上、下游引物(10 μmol/L)各0.5 μL,dNTP(10 mmol/L)2 μL,MgCl2(25 mmol/L)1.5 μL,10×ExTaqbuffer(Mg2+free) 2.5 μL,ExTaq0.3 μL,ddH2O 15.7 μL。
1.2.2 大肠杆菌感受态E.coilDH 5α的制备
将活化后的大肠杆菌E.coilDH 5α培养液按0.1%的接种量接入到新鲜的LB培养基中,37 ℃剧烈振荡培养1~3 h;将培养的OD600值小于0.5的菌液分装到1.5 mL的离心管中,放置于冰上约10 min,然后在4 ℃、12 000 r/min条件下离心2 min回收细菌;除尽离心管中的上清,然后每管中加入1 mL预冷的CaCl2(0.1 mol/L)洗涤细菌,混悬,并在冰上放置30 min,再次离心后回收细菌;往回收的细菌中加入0.2 mL的0.1 mol/L的CaCl2悬浮细胞振荡,冰浴20 min后就将制备的感受态细胞悬液保存于-70 ℃的冰箱中备用。
1.2.3 质粒转化感受态细胞
向盛有50 μL感受态细胞悬液的离心管中加入5 μL的目的DNA,轻轻混匀后在冰中静置30 min;将上述离心管放置到42 ℃的水浴中60~90 s,然后快速将离心管转移到冰浴中2~3 min;向离心管中加入900 μL的无菌LB液体培养基(不含抗生素),混匀后在37 ℃的摇床中以150 r/min振荡培养45 min;培养结束后吸取100 μL的培养物涂布于含有抗生素的LB固体培养上,37 ℃,倒置培养12~16 h。
1.2.4 TA克隆
在冰盒上,将胶回收得到的PCR产物4 μL、溶液Ⅰ5 μL与pMD18-T 1 μL混合均匀,然后在Thermomixer comfort混匀器上16 ℃连接过夜,然后将质粒转化的感受态细胞E.coilDH 5α涂布于Amp抗性平板上,在37 ℃恒温培养箱中培养12~16 h,挑出单菌落在含有Amp的LB液体培养基中培养,用质粒抽提试剂盒提取质粒DNA并测序,将测序结果输入NCBI中用Blast工具进行同源性分析。
2 结果与分析
2.1 利用细菌通用引物进行PCR扩增
利用通用引物对长双歧杆菌和本实验室筛出的双歧杆菌进行PCR扩增,通过对PCR反应进行优化,选择退火温度为55 ℃,延伸温度和时间分别为72 ℃、1 min,通用引物的序列为:27F:5′-AGAGTTTGATCCTGGCTCAG -3′ ;1429R:5′-GGTTACCTTGTTACGACTT-3′,通用引物由南京金斯瑞生物技术有限公司合成,扩增结果见图1。
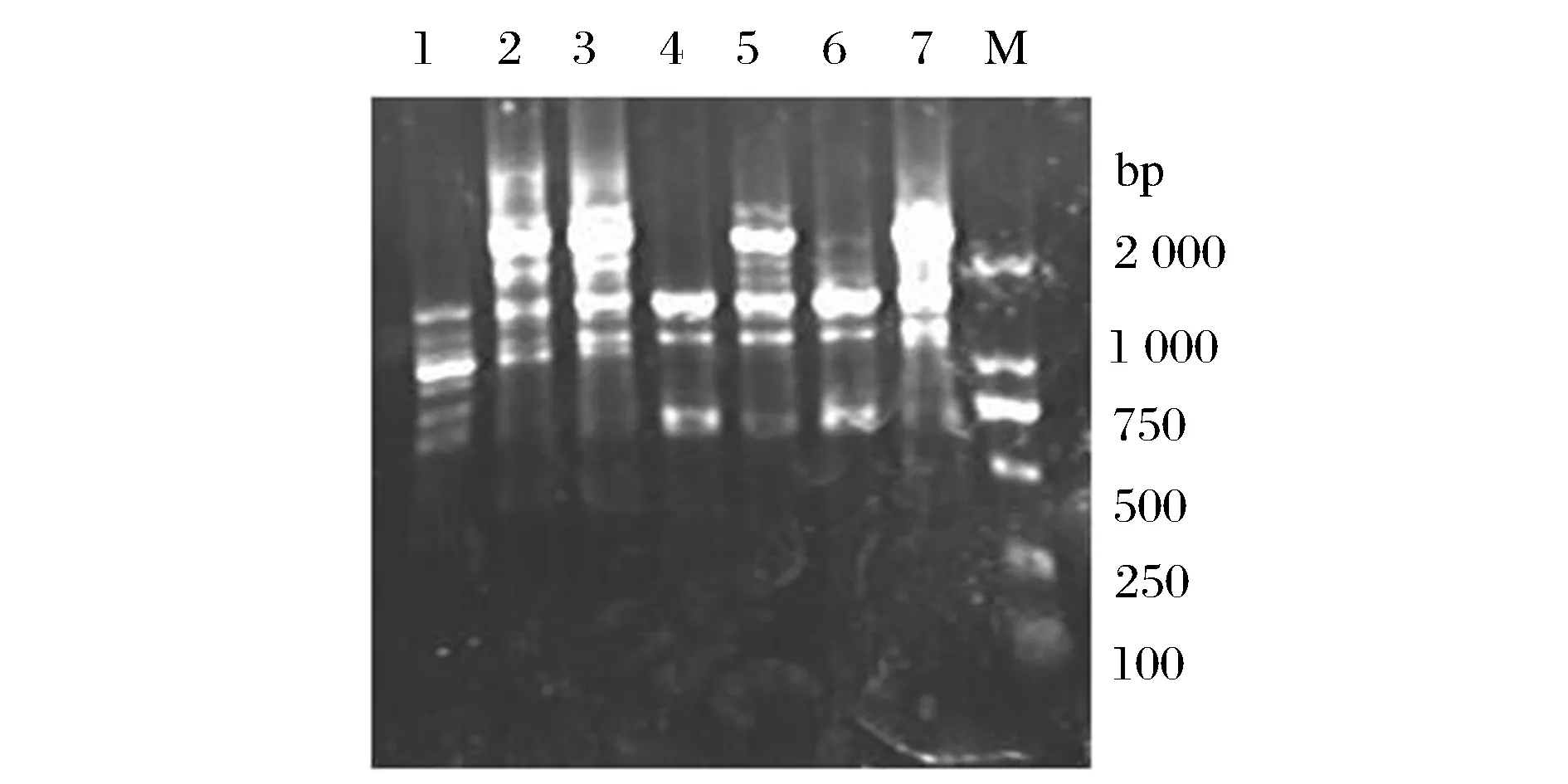
1-长双歧杆菌标准菌株;2-青春双歧杆菌标准菌株;3-两歧双歧杆菌标准菌株;4-短双歧杆菌标准菌株;5~7-分别为菌株B4、B13、B17;M-DL2000Marker图1 利用细菌通用引物进行PCR的结果Fig.1 The result of the Bacterial universal primers for PCR
结果表明,细菌通用引物应不适合双歧杆菌的特异性扩增,即使提高退火温度,延长延伸时间,将ExTaq换为保真性更高的Prime STAR HS DNA Polymerase, PCR结果仍然不理想,这可能和双歧杆菌的基因序列有关:双歧杆菌16S rRNA基因序列的高度相似之处[12],利用细菌通用引物容易发生错配。因此在利用PCR方法鉴定双歧杆菌时应根据其16S 区域或16S~23S的保守序列进行引物设计。
2.2 双歧杆菌特异性引物设计
根据NCBI中已知的双歧杆菌的16S rDNA特异性序列,参考文献并利用软件Primer Premier 5.0[13-14],根据扩增预期结果在550 bp和1 400 bp处分别设计了相应的引物:上游引物Lm3r:5′-CGGGTGCTACCCACTTTCATG-3′,下游引物Im26:5′-GATCCTGGCTCAGGATGAACG-3′;上游引物g-Bifid-R:5′-GGTGTTCTTCCCGATATCTACA-3′,下游引物g-Bifid-F:5′-CTCCTGGAAACGGGTGG-3′;引物由南京金斯瑞生物技术有限公司合成。
2.3 利用双歧杆菌特异性引物进行PCR扩增
2.3.1 PCR退火温度的确定
利用长双歧杆菌标准菌株(CICC6068)进行梯度PCR以选择最适退火温度,将退火温度分别设为49、51、53、55、57、59 ℃,其余的条件不变进行PCR扩增,结果见图2。

1~6-菌株B4的退火温度分别为49、51、53、55、57、59 ℃;M-DL2000Marker图2 长双歧杆菌梯度PCR扩增结果Fig.2 The result of the gradient PCR Methods of B.longum
结果显示,长双歧杆菌标准菌株在进行PCR扩增时,退火温度在57 ℃和59 ℃能够扩增出片段,而且片段长度在1 400 bp左右,大小与预期结果一致,因此选择57 ℃为后续PCR试验的退火温度。
2.3.2 标准菌株的PCR扩增
分别通过扩增片段长度在550 bp和1 400 bp的双歧杆菌特异性引物对大肠杆菌、枯草芽孢杆菌、乳酸菌、放线菌、双歧杆菌B4、长双歧杆菌、青春双歧杆菌、两歧双歧杆菌、短双歧杆菌进行PCR扩增,扩增结果见图3。
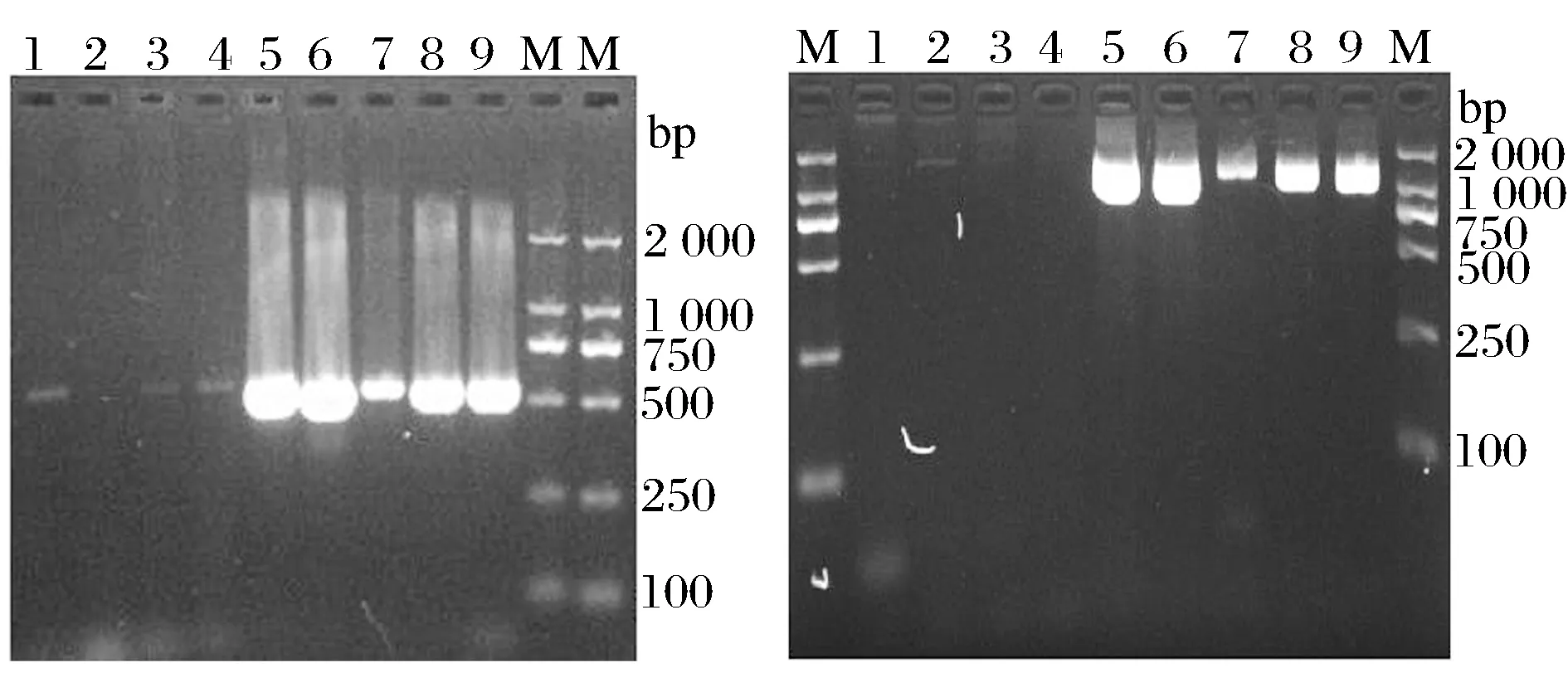
1-大肠杆菌;2-枯草芽孢杆菌;3-乳酸菌;4-放线菌;5-乳双歧杆菌;6-长双歧杆菌;7-青春双歧杆菌;8-两歧双歧杆菌;9-短双歧杆菌; M-DL2000Marker图3 利用双歧杆菌特异性引物进行PCR扩增的结果Fig.3 The result of the Bifidobacterium specific primers for PCR
如图3所示,已知的4种双岐杆菌标准菌株以及乳双歧杆菌,分别在550 bp和1 400 bp处PCR扩增出明亮条带,而大肠杆菌、枯草芽孢杆菌、乳酸菌、放线菌扩增出来的条带不明显或没有条带,表明两对引物对双歧杆菌属的菌株具有特异性。同时,各标准菌株在1 400 bp处扩增出的条带更加清晰,因此选用1 400 bp处的引物对待测菌株进行后续的PCR扩增。
2.3.3 待测菌株的PCR扩增
利用本实验设计的双歧杆菌特异性引物分别对菌株B4、B13、B17、B21、B23、B24以及乳杆菌、大肠杆菌进行PCR扩增,从扩增结果(图4)来分析:菌株B13、B17、B20、B23、B24和长双歧杆菌标准菌株在同一位置1 400 bp处均出现清晰条带,实验选取的对照组乳杆菌和大肠杆菌均无目的条带的产生,说明本实验设计的引物对双歧杆菌具有一定的特异性。菌株B4没有扩增出预期条带,可能是菌株本身或PCR条件的原因。

1~6-分别为菌株B4、B13、B17、B21、B23、B24;7-长双歧杆菌标准菌株;M-DL2000Marker;8-乳杆菌;9-大肠杆菌图4 在57 ℃条件对菌株进行PCR扩增的结果Fig.4 The result of the strains for PCR in 57℃
2.3.4 利用降落PCR(touch-down PCR,TD-PCR)对菌株B4进行扩增
在常规的PCR中,若所选择的退火温度较低,就会造成引物与模板之间的错配,使引物与位点的结合不正确,难以获得理想的扩增效果,利用TD-PCR可以减少这种错配,因此,在无法得到目标产物时可以选择TD-PCR进行扩增[15-17]。由于菌株B4在梯度PCR时无法扩增出目的基因片段,本文尝试用降落PCR对菌株B4进行扩增。本实验设计引物的Tm值在50 ℃左右,在进行TD-PCR时退火温度可以从55 ℃开始设置,降落到43 ℃,每2个循环降1 ℃,最后在43 ℃上做10个循环。
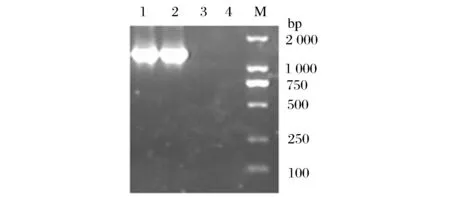
1-长双歧杆菌标准菌株; 2-菌株B4; 3-乳杆菌;4-大肠杆菌; M-DL2000Marker图5 利用TD-PCR的方法对菌株进行PCR扩增Fig.5 The result of the strains for the TD-PCR
从实验结果(图5)来看,利用TD-PCR长双歧杆菌和菌株B4在1 400 bp处均能扩增出明亮的条带,与预期一致,而大肠杆菌和乳杆菌均未能扩增出相应的条带。
2.3.5 质重组子的获得及质粒的提取与测序分析
将胶回收产物与pMD18-T在16 ℃连接过夜,第2天连接产物转化感受态细胞E.coilDH 5α,涂布于有Amp的LB平板上,37 ℃培养12~16 h,挑取单菌落于盛有1 mL LB液体培养基的无菌离心管中进行增殖培养12 h,随机挑取重组子提取质粒,送至南京金斯瑞公司测序,将测序结果输入NCBI用blast工具进行分析,结果表明:菌株B4、B13、B17、B23与动物双歧杆菌乳亚种的同源性高达99%,菌株B21与长双歧杆菌的同源性达到98%,B24与两歧双歧杆菌的同源性也达98%。菌株B4与动物双歧杆菌乳亚种的同源性高达99%。其中,菌株B21和B24已经申请中国典型培养物保藏中心(CCTCC)进行专利保藏,保藏编号为M2014467和M2014468。因此,该方法可以用作双歧杆菌属间的分子生物学鉴定。
3 讨论
由于传统的生理生化鉴定容易受培养条件、培养环境等影响,对于微生物的鉴定存在一些误差,因此可以结合分子生物学的手段,对微生物进行进一步的鉴定,以保证实验结果的准确性。
(1)双歧杆菌属16S rRNA区域具有高度相似性,在利用通用引物对双歧杆菌16S rRNA区域进行扩增时,由于通用引物对双歧杆菌16S rRNA区域没有特异性,因此,在扩增的过程中容易发生错配的现象,导致PCR结果不理想,目的条带不明确,无法得到目的DNA。
(2)利用新合成的双歧杆菌特异性引物进行扩增时,梯度PCR和降落PCR相结合的方法能够快速扩增出目的片段,而作为比对的大肠杆菌和乳杆菌不能扩增出任何条带,这说明了我们所设计的引物对双歧杆菌具有特异性。将扩增产物与pMD18-T载体相连接,进行克隆提取质粒测序,结果证明了所筛选出的菌株均为双歧杆菌,同源性均在98%以上。
(3)利用双岐杆菌特异性引物对已知菌株和待测菌株进行PCR扩增,通过在550 bp和1 400 bp的条带比对可以快速、准确的鉴定双歧杆菌,为双岐杆菌分子生物学鉴定提供了依据。
[1] 张明江, 孟祥晨, 王丽群. 双歧杆菌用于肿瘤基因治疗的研究现状[J]. 中国微生态学杂志, 2006, 18(2):145-146.
[2] HADADJI M, SAIDI N. Identification of cultivable Bifidobacterium species isolated from breast-fed infants feces in West-Algeria[J]. African Journal of Biotechnology, 2005, 4(5):422-430.
[3] MEDEIROS, ADJA Cristina Lira de. Structural characterisation and cell viability of a spray dried probiotic yoghurt produced with goats′milk andBifidobacteriumanimalissubsp. lactis (BI-07)[J]. International Dairy Journal,2014,39:71-77.
[4] STENMAN L K, WAGET A, GARRET C, et al. Potential probioticBifidobacteriumanimalisssp. lactis 420 prevents weight gain and glucose intolerance in diet-induced obese mice.[J]. Beneficial Microbes, 2014, 5(4):437-45.
[5] 李正义, 肖敏, 卢丽丽等. 转糖基β-半乳糖苷酶生产含低聚半乳糖的低乳糖牛奶[J]. 食品科学, 2007, 28(5):241-244.
[6] 程茜,刘作文.双歧杆菌防治鼠伤寒沙门菌感染的实验研究[J].中国微生态学杂志,1999,11(5):260-263.
[7] FUJIMORI M, AMANO J, TANIGUCHI S. The genus Bifidobacterium for cancer gene therapy[J]. Current Opinion in Drug Discovery & Development, 2002, 5(5):200-203.
[8] 张翠所. 药品微生物控制菌检查及菌种鉴定/基因分型方法的研究[D]. 石家庄:河北医科大学, 2015.
[9] 陈茶, 屈平华, 顾全,等. 基于细菌16S rRNA基因的PCR扩增与测序分析在临床不常见菌鉴定中的应用[J]. 中华检验医学杂志, 2012, 35(7):612-619.
[10] 张华香. 分子生物学技术在微生物鉴定和分类中的应用[J]. 科技视界, 2015(13):199-199.
[11] WOO P C Y, TENG J L L, YEUNG J M Y, et al. Automated identification of medically important bacteria by 16S rRNA gene sequencing using a novel comprehensive database, 16SpathDB[J]. Journal of Clinical Microbiology, 2011, 49(5):1 799-1 809.
[12] YOUN S Y, SEO J M, JI G E. Evaluation of the PCR method for identification ofBifidobacterium, species[J]. Letters in Applied Microbiology, 2008, 46(1):7-13.
[13] 吴拥军, 王嘉福. 应用16S rDNA鉴定食品中的双歧杆菌[J]. 食品科学, 2009, 30(18):359-361.
[14] 沈永才, 袁佩娜. 双歧杆菌的遗传学分类方法研究进展[J]. 中国微生态学杂志, 2000, 12(3):171-173.
[15] 李玉恒, 赵明慧, 赵紫阳,等. 利用梯度PCR和降落PCR扩增CIRP基因的比较[J]. 黑龙江八一农垦大学学报, 2011, 23(5):46-49.
[16] 黄留玉. PCR最新技术原理、方法及应用[M]. 北京:化学工业出版社, 2011.
[17] SHAN T D, DENG Z Y, ZHANGF X, et al. Comparative study of molecular biology on acute high altitude and plain intestinalBifidobacteriumin rats[J]. Chinese Journal of Microecology, 2011, 23(3):197-200.
The molecular identification of bifidobacterium
XIONG Qiang*, WANG Yan-bin, HAN Hao
(College of Food Science and Light Industry, Nanjing Tech University, Nanjing 211800,China)
In this paper, the specific primers for bfidobacterium designed by our laboratory was combined the touch-down PCR to amplify 16S rDNA of test strains. The amplification effects of the universal primers for bacteria and the specific primers for bifidobacterium on different strains of the genus bifidobacterium and reference strains were compared. The experimental results showed that the amplification of sample from different bifidobacteria using universal primers for bacteria resulted in unclear bands, while amplification with specific primers for bifidobacterium gave rise to very bright bands. Therefore, this method can accurately identify the bifidobacterium and our work provides a theoretical basis for the identification of bifidobacterium.
bifidobacterium; Polymerase Chain Reaction(PCR); molecular biology; identification
10.13995/j.cnki.11-1802/ts.201612008
副教授(本文通讯作者,E-mail:xiongqiang@njtech.edu.cn)。
2016-07-18,改回日期:2016-08-28

