H2O2诱导不同品种花生叶片中白藜芦醇合成变化
王琴飞,汪 彪, 张如莲 *, 应东山,王 明,李莉萍
(1.中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创制重点实验室/农业部热带作物种子种苗质量监督检验测试中心,海南 儋州 571737;2.海南大学儋州校区 应用科技学院,海南 儋州 571737)
H2O2诱导不同品种花生叶片中白藜芦醇合成变化
王琴飞1,汪 彪2, 张如莲1 *, 应东山1,王 明1,李莉萍1
(1.中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创制重点实验室/农业部热带作物种子种苗质量监督检验测试中心,海南 儋州 571737;2.海南大学儋州校区 应用科技学院,海南 儋州 571737)
花生叶片中白藜芦醇含量较少或检测不到,合理的诱导方式可以使花生植株中白藜芦醇积累。实验以花生幼苗叶片为材料,研究了H2O2诱导不同品种花生幼苗中白藜芦醇合成差异,同时对花生种皮颜色、种子单粒重与其叶片中白藜芦醇合成差异的相关性进行了探讨。结果表明,H2O2能诱导不同品种的花生幼苗叶片中白藜芦醇的显著增加,并在24~36 h达到合成高峰;在考察的浅褐色、浅红色、粉色和深红色品种中白藜芦醇最高含量分别达到了7.2、35.5、7.6 和16.9 μg/g。花生叶片中白藜芦醇的原始含量和诱导后合成最大值与花生种子的种皮颜色无关。8个相同种皮颜色的花生品种,种子单粒重与未诱导的花生叶片中白藜芦醇含量呈显著负相关,相关系数(r)为-0.827;考察的四类种皮颜色的17个花生品种中,种子单粒重与未诱导的花生叶片中白藜芦醇含量极显著负相关,相关系数(r)为-0.742;不同品种花生叶片中白藜芦醇诱导合成潜力与种子单粒重相关性不显著。研究表明,H2O2能花生幼苗中白藜芦醇的增加,种子单粒重可作为评价花生品种中原始白藜芦醇含量高低的依据;花生合成白藜芦醇的潜力与诱导后放置合适时间有关,花生种皮颜色不能作为筛选高含量白藜芦醇花生品种的依据。
白藜芦醇;H2O2;花生品种;诱导
前言花生是世界重要的农作物之一,除作为重要油料来源,花生副产物还含有其他的功能成分,如多酚类,酚酸,植物甾醇化合物和高含量的精氨酸等,被研究者认为一种功能食品开发,而这些功能成分中,白藜芦醇为关注的焦点[1]。白藜芦醇(Resveratrol)是含有芪类结构的非黄酮类多酚化合物,广泛存在于葡萄、虎杖和花生等植物组织中,是植物处于逆境胁迫下产生的一种植物抗毒素[2]。白藜芦醇的生物学功能研究表明,该物质具有抗癌抑癌、抗氧化和保护心血管等多种生理活性,天然的白藜芦醇广泛应用于化妆品和功能食品领域[3]。花生中白藜芦醇含量差异较大,有的甚至检测不到,但在受到生物或非生物诱导时会大量积累以抵御逆境,并在花生种子中作为一种抗病指标被深入研究[4-6]。随着花生不同组织中白藜芦醇的广泛研究,人们发现花生毛状根和花生植株可在紫外或其他非生物的诱导方式下产生大量的白藜芦醇或衍生物,可实现花生中白藜芦醇工厂化生产[2, 7]。同时,研究者发现紫外照射花生采收后未失活的根,白藜芦醇含量提高65 %~120 %,可实现花生采收后废弃物综合利用[8];而非生物方式诱导白藜芦醇合成方法很多,如紫外,水杨酸,茉莉酸甲酯,臭氧,氯化铝,乙磷铝等[9-13],这些诱导方式不但增强了植物在田间的抗病性,还可提高植物的药用价值[14-15]。但不同品种的花生中白藜芦醇含量差异较大,诱导后白藜芦醇的合成也存在品种的差异性[16-17]。前期研究表明,激素或非生物胁迫可诱导花生叶片中白藜芦醇及其代谢产物的积累,在花生叶片不萎焉的情况下,1 % H2O2最适合诱导花生叶片中白藜芦醇的合成[18-19]。H2O2不但能诱导植物中白藜芦醇的合成,也参与了白藜芦醇的代谢过程[12, 20],因此,了解H2O2诱导花生中白藜芦醇的合成规律,对于有效的调控花生中白藜芦醇的合成与代谢至关重要。本试验以1 % H2O2诱导花生幼苗叶片,探索H2O2诱导不同品种花生叶片中白藜芦醇的合成规律;通过花生品种的品质形状(种皮颜色、种子大小)与白藜芦醇的合成含量的相关性分析,期望实现快速筛选高含量白藜芦醇花生品种,为花生功能成分开发和利用提供参考,提高花生采后废弃物的综合利用价值。
1 材料与方法
1.1 试验材料
花生品种来源如表1所示,于2014年夏季种植于农业部植物新品种测试(儋州)分中心,种子采收后自然晾干,储存于种子低温低湿储藏柜中[湿度:(40±5)%,温度4~8 ℃]。种皮颜色划分参照《植物新品种特异性、一致性和稳定性测试指南花生》进行,种子单粒重(g)=100粒种子重量(g)/100。花生幼苗种植于农业部植物新品种测试(儋州)分中心大棚内,育苗袋规格为10 cm×15 cm(d×h),基质为表土∶椰糠∶牛肥=1∶1∶1,选择长势一致,生长健壮,无病虫害的20 d苗龄、有稳定的6~7片叶的花生幼苗为试验材料。
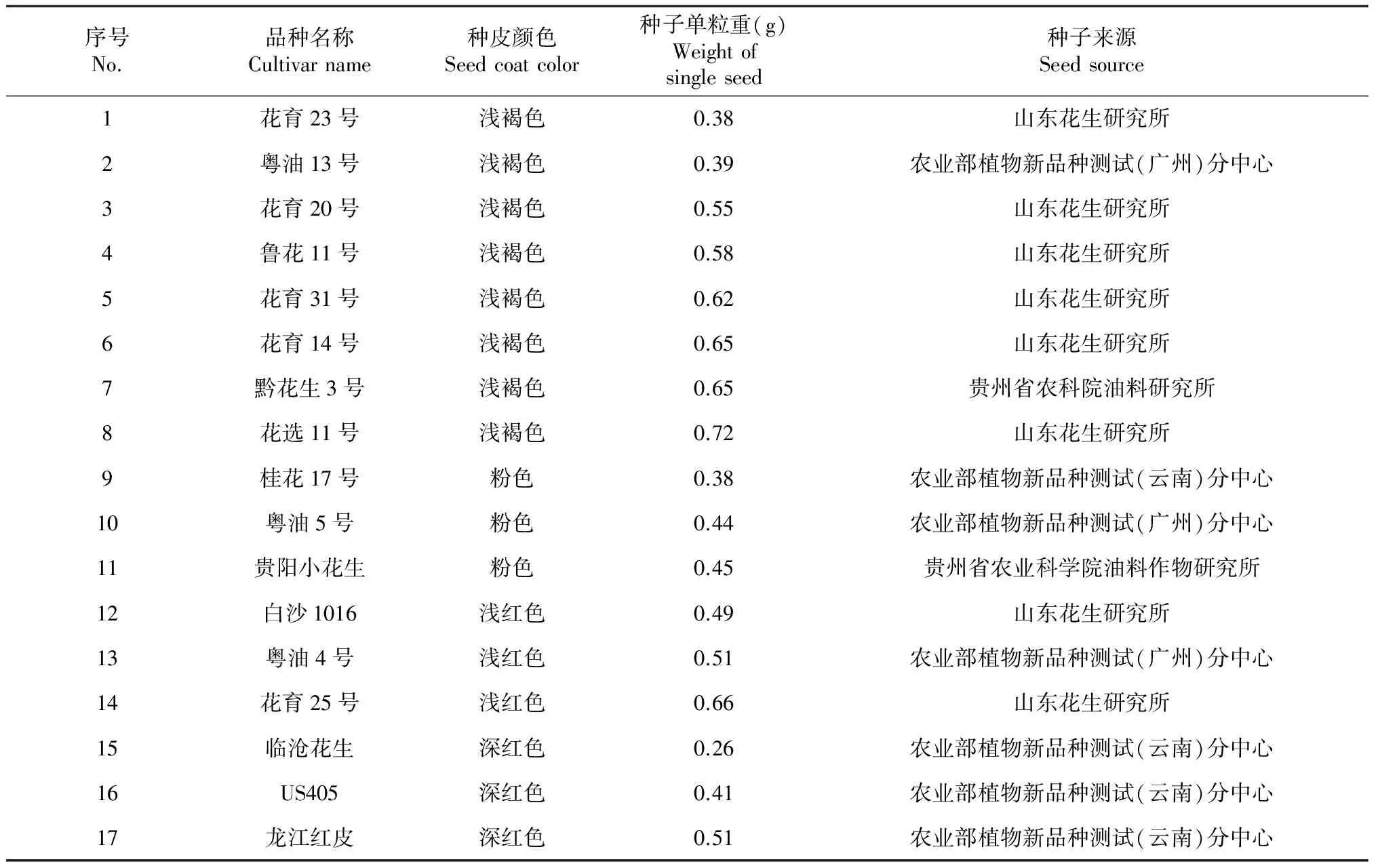
表1 花生品种信息及来源
白藜芦醇购买于美国Sigma公司(纯度≥98 %),甲醇、乙腈为色谱纯,购买于美国Sigma公司;超纯水(电阻率:18.2 MΩcm)。过氧化氢(H2O2)浓度为30 %(v/v),购买于阿拉丁生物试剂有限公司。采用Agilent1260型液相色谱系统分析白藜芦醇,配备自动进样器(型号:G1329B)、二极管阵列列检测器(型号:G1315D)和柱温箱(型号:G1316A)。色谱柱为Purospher STAR RP-18e(Hiber150 × 4.6 mm,5 μm;德国Merck公司)。Elix3+Synergy超纯水系统,购买于美国Millipore公司;超声波清洗器(KQ-400KDE)购买于江苏昆山市超声仪器有限公司。
1.2 试验方法
1.2.1 材料的处理 花生幼苗运回实验室,在相对湿度(RH)(60±5) %,温度为(25±2)℃环境下缓苗24 h,参照文献方法[18],将花生幼苗分别喷施1 % H2O2后,放置于相对湿度RH(60±5) %,温度为(25±2)℃,光照和黑暗交替16/8 h,光照强度为250 μmol/m2/s环境条件下,分别在处理后放置时间为0(对照)、12、24、36 h剪取中部3~6片叶混合后液氮速冻,-40 ℃保存待用。每个时间取12盆花生幼苗的叶片混合。
1.2.2 花生幼苗中白藜芦醇的提取与检测 参照Tang等方法稍作修改[12],花生叶片液氮研磨后,准确称取粉末0.5 g于10 mL离心管中,加入2 mL甲醇/水(80/20),4 ℃避光静置浸提1 h,离心(4 ℃,12 000×g)15 min,取上清过0.22 μm有机膜,直接HPLC进样分析,每个样品设置3个重复。为防止白藜芦醇顺式化,整个提取过程均避光操作。 白藜芦醇 的检测采用HPLC法,流动相为乙腈-水(40∶60)混合溶液等度洗脱,检测时间10 min,检测波长306 nm,流速0.8 mL/min,进样体积20 μl,柱温30 ℃,采用外标法定量。
利用该方法对标准样品和样品中的白藜芦醇进行分析,标样的保留时间为4.045(图1A),样品的保留时间为4.046(图1B),样品与标样的保留时间一致。以该方法对白藜芦醇的不同浓度标准溶液(x,μg/mL)进样分析,与对应的峰面积(y,mAU)做标准曲线,线性方程为:y= 133.28x-22.378,在0.01~20 μg/mL范围内相关性较好,相关系数(R2)为0.9997。
1.3 数据分析与画图
采用Microsoft Excel和IBM SPSS Statistics 22.0进行数据分析;Sigmaplot12.5画图软件绘制图形。
2 结果与分析
2.1 H2O2对不同品种花生幼苗中白藜芦醇诱导差异
通过1 % H2O2对不同品种花生幼苗诱导处理后发现,在考察的4类种皮颜色12个花生品种中,白藜芦醇诱导合成的含量在品种间差异较大,并且与花生的种皮颜色无关。花生幼苗受H2O2诱导后,白藜芦醇合成含量随放置时间的增加都有明显的升高,合成高峰都出现在24或36 h。与对照相比,3个浅褐色品种中白藜芦醇含量增加量分别为7.1、2.7、3.1 μg/g,以花育20号最高,在诱导后36 h时达到了7.2 μg/g(图2A);3个浅红色品种中白藜芦醇含量增加量分别为4.4、9.6、34.6 μg/g,其中以花育22号白藜芦醇含量最高,36 h时含量达到了35.5 μg/g(图2B);3个粉色的花生品种中,白藜芦醇含量增加量分别为1.3、7.5、1.4 μg/g,以粤油5号含量最大,达到了7.6 μg/g(图2C);而3个深红色品种中,白藜芦醇含量增加量分别为16.7、4.0、4.5 μg/g,其中以临沧花生中白藜芦醇含量最高,含量达到了16.9 μg/g(图2D)。H2O2可诱导不同品种花生幼苗中白藜芦醇的合成,与对照相比(0 h)含量都达到了显著增加。同时结果分析发现,未诱导的花生叶片中白藜芦醇含量较高,在诱导后达到最大值时含量并不一定最高,如临沧花生和花育22号,对照中白藜芦醇含量分别为0.22 μg/g和未检测到,诱导后最大值分别为16.7和35.5 μg/g,结果表明,花生诱导后的白藜芦醇含量与原始含量的高低并没有关系。

图1 样品和标准样品中白藜芦醇的高效液相色谱图Fig.1 HPLC chromatogram of resveratrol in samples (A) and standard samples (B)
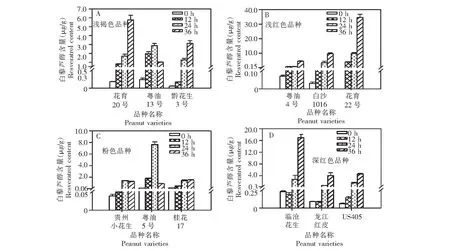
图2 H2O2诱导不同品种花生幼苗叶片中白藜芦醇合成差异Fig.2 Accumulation of resveratrol in peanut seedling leaves of different varieties responding to H2O2
2.2 相同种皮颜色花生种子大小与其幼苗叶片中白藜芦醇含量的相关性
利用8个相同种皮的花生品种(表1中1~8号),其幼苗叶片进行H2O2诱导处理,对白藜芦醇进行分析发现,未诱导的花生叶片中白藜芦醇含量在0.03~0.19 μg/g之间;诱导后叶片中白藜芦醇含量都显著增加,含量可达到1.1~26.6 μg/g。对8个品种的花生种子单粒重和叶片中诱导前后白藜芦醇含量进行相关分析表明,花生种子重量越小,其幼苗叶片中白藜芦醇含量越高,花生种子单粒重与未诱导的花生叶片中白藜芦醇含量呈显著负相关,相关系数(r)为-0.827(图3A);通过诱导后花生叶片中白藜芦醇合成的峰值与种子单粒重进行相关分析发现,白藜芦醇合成峰值与种子大小的相关性为0.169,相关性不显著(图3B)。

1.“*”表示相关系数在0.05水平达到显著水平;2.A:对照中白藜芦醇含量与种子单粒重相关性分析;B:H2O2诱导后白藜芦醇合成最大值与种子单粒重相关性分析1.‘*’Correlation is significant at the 0.05 level (2-tailed);2.A:Correlation analysis for the content of resveratrol in controls and weight of single seed, B:Correlation analysis for accumulation maximum of resveratrol after induction with H2O2 and weight of single seed图3 花生种子单粒重与H2O2诱导前后花生幼苗叶片中白藜芦醇含量的相关性Fig.3 Correlation analysis for peanut seeds single grain weight,accumulation of resveratrol induction with H2O2 in peanut seedling leaves
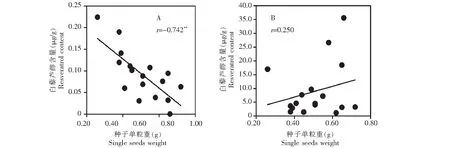
1.“**”相关系数在0.01水平达到极显著水平。2.A:对照中白藜芦醇含量与种子单粒重相关性分析,B:H2O2诱导后白藜芦醇合成最大值与种子单粒重相关性分析1.‘**’Correlation is significant at the 0.01 level (2-tailed). 2.A:Correlation analysis for the content of resveratrol in controls and weight of single seed,B:Correlation analysis for accumulation maximum of resveratrol after induction with H2O2 and weight of single seed图4 不同品种花生种子单粒重与其H2O2诱导前后花生幼苗中白藜芦醇含量的相关性Fig.4 Correlation analysis for peanut seeds single grain weight,accumulation of resveratrol induction with H2O2 in peanut seedling leaves
2.3 不同种皮颜色花生种子大小与其幼苗叶片中白藜芦醇含量的相关性
为了进一步确认花生种子大小与花生幼苗叶片中白藜芦醇的含量有关,试验扩大样品的考察范围,对表1中1~17号花生品种幼苗叶片中白藜芦醇进行了分析,发现在考察的四类种皮颜色的17个花生品种中,未诱导(0 h)的花生叶片白藜芦醇含量在0~0.22 μg/g;诱导后叶片中白藜芦醇含量显著增加,最高含量在1.1~35.5 μg/g,诱导前后17个花生品种之间白藜芦醇差异都较大。对17个品种的花生种子单粒重和叶片中诱导前后白藜芦醇含量进行相关分析表明,与相同种皮颜色的花生品种中白藜芦醇含量呈现同样的现象,花生种子单粒重与未诱导的花生叶片中白藜芦醇含量极显著负相关,相关系数(r)为-0.742(图4 A),即花生种子重量越小,其幼苗叶片中白藜芦醇含量越高;通过诱导后花生叶片中白藜芦醇合成的峰值与种子单粒重进行相关分析发现,白藜芦醇合成峰值与种子大小的相关性为0.250,相关性不显著(图4 B)。
3 讨论与结论
3.1 H2O2对不同品种花生幼苗中白藜芦醇诱导作用
白藜芦醇作为一种植保素,可以通过生物或非生物胁迫来提高植物中白藜芦醇及其代谢产物的含量,未受逆境胁迫的植物中含量极少或检测不到[19, 21]。已有的研究表明,非生物胁迫中以紫外(UV)对芪类物质的诱导最为显著,但紫外诱导的使用在田间存在局限性[10]。前期的研究表明,合适的H2O2浓度,也可以诱导白藜芦醇的大量合成,达到紫外诱导的剂量[18],同时,H2O2作为一种信号分子,在白藜芦醇的合成与代谢中起到至关重要的作用[20, 22]。因此, H2O2可以作为一种无毒无害的诱导剂诱导白藜芦醇的产生。另外,不同的作物,H2O2的最佳使用剂量不同[23];同时,高浓度的H2O2在诱导植物中STS(白藜芦醇合成酶基因)的表达,但白藜芦醇的含量却降低,这可能是因为高浓度的H2O2导致了花生叶片的损伤,研究认为叶片损伤程度的加重可能导致酶促反应底物合成受限,另一方面叶片坏死所导致木质化的加剧反映了芪合酶底物有可能流向木质素合成途径[24];因此,为了稳定的提高白藜芦醇的含量,实验使用了1 %的H2O2作为诱导剂。试验中,不同品种花生在24或36 h后达到白藜芦醇的合成高峰,峰值出现的时间不同可能与品种自身STS(白藜芦醇合酶基因)的表达速度和不同品种的抗逆性强弱有关[25]。
花生种皮是花生抵御病毒侵染的首要屏障,已有研究报道花生种皮含有的酚类、丹宁酸、类黄酮等化合物具有抵抗黄曲霉侵染的作用,在选择对抗黄曲霉侵染抗性品种和易感品种的区别就在于其种皮结构和化学组成上的差异[26-27]。而花生种子中白藜芦醇的合成也可以抵抗黄曲霉菌的侵染[6];研究认为,花生红衣是花生种子中含有白藜芦醇较高的组织,花生种子发芽的过程中,白藜芦醇可显著的提高,并且从种子到幼苗,种皮中白藜芦醇不断降低的同时,子叶中白藜芦醇却不断增加,因此推测花生种皮中白藜芦醇的含量随着种子发芽而转移到幼苗子叶中[2, 28]。在本研究考察的四类种皮颜色的12个花生品种中,相同和不同种皮颜色的花生幼苗诱导前后白藜芦醇差异都较大,实验结合前人的研究报道可知,花生种皮中白藜芦醇的含量可能影响幼苗中白藜芦醇含量,但花生种皮颜色与幼苗中白藜芦醇合成潜力不具规律性,而不同种皮颜色花生中白藜芦醇含量与其幼苗中白藜芦醇含量的相关性还需作进一步研究。
3.2 花生种子大小与其幼苗中白藜芦醇含量的关系
种子是形成下一代植物幼体和植物生长发育的基础,不同大小种子从理论上反映种胚所存物质能量的多少,对种子萌发、出苗和有幼苗生长有明显影响。本次实验发现,未诱导的花生叶片中, 白藜芦醇的含量与种子单粒重存在显著负相关性,即种子越小, 白藜芦醇的含量量越高。在进行花生种子芪化物与抗黄曲霉菌侵染实验中也发现,花生种子越小,芪化物含量越高,并且抗黄曲霉菌侵染和产毒的能力越强(数据未发表),可能是花生种子越大,油酸含量较高的原因[29]。种子在发芽过程中,其所有营养物质都参与到植株的建成,因此,种子中白藜芦醇含量可能直接影响了幼苗中白藜芦醇的含量,但幼苗形成后,H2O2诱导处理启动了相关的抗性酶活性[30],而白藜芦醇的合成受环境及很多酶的调控[12],因此导致诱导后差异较大,并与种子的大小没有显著的相关性。通过H2O2处理不同品种的花生叶片,可以筛选出合成白藜芦醇合成潜力较高的花生品种。
3.3 结论
H2O2是诱导花生叶片中白藜芦醇合成的有效诱导剂,能诱导不同品种花生叶片中白藜芦醇的合成;花生种子越小,幼苗中原始的白藜芦醇的含量越高,种子单粒重可作为评价花生品种中原始白藜芦醇含量高低的依据,但花生种皮颜色不能作为筛选高含量白藜芦醇的依据,不同花生品种合成白藜芦醇的潜力,与合理的诱导方式、诱导后放置合适时间有关。
[1]Arya S S, Salve A R, Chauhan S. Peanuts as functional food: a review[J]. Journal of Food Science and Technology, 2015,53(1):31-41.
[2]Hasan M M, Cha M, Bajpai V K, et al. Production of a major stilbene phytoalexin, resveratrol in peanut (Arachishypogaea) and peanut products: a mini review [J]. Reviews in Environmental Science and Bio/Technology, 2013, 12(3): 209-221.
[3]Kiselev K V. Perspectives for production and application of resveratrol[J]. Applied Microbiology and Biotechnology, 2011, 90(2): 417-425.
[4]王后苗,黄家权,雷 永,等. 花生种子白藜芦醇含量与黄曲霉产毒抗性的关系[J]. 作物学报, 2012, 38(10): 1875-1883.
[5]Sobolev V S, Guo B Z, Holbrook C C, et al. Interrelationship of Phytoalexin Production and Disease Resistance in Selected Peanut Genotypes[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 2195-2200.
[6]王琴飞,王 明,李莉萍,等. 花生种子中芪化物的合成与抗黄曲霉菌产毒的相关性研究[J]. 热带作物学报, 2015, 36(2): 344-352.
[7]Medina-Bolivar F, Condori J, Rimando A M, et al. Production and secretion of resveratrol in hairy root cultures of peanut[J]. Phytochemistry, 2007, 68(14): 1992-2003.
[8]Chen R S, Wu P L, Chiou R Y Y. Peanut roots as asource of resveratrol[J]. J. Agric. Food Chem, 2002, 50: 1665-1667.
[9]罗 葵,王琴飞,张 岱,等. 葡萄叶片中白藜芦醇的紫外线诱导研究[J]. 中外葡萄与葡萄酒, 2007(4): 4-6.
[10]李晓东,郑先波,闫树堂,等. 水杨酸和紫外线对诱导采后葡萄果皮内白藜芦醇合成作用研究[J]. 果树学报, 2007(1): 30-33.
[11]Adrian M J P, Bessis R. Induction of phytoalexin(Resveratrol) synthesis in Grapevine leaves treated with Aluminum Chloride(AlCl3) [J]. Journal of Agricultral Food Chemistry, 1996, 44: 1979-1981.
[12]Tang K, Zhan J C, Yang H R, et al. Changes of resveratrol and antioxidant enzymes during UV-induced plant defense response in peanut seedlings[J]. Journal of Plant Physiology, 2010, 167(2): 95-102.
[13]Grimmiga B, M. N G C, Gerhard W, et al. Ethylene- and ozone-induced regulation of a grapevine resveratrol synthase gene: different responsive promoter regions[J]. Plant Physiology and Biochemistry, 2002, 40(10): 865-870.
[14]Gindro K, Spring J L, Pezet R, et al. Histoligical and biochemcal criteria for objective and early selection of grapexine cultivars resistant to plasmopara viticola[J]. Vitis, 2006, 45(4): 191-196.
[15]Zorzete P, Reis T A, Felício J D, et al. Fungi, mycotoxins and phytoalexin in peanut varieties, during plant growth in the field[J]. Food Chemistry, 2011, 129(3): 957-964.
[16]Douillet-Breuil A, Jeandet P, Adrian M, et al. Changes in the Phytoalexin Content of VariousVitisspp. in Response to Ultraviolet C Elicitation[J]. Journal of Agricultural and Food Chemistry, 1999, 47(10): 4456-4461.
[17]张 磊,孙奎香,孙庆杰,等. 反相高效液相色谱法测定不同品种花生白藜芦醇含量[J]. 粮食与油脂, 2012(2): 33-34.
[18]王琴飞,许 强,张如莲,等. 激素和非生物胁迫对花生叶片白藜芦醇及其代谢产物合成的影响[J]. 中国油料作物学报, 2015,37(3): 301-309.
[19]Chung I, Myoung R P, Jae C C, et al. Resveratrol accumulation and resveratrol synthase gene expression in response to abiotic stresses and hormones in peanut plants[J]. Plant Science, 2003, 164(1): 103-109.
[20]Belchí-Navarro S, Almagro L, Sabater-Jara A B, et al. Early signaling events in grapevine cells elicited with cyclodextrins and methyl jasmonate[J]. Plant Physiology and Biochemistry, 2013, 62: 107-110.
[21]Rao P V S, Wasia K D R, Strange R N. Biotic and abiotic elicitation of phytoalexins in leaves of groundnut (ArachishypogaeaL.)[J]. Physiological and Molecular Plant Pathology, 1996, 46:343-357.
[22]王琴飞. 赤霞珠葡萄叶片中以白藜芦醇为底物的代谢酶的研究[D]. 海口: 海南大学, 2008.
[23]黄方爱,张 波,杨晓燕,等. “H2O2”对葡萄离体叶片白藜芦醇的诱导作用[J]. 新疆农业科学, 2012, 49(10): 1799-1804.
[24]Wang W, Tang K, Yang H R, et al. Distribution of resveratrol and stilbene synthase in young grape plants (VitisviniferaL. cv. Cabernet Sauvignon) and the effect of UV-C on its accumulation[J]. 2010, 48(2-3): 142-152.
[25]梁炫强,周桂元,邹世春. 花生种子白藜露醇的诱导与抗黄曲霉侵染关系的研究[J]. 中国油料作物学报, 2006, 28(1): 59-62.
[26]姜慧芳,任小平,王圣玉,等. 花生黄曲霉侵染抗性持久性及种皮完整性对产毒的影响[J]. 作物学报, 2006, 32(6): 851-855.
[27]单世华,李春娟,严海燕,等. 花生种皮抗黄曲霉差异基因表达分析[J]. 植物遗传资源学报, 2007, 8(1): 26-29.
[28]Sobolev V S, Horn B W, Potter T L, et al. Production of Stilbenoids and Phenolic Acids by the Peanut Plant at Early Stages of Growth[J]. J. Agric. Food Chem, 2006, 54(10): 3505-3511.
[29]姜慧芳,任小平,王圣玉. 花生种质资源对黄曲霉菌侵染和产毒的抗性鉴定[J]. 中国油料作物学报, 2005,27(3): 21-25.
[30]宋喜贵,佘小平. 植物体内过氧化氢的产生及其生理作用[J]. 连云港师范高等专科学校学报, 2010(4):99-103.
(责任编辑 李山云)
Changes of Resveratrol Content in Seedling Leaves of Different Peanut Varieties Induced by H2O2
WANG Qin-fei1, WANG Biao2, ZHANG Ru-lian1 *, YING Dong-shan1,WANG Ming1,LI Li-ping1
(1.Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Crop Gene Resources and Germplasm Enhancement in Southern China/Ministry of Agriculture Quality Control and Test Centre for Seeds/Seedlings of Tropical Crops, Hainan Danzhou 571737, China;2.College of Applied Science and Technology of Hainan University, Hainan Danzhou 571737, China)
Resveratrol content in peanut leaves is very low or undetectable, but reasonable inducing method will contribute to resveratrol accumulation in peanut plants. In this study, we investigated the differences in resveratrol synthesis among seedling leaves of different peanut varieties with H2O2induction, and explored their relationship with the color and single seed weight of peanut seed. The results showed that resveratrol content in seedling leaves of different peanut varieties was significantly increased after H2O2inducing, and reached peak value at synthesis time of 24 to 36 hours. The highest resveratrol content for seeds of light brown, light red, pink and magenta color were 7.2, 35.5, 7.6 and 16.9 μg/g, respectively. The original and synthesis content of resveratrol in peanut seedling leaves have no relationship with seed color. Significant negative correlation (r= -0.827) was observed between single seed weight and resveratrol content in non-induced seedling leaves of 8 same color peanut varieties. Among the 17 varieties (four different colors), single seed weight was significant negative correlated (r=-0.742) with resveratrol content in non-induced seedling leaves, and weakly correlated with synthesis potential after H2O2inducing. This study has demonstrated that H2O2inducing can increase the resveratrol content in peanut seedling leaves, and single seed weigh can server as indicator for evaluating original resveratrol content for peanut varieties. In addition, the potential of resveratrol synthesis in peanut seedling leaves is related to the placing time after H2O2inducing, and seed color cannot be used for screening peanut varieties that have high levels of resveratrol.
Resveratrol; H2O2; Peanut varieties; Induction
1001-4829(2016)09-2086-07
10.16213/j.cnki.scjas.2016.09.014
2015-10-12
中央级公益性科研院所基本科研业务费专项资金(中国热带农业科学院热带作物品种资源研究所)资助项目(1630032012025)
王琴飞(1982-),女, 侗族,贵州遵义人,助理研究员,理学硕士,研究方向为:植物逆境生理和种子生理学,E-mail:wangqf508@163.com,Tel:0898-23300488,*为通迅作者。
S565.201
A

