Parkin基因甲基化对鼻咽癌早期诊断及预后判断的价值研究
江波 倪海峰 周珍 李勇 黄光武
●基础研究
Parkin基因甲基化对鼻咽癌早期诊断及预后判断的价值研究
江波 倪海峰 周珍 李勇 黄光武
目的 研究Parkin基因甲基化在鼻咽癌早期诊断及预后判断中的价值。方法 运用甲基化特异性PCR检测54例鼻咽癌组织、16例慢性鼻咽炎症组织和16例正常鼻咽上皮组织中Parkin基因启动子区甲基化情况,并分析其与鼻咽癌临床生物学因素的关系。结果 慢性鼻咽炎症组织和正常鼻咽上皮组织中均未检测到Parkin基因甲基化,而在鼻咽癌组织中甲基化率为62.96% (34/54),3种鼻咽组织Parkin基因甲基化情况比较有统计学差异(P<0.05)。进一步统计学分析发现鼻咽癌组织Parkin基因甲基化与其临床生物学因素均无关(均P>0.05)。结论 Parkin基因甲基化具有肿瘤特异性,与鼻咽癌发生、发展密切相关,有望成为早期分子生物学辅助诊断的标志物,但不能作为判断鼻咽癌预后的预测指标。
Parkin 鼻咽癌 甲基化
近年研究发现Parkin基因与肿瘤发生关系密切,Parkin基因在肿瘤中主要表现为基因突变或杂合性缺失[1-3]。虽然有关肿瘤组织中Parkin基因甲基化的报道少见,但已有研究在急性淋巴细胞性及慢性粒细胞性白血病中发现Parkin基因甲基化[4]。基于此,本研究通过检测鼻咽癌组织、慢性鼻咽炎症组织和正常鼻咽上皮组织中Parkin基因启动子区甲基化情况,分析Parkin基因甲基化与鼻咽癌临床生物学因素的关系,探讨其在鼻咽癌早期诊断及预后判断中的价值。
1 对象和方法
1.1 对象 选取2008至2011年杭州市第一人民医院和广西医科大学第一附属医院收治的经病理学检查确诊为鼻咽癌患者54例[男39例,女15例;年龄20~78(中位数45.8)岁]、慢性鼻咽炎症患者16例[男10例,女6例;年龄22~66(中位数40.8)岁]及正常鼻咽上皮患者16例[男11例,女5例;年龄18~68(中位数42.5)岁;均为行鼻窦内镜手术及扁桃体切除术患者]。3组患者性别、年龄比较均无统计学差异(均P<0.05)。分别留取每例患者的组织标本,即鼻咽癌组织54例、慢性鼻咽炎症组织16例、正常鼻咽上皮组织16例。另取1例健康青年人外周血淋巴细胞作甲基化和非甲基化特异性PCR阳性对照标本。本研究经医院伦理委员会批准,获得患者及其家属知情同意并签署知情同意书。
1.2 方法
1.2.1 DNA的提取 采用经典的蛋白酶K消化,酚/氯仿抽提,乙醇沉淀的方法,分别从鼻咽癌组织、慢性鼻咽炎症组织、正常鼻咽上皮组织及外周血淋巴细胞中提取DNA,用紫外分光光度仪测 A260、A280,计算浓度及A260/ A280比值。
1.2.2 DNA的CpG甲基化酶修饰 取1μg外周血淋巴细胞DNA、0.1μl 200×S-腺苷甲硫氨酸、1U的CpG甲基化酶(新英格兰BioLabs公司)、2μl 10×反应缓冲液,加水至20μl,37℃温育1h;再进行下一步DNA的亚硫酸氢盐修饰,作为甲基化的阳性对照模板。
1.2.3 DNA的亚硫酸氢盐修饰 将鼻咽癌组织、慢性鼻咽炎症组织、正常鼻咽上皮组织及外周血淋巴细胞中提取的DNA及经CpG甲基化酶修饰的DNA分别作亚硫酸氢盐修饰,具体实验步骤参照文献[5]。外周血淋巴细胞中提取DNA经亚硫酸氢盐修饰后用于非甲基化阳性对照模板(所需试剂低熔点琼脂糖、矿物油、Hydroquinone、Sodium metabisulphite等均购自美国Sigma公司)。
1.2.4 甲基化特异性PCR Parkin基因甲基化特异性及非甲基化PCR引物序列见表1。甲基化特异性PCR程序:95℃预变性3min,94℃30s、63℃20s、72℃20s 37个循环,最后延伸72℃5min。非甲基化特异性PCR程序:95℃预变性3min,94℃ 30s、61℃ 20s、72℃ 20s 37个循环,最后延伸72℃5min。2%的琼脂糖凝胶电泳分析,去离子水作空白对照。阳性(甲基化)标本:仅有甲基化引物特异性扩增产物,或甲基化和非甲基化引物均有特异性扩增产物。阴性(非甲基化)标本:仅有非甲基化引物特异性扩增产物。

表1 Parkin基因甲基化及非甲基化特异性PCR引物序列
1.3 统计学处理 应用SPSS13.0统计软件,计数资料以构成比表示,组间比较采用χ2检验。
2 结果
2.1 3种鼻咽组织Parkin基因甲基化情况比较 在慢性鼻咽炎症组织和正常鼻咽上皮组织中均未检测到Parkin基因甲基化,而在鼻咽癌组织中甲基化率为62.96%(34/54),3种鼻咽组织Parkin基因甲基化情况比较有统计学差异(P<0.05)。3种鼻咽组织Parkin基因甲基化特异性PCR检测电泳图见图1。
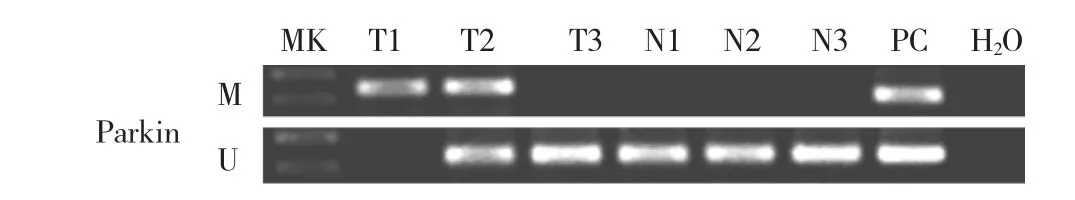
图1 3种鼻咽组织Parkin基因甲基化特异性PCR检测电泳图(M:甲基化特异性PCR;U:非甲基化特异性PCR;MK:Marker;T1、T2、T3:鼻咽癌组织;N1、N2:慢性鼻咽炎症组织;N3:正常鼻咽上皮组织;PC:阳性对照;H2O:阴性对照)
2.2 鼻咽癌组织Parkin基因甲基化情况与临床生物学因素的关系 见表2。
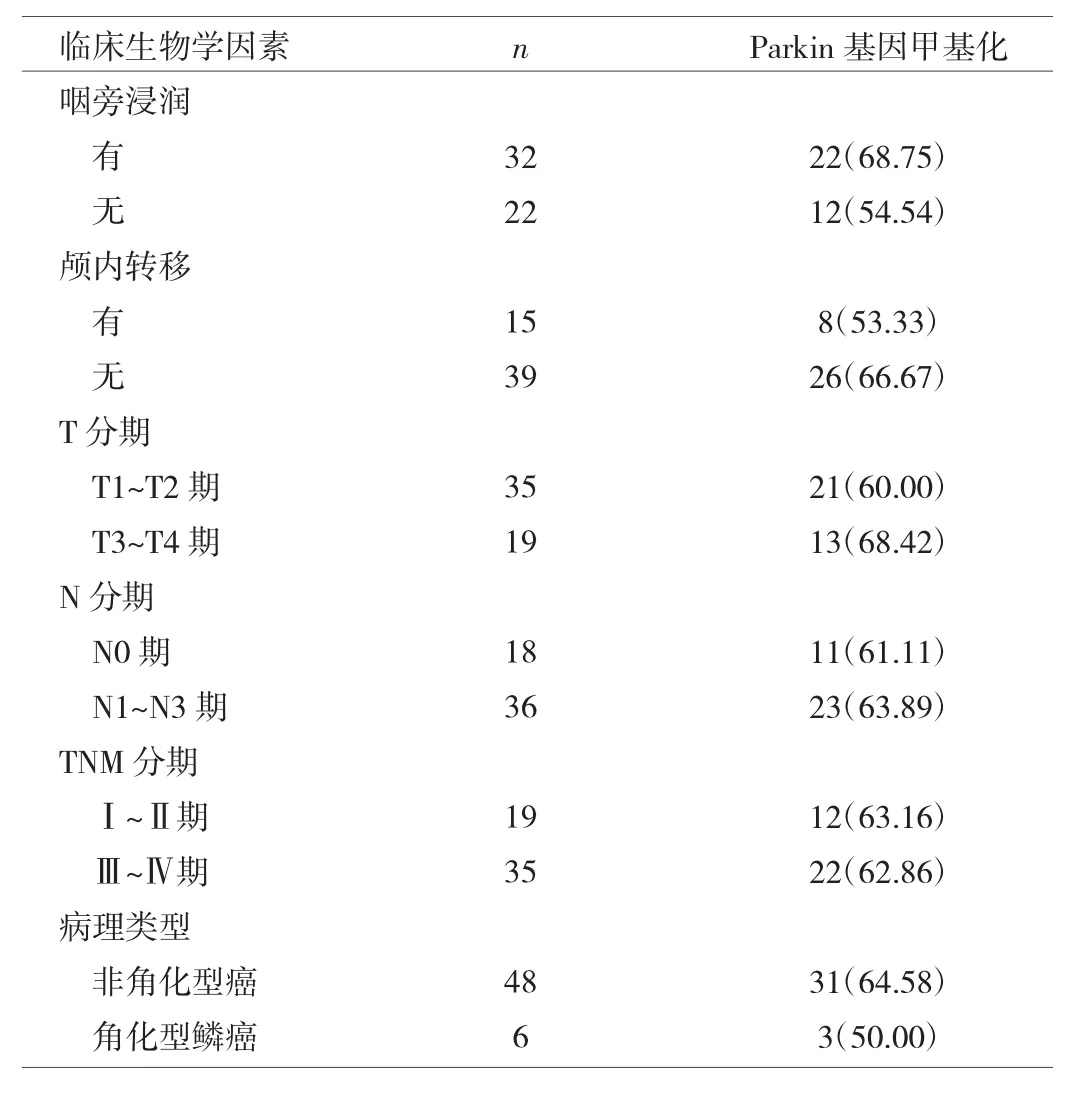
表2 鼻咽癌组织Parkin基因甲基化情况与临床生物学因素的关系[例(%)]
由表2可见,鼻咽癌组织Parkin基因甲基化情况与癌组织有无咽旁浸润、有无颅内转移、T分期、N分期、TNM分期、病理类型等临床生物学因素均无关(均P>0.05)。
3 讨论
鼻咽癌恶性度高,发病部位隐蔽,早期症状不明显,因而早期诊断困难,严重影响其治疗效果和预后。在过去20年里,我国鼻咽癌发病率及病死率几乎无明显改善,按现有设备、技术,如果每例鼻咽癌患者的临床分期能降低一期,则总的5年生存率可以提高20%,因此筛选和鉴定鼻咽癌早期诊断和预后判断的特异性分子生物学标志物意义重大。肿瘤相关基因甲基化是肿瘤发生的早期敏感指标,被认为是最有前景的肿瘤分子生物学标志物。甲基化的DNA检测应用于肿瘤早期诊断,其前提条件是发现和鼻咽癌发生、发展密切相关的甲基化基因。尽管基因甲基化与肿瘤的关系已经成为当前研究热点,而目前报道甲基化的鼻咽癌相关基因还为数不多。
Parkin基因最初被发现是遗传性少年型帕金森病的致病基因。Parkin蛋白在帕金森病中主要作用机制是作为一种E3类泛素蛋白连接酶参与蛋白质的泛素化过程。近年研究又发现Parkin基因与大肠癌[1]、肺癌[2-3]、白血病[4]、肝癌[6]、肾癌[7]、乳腺癌[8]、胰腺癌[9]、卵巢癌[10]、胶质细胞瘤[11]等多种肿瘤有关,因此Parkin基因被认为是一种新的肿瘤候选抑癌基因,但其在肿瘤中的作用并不仅限于参与蛋白质的泛素化过程。
Fujiwara等[6]研究发现肝癌中Parkin基因不是通过激活泛素连接酶促进蛋白体降解起作用,而是通过激活β连环蛋白促进卵泡抑素表达,加速肝细胞增殖。Wang等[12]报道Parkin基因通过与微管细胞骨架相互作用增加乳腺癌细胞对紫杉醇诱导细胞多核化和凋亡的敏感性,Lee等[13]研究发现Parkin基因可调节细胞有丝分裂,其缺陷可引起细胞基因组不稳定性,从而促进肿瘤发生。Gong等[14]和Lee等[15]分别发现Parkin基因作为一个关键的调节分子,可调节细胞周期蛋白的稳定性,引起细胞周期阻滞于G1/S期和G2/M期,从而抑制肿瘤细胞的生长。
本研究结果显示,在3种鼻咽组织中,Parkin基因甲基化只发生在鼻咽癌组织,具有肿瘤特异性,经统计学分析还发现其甲基化情况与鼻咽癌有无咽旁浸润、有无颅内转移、T分期、N分期、TNM分期、病理类型等临床生物学因素均无关。这提示Parkin基因甲基化可能在鼻咽细胞的癌变过程早期即发生,参与了鼻咽癌发生、发展的全过程,有望成为早期分子生物学诊断的标志物,然而将其推广应用还需要进行大样本、随机、前瞻性的临床研究支持。
综上所述,Parkin基因甲基化参与鼻咽癌发生、发展全过程,且具有肿瘤特异性,有助于鼻咽癌的早期诊断,但不能作为判断鼻咽癌临床预后的预测指标;将Parkin基因甲基化作为鼻咽癌早期分子生物学辅助诊断的标志物仍需进一步研究验证。
[1] Poulogiannis G,McIntyre R E,Dimitriadi M,et al.PARK2 deletions occur frequently in sporadic colorectal cancer and accelerate adenoma development in Apc mutant mice[J].Proc Natl Acad Sci USA,2010,107(34):15145-15150.
[2] Xiong D,Wang Y,Kupert E,et al.A recurrent mutation in PARK2 is associated with familiallung cancer[J].Am J Hum Genet,2015, 96(2):301-308.
[3] Iwakawa R,Okayama H,Kohno T,et al.Contribution of germline mutations to PARK2 gene inactivation in lung adenocarcinoma [J].Genes Chromosomes Cancer,2012,51(5):462-472.
[4] Agirre X,Roman-Gomez J,Vazquez I,et al.Abnormal methylation of the common PARK2 and PACRG promoter is associated with downregulation of gene expression in acute lymphoblastic leukemia and chronic myeloid leukemia[J].Int J Cancer,2006,118 (8):1945-1953.
[5] Zhang Z,Sun D,Van do N,et al.Inactivation of RASSF2A by promoter methylation correlates with lymph node metastasis in nasopharyngeal carcinoma[J].Int J Cancer,2007,120(1):32-38.
[6] Fujiwara M,Marusawa H,Wang H Q,et al.Parkin as a tumor suppressor gene for hepatocellular carcinoma[J].Oncogene, 2008,27(46):6002-6011.
[7] Toma M I,Wuttig D,Kaiser S,et al.PARK2 and PACRG are commonly downregulated in clear-cell renal cell carcinoma and are associated with aggressive disease and poor clinical outcome[J].Genes Chromosomes Cancer,2013,52(3):265-273.
[8] Tay S P,Yeo C W,Chai C,et al.Parkin Enhances the Expression of Cyclin-dependent Kinase 6 and Negatively Regulates the Proliferation of Breast Cancer Cells[J].J Biol Chem,2010,285 (38):29231-29238.
[9] Sun X,Liu M,Hao J,et al.Parkin deficiency contributes to pancreatic tumorigenesis by inducing spindle multipolarity and misorientation[J].Cell Cycle,2013,12(7):1133-1141.
[10] Mehdi S J,Ali A,Rizvi M M.Parkin gene alterations in ovarian carcinoma from northern Indian population[J].Pathol Oncol Res,2011,17(3):579-586.
[11] Lin D C,Xu L,Chen Y,et al.Genomic and Functional Analysis of the E3 Ligase PARK2 in Glioma[J].Cancer Res,2015,75 (9):1815-1827.
[12] Wang H,Liu B,Zhang C,et al.Parkin regulates paclitaxel sensitivity in breast cancer via a microtubule-dependent mechanism[J].J Pathol,2009,218(1):76-85.
[13] Lee S B,Kim J J,Nam H J,et al.Parkin Regulates Mitosis and Genomic Stability through Cdc20/Cdh1[J].Mol Cell,2015,60 (1):21-34.
[14] Gong Y,Zack T I,Morris L G,et al.Pan-cancer genetic analysis identifies PARK2 as a master regulator of G1/S cyclins[J]. Nat Genet,2014,46(6):588-594.
[15] Lee M H,Cho Y,Jung B C,et al.Parkin induces G2/M cell cycle arrest in TNF-α-treated HeLa cells[J].Biochem Biophys Res Commun,2015,464(1):63-69.
Parkin genepromoter methylation in nasopharyngeal carcinoma
JIANG Bo, NIHaifeng, ZHOU Zhen, etal. Departmentof Otolaryngology,Hangzhou First People's Hospital,Hangzhou 310006,China
【 Abstract】 Objective To investigate Parkin gene promoter methylation in nasopharyngeal carcinoma(NPC). Methods The methylation-specific PCR(MSP)was used to detect methylation level of Parkin gene in 54 tissue specimens of NPC,16 specimens of chronic nasopharyngitis and 16 specimens of normal nasopharyngeal epithelia tissues,and its relationship with the clinical and biological features of NPC was analyzed. Results Parkin gene promoter methylation was detected in 62.96%(34/54) ofNPC specimens,not in any specimens ofchronic nasopharyngitis and normal nasopharyngeal epithelia tissues(P<0.05).Parkin gene methylation was not correlated with clinicaland biologicalvariables ofNPC(all P>0.05). Conclusion Parkin gene promoter methylation has high specificity in distinguishing NPC from normal nasopharyngeal tissues and inflammatory nasopharyngeal disease,suggesting that it may be used for early molecular diagnosis ofNPC.
Parkin Nasopharyngealcarcinoma Methylation
2016-02-17)
(本文编辑:李媚)
浙江省医药卫生科技一般项目(2011KYA127);浙江省医药卫生骨干平台项目(2012RCB038)
310006 杭州市第一人民医院耳鼻咽喉头颈外科(江波、倪海峰、周珍、李勇);广西医科大学第一附属医院耳鼻咽喉头颈外科(黄光武)
倪海峰,E-mail:nihaifeng138@163.com

