CALLG2008方案治疗60岁以下初发成人急性B淋巴细胞白血病的临床研究
张开峰 韦菊英 黄健 俞文娟 孟海涛 麦文渊 佟红艳 金洁 钱文斌
●论 著
CALLG2008方案治疗60岁以下初发成人急性B淋巴细胞白血病的临床研究
张开峰 韦菊英 黄健 俞文娟 孟海涛 麦文渊 佟红艳 金洁 钱文斌
目的 评价按照中国成人急性淋巴细胞白血病(ALL)协作组制定的成人ALL序贯化疗整体方案(CALLG2008)治疗60岁以下初发成人B细胞ALL(B-ALL)的疗效,并比较分析不同危险因素分层亚组之间的治疗结果,观察异基因造血干细胞移植(Allo-SCT)对患者生存期的影响。方法 对2009年3月至2014年8月接受CALLG2008方案治疗的60岁以下初发成人B-ALL患者39例进行随访,分析接受该方案诱导治疗后患者的完全缓解(CR)率、毒性反应和总生存(OS)、无事件生存(EFS)情况。结果39例患者中3例早期死亡,其余36例中33例获CR,1个疗程CR率为91.7%。随访至2014年8月1日,中位随访时间25个月;预计3年OS率为53.7%,EFS率为45.6%。预后因素分析提示,患者年龄>35岁以及初诊时白细胞计数>30×109/L是预后的不良因素。Allo-SCT能显著延长患者尤其是高危组患者的OS期及EFS期。主要不良反应为血液学毒性反应,诱导治疗中有88.9%(32/36)出现Ⅳ级血液学毒性反应。结论 CALLG2008方案治疗60岁以下成人B-ALL有较高CR率及长期生存。患者年龄和初诊时白细胞计数是影响预后的重要因素。Allo-SCT可明显延长OS期。
急性淋巴细胞白血病 化疗 预后 Ph染色体
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是一组起源于淋巴系统的恶性肿瘤,成人ALL治疗效果不佳。尽管初治患者的完全缓解(CR)率可达80%~90%,但超过40%的患者会在1~2年内复发[1-2]。CALLG2008方案是由中国成人ALL协作组于2008年制定的非指南性成人ALL序贯化疗方案,包括诱导、强化、巩固、维持及庇护所治疗等一系列整体化疗方案,但其治疗成人ALL的长期疗效尚不十分清楚。本研究回顾性分析了浙江大学附属第一医院应用CALLG2008方案治疗的39例初发成人ALL患者临床资料,并对该方案诱导治疗后的CR率、毒性反应以及患者的总生存(OS)期、无事件生存(EFS)期进行评估。
1 对象和方法
1.1 对象 收集2009年3月1日至2014年8月1日在浙江大学附属第一医院血液科住院的年龄<60岁的初发成人B细胞ALL(B-ALL)患者39例,其中男17例,女22例,年龄14~57岁,中位年龄30岁。其它初诊时临床特征见表1。治疗采用CALLG2008方案。本研究为中国成人ALL协作组分中心项目,通过中心伦理委员会批准。

表1 ALL患者的临床特征
1.2 治疗方案 应用CALLG2008方案,预治疗采用CP方案,诱导治疗为VDCLP。对于Ph染色体阳性(Ph+)的患者加用伊马替尼400mg/d。早期巩固强化治疗采用序贯CAM方案、HD-MTX+VD方案、MA方案。早期巩固强化后,对有条件者行Allo-SCT,无条件者行晚期强化治疗。晚期强化治疗采用序贯VDLP方案、COATD方案、HD-MTX+L-ASP方案、TA方案。维持治疗为6-MP+MTX方案,与维持强化MOACD方案交替,详见表2。

表2 中国成人ALL协作组CALLG2008方案(2008)
1.3 支持治疗 治疗中常规预防口腔及肛周感染,辅以水化、碱化、止吐、护胃、解救等治疗。骨髓抑制期给予粒细胞集落刺激因子(G-CSF)升白细胞、输注血制品及抗感染等治疗。
1.4 诊断标准和疗效评价 诊断参照WHO关于前体B细胞肿瘤分类标准,免疫表型应用流式细胞仪检测,Ph染色体和bcr-abl融合基因应用常规染色体显带技术和逆转录定量实时PCR检测。疗效标准按照张之南等[3]主编的《血液病诊断及疗效标准》(第3版)。MRD阳性定义为>0.1%,毒性反应参照WHO急性和亚急性毒性反应分级标准。
早期死亡定义为诱导治疗开始后30d内死亡。OS为诊断到死亡或末次随访之间的时间。EFS为诊断到发生事件或末次随访之间的时间。事件定义为死亡、首次复发其中任意一项。
1.5 统计学处理 应用SPSS 13.0统计软件。Kaplan-Meier生存分析法绘制OS和EFS曲线。不同预后因素的生成曲线差异比较采用log-rank检验。
2 结果
2.1 疗效评估 39例患者中3例(7.7%)早期死亡,分别死于脑出血、呼吸衰竭和口底蜂窝织炎窒息。其余可评估疗效的36例患者中1个疗程33例CR,CR率91.7%。随访时间69个月,生存时间0.5~69个月,中位生存时间25个月。1年OS率69.2%(95%CI:0.562~0.853),EFS率66.7%(95%CI:0.534~0.832)。3年预期OS率为53.7%(95%CI:0.395~0.731),EFS率为45.6%(95% CI:0.316~0.656),见图1。先后有15例患者复发,复发率为38.5%,复发时间2~40个月,中位复发时间9个月。其中骨髓复发13例,中枢复发2例。晚期死亡15例,其中因感染死亡6例,脑出血死亡7例,中枢神经系统白血病死亡2例。

图1 36例ALL患者OS及EFS曲线
2.2 OS和EFS的单因素分析 参照中国成人ALL诊断与治疗专家共识,将患者年龄是否<35岁、初诊时白细胞计数、Ph染色体是否阳性、1个疗程后MRD、是否进行Allo-SCT纳入单因素分析。结果提示,年龄>35岁、初诊时白细胞计数>30×109/L、未进行Allo-SCT的患者预后不良(P<0.05或0.01);而Ph+与否及1个疗程后MRD是否<0.1%对生存影响均无统计学差异(均P>0.05)。生存分析图见图2。
2.3 不同危险度成人ALL患者的预后分析 根据患者年龄、发病时白细胞计数、Ph染色体及达到CR时间将患者分为标危组和高危组。标危组患者年龄<35岁、白细胞计数<30×109/L,4周内达到CR;高危组患者年龄≥35岁,白细胞计数≥30×109/L,Ph+和bcr-abl融合基因阳性,达到CR时间超过4周。两组生存分析结果显示,高危组患者的OS及EFS显著低于标危组,均有统计学差异(均P<0.01),见图3。
2.4 不良反应 化疗过程中主要的不良反应为血液学毒性反应,主要表现为粒细胞减少、贫血、血小板减少。其中3例患者早期死亡,其余36例患者中32例出现Ⅳ级血液学毒性反应,发生率88.9%。除血液学毒性反应外,常见并发症还包括不同程度的感染,包括呼吸道、口腔、肠道、肛周等部位感染,大部分经积极抗感染及对症支持等治疗后均能控制。
3 讨论
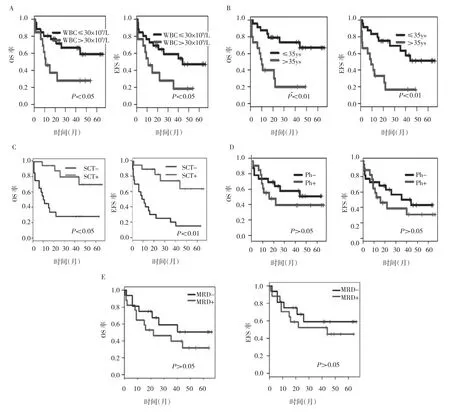
图2 成人ALL患者OS和EFS的单因素分析(A:初诊时白细胞计数对OS及EFS的影响;B:患者年龄对OS及EFS的影响;C:Allo-SCT与否对OS及EFS的影响;D:Ph+与否对OS及EFS的影响;E:1个疗程后MRD对OS及EFS的影响)
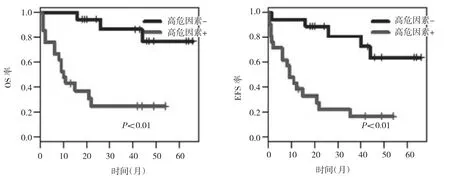
图3 高危因素对成人ALL患者OS和EFS的影响
由于成人ALL患者预后差,国际上对年龄<65岁、Ph染色体阴性(Ph-)的ALL治疗主要采用类似儿童ALL的强烈化疗方案[4]。以往,我国治疗成人ALL的诱导方案主要应用VDCP(长春地辛+柔红霉素+环磷酰胺+甲泼尼松)或VDLP(长春地辛+柔红霉素+左旋门冬酰胺酶+甲泼尼松)方案,患者的长期生存率较低。CALLG2008方案是由中国成人ALL协作组于2008年制定的成人ALL序贯化疗的方案,诱导治疗方案与国际接轨,采用VDCLP 5药联合方案。杨小珠等[5]采用CALLG2008方案治疗33例成人ALL患者,CR率达93.9%,1年OS率为66.7%,与本研究结果类似。本研究采用的CALLG2008方案治疗39例成人ALL患者,早期病死率为7.7%。1个疗程CR率达91.7%,预计3年OS率为53.7%,EFS率为45.6%,这个结果与DeAngelo等[4]采用类似儿童ALL的强烈化疗方案疗效相似。DeAngelo等[4]采用VDLP+HD-MTX方案进行诱导治疗,CR率为85.0%,4年OS率达67.0%,EFS率为69.0%。以上研究结果均提示应用类似儿童ALL的强烈化疗方案治疗成人ALL能提高患者的OS和EFS。
成年ALL患者的年龄和发病时白细胞计数是预后的高危因素[6-7]。国际大样本(1 521例)的多中心临床研究显示:Ph-的高危组患者[年龄>35岁和白细胞计数(B-ALL>30×109/L)]和标危组相比,5年的OS率分别是29.0%和54.0%[8]。本研究以年龄、白细胞计数、4周内是否达CR和Ph染色体是否阳性将患者分为高危组和标危组,临床随访结果显示两组患者的OS率和EFS率均有统计学差异。进一步进行亚组分析,同样发现≤35岁患者的3年OS率及EFS率(分别为68.0%和51.0%)均明显好于35岁以上者(分别为20.0%和18.0%)。但是,即使应用CALLG2008方案治疗,高危组患者预后也非常不理想;提示高危成人ALL的治疗方法有待进一步研究。
伊马替尼出现之前,Ph+的成人ALL预后很差,3年OS率通常<20.0%[9]。国际多中心临床研究证实,Ph+和Ph-的ALL患者的5年EFS率分别为16.0%和36.0%(P<0.01;调整年龄、性别和白细胞计数),5年OS率分别为22.0%和41.0%(P<0.01)[10]。伊马替尼显著改善了Ph+成人ALL患者的预后,Daver等[11]报道伊马替尼联合hyper-CVAD方案治疗,患者5年OS率达到43.0%。本研究中,伊马替尼联合VDLCP方案治疗,Ph-和Ph+的ALL患者3年OS率分别为56.0%和42.0%,EFS率分别为44.0%和32.0%,虽然Ph-的ALL患者生存要好于Ph+者,但无统计学差异,说明伊马替尼能够改善Ph+成人ALL患者的预后。
Allo-SCT在成人ALL治疗中占有非常重要的地位。国际多中心临床研究报道,Ph-的ALL患者移植后5年OS率显著高于不移植者,分别为53.0%和45.0%(P<0.05);移植者的白血病复发率也显著降低(P<0.01)[12]。同样,Allo-SCT也能显著改善Ph+的ALL患者的OS和EFS[9,13]。2014年NCCN指南推荐对Ph+、MRD阳性及有高危细胞遗传学改变的ALL患者进行Allo-SCT。本研究中,移植组患者的3年预期OS率为70.0%,而未移植组仅为28.0%,显著低于移植组(P<0.05)。因此,对高危成人ALL患者应积极实施Allo-SCT。
目前认为,MRD在判断成人ALL患者预后和指导治疗方面有重要作用[14-15]。Holowiecki等[16]报道,无论是标危组还是高危组患者,诱导治疗后MRD<0.1%者,其3年复发的风险明显低于MRD水平高者。标危组患者诱导治疗后MRD<0.1%,其3年复发率为9.0%;而≥0.1%者复发率达到71.0%(P<0.01)。但本组研究中,1个疗程结束时检测MRD水平发现对患者的生存无明显影响,笔者认为其原因可能与MRD检测手段或病例数较少有关。
总之,应用CALLG2008方案治疗60岁以下成人ALL有较高CR率和较长生存期,患者年龄、初诊时白细胞计数以及CR后是否行Allo-SCT是影响预后的重要因素。CALLG2008方案是治疗60岁以下成人ALL的有效、安全的方法,但尚需大样本临床研究证实。对高危成人ALL则应争取行Allo-SCT。
[1] Brüggemann M,G o kbuget N,Kneba M.Acute lymphoblastic leukemia:monitoring minimal residual disease as a therapeutic principle[J].Semin Oncol,2012,39(1):47-57.
[2] Ram R,Wolach O,Vidal L,et al.Adolescents and young adults with acute lymphoblastic leukemia have a better outcome when treated with prdiatic-inspired regimens:systematic review and meta-analysis[J].Am J Hematol,2012,87(5):472-478.
[3] 张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007: 131-134.
[4] DeAngelo D J,Stevenson K E,Dahlberg S E,et al.Long-term outcome of a pediatric-inspired regimen used for adults aged 18-50 years with newly diagnosed acute lymphoblastic leukemia [J].Leukemia,2015,29(3):526-534.
[5] 杨小珠,刘庭波,郑静,等.CALLG2008方案治疗成人急性淋巴细胞白血病的单中心疗效分析[J].中国实验血液学杂志,2013,21(4):886-890.
[6] Bassan R,Hoelzer D.Modern therapy of acute lymphoblastic leukemia[J].J Clin Oncol,2011,29(5):532-543.
[7] Yeoh AE,Tan D,LiC K,et al.Management ofadult and paediatric acute lymphoblastic leukaemia in Asia:resource-stratified guidelines from the Asian Oncology Summit 2013[J].Lancet Oncol, 2013,14(12):e508-523.
[8] Rowe J M,Buck G,Burnett A K,et al.Induction therapy for adults with acute lymphoblastic leukemia:results ofmore than 1 500 patients from the international ALL trial:MRC UKALL XII/ECOG E2993[J].Blood,2005,106(12):3760-3767.
[9] Mizuta S,Matsuo K,NishiwakiS,et al.Pretransplant administration of imatinib for allo-HSCT in patients with BCR-ABL-positive acute lymphoblastic leukemia[J].Blood,2014,123(15):2325-2332.
[10] Moorman A V,Harrison C J,Buck G A,et al.Karyotype is an independent prognostic factor in adult acute lymphoblastic leukemia(ALL):analysis ofcytogenetic data from patients treated on the Medical Research Council(MRC)UKALLXII/Eastern Cooperative Oncology Group(ECOG)2993 trial[J].Blood,2007, 109(8):3189-3197.
[11] Daver N,Thomas D,Ravandi F,et al.Final report of a phase II study of imatinib mesylate with hyper-CVAD for the front-line treatment ofadult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Haematologica,2015,100 (5):653-661.
[12] Ribera J M,Ribera J,Genescà E.Treatment of adolescent and young adults with acute lymphoblastic leukemia[J].Mediterr J HematolInfect Dis,2014,6(1):e2014052.
[13] Mizuta S,Matsuo K,Yagasaki F,et al.Pre-transplant imatinibbased therapy improves the outcome of allogeneic hematopoietic stem cell transplantation for BCR-ABL-positive acute lymphoblastic leukemia[J].Leukemia,2011,25(1):41-47.
[14] Beldjord K,Chevret S,AsnafiV,et al.Oncogenetics and minimal residual disease are independent outcome predictors in adult patients with acute lymphoblastic leukemia[J].Blood,2014,123 (24):3739-3749.
[15] Van Dongen J J,van der Velden V H,Brüggemann M,et al. Minimal residual disease diagnostics in acute lymphoblastic leukemia:need for sensitive,fast,and standardized technologies[J].Blood,2015,125(26):3996-4009.
[16] Holowiecki J,Krawczyk-Kulis M,Giebel S,et al.Status of minimal residual disease after induction predicts outcome in both standard and high-risk Ph-negative adult acute lymphoblastic leukaemia.The Polish Adult Leukemia Group ALL 4-2002 MRD Study[J].Br J Haematol,2008,142(2):227-237.
Efficacy and safety of CALLG2008 protocol in treatment of patients with incipient acute B lymphoblastic leukemia
ZHANG Kaifeng, WEI Juying,HUANG Jian,et al.Department of Hematology,the First Affiliated Hospital,Zhejiang University School of Medicine, Hangzhou 310003,China
【 Abstract】 Objective To evaluate the efficacy and safety of CALLG2008 protocol,which was suggested by China Collaborative Group of Acute Lymphoblastic Leukemia,in patients with incipient acute B lymphoblastic leukemia. Methods The clinical data of 39 patients aged<60 years with acute B lymphoblastic leukemia(B-ALL)receiving CALLG2008 protocol were reviewed.The event-free survival(EFS),overall survival(OS)rate and adverse events were assessed. Results Thirty-three (91.7%)patients showed complete remission.Median OS was 25 months.Three years estimated OS and EFS rates were 53.7% and 45.6%,respectively(median follow-up,25 months).Age>35 years and white blood cell count>30×109/L at diagnosis were associated with shorter OS and EFS.Allogeneic hematopoietic stem cell transplantation significantly prolonged the OS and EFS, especially in patients with high risks. Conclusion These data indicate that CALLG2008 protocol for ALL exhibits benefit in the improvement of outcomes of adult B-ALL patients.
Acute lymphoblastic leukemia Chemotherapy Prognosis Ph chromosome
2015-08-26)
(本文编辑:田云鹏)
浙江省卫生厅科研基金(2012KYA069);浙江省中医药管理局科研基金(2012ZA073);浙江省重点科技创新团队(2011R50015)
310003 杭州,浙江大学附属第一医院血液科(张开峰系进修医师,现在新昌县人民医院血液科工作)
韦菊英,E-mail:weijuy@hotmail.com

