肥大细胞浸润密度与浸润性乳腺癌分子分型关系的初步研究
黄韬,伊丹丹,桑剑锋
(南京医科大学鼓楼临床医学院 甲乳外科,江苏 南京 210008)
·论 著·
肥大细胞浸润密度与浸润性乳腺癌分子分型关系的初步研究
黄韬,伊丹丹,桑剑锋
(南京医科大学鼓楼临床医学院 甲乳外科,江苏 南京 210008)
目的:探讨浸润性乳腺癌(非特殊类型)各个预后影响因素及新辅助化疗对乳腺癌组织中肥大细胞密度(MCD)的影响,进一步分析肥大细胞浸润与乳腺癌新辅助化疗的相关性及临床意义。方法:(1) 采用甲苯胺蓝特殊染色法检测195例浸润性乳腺癌(非特殊类型)癌巢内肥大细胞浸润情况,由两名病理专科医师阅片并计数MCD,应用统计分析软件SPSS 22.0分析MCD与乳腺癌临床病理特征的关系。(2) 58例浸润性乳腺癌(非特殊类型)患者接受新辅助化疗,同样的方法分别计数新辅助化疗前后癌巢内MCD,并应用统计分析软件SPSS 22.0进行分析对比。结果:(1) 在195例浸润性乳腺癌(非特殊类型)中,ER阳性癌巢中MCD较ER阴性癌巢中高,PR阳性癌巢中MCD较PR阴性癌巢中高,差异均有统计学意义(P<0.05);浸润性小叶癌癌巢中MCD高于浸润性导管癌,但差异无统计学意义(P>0.05)。MCD与年龄、肿块大小、区域淋巴结状况、Her- 2及Ki67等因素无关(P>0.05)。Luminal各型之间相互比较,Luminal A、Luminal B型者癌巢中MCD较Her- 2过表达型及三阴型者高,但是仅Luminal B型者与三阴型者之间差异有统计学意义(P<0.05),其余各型之间差异无统计学意义(P>0.05)。(2) 新辅助化疗后患者癌巢内MCD明显高于新辅助化疗前,差异有统计学意义(P<0.05)。结论:激素受体阳性乳腺癌癌巢内肥大细胞浸润程度较激素受体阴性者高,提示肥大细胞可能通过ER、PR影响乳腺癌预后,乳腺癌患者化疗后癌巢中肥大细胞增多,从而可能发挥抗肿瘤作用。
浸润性乳腺癌; 肥大细胞; 辅助化疗
乳腺癌是女性最常见的恶性肿瘤,也是导致女性死亡的最主要的恶性肿瘤之一。乳腺癌的发病率现已超过子宫颈癌,跃居女性恶性肿瘤首位,占全部恶性肿瘤死亡率的14%[1],已成为女性健康的主要威胁之一。另一方面,除手术、化疗、放疗等造成的身体创伤外,女性性征的缺失导致的心理创伤同样值得我们关注[2]。随着近年来对本病认识的逐渐深入以及宣传的逐渐普及,加之诊断技术的不断提高,乳腺癌的早期诊断率已明显提高,而化疗方案的改进和内分泌治疗药物、靶向治疗药物的应用及升级使乳腺癌的预后更加乐观。保乳手术、微创手术的开展在治愈疾病的同时,也大大减轻了患者的生理、心理创伤。尽管如此,复发和远处转移仍是乳腺癌患者的主要死亡原因[3],因此乳腺癌的复发与远处转移一直是研究的热点之一,寻找一个新的治疗靶点对乳腺癌复发、转移的预防和治疗均具有十分重要的意义。
肥大细胞于1878年首次被发现,很长一段时间以来被认为是一种炎症反应相关细胞。近年来,肥大细胞与恶性肿瘤的关系越来越受到研究者的重视。众多研究显示,癌组织中肥大细胞聚集在多种恶性肿瘤如黑色素瘤[4]、霍奇金淋巴瘤[5]、胰腺癌[6]、前列腺癌[7]、食管癌[8]、慢性淋巴细胞性白血病[9- 10]等的病程中与预后不良、远隔转移等不良转归密切相关,提示肥大细胞在恶性肿瘤的发生发展中很可能起到了促进作用。另一方面,研究者们同样发现肥大细胞存在抑制肿瘤发生发展的作用[11- 15]。鉴于现有研究结论矛盾众多,肥大细胞与恶性肿瘤之间的关系暂无定论,仍需进一步深入研究。
肥大细胞与乳腺癌之间的关系同样尚不明确,数项关于肥大细胞浸润程度与乳腺癌预后关系的研究结果相悖[16- 18]。本研究通过检测乳腺癌组织内肥大细胞密度(MCD),结合患者的临床病理特征,分析肥大细胞浸润与乳腺癌分子分型及预后之间的关系,为今后乳腺癌的诊断、治疗提供有意义的生物学指标,探究新辅助化疗对乳腺癌组织中MCD的影响,进一步分析肥大细胞浸润与乳腺癌化疗的相关性及临床意义。
1 材料与方法
在取得患者知情同意后,收集整理南京鼓楼医院、江苏省中医院2014年1月1日至2015年12月31日间经手术切除或粗针穿刺活检确诊的浸润性乳腺癌(非特殊类型)患者195例及南京鼓楼医院、江苏省中医院2014年1月1日至2015年12月31日间经粗针穿刺活检确诊后行新辅助化疗患者58例的临床资料,用甲苯胺蓝染色法检测乳腺癌组织内肥大细胞的浸润密度,分析其与临床病理参数之间的关系。所有结果均由两名副高职称以上病理科专科医师依照指南规范[19]判定。甲苯胺蓝染色时肥大细胞呈红紫色,而背景则为蓝色,以HE染色片为阴性对照,以已知的阳性片作为阳性对照。每一切片随机选取5个低倍视野(×100),在高倍镜(×400)下计数20个高倍视野内的肥大细胞总数,取平均数作为每个高倍视野下肥大细胞计数值。数据均采用SPSS 22.0 for Windows统计软件进行分析,根据不同资料类型和统计目的采用不同类型的秩和检验(rank test),计量资料均用平均秩次表示。两组间差异比较采用两样本比较的秩和检验,配对比较的数据采用Wilcoxon符号秩和检验,3组及以上总体比较用多个样本比较的秩和检验。均以P<0.05为差异有统计学意义。
2 结 果
2.1 肥大细胞在乳腺癌组织中的浸润情况观察
肥大细胞阳性细胞呈紫红色,其内含多量异染颗粒,多呈局灶状分布于癌巢与正常组织分界处,少量散布于间质及癌巢内,而背景呈广泛蓝色(图1)。
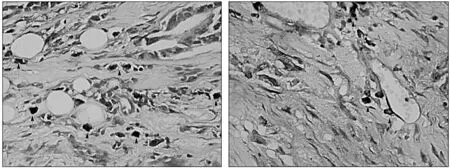
图1 乳腺癌组织中的肥大细胞(箭头处,甲苯胺蓝染色,×400)
2.2 MCD与浸润性乳腺癌临床病理参数之间的关系
在195例浸润性乳腺癌(非特殊类型)中,ER阳性癌巢中MCD较ER阴性癌巢中高,PR阳性癌巢中MCD较PR阴性癌巢中高,差异均有统计学意义(P<0.05);MCD与年龄、肿块大小、组织学类型、区域淋巴结状况、Her- 2及Ki67等因素无关(P>0.05)。不同肿块长径之间相互比较,各组间MCD差异均无统计学意义(P>0.05);Luminal各型之间相互比较,Luminal A、Luminal B型者癌巢中MCD较Her- 2过表达型及三阴型者高,但是仅Luminal B型者与三阴型者之间差异有统计学意义(P<0.05),其余各型之间差异无统计学意义(P>0.05)。见表1。
2.3 MCD与新辅助化疗之间的关系
共58例患者术前接受新辅助化疗,方案均为3周期TEC三周方案,即多西他赛(docetaxel,T)+表柔比星(epirubicin,E)+环磷酰胺(cyclophosphamide,C),剂量分别为75、50、500 mg·m-2体表面积。3个周期化疗完成后行病情评估,其中无完全缓解(complete remission,CR)病例,部分缓解(partial remission,PR)者49例,疾病稳定(stable disease,SD)者8例,疾病进展(progression of disease,PD)1例。新辅助化疗前后癌巢内MCD比较结果见表2。
3 讨 论
乳腺癌是女性最常见的恶性肿瘤之一,我国虽属乳腺癌低发区域,但近年来发病率不断上升,且乳腺癌发病趋向年轻化,已成为现代女性健康的主要威胁之一,局部复发和远处转移则是乳腺癌患者死亡的主要原因[20]。因此乳腺癌的综合治疗显得尤其重要[21],寻求一个新的治疗靶点成为乳腺癌精准治疗的关键。本研究发现癌巢内MCD与激素受体状态有关,ER阳性、PR阳性者分别高于ER阴性、PR阴性者,差异有统计学意义,而与患者年龄、肿块大小、区域淋巴结有无转移、Her- 2、Ki67等其他预后影响因素无关,提示激素受体阳性可能促进肥大细胞聚集,这一点与Rovere等[22]的研究结果一致。ER阳性、PR阳性乳腺癌对内分泌治疗敏感,预后相对较好。本实验结果显示ER阳性、PR阳性乳腺癌中MCD明显升高,肥大细胞浸润密度高者似乎预后较好,肥大细胞浸润密度与乳腺癌预后可能有一定相关性,但是仍需要进一步随访证实。
我们的研究同样发现,Luminal A型、Luminal B型浸润性乳腺癌癌巢中MCD高于Her- 2过表达型及三阴型,但仅Luminal B型与三阴型间MCD差异有统计学意义。结合MCD与ER、PR的关系,推测Luminal A型浸润性乳腺癌癌巢中MCD也应当高于三阴型,然而本研究中两者MCD差异虽然与推测相符,但差异并无统计学意义,考虑与样本量较少有关,希望后续研究可以增大样本量,明确两者的关系。另一方面,浸润性小叶癌癌巢中MCD明显高于浸润性导管癌,但差异无统计学意义(P>0.05),亦与先前研究结论[23]相符,差异无统计学意义考虑与浸润性小叶癌仅8例有关,如能扩大样本量,应能证实其差异性。
表1 MCD与乳腺癌预后影响因素之间的关系

影响因素例数平均秩次P值年龄0.207 <50岁79104.16 ≥50岁11693.81肿块长径0.469 <2cm91102.41 2~5cm9895.07 >5cm679.00 <2cm与2~5cm比较0.67 <2cm与>5cm比较0.62 2~5cm与>5cm比较0.79组织学类型0.164 浸润性导管癌18796.84 浸润性小叶癌8125.06淋巴结转移0.633 有11296.34 无83100.23ER0.001 阳性138106.86 阴性5776.54PR0.012 阳性134104.84 阴性6182.97Her-20.479 阳性4692.87 阴性14999.58Ki670.693 <15%39101.18 ≥15%156101.18分型0.011 LuminalA型3098.97 LuminalB型120106.12 Her-2过表达型2186.83 三阴型2465.96 LuminalA型与LuminalB型比较0.390.82 LuminalA型与Her-2过表达型比较0.580.75 LuminalA型与三阴型比较4.600.10 LuminalB型与Her-2过表达型比较2.100.35 LuminalB型与三阴型比较10.210.01 Her-2过表达型与三阴型比较1.540.46
表2 新辅助化疗前后MCD对比
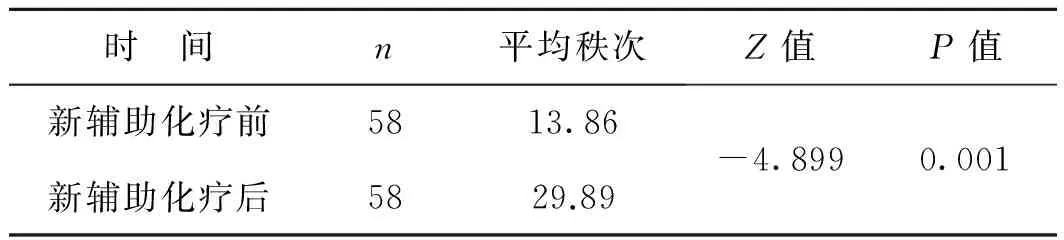
时 间n平均秩次Z值P值新辅助化疗前5813.86新辅助化疗后5829.89-4.8990.001
值得关注的是,本研究发现新辅助化疗后的乳腺癌组织内MCD较新辅助化疗前升高,差异有统计学意义。其机制可能为癌细胞在化疗药物作用下坏死,释放大量炎症介质,引起局部炎症,肥大细胞作为早期炎症反应细胞进入癌组织,释放多种细胞因子及酶类,招募其他炎症反应细胞,扩大炎症反应,同时亦招募成纤维细胞,促进其胶原合成功能的活化及维持[24],启动组织纤维修复,而最终纤维化、胶原化。
Rovere等[22]观察到在肥大细胞浸润密度较高的乳腺癌组织中肥大细胞吞噬癌细胞的现象,而本研究无论肥大细胞浸润密度高低,我们并未发现有肥大细胞吞噬的现象,可能与肥大细胞吞噬能力较弱,主要以脱颗粒释放炎症介质及抗肿瘤物质为作用机制有关,有待进一步实验观察。另一方面,Ueshima等[25]发现:若乳腺癌组织中肥大细胞内的KIR2DL4(killer- cell Ig- like receptor 2DL4,即CD158d)表达升高,其发生淋巴结转移的概率亦相应升高,提示肥大细胞与乳腺癌的关系可能并非简单的浸润密度关系,这一点值得我们深入探究。
本研究表明乳腺癌新辅助化疗后癌组织内MCD高于新辅助化疗前,差异有统计学意义。新辅助化疗后较化疗前升高,原因可能为癌细胞在化疗药物作用下坏死,释放大量炎症介质,引起局部炎症,肥大细胞作为早期炎症反应细胞进入癌组织,可能招募成纤维细胞促进组织纤维修复,同时通过释放炎症介质起到辅助抑制肿瘤的作用。如能在发挥肥大细胞抗乳腺癌作用的同时,抑制类胰蛋白酶的作用,则可为乳腺癌的治疗提供新的预后判断因素与治疗靶点。
[1] AHMEDIN J,FREDDIE B,MELISSA M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69- 90.
[2] 蔡雁,施晓群,金艳.乳腺癌患者术后乳房缺失心理体验的质性研究[J].中华护理杂志,2006,41(2):105- 108.
[3] JOSE R,HYE- JUNG H,YOSHINORI K,et al.New advances in breast cancer metastasis[J].Womens Health(Lond Engl),2008,4(6):547- 549.
[4] RIBATTI D,ENNAS M G,VACCA A,et al.Tumor vascularity and tryptase- positive mast cells correlate with a poor prognosis in melanoma[J].Eur J Clin Invest,2003,33(5):420- 425.
[5] GLIMELIUS I,EDSTRÖM A,FISCHER M,et al.Angiogenesis and mast cells in Hodgkin lymphoma[J].Leukemia,2005,19(12):2360- 2362.
[6] STROUCH M J,CHEON E C,SALABAT M R,et al.Crosstalk between mast cells and pancreatic cancer cells contributes to pancreatic tumor progression[J].Clin Cancer Res,2010,16(8):2257- 2265.
[7] NONOMURA N,TAKAYAMA H,NISHIMURA K,et al.Decreased number of mast cells infiltrating into needle biopsy specimens leads to a better prognosis of prostate cancer[J].Br J Cancer,2007,97(7):952- 956.
[8] ELPEK G O,GELEN T,AKSOY N H,et al.The prognostic relevance of angiogenesis and mast cells in squamous cell carcinoma of the oesophagus[J].J Clin Pathol,2001,54(12):940- 944.
[9] MOLICA S,VITELLI G,LEVATO D,et al.Increased serum levels of matrix metalloproteinase- 9 predict clinical outcome of patients with early B- cell chronic lymphocytic leukaemia[J].Eur J Haematol,2003,70(6):373- 378.
[10] MOLICA S,VACCA A,CRIVELLATO E,et al.Tryptase- positive mast cells predict clinical outcome of patients with early B- cell chronic lymphocytic leukemia[J].Eur J Haematol,2003,71(2):137- 139.
[11] TAN S Y,FAN Y,LUO H S,et al.Prognostic significance of cell infiltrations of immunosuveillance in colorectal cancer[J].World J Gastroenterol,2005,11(8):1210- 1214.
[12] 王先松,阮幼冰,武忠弼,等.肥大细胞对肝癌细胞毒性作用的体外实验研究[J].中华肿瘤杂志,1996,18(4):276- 278.
[14] OLDFORD S A,HAIDL I D,HOWATT M A,et al.A critical role for mast cells and mast cell- derived IL- 6 in TLR2- mediated inhibition of tumor growth[J].J Immunol,2010,185(11):7067- 7076.
[15] MALTBY S,KHAZAIE K,MCNAGNY K M.Mast cells in tumor growth:angiogenesis,tissue remodelling and immune- modulation[J].Biochim Biophys Acta,2009,1796(1):19- 26.
[16] AALTOMAA S,LIPPONEN P,PAPINAHO S,et al.Mast cells in breast cancer[J].Anticancer Res,1993,13(3):785- 788.
[17] HARTVEIT F,THORESEN S,TANGEN M,et al.Mast cell changes and tumour dissemination in human breast carcinoma[J].Invasion Metastasis,1984,4(3):146- 155.
[18] FISHER E R,SASS R,WATKINS G,et al.Tissue mast cells in breast cancer[J].Breast Cancer Res Treat,1985,5(3):285- 291.
[19] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2015版)[J].中国癌症杂志,2015,25(9):692- 754.
[20] 黄韬,伊丹丹,桑剑锋.肥大细胞在疾病发生发展预后中的作用[J].东南大学学报:医学版,2016,35(3):443- 448.
[21] 高小康,孙鹤庆.新辅助化疗对乳腺癌Cerb- B2表达的影响及其临床意义[J].现代医学,2013,41(11):787- 791.
[22] ROVERE F D,GRANATA A,MONACO M,et al.Phagocytosis of cancer cells by mast cells in breast cancer[J].Anticancer Res,2009,29(8):3157- 3162.
[23] KASHIWASE Y,MORIOKA J,INAMURA H,et al.Quantitative analysis of mast cells in benign and malignant breast lesions.Immunohistochemical study on formalin- fixed,paraffin- embedded tissues[J].Int Arch Allergy Immunol,2004,134(3):199- 205.
[24] HILL P B,MARTIN R J.A review of mast cell biology[J].Vet Derm,1998,9(3):145- 166.
[25] UESHIMA C,KATAOKA T R,HIRATA M,et al.The killer cell Ig- like Receptor 2DL4 expression in human mast cells and its potential role in breast cancer invasion[J].Cancer Immunol Res,2015,3(8):871- 880.
The preliminary study of the relationship between mast cell infiltratingdensity and Luminal types of invasive breast cancer
HUANG Tao,YI Dan- dan,SANG Jian- feng
(DepartmentofThyroidandBreastSurgery,DrumTowerClinicalCollegeAffiliatedofNanjingMedicalUniversity,Nanjing210008,China)
Objective: To investigate the mast cell density(MCD)in carcinoma nest of patients with invasive breast cancer(non- specific types), and analyze the correlation between MCD and clinical prognosis factors of breast cancer. Methods: (1) The MCD was calculated in 195 cases of invasive breast cancer(non- specific types)by two pathologists. Toluidine blue dyeing was used to examine the infiltration of mast cell. SPSS 22.0 statistic software was applied to analyze the data. (2) 58 cases of invasive breast cancer(non- specific types)accepted neo- adjuvant chemotherapy before surgery. We used the same procedure to calculate the MCD in cancer nest before and after neo- adjuvant chemotherapy. SPSS 22.0 statistic software was applied to analyze the data. Results: (1) The MCD were higher in invasive breast cancer nest with ER+and PR+than those with ER-and PR-respectively, the difference was significant(P<0.05). MCD were higher in invasive lobular carcinoma than in invasive ductal carcinoma, but the difference was not significant(P>0.05). The MCD were higher in Luminal A type and Luminal B type breast cancer nest than those in Her- 2 overexpression type and triple- negative type, but only the difference between Luminal B type and triple- negative type was significant(P<0.05), there was no differences between any other Luminal types(P>0.05). There were not enough evidences to prove that MCD was related to age, diameter of the mass, histological type, regional lymph nodes situation, Her- 2 and Ki67. (2) The MCD was lower in breast cancer nest before neo- adjuvant chemotherapy than that after neo- adjuvant chemotherapy. The difference was significant(P<0.05). Conclusion: The MCDs in hormone receptors positive breast cancers’ nest are higher than those in negative, which indicates that mast cell may have positive effect on breast cancer prognosis by ER and PR. MCD increases in cancer nest after neo- adjuvant chemotherapy, which may play a part in anti- cancer system.
invasive breast cancer; mast cell; neo- adjuvant chemotherapy
2016- 06- 21
2016- 08- 23
黄韬(1990-),男,江苏连云港人,在读硕士研究生。E- mail:lyghuangtao@163.com
桑剑锋 E- mail:drsangjianfeng@163.com
黄韬,伊丹丹,桑剑锋.肥大细胞浸润密度与浸润性乳腺癌分子分型关系的初步研究[J].东南大学学报:医学版,2016,35(6):956- 960.
R655.8
A
1671- 6264(2016)06- 0956- 05
10.3969/j.issn.1671- 6264.2016.06.026

