肝微粒体孵育体系中大黄酸及其代谢活化产物的检测方法研究
李恩泽,袁媛,邵华
(1.东南大学医学院 药理学教研室,江苏 南京 210009; 2.苏州大学药学院 药物代谢动力学教研室,江苏 苏州 215123; 3.东南大学附属中大医院 药剂科,江苏 南京 210009)
·论 著·
肝微粒体孵育体系中大黄酸及其代谢活化产物的检测方法研究
李恩泽1,袁媛2,邵华3
(1.东南大学医学院 药理学教研室,江苏 南京 210009; 2.苏州大学药学院 药物代谢动力学教研室,江苏 苏州 215123; 3.东南大学附属中大医院 药剂科,江苏 南京 210009)
目的:优化和建立大黄酸及其代谢活化产物检测方法,并应用于大黄酸肝微粒体代谢活化研究。方法:肝微粒体孵育样品以含3%甲酸的甲醇酸化并沉淀蛋白后,用API 4000LC- MS/MS对大黄酸和其活性代谢物大黄酸乙酰葡糖醛酸进行定性、定量分析。使用Agela Venusil XBP C18column(50×2.1 mm,3 μm)色谱柱,流动相为0.1%甲酸水- 乙腈梯度洗脱。ESI离子源在负离子模式下进行测定,多反应离子监测,用于定量分析的离子对为m/z 283.0→239.5(大黄酸)和459.0→283.0(大黄酸葡糖醛酸)。结果:大黄酸乙酰葡糖醛酸在PBS、甲醇中都不稳定,以含3%甲酸的甲醇处理后,大黄酸乙酰葡糖醛酸在样品溶液中稳定性良好。大黄酸和大黄酸乙酰葡糖醛酸的线性范围分别为100~25 000 nmol·L-1和10~5 000 nmol·L-1,日内和日间RSD均<10.7%,准确度在95.8%~112%之间。最适宜孵育时间优化为40 min。结论:本实验所建立的肝微粒体体系中大黄酸及其代谢活化产物大黄酸乙酰葡糖醛酸的测定方法简便、可行,为进一步研究大黄酸的代谢活化提供了基础。
大黄酸; 大黄酸乙酰葡糖醛酸; 代谢活化; 高效液相色谱- 质谱联用
大黄酸是中药大黄的主成分之一,而大黄是我国四大最常用中药之一,被广泛运用于多种疾病治疗[1]。大黄酸同时也广泛地分布在其它中草药中,比如何首乌、番泻叶、虎杖等。大黄酸也是口服双醋瑞因的主要入血成分,双醋瑞因是欧洲批准上市被用于治疗骨关节炎的常用药物[2]。大黄酸具有多种药理活性,包括抗菌、保肝、抗肿瘤、防治糖尿病等[3- 5]。
葡糖醛酸结合反应是人体内最为重要、也最为普遍的肝脏生物转化。对于含有羧基的有机酸药物而言,与葡糖醛酸结合生成乙酰葡糖醛酸也是其消除的主要途径。但是,近年来的体内、体外研究表明乙酰葡糖醛酸具有反应活性,可以通过与蛋白质共价结合而引起不良反应[6]。根据文献报道,大黄酸在肝脏中会发生强烈的二相代谢反应,主要代谢途径为葡糖醛酸化[7]。大黄酸的葡糖醛酸化会生成3种葡糖醛酸代谢产物,两个为大黄酸的羟基葡糖醛酸,一个为大黄酸乙酰葡糖醛酸,该大黄酸乙酰葡糖醛酸也有一定反应活性[8]。由于大黄酸乙酰葡糖醛酸标准品难以获得,并且因其反应活性并不稳定,建立大黄酸代谢活化研究的检测方法较为困难。目前尚无大黄酸乙酰葡糖醛酸的定性与定量研究方法报道。因此,本实验拟优化并建立大黄酸及其乙酰葡糖醛酸代谢物检测方法,并应用于大黄酸体外肝脏代谢活化研究,为大黄酸的合理使用提供理论依据。
1 材料与方法
1.1 试剂与仪器
岛津20A高效液相色谱仪,包括DGU- 20A在线脱气机、LC- 20AD双泵、SIL- 20A自动进样器和CBM- 20A控制器。API 4000型四极杆串联质谱仪(美国ABI公司),配备电喷雾离子化源(ESI)。
大黄酸、大黄酸乙酰葡糖醛酸、金丝桃苷(纯度>97.0%)购于成都普瑞科技有限公司,乙腈、甲酸(色谱纯)购于美国默克公司。
1.2 实验方法
1.2.1 色谱检测方法
色谱柱:AgelaVenusil XBP C18柱,(50×2.1 mm,3 μm),流动相:0.1%甲酸水溶液(A)- 乙腈(B),梯度洗脱(0~0.5 min,10% B;0.5~1.5 min,10%~30% B;1.5~6.0 min,30%~70% B;6.0~7.0 min 70%~100% B;7.0~8.0 min 100%~10% B;8~10 min,10% B);流速:0.3 ml·min-1;进样量:5 μl。质谱采用电喷雾离子源(ESI),负离子模式下以多反应监测方式(MRM)进行定量分析。电喷雾电压(IS):4 500 V;离子源温度(TEM):450 ℃;辅助气1(GS1):55,辅助气2(GS2):55;气帘气压力(CUR):30;大黄酸、大黄酸乙酰葡糖醛酸和金丝桃苷的定量分析离子对分别为m/z 283.0→239.5,459.0→283.0和463.1→300.0。
1.2.2 方法专属性考察
在高温灭活微粒体配置的温孵体系中同时加入大黄酸、大黄酸乙酰葡糖醛酸、金丝桃苷标准品,用3倍体积含有3%甲酸的甲醇沉淀蛋白后离心取上清后进样。考察液相色谱- 串联质谱仪(LC- MS/MS)法是否能够分别将3种药物从样品中检测到,以及在该方法下能否将3种药物完全分离。
1.2.3 线性关系考察
在高温灭活微粒体配置的温孵体系中,稀释系列浓度大黄酸(100、200、500、1 000、2 000、5 000、10 000、15 000、20 000、25 000 nmol·L-1)以及大黄酸乙酰葡糖醛酸(10、20、50、100、200、500、1 000、2 000、5 000 nmol·L-1)样品溶液,加入内标溶液后,用3倍体积含有3%甲酸的甲醇沉淀蛋白并离心取上清后进样。以化合物理论浓度为横坐标,化合物与内标的峰面积比值为纵坐标,用加权(Weight=1/x2)最小二乘法进行回归计算,得到标准曲线。
1.2.4 精密度与准确度考察
在高温灭活微粒体配置的温孵体系中,分别稀释高、中、低3个浓度大黄酸样品溶液(500、5 000、10 000 nmol·L-1)和大黄酸乙酰葡糖醛酸样品溶液(50、500、1 000 nmol·L-1),每个浓度样品3份。加入内标溶液后,用3倍体积含有3%甲酸的甲醇沉淀蛋白并离心取上清,于同日内和连续3天分别测定。记录色谱图,计算药物峰面积和内标峰面积的比值,代入当天的标准曲线求得实测浓度,计算日内、日间精密度。
用已知含大黄酸(200 nmol·L-1)或大黄酸乙酰葡糖醛酸(20 nmol·L-1)的样品溶液作为基质溶液,加入大黄酸(终浓度500、5 000、10 000 nmol·L-1)和大黄酸乙酰葡糖醛酸储备液(终浓度50、500、1 000 nmol·L-1)制成样品溶液,分别测定基质溶液和所配样品溶液中大黄酸和大黄酸乙酰葡糖醛酸的量,以测得样品溶液和基质溶液的差值与加入量的百分比计算精密度。
1.2.5 大鼠肝微粒体温孵体系反应条件优化
1.2.5.1 温孵反应条件 分别取冻存大鼠肝微粒体(RLM)、人肝微粒体(HLM)融化后,以新鲜配制的50 mmol·L-1磷酸盐缓冲溶液(含5 mmol·L-1MgCl2,20 μg·ml-1丙甲菌素,5 mmol·L-1D- 葡萄糖二酸- 1,4- 内酯)稀释,并加入底物大黄酸,置37 ℃恒温水浴预孵育10 min后加入2 mmol·L-1尿苷二磷酸葡萄糖醛酸(UDPGA)启动反应。
1.2.5.2 温孵反应后样品处理 分别配置含大黄酸和大黄酸乙酰葡糖醛酸的温孵样品,停止反应,加入内标溶液后分别向样品种加入3倍体积的PBS、甲醇、含3%甲酸甲醇,离心去除蛋白取上清后在室温下放置。分别在0、5、8、10、24、48 h后测定其中大黄酸以及大黄酸乙酰葡糖醛酸含量,选取合适样品处理方法。
1.2.5.3 温孵时间考察 取“1.2.5.1”项中RLM和HLM的温孵体系,固定蛋白浓度分别为1.6 mg·ml-1(RLM)和1.0 mg·ml-1(HLM),加入UDPGA后开始计时,于0 min、5 min、20 min、40 min、1 h、2 h、4 h、8 h后终止反应,加入内标溶液后用3倍体积含有3%甲酸的甲醇沉淀蛋白并离心取上清进行测定。以大黄酸和大黄酸乙酰葡糖醛酸对时间做非线性回归曲线,即得孵育时间对大黄酸代谢的影响。
2 结 果
2.1 方法专属性
在以上的实验条件下,温孵样品的内源性物质均不干扰样品的检测。如图1所示,大黄酸(rhein)的保留时间为5.6 min左右,大黄酸乙酰葡糖醛酸(RAG)的保留时间为4.3 min左右,内标金丝桃苷(IS)的保留时间为3.3 min左右,三者完全达到了基线分离,证实该液相方法对于检测大黄酸和大黄酸乙酰葡糖醛酸专属性良好。

Rhein:大黄酸;RAG:大黄酸乙酰葡糖醛酸;IS:内标金丝桃苷
图1 大黄酸和大黄酸葡糖醛酸的LC- MS/MS色谱图
2.2 线性范围
大黄酸(100~25 000 nmol·L-1)和大黄酸乙酰葡糖醛酸(10~5 000 nmol·L-1)在各自的浓度范围内线性关系良好,两者的回归方程如下:大黄酸:Y=0.049 7X-0.000 659,(r=0.998 5);大黄酸乙酰葡糖醛酸:Y=0.000 195X-0.000 523,(r=0.998 4)。本实验所建立的LC- MS/MS法可以对大黄酸及其代谢活化产物大黄酸乙酰葡糖醛酸进行有效分离及定量测定。
2.3 精密度与准确度
在所建立的LC- MS/MS检测条件下,大黄酸与大黄酸乙酰葡糖醛酸的精密度和准确度,如表1所示。其中内日、日间的精密度都小于10.73%,加样回收的准确度在95.8%~112.0%之间,结果显示所建立方法具有良好的精密度与准确度。
表1 大黄酸与大黄酸乙酰葡糖醛酸检测的精密度与准确度

物质浓度/nmol·L-1精密度(RSD)/%日间日内准确度/%大黄酸5001.279.29112.050004.0110.73110.2100003.846.71110.5大黄酸乙酰葡糖醛酸504.982.8795.85005.152.89101.110002.473.04106.1
2.4 温孵样品处理条件优化
大黄酸和大黄酸乙酰葡糖醛酸在温孵的样品溶液中用不同的溶剂处理后,其稳定性差异较大。如图2所示,大黄酸在经PBS溶液、甲醇溶液以及含3%甲酸的甲醇溶液处理后,稳定性都较好,含量在48 h之内保持稳定。但是大黄酸乙酰葡糖醛酸在甲醇以及PBS溶液处理的样品中稳定性较差,随着时间的延长含量迅速下降。但在含3%甲酸的甲醇溶液处理的样品中,大黄酸乙酰葡糖醛酸含量稳定,48 h后仍有95%以上保留在样品中。结果显示,大黄酸的肝微粒体代谢反应样品应该用3%甲酸的甲醇溶液处理,保证活化代谢物的稳定性。

图2 大黄酸和大黄酸乙酰葡糖醛酸在PBS、甲醇和含3%甲酸的甲醇溶液中的稳定性
2.5 温孵时间优化
大黄酸在大鼠及人肝微粒体代谢体系中孵育不同时间后,其原型药物大黄酸及其代谢活化产物乙酰葡糖醛酸的含量随时间变化如图3所示。在0~40 min内大黄酸原药的减少以及乙酰葡糖醛酸的增加都呈线性关系,40 min后反应速度增加变慢。结果显示40 min内的大黄酸代谢反应呈线性,可选择40 min作为孵育时间。
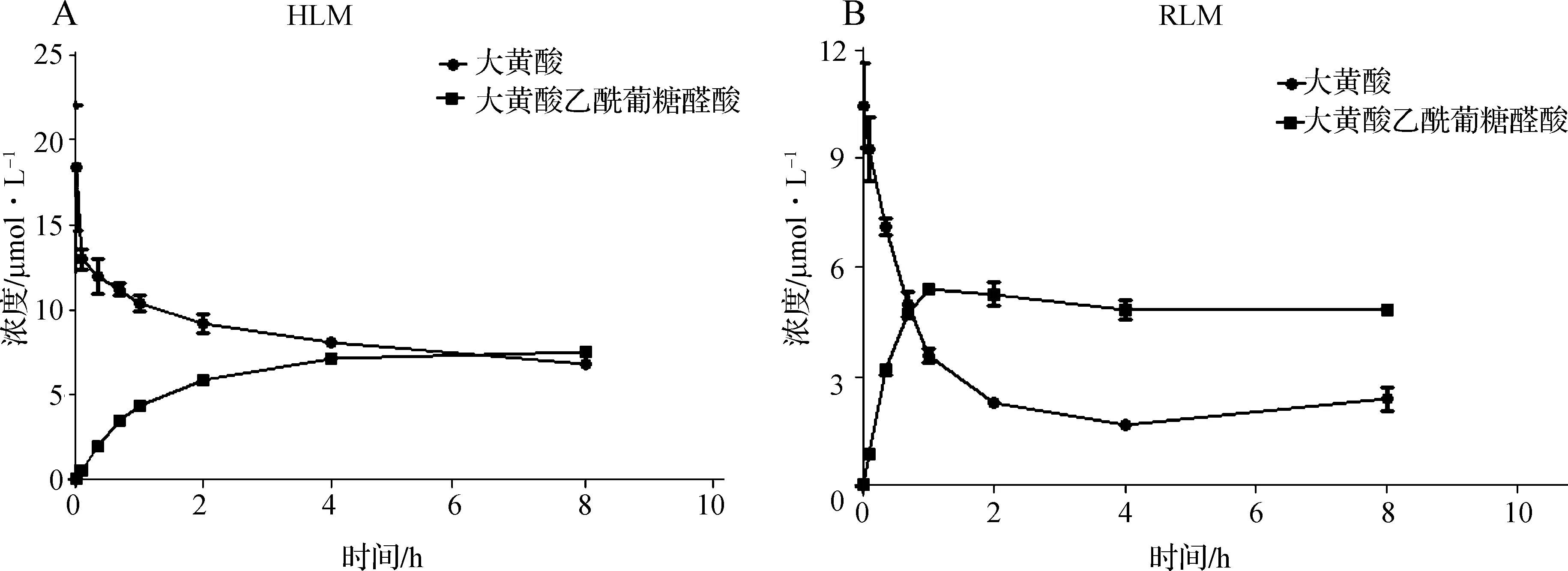
A.人肝微粒体孵育体系(HLM); B.大鼠肝微粒体孵育体系(RLM)
图3 不同孵育时间后大黄酸和大黄酸乙酰葡糖醛酸的含量变化
2.6 大黄酸在人以及大鼠肝微粒体中的代谢
将大黄酸分别与大鼠与人肝微粒孵育40 min后,除大黄酸乙酰葡糖醛酸外,还生成两个m/z 459.0→283.0的代谢产物,如图4所示,提示这两个代谢产物为大黄酸的羟基葡糖醛酸代谢产物。并且在人和大鼠肝微粒体中,产生活化代谢产物乙酰葡糖醛酸的比例存在明显的种属差异。在人肝微粒体中,大黄酸主要代谢路径为活化代谢产物乙酰葡糖醛酸,而在大鼠肝微粒体中,大黄酸主要被代谢成没有反应活性的羟基葡糖醛酸代谢产物。
3 讨 论
有机酸类药物可以经过葡糖醛酸化转化为乙酰葡糖醛酸代谢产物,许多有机酸药物的乙酰葡糖醛酸代谢产物具有反应活性[9]。乙酰葡糖醛酸可以进一步发生分子内迁移、糖醛酸开环、烷基化等反应,因此乙酰葡糖醛酸的反应活性。经过对样品处理方法的优化,大黄酸乙酰葡糖醛酸在含3%甲酸的甲醇溶液处理过的样品溶液中稳定性良好,可以用来进行代谢活化研究。

A.大黄酸与人肝微粒体孵育40 min样品溶液; B.大黄酸与大鼠肝微粒体孵育40 min样品溶液
图4 大黄酸和大黄酸葡糖醛酸的LC- MS/MS色谱图
大黄酸被证实在人肝微粒体中有较强的代谢活化,会生成大黄酸乙酰葡糖醛酸。临床上许多有机酸类药物的不良反应与其代谢活化相关,例如因不良反应被退市的阿氯芬酸、苄达酸、苯恶洛芬、芬氯酸[11]等。乙酰葡糖醛酸醛酸引起不良反应的机制是因其反应活性,与人体内蛋白质、DNA等生物大分子发生共价结合,破坏生物大分子的功能等。临床上有关于服用富含大黄酸的大黄、何首乌引起肝毒性的报道[12- 13],这可能与大黄酸的代谢活化相关。本实验提供了检测大黄酸代谢活化的方法,为今后研究大黄酸的代谢活化与临床不良反应的关系提供了基础。
在温孵样品的检测中,除了大黄酸乙酰葡糖醛酸外,本实验还检测到两个与大黄酸乙酰葡糖醛酸同样离子对的代谢产物。两者的质谱图与大黄酸乙酰葡糖醛酸一致,这两个代谢产物为两个大黄酸的羟基葡糖醛酸(RG1,RG2)。其中RG1与内标并未完全分离,但是由于质谱的多离子反应监测,RG1和IS的监测离子对并不相同,因此两者不会影响各自的检测。
本研究结果显示,大黄酸的葡糖醛酸化代谢途径在大鼠和人肝微粒体中表现出明显的种属差异。在大鼠的肝微粒中主要代谢为两个没有反应活性羟基葡糖醛酸代谢产物,而在人肝微粒体中主要代谢为有反应活性的乙酰葡糖醛酸代谢产物,即代谢活化路径。结果提示在人体中大黄酸的代谢活化较大鼠更为严重。
本实验建立并验证了肝微粒体体系中大黄酸及其代谢活化产物大黄酸乙酰葡糖醛酸的检测方法,并揭示了大黄酸在人肝微粒中有较强的代谢活化。
[1] 焦东海,杜上鉴.大黄研究[M].上海:上海科学技术出版社,2000:252- 255.
[2] 张林,陆军,李永刚.骨关节炎中介导软骨细胞代谢失衡的相关信号通路研究进展[J].东南大学学报:医学版,2013,32(4):465- 472.
[3] 刘凯,郑海生,李应东.大黄酸的药理作用研究述略[J].中医药学刊,2004(22):1732- 1734.
[4] 李强.大黄药理与临床应用[J].现代中西医结合杂志,2011(5):165- 166.
[5] HUANG Q,LU G,SHEN H M,et al.Anti- cancer properties of anthraquinones from rhubarb[J].Med Res Rev,2007,27:609- 630.
[6] REGAN S L,MAGGS J L,HAMMOND T G,et al.Acyl glucuronides:the good,the bad and the ugly[J].Biopharm Drug Dispos,2010,31:367- 395.
[7] DAHMS M,LOTZ R,LANG W,et al.Elucidation of phase Ⅰ and phase Ⅱ metabolic pathways of rhein:species differences and their potential relevance[J].Drug Metab Dispos,1997,25:442- 452.
[8] BOELSTERLI U A.Acyl glucuronides:mechanistic role in drug toxicity[J].Current Drug Metabolism,2011,12:213- 214.
[9] MIYASHITA T,KIMURA K,FUKAMI T,et al.Evaluation and mechanistic analysis of the cytotoxicity of the acyl glucuronide of nonsteroidal anti- inflammatory drugs[J].Drug Metabolism and Disposition,2014,42:1- 8.
[10] SHIPKOVA M,ARMSTRONG V W,OELLERICH M,et al.Acyl glucuronide drug metabolites:toxicological and analytical implications[J].Ther Drug Monit,2003,25:1- 16.
[11] ZIMMERMAN H J.Hepatic injury associated with nonsteroidal anti- inflammatory drugs[M]∥.LEWIS A J,FURST D E.Nonsteroidal antiinflammatory drugs:mechanisms and clinical use.New York:Marcel Dekker,1994:171- 194.
[12] 许英.中药的药物性肝损害30例临床分析[J].现代中西医结合,2005(14):600- 601.
[13] National Library of Medicine. National Institutes of Health,U.S[EB/OL].http://livertox.nih.gov/ShouWuPian.htm
Study of the analytical method of rhein and its activated metabolites in liver microsome incubations
LI En- ze1,YUAN Yuan2,SHAO Hua3
(1.DepartmentofPharmacology,MedicalSchoolofSoutheastUniversity,Nanjing210009,China; 2.DepartmentofPharmacokinetics,CollegeofPharmaceuticalSciences,SoochowUniversity,Suzhou215123,China;3.DepartmentofPharmacy,ZhongdaHospital,SoutheastUniversity,Nanjing210009,China)
Objective: To optimize and establish an analytical method for determination of rhein and its activated metabolite, and further apply in the study of metabolic activation of rhein in liver microsomes. Methods: Incubation samples of liver microsomes was deproteinized by addition of methanol containing 3% formic acid. API 4000 LC- MS/MS was used to qualitatively and quantitatively determine rhein and rhein acyl glucuronide. Samples were analyzed on an Agela Venusil XBP C18column(50×2.1 mm, 3 μm)adopting a gradient elution. MRM mode in negative ionization was chosen and ion transitions were monitored as rhein, 283.0→239.5; rhein glucuronides, 459.0→283.0. Results: Rhein acyl glucuronide was not stable in PBS and methanol, but it was stable in the sample solution processed by methanol containing 3% formic acid. A good linearity of rhein and rhein acyl glucuronide was obtained in the range of 100-25 000 nmol·L-1and 10-5 000 nmol·L-1, respectively. Intra- and inter- day variations were <10.7% and great accuracies of95.8%-112% were achieved at the concentrations examined. The incubation time was optimized as 40 min. Conclusion: The established method is stable and applicable, and can be used for the determination of rhein and rhein acyl glucuronidations in human liver microsomes(HLM)and rat liver microsomes(RLM). Our study also provides experimental foundation for the further investigation of metabolic activation of rhein.
rhein; rhein acyl glucuronidations; metabolic activation; liquid chromathgraphy tandem mass spectrometry
2016- 05- 03
2016- 08- 04
李恩泽(1991-),女,陕西咸阳人,在读硕士研究生。E- mail:lienze0413@126.com
邵华 E- mail:gycsh@163.com
李恩泽,袁媛,邵华.肝微粒体孵育体系中大黄酸及其代谢活化产物的检测方法研究[J].东南大学学报:医学版,2016,35(6):894- 899.
R969
A
1671- 6264(2016)06- 0894- 06
10.3969/j.issn.1671- 6264.2016.06.013

