SynGAP(1- 700aa)中670- 685aa缺失突变质粒的构建及表达
张清秀,魏秀娥,高红,荣良群
(徐州医科大学第二附属医院 神经内科,江苏 徐州 221006)
·论 著·
SynGAP(1- 700aa)中670- 685aa缺失突变质粒的构建及表达
张清秀,魏秀娥,高红,荣良群
(徐州医科大学第二附属医院 神经内科,江苏 徐州 221006)
目的:缺失突变SynGAP(1- 700aa)- Flag中的670- 685aa片段,为后续实验中新的药物靶点的鉴定提供可靠理论依据。方法:以前期构建好的pCMV- SynGAP(1- 700aa)- Flag 质粒为模板,重叠延伸PCR技术缺失突变670- 685aa片段,扩增出目的片段;限制性内切酶将载体线性化,然后分别纯化目的片段与线性化载体;利用同源重组技术连接目的片段与线性化载体,获取重组质粒;PCR技术鉴定重组质粒构建成功,测序进一步验证质粒碱基正确;将质粒转入293T细胞,免疫印迹鉴定能否成功表达。结果:重叠PCR成功缺失突变670- 685aa片段,成功构建重组质粒,且测序正确。免疫印迹结果表明,SynGAP(1- 700aa)缺失突变670- 685aa片段后仍可成功表达。结论:成功缺失突变SynGAP(1- 700aa)中的670- 685aa片段,并且在细胞株中稳定表达。该质粒的成功构建,为我们的后续研究奠定实验基础。
SynGAP; 重叠延伸聚合酶链式反应; 缺失突变
突触GTP酶活化蛋白(SynGAP)是神经元Ras GTP酶活化蛋白(RasGAP),在大脑内选择性表达,在兴奋性突触中高度表达,受CaMKⅡ磷酸化调控,自身负调控Ras的活性及其下游的信号通路。SynGAP不仅在神经元发育及突触可塑性中具有重要作用,在缺血性脑损伤中也发挥调控作用。Rong 等[1]发现脑缺血后SynGAP表达受抑制。Song等[2]发现脑缺血后SynGAP丝氨酸磷酸化水平显著增加,导致MAPK信号通路的激活,保护脑缺血神经元损伤。SynGAP可通过与PSD- 95、NMDAR受体形成复合物,调节ERK/MAPK信号通路、突触可塑性以及学习记忆[3]。我们前期实验已经证实PSD- 93可以与SynGAP结合,且结合位点位于SynGAP的670- 685aa片段,因此我们拟构建SynGAP的突变体,期望为后续研究及临床应用提供新的思路。
1 材料与方法
1.1 主要试剂
质粒抽提试剂盒(Promega,A1460);In- FusionTMPCR Cloning Kit(美国clontech,639626);限制性内切酶XhoⅠ、KpnⅠ(New England Biolabs,R0136V);Taqpolymerase(SinoBio,E001- 02B);dNTPs(Takara,D4030A);5kb DNA ladder Marker[富酶泰斯生物技术(深圳)有限公司,SM0311];琼脂糖(上海赛百盛基因技术有限公司,GA4- 100);Primer(上海捷瑞生物工程有限公司);DMEM培养基(Gibco,10- 013- CV);胎牛血清(FBS,杭州四季青生物技术有限公司);10×PEI(Sigma- Aldrich,40,872- 7);FLAG antibody(Sigma- Aldrich,#F1804)[4];Goat- anti- mouse IgG(H+L)- HRP(南京巴傲得生物技术有限公司)。
1.2 主要仪器
PCR仪(美国应用生物系统公司,ABI2720),positive clone测序仪(美季生物技术公司,ABI3730),凝胶成像仪(广州誉维生物科技仪器有限公司,Tanon 1600R),细菌摇床(太仓华利达实验设备有限公司,HI- 9211K),细菌培养箱(上海一恒科学仪器有限公司,LRH- 500F),高速离心机[日立(中国)有限公司,TGL- 16G- A],电泳仪(美国Bio- Rad),电转仪(美国Bio- Rad)。
1.3 工具载体
GV143(4.8kb),pCMV- SynGAP(1- 700aa)- Flag质粒,293T细胞。
1.4 载体酶切
在总体积为10μl酶切体系中,工具载体GV143(4.8kb) 1μl,XhoⅠ和KpnⅠ各0.5μl,10×buffer 1μl, 100×BSA 0.5μl,不足ddH2O补足,37℃双酶切2h获得线性化载体。然后胶回收试剂盒纯化线性化载体。
1.5 重叠PCR获取缺失突变质粒
以构建好的SynGAP(1- 700aa)质粒为模板,引物P1:5′- TACCGGACTCAGATCTCGAGATGAGCAGGTCTCGAGCCTCCATC- 3′,P2:5′- GATCCCGGGCCCGCGGTACCGTCAGCACCTCCCAGAGTAGGGCATGCAGTGTGGAGAG- 3′,P3:5′- GTAGGGCATGCAGTGTGGAGAGCTCTCGGCCATTGGAGATCTCATACAAAAACTGC- 3′,其中P1、P2分别为目的基因片段的上下游引物,P3为中间缺失基因序列的上下游碱基构成,按照Promega试剂盒说明书,通过重叠PCR缺失突变670- 685aa序列。首先以P1和P3引物缺失670- 685aa序列,获得2058bp片段a,然后以P1和P3为引物,序列a为模板,获取2094bp 片段b,那么序列b则为最终的目的片段,琼脂糖凝胶电泳初步鉴定其扩增大小与目的基因片段大小相近。胶回收试剂盒纯化目的片段,然后与载体相连,PCR验证,测序。
1.6 重组质粒构建
将纯化好的线性化载体GV143以及目的基因片段以一定比例加入到10μl反应体系中,10×buffer 1μl,DNA连接酶1μl,DNA∶pCMV- C- Flag=9∶1,16℃,4h,琼脂糖凝胶初步鉴定重组质粒大小[5]。
1.7 PCR鉴定重组质粒构建成功
以构建好的重组质粒为模板,根据目的片段序列设计上下游引物P1:5′- GTGCCCTGTTGAAGGACC- 3′,P2:5′- CGTCGCCGTCCAGCTCGACCAG- 3′,通过PCR鉴定目的片段与载体是否成功连接。然后抽提质粒,测序。
1.8 免疫印迹检测重组质粒表达情况
PEI转染法将纯化好的重组质粒转入293T细胞。根据前期实验条件,分别用无血清培养基稀释质粒与10×PEI。2 μg质粒与2μl PEI混匀后,静置15 min,期间将细胞全培养液换为无血清培养液,然后将质粒加入细胞培养液中,2~3h换为正常培养基,培养48 h,收集细胞,超声破碎细胞,BCA法测蛋白,SDS- PAGE凝胶电泳检测融合蛋白表达情况。
2 结 果
2.1 目的基因片段的获取
前期实验已经构建SynGAP(1- 700aa)片段质粒,免疫印迹证明其可在细胞内过表达。实验需要将SynGAP(1- 700aa)质粒的(670- 685aa)氨基酸缺失掉,因此,我们采用缺失突变重叠PCR技术获得最终目的基因。结果见图1。

1.缺失掉670- 685aa片段的SynGAP(1- 700aa)线性化DNA片段; 2.5kb DNA Marker
图1 重叠延伸PCR技术获取目的基因
Fig 1 Obtain targeted gene by overlap extension PCR technology
2.2 载体酶切
工具载体GV143(4.8kb)经XhoⅠ和KpnⅠ双酶切,37℃酶切2h获得线性化载体。酶切结果见图2。
2.3 PCR验证重组质粒构建成功
将PCR获得的目的基因以及酶切获得的线性化载体回收纯化(胶回收试剂盒),PCR产物交换入线性化表达载体,然后PCR鉴定重组质粒构建成功。鉴定结果见图3。
2.4 重组质粒表达检测
将构建好的质粒PEI法转入293T细胞,转染24 h,观察转染率,并收集细胞,检测目的蛋白的表达情况。结果显示,重组质粒转染率大于80%(图4A),与对照组(未转染质粒的人胚肾293T细胞)相比,目的蛋白在细胞内表达量显著增加,表明目的基因构建成功(图4B)。
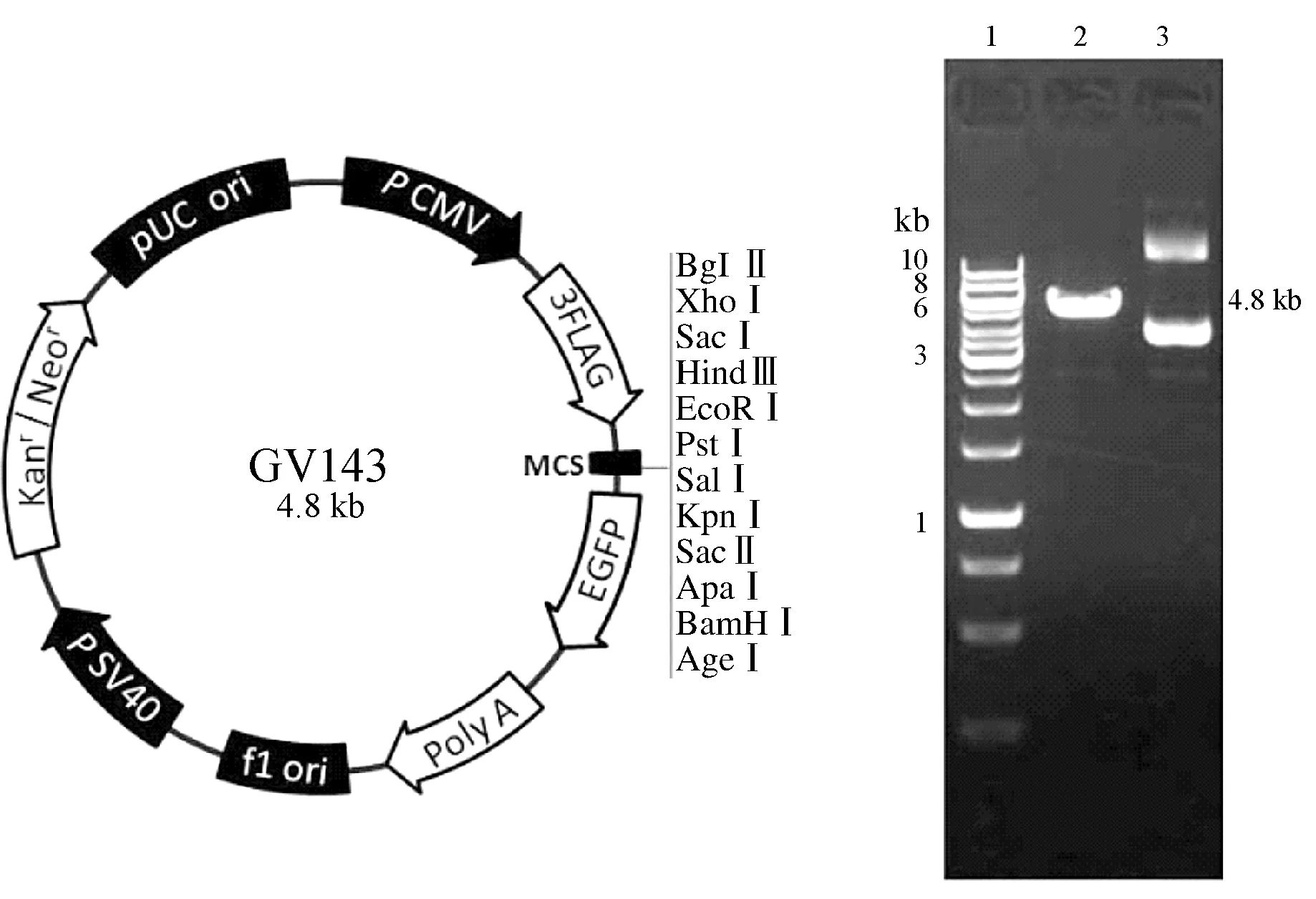
1.10kb Marker; 2.载体酶切产物;3.未酶切载体
图2 载体及载体线性化酶切结果
Fig 2 GV143 vector and its linearized vector digested by endonuclease

1.阴性对照(ddH2O);2.阴性对照(空载自连对照组);3.阳性对照(GAPDH);4.Marker,自上而下依次为5 kb、3 kb、2 kb、1.5 kb、1 kb、750 bp、500 bp、250 bp、100 bp;5~7.SynGAP1 1~3号转化子
图3 PCR鉴定重组质粒构建成功
Fig 3 Identify the recombinant plasmid was successfully constructed using PCR
3 讨 论
神经元特异性RasGTP酶活化蛋白SynGAP,在哺乳动物前脑的突触后致密部高度表达。SynGAP是一个复杂的基因,具有多个结构域。其可通过剪切形成不同的异构体,SynGAP mRNA的可变剪切形成C- 末端的多种异构体,包括α、β、γ。SynGAP的N- 末端具有ras- GAP结构域,而其C2结构域则主要与Ca2+以及脂筏结合。研究发现,SynGAP C- 末端的QTRV是与PSD- 95/SAP90的第3个PDZ结构域结合必需的,并使其串集于NMDAR形成多蛋白复合物,参与脑损伤[6]。

图4 免疫印迹检测质粒表达情况 ×200
Fig 4 Western blotting isused to detect the plasmid expression ×200
SynGAP作为信号通路中的关键蛋白之一,其上游受NMDAR及CAMKⅡ、CDK5调控,下游负调控小G蛋白,如ras、rap等,同时也负调控AMPA受体向兴奋性突触后膜运输[7],参与调控各种病理生理机制,在脑缺血、智力低下、儿童自闭症、突触可塑性中都发挥重要作用。SynGAP1基因突变可导致一些疾病,典型的就是儿童智力低下和儿童自闭症。研究发现,SynGAP1从头截短突变导致非综合征性智力障碍(NSID)[8]。SynGAP1- /+杂合子具有与精神分裂症类似的行为表征。Guo等[9]发现,SynGAP1的表达减少将会导致异常的行为。前期研究显示,SynGAP在神经系统发育以及突触可塑性中具有重要作用。SynGAP1与NMDAR受体及PSD95结合,调节骨架蛋白Actin及AMPAR受体上膜,进而影响突触可塑性以及长时程增强效应(LTP)[10]。synGAP与 PSD- 95相互作用决定树突棘的生成及成熟树突棘大小[11- 12]。此外,SynGAP- /- 导致小鼠出生后1周内死亡[13]。Knuesel等[14]发现SYNGAP1蛋白减少会促进凋亡,这与我们的前期研究结果一致。脑缺血后synGAP与 PSD- 93结合,激活下游的Ras信号通路,介导细胞凋亡。
SynGAP突变会导致一系列神经疾病,作为信号网络中的关键成员之一,研究其结构及功能具有重要作用。因此,我们在前期研究基础上,成功构建了SynGAP突变体,为后续研究提供新的靶向。
[1] RONG R,YANG H,RONG L,et al.Proteomic analysis of PSD- 93 knockout mice following the induction of ischemic cerebral injury[J].Neurotoxicology,2016,53:1- 11.
[2] SONG B,MENG F,YAN X,et al.Cerebral ischemia immediately increases serine phosphorylation of the synaptic RAS- GTPase activating protein SynGAP by calcium/calmodulin- dependent protein kinase II alpha in hippocampus of rats[J].Neurosci Lett,2003,349(3):183- 186.
[3] KOMIYAMA N H,WATABE A M,CARLISLE H J,et al.SynGAP regulates ERK/MAPK signaling,synaptic plasticity,and learning in the complex with postsynaptic density 95 and NMDA receptor[J].J Neurosci,2002,22(22):9721- 9732.
[4] 齐斌,任威,李春江,等.NLRP3基因真核表达载体的构建和定位[J].现代医学,2014,42(4):363- 366.
[5] 沈涛,杨礼庆,李妍,等.hPlk2基因真核表达载体的构建及蛋白的表达和定位[J].东南大学学报:医学版,2012,31(2):162- 165.
[6] RUMBAUGH G,ADAMS J P,KIM J H,et al.SynGAP regulates synaptic strength and mitogen- activated protein kinases in cultured neurons[J].Proc Natl Acad Sci U S A,2006,103(12):4344- 4351.
[7] WALKUP W G T,WASHBURN L,SWEREDOSKI M J,et al.Phosphorylation of synaptic GTPase- activating protein(synGAP) by Ca2+/calmodulin- dependent protein kinase Ⅱ(CaMKII) and cyclin- dependent kinase 5(CDK5) alters the ratio of its GAP activity toward Ras and Rap GTPases[J].J Biol Chem,2015,290(8):4908- 4927.
[8] PARKER M J,FRYER A E,SHEARS D J,et al.De novo,heterozygous,loss- of- function mutations in SYNGAP1 cause a syndromic form of intellectual disability[J].Am J Med Genet A,2015,167A(10):2231- 2237.
[9] GUO X,HAMILTON P J,REISH N J,et al.Reduced expression of the NMDA receptor- interacting protein SynGAP causes behavioral abnormalities that model symptoms of Schizophrenia[J].Neuropsychopharmacology,2009,34(7):1659- 1672.
[10] HUANG K.SYNGAP:bridging the gap between genetic factors and autosomal non- syndromic mental retardation[J].Clin Genet,2009,76(2):149- 151.
[11] VAZQUEZ L E,CHEN H J,SOKOLOVA I,et al.SynGAP regulates spine formation[J].J Neurosci,2004,24(40):8862- 8872.
[12] JEYABALAN N,CLEMENT J P.SYNGAP1:Mind the Gap[J].Front Cell Neurosci,2016,10:32.
[13] MUHIA M,FELDON J,KNUESEL I,et al.Appetitively motivated instrumental learning in SynGAP heterozygous knockout mice[J].Behav Neurosci,2009,123(5):1114- 1128.
[14] KNUESEL I,ELLIOTT A,CHEN H J,et al.A role for synGAP in regulating neuronal apoptosis[J].Eur J Neurosci,2005,21(3):611- 621.
Construction and expression of SynGAP(1- 700aa)plasmid mutanted deletion at 670- 685aa residues
ZHANG Qing- xiu,WEI Xiu- e,GAO Hong,RONG Liang- qun
(DepartmentofNeurology,SecondAffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou221006,China)
Objective: To mutant deletion 670- 685aa fragments of SynGAP(1- 700aa)- Flag plasmid,to provide a reliable theoretical basis for subsequent experiments on identification of new drug targets. Methods: The constructed pCMV- SynGAP(1- 700aa)- Flag plasmid as template,mutanted deletion 670- 685aa and amplified fragment by overlap extension PCR(SOE PCR) ; then made vector linearized with restriction endonuclease,and purified amplified fragment and the linearized vector; connected the linearized vector and amplified fragment by homologous recombination technology to obtain recombinant plasmid; PCR technology was used to identify if recombinant plasmid was successfully constructed,sequence technology was used to further verify bases in constructed plasmid; and finally transfected the mutanted plasmid into 293T cells,collected cells after 48 hours,Western blot was used to identify whether it could express sucessfully. Results: 670- 685aa was mutanted deletion successfully by SOE PCR,and recombinant plasmid was successfully constructed,and the sequence results was correct.Western blot analysis showed that SynGAP(1- 700aa) plasmid mutanted deletion 670- 685aa could express successfully. Conclusion:SynGAP(1- 700aa) plasmid mutantes deletion 670- 685aa successfully,and it can be expressed stably in cell lines.The successfully constructed plasmid will be an experimental basis for our follow- up study.
SynGAP; gene splicing by overlap extension PCR; deletion mutation
2016- 06- 28
2016- 07- 17
国家自然科学基金青年项目(81301120);江苏省高校自然科学基金面上项目(13KJB320027)
张清秀(1980-),女,江苏徐州人,副主任医师,医学博士。E- mail:zhangqingxiu@163.com
荣良群 E- mail:rongliangqun@163.com
张清秀,魏秀娥,高红,等.SynGAP(1- 700aa)中670- 685aa缺失突变质粒的构建及表达[J].东南大学学报:医学版,2016,35(6):832- 835.
Q782
A
1671- 6264(2016)06- 0832- 04
10.3969/j.issn.1671- 6264.2016.06.002

