肺癌细胞中NKG2D配体MICA及ULBP高表达及其在CIK介导的肿瘤细胞杀伤中的作用
殷小伟,卢绪章,毛正道,张倩,曹琦,黄燕华
(南京医科大学附属常州第二人民医院 1.呼吸科,2.血液科,江苏 常州 213161)
·论 著·
肺癌细胞中NKG2D配体MICA及ULBP高表达及其在CIK介导的肿瘤细胞杀伤中的作用
殷小伟1,卢绪章2,毛正道1,张倩1,曹琦1,黄燕华1
(南京医科大学附属常州第二人民医院 1.呼吸科,2.血液科,江苏 常州 213161)
目的:探索肺癌细胞中NKG2D配体的表达量及其与CIK细胞介导的肿瘤细胞毒性的关系。方法:在肺癌组织、癌旁组织及肺癌细胞株中用实时荧光定量PCR及蛋白质免疫印迹法检测NKG2D配体的表达量。应用流式细胞仪检测肿瘤细胞株A549和QG56表面NKG2D配体的表达情况。体外分离培养CIK细胞,比较NKG2D单克隆抗体预处理CIK细胞和无NKG2D单克隆抗体预处理CIK细胞介导的肿瘤细胞毒性。结果:NKG2D在肺癌组织及肺癌细胞株中高表达。CIK细胞对肺癌细胞株A549表现出较强的细胞毒性,但用NKG2D单克隆抗体预处理CIK细胞后可显著降低这种作用(P<0.05)。结论:NKG2D配体在肺癌组织和肺癌细胞株中高表达。对于CIK细胞介导的肺癌细胞杀伤作用,NKG2D与其配体的相互作用至关重要。
肺癌; NKG2D配体; CIK细胞; MICA/B
肺癌是最常见的危害人类健康的恶性肿瘤之一,近年来,世界各国肺癌的发生率和死亡率均呈上升趋势,每年约有130万人死于肺癌[1]。近20年来,随着对肺癌研究的深入,一些分子靶向药物应用于临床,在部分肺癌患者的治疗方面获得一定成效,但总体5年生存率仍然低于15%[2]。目前人们已经认识到,肿瘤的发生发展与机体免疫状态尤其是细胞免疫密切相关,因此随着多学科治疗模式的逐步形成,免疫治疗作为继手术、化疗及放疗后的第4种肿瘤治疗手段受到人们的广泛关注,能否通过生物免疫的方法治疗肺癌同样值得研究。
肿瘤生物免疫治疗主要是通过免疫细胞对肿瘤细胞的识别和杀伤。免疫细胞可以通过分泌细胞因子促进肿瘤细胞的凋亡,还可以通过免疫细胞表面的活化性受体识别肿瘤细胞表面相应的配体对肿瘤细胞实施杀伤[3- 5]。目前细胞因子诱导的杀伤(cytokine induced killer,CIK)细胞输注被广泛应用于肿瘤的治疗并取得一定的临床效果[6- 7]。CIK细胞是骨髓或者外周血来源的多克隆淋巴细胞,包括NK细胞、T细胞和NKT细胞。NKG2D的受体和配体相互作用,可以激活免疫细胞介导的杀伤作用,同时NKG2D还可以作为协同刺激分子增强T细胞受体的信号传导,从而介导T细胞杀伤肿瘤的作用[8]。NKG2D和其相应的配体相互作用介导的免疫系统反应在调节主动免疫和特殊免疫中起重要作用,对肿瘤及病原体有重要的免疫监督作用。目前已经发现NKG2D特异的配体分子主要包括MICA/B和ULBPs两类,是NKG2D发挥杀伤活性的主要配体[9]。本研究旨在探索肺癌细胞中NKG2D配体的表达量及其与CIK细胞介导的肿瘤细胞毒性的关系。
1 材料与方法
1.1 临床样本收集
本研究获得常州第二人民医院伦理委员会批准。所有患者均签署书面的知情同意书。肺癌病人经常州第二人民医院病理科确诊,无其它特殊的纳入及排除标准。
1.2 细胞株
肺癌细胞株A549和QG56购自中国科学院典型培养物保藏委员会(上海,中国)。用含10%胎牛血清(Gibco,USA)的DMEM高糖培养基(Hyclone,USA)于37℃、5% CO2培养箱中培养细胞。
1.3 CIK细胞培养
采用密度梯度离心法分离人外周血单核细胞(PBMCs),CIK细胞的具体培养参照本课题组发表的实验方法[10]。PBMCs采用RPMI 1640培养基培养,加入10% 胎牛血清和1000 U·ml-1γ干扰素(IFNγ;PROSPEC,USA)。培养24 h后加入50 ng·ml-1人源 抗- CD3 单克隆抗体(武汉生物制品研究所,武汉,中国)和1000 U·ml-1重组人白细胞介素- 2(rhIL- 2;PROSPEC,USA)。细胞培养过程中每隔3 d在原培养瓶中加入配制好的新鲜培养基,连续培养3周后收集CIK细胞。
1.4 RNA提取与实时荧光定量PCR
采用Trizol(Invitrogen,USA)法提取临床组织RNA,抽提所得RNA参照Superscript Ⅱ Reverse Transcriptase(Invitrogen,Carlsbad,CA)说明逆转录合成cDNA并于-20℃长期保存。根据NCBI提供基因序列,用Primer5设计引物序列,MICA正向引物5′- GAGCTCCCAGCATTCTACTAC- 3′,MICA反向引物 5′- GGTGTCGTGGCTCAAAGATA- 3′;ULBP2正向引物 5′- GAGAGGTGGTGGACATACTTAC- 3′,ULBP2反向引物5′- CAAGCCATCCTATACAGTCTCC- 3′;GAPDH 正向引物5′- CTATTCGATGCCGTGTATGC- 3′,GAPDH反向引物5′- GCCTGGTCCAGACTTCTTTC- 3′。引物序列送由上海生工生物工程股份有限公司(上海,中国)合成。
1.5 Western- blot检测组织中相关蛋白表达
提取肺癌及癌旁组织蛋白,BCA法测定蛋白浓度。运用10%聚丙烯酰胺凝胶(SDS- PAGE)电泳分离蛋白,PVDF膜转膜后5%脱脂牛奶封闭。用含一抗MICA(1∶500;Abcam Inc,USA),β- actin(1∶10000;Cell Signaling Inc,USA) 稀释液于4℃孵育过夜。用TBST洗涤膜5次,用含羊抗兔二抗(1∶6000;Santa Cruz Biotechnology,USA) 和羊抗鼠二抗(1∶10000;Santa Cruz Biotechnology,USA)稀释液室温孵育2h。应用ECL化学发光显色,Image J进行灰度值分析,以β- actin为内参进行灰度分析。
1.6 细胞毒性实验
A549和QG56细胞株分别与0.1μmol·L-1CAM(Calcein Acetoxymethyl Ester,Sigma Aldrich,USA)于37℃下避光共孵育15 min,然后用含10%胎牛血清的培养基洗两遍。含10%胎牛血清的DMEM培养基重悬细胞,按照一定比例种植于96孔板中。按照Effector- To- Target比(E∶T)为10的比例添加CIK细胞,终体积为 200μl。共培养细胞体系于37℃避光孵育10h,PBS洗涤细胞5次,用100μl结合缓冲液(10mmol·L-1HEPES/NaOH,140mmol·L-1NaCl,2.5mmol·L-1CaCl2,pH7.4)重悬细胞,加入10μl 7- Amino- actinomycin D(7- AAD;Molecular Probes,USA)混匀。室温避光孵育10 min后用流式细胞仪进行分析。CIK对靶细胞的杀伤作用用特异性裂解率来表示,计算公式为:特异性裂解率=(CT- TE/CT)×100%,CT为无CIK细胞时的活靶细胞百分比,TE为CIK细胞与靶细胞共孵育后的活细胞百分比。在NKG2D阻滞实验中,CIK细胞与10μg·ml-1抗- NKG2D抗体37℃共孵育30 min后将其加入靶细胞中。
1.7 流式细胞术检测细胞株中NKG2D配体表达
收集细胞,MICA/B(Clone 6D4,eBioscience,USA) 和ULBP1,ULBP3和ULBP2(R&D Systems,USA)分别与细胞共孵育30 min,流式细胞仪(BD FACS Canto Ⅱ)检测细胞株NKG2D配体表达。结果采用 FlowJo 软件(Tri Star,Inc.,Ashland,USA)进行分析。
1.8 统计学处理
所有实验重复至少3次,应用SPSS 17.0进行统计分析。数据用均数±标准差表示,组间比较采用t检验或单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 NKG2D配体在癌组织中高表达
采用qRT- PCR检测NKG2D配体在24例肺癌组织及5例正常组织中的表达,结果显示,与正常组相比NKG2D配体MICA和ULBP2在肺癌组织中显著高表达,平均上调倍数为5.5(P<0.05,图1A)。同时Western- blot检测肺癌组织及正常组织中MICA蛋白表达,与正常组相比,肺癌组织中MICA蛋白表达显著上调,平均上调倍数为3.5(P<0.05,图1B、C)。

A. 肺癌组与正常组NKG2D配体相对表达量

B. 蛋白质免疫印迹法检测MICA蛋白表达

C. 肺癌组与正常组MICA蛋白相对表达量
与正常组比较,aP<0.05
图1 NKG2D配体MICA和ULBP2在肺癌组织及正常组织中的蛋白和基因表达
2.2 NKG2D配体在肺癌细胞株中的表达
培养肺癌细胞株A549和QG56,流式细胞术分别检测细胞表面NKG2D配体表达。肺癌细胞株A549和QG56中均表达NKG2D和HLA Ⅰ类分子,且MICA分子在A549细胞株中的表达量较QG56高(图2、表1)。
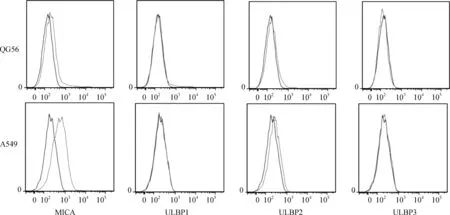
图2 NKG2D配体在肺癌细胞株中的表达
表1 肺癌细胞株中NKG2D配体表达 MFI
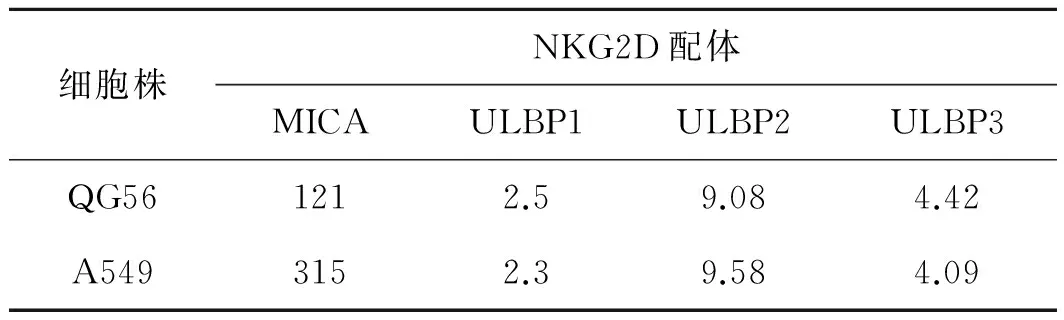
细胞株NKG2D配体MICAULBP1ULBP2ULBP3QG561212.59.084.42A5493152.39.584.09
MFI:平均荧光密度;MICA:MHC- Ⅰ related molecules A;ULBP2,3:UL16- binding protein 2,3;自定义MFI值小于10为阴性不表达
2.3 ULBP2及MICA在A549和QG56中差异表达
培养肺癌细胞株,采用qRT- PCR检测NKG2D配体的表达。结果显示A549细胞株中MICA的mRNA表达量显著高于QG56,而ULBP2在两细胞株中的表达无显著差异(图3)。
2.4 NKG2D与CIK介导的肺癌细胞溶解相关
CIK细胞对A549表现出较强的细胞杀伤作用,细胞杀伤率达60%。但是NKG2D单克隆抗体预处理CIK细胞后,CIK细胞的这种杀伤作用显著降低,杀伤率仅达30%(P<0.05,图4)。
3 讨 论
NKG2D配体在正常机体组织中很少表达,但是在毒物刺激、感染、肿瘤恶性转化等条件下诱导表达[11]。本研究发现,相比于癌旁组织,肺癌组织中NKG2D配体的表达量显著升高。NKG2D配体广泛表达于肿瘤细胞膜上。有证据表明,在多种肿瘤细胞中,NKG2D能触发免疫细胞介导的细胞毒性作用[12- 13],但NKG2D介导的细胞毒性作用除了需要免疫细胞表达NKG2D受体外,还需要靶细胞(肿瘤细胞)表达NKG2D配体[14]。

与A549细胞株比较,aP<0.05
图3 MICA和ULBP2在肺癌细胞株中基因表达差异

图4 NKG2D在CIK介导的肺癌细胞溶解中的作用
CIK细胞是骨髓或者外周血来源的多克隆淋巴细胞,包括NK细胞、T细胞和NKT细胞。NKG2D是一种表达在免疫效应细胞表面的活化性受体,主要表达在NK细胞、γδT细胞及NKT细胞[15]。我们前期运用流式细胞仪检测发现大多数(86.32%±4.75%)培养的CIK 细胞表达 NKG2D受体[16]。研究表明NKG2D配体决定了免疫细胞的不同作用效果[14]。本研究发现NKG2D配体表达于肺癌细胞株 A549细胞表面。此外,病人肺癌组织中NKG2D配体和UBP2高表达可能在肿瘤细胞被免疫细胞识别中发挥了重要作用。体外实验表明,CIK对A549细胞具有较强的细胞毒性作用,但这种作用可以被NKG2D抗体部分阻断。这些研究结果提示,NKG2D与其配体的相互作用在CIK细胞对肺癌细胞的识别和杀伤过程中起到了非常重要的作用。
综上所述,本研究证实NKG2D配体在肺癌组织和肺癌细胞株中高表达。对于CIK细胞介导的肺癌细胞杀伤作用,NKG2D与其配体的相互作用至关重要。
[1] JEMAL A,SIEGEL R,WARD E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225- 249.
[2] YOULDEN D R,CRAMB S M,BAADE P D.The international epidemiology of lung cancer:geographical distribution and secular trends[J].J Thorac Oncol,2008,3(8):819- 831.
[3] LJUNGGREN H G,MALMBERG K J.Prospects for the use of NK cells in immunotherapy of human cancer[J].Nat Rev Immunol,2007,7(5):329- 339.
[4] 蔡枫,何贞月,姜婷婷,等.肿瘤微环境中的树突状细胞及其在肿瘤治疗中的作用[J].东南大学学报:医学版,2012,31(2):225- 229.
[5] 李红英,王蓉,汪蕾.沉默microRNA- 20a对乳腺癌MCF7细胞表达NK细胞活化性受体配体MICA的研究[J].现代医学,2014,42(1):22- 25.
[6] LINN Y C,LAU L C,HUI K M.Generation of cytokine- induced killer cells from leukaemic samples withinvitrocytotoxicity against autologous and allogeneic leukaemic blasts[J].Br J Haematol,2002,116(1):78- 86.
[7] HONTSCHA C,BORCK Y,ZHOU H,et al.Clinical trials on CIK cells:first report of the international registry on CIK cells(IRCC)[J].J Cancer Res Clin Oncol,2010,137(2):305- 310.
[8] MORETTA A,BOTTINO C,VITALE M,et al.Activating receptors and coreceptors involved in human natural killer cell- mediated cytolysis[J].Annu Rev Immunol,2001,19:197- 223.
[9] EAGLE R A,TROWSDALE J.Promiscuity and the single receptor:NKG2D[J].Nat Rev Immunol,2007,7(9):737- 744.
[10] LINN Y C,LAU S K,LIU B H,et al.Characterization of the recognition and functional heterogeneity exhibited by cytokine- induced killer cell subsets against acute myeloid leukaemia target cell[J].Immunology,2009,126(3):423- 435.
[11] WANG Q J,HANADA K,YANG J C.Characterization of a novel nonclassical T cell clone with broad reactivity against human renal cell carcinomas[J].J Immunol,2008,181(6):3769- 3776.
[12] ZAFIROVA B,WENSVEEN F M,GULIN M,et al.Regulation of immune cell function and differentiation by the NKG2D receptor[J].Cell Mol Life Sci,2011,68(21):3519- 3529.
[13] CHAMPSAUR M,LANIER L L.Effect of NKG2D ligand expression on host immune responses[J].Immunol Rev,2010,235(1):267- 285.
[14] FUERTES M B,GIRART M V,MOLINERO L L,et al.Intracellular retention of the NKG2D ligand MHC class I chain- related gene A in human melanomas confers immune privilege and prevents NK cell- mediated cytotoxicity[J].J Immunol,2008,180(7):4606- 4614.
[15] OGASAWARA K,LANIER L L.NKG2D in NK and T cell- mediated immunity[J].J Clin Immunol,2005,25(6):534- 540.
[16] 何金媛,贾祝霞,蔡晓辉,等.NKG2D 在细胞因子诱导的杀伤性细胞(CIK)抗血液肿瘤细胞的作用[J].中国实验血液学杂志,2013,21(6):1380- 1384.
High expression level of NKG2D ligands MICA and ULBP in lung cancer cell and the role in CIK mediated cytotoxicity
YIN Xiao- wei1,LU Xu- zhang2,MAO Zheng- dao1,ZHANG Qian1,CAO Qi1,HUANG Yan- hua1
(1.DepartmentofRespiratory, 2.DepartmentofHematology,ChangzhouNo.2People’sHospital,theAffiliatedHospitalofNanjingMedicalUniversity,Changzhou213161,China)
Objective: To identify the expression level of NKG2D ligands in lung cancer cell and the interaction between NKG2D and NKG2D ligands in the CIK mediated cytotoxicity against tumor cells. Methods: We used RT- PCR and Western- blot to detect the expression level of NKG2D ligands in lung cancer tissue,para- carcinoma tissues and cell lines.The expression of NKG2D ligands in the surface of lung cancer cell lines was determined by flow cytometry.CIK cells were isolated and culturedinvitro.The anti- NKG2D mAbs treated CIK and non- anti- NKG2D mAbs treated CIK cells mediating cytotoxicity against A549 was determined by flow cytometry also. Results: NKG2D ligands highly expressed in lung cancer cells.The CIK cells caused cytolysis against the A549,but this cytolysis was decreased(30%±3.2%) by pretreatment of CIK cells with anti- NKG2D mAbs. Conclusion: The present study demonstrates the higher expression level of NKG2D ligands in lung cancer tissue than para- carcinoma tissue.The killing effect of lung cancer cells by CIK cell is partially mediated by NKG2D- NKG2D ligand interaction.The interaction between NKG2D and NKG2D ligands play a vital role in the CIK mediated tumor cell killing.
lung cancer; NKG2D ligands; CIK cells; MICA/B
2016- 05- 12
2016- 09- 01
南京医科大学重点医学项目(2012NJMU126)
殷小伟(1969-),男,江苏常州人,主任医师。E- mail:xiaoweiyinhuxi@163.com
卢绪章 E- mail:luxuzhang2008@163.com
殷小伟,卢绪章,毛正道,等.肺癌细胞中NKG2D配体MICA及ULBP高表达及其在CIK介导的肿瘤细胞杀伤中的作用[J].东南大学学报:医学版,2016,35(6):861- 865.
R734.2
A
1671- 6264(2016)06- 0861- 05
10.3969/j.issn.1671- 6264.2016.06.007

