siRNA下调Gli基因表达对肺鳞癌SK- MES- 1细胞生物学行为的影响
米源,杜媛鲲,刘庆熠,廖海江,王林,王雷
(1.河北医科大学第四医院 胸二科,河北 石家庄 050011; 2.河北医科大学 期刊社,河北 石家庄 050017)
·论 著·
siRNA下调Gli基因表达对肺鳞癌SK- MES- 1细胞生物学行为的影响
米源1,杜媛鲲2,刘庆熠1,廖海江1,王林1,王雷1
(1.河北医科大学第四医院 胸二科,河北 石家庄 050011; 2.河北医科大学 期刊社,河北 石家庄 050017)
目的:探讨Gli表达下调对肺鳞癌SK- MES- 1细胞周期分布和上皮- 间质转化能力的影响及其分子机制。方法:将Gli1和Gli2 siRNA与空白对照siRNA分别转染SK- MES- 1细胞48 h,实时荧光定量PCR法检测Gli1、Gli2 mRNA表达水平;Western blot法检测SK- MES- 1细胞Gli1、Gli2、Cyclin D1、Cyclin E、E- cadherin、N- cadherin蛋白的表达;流式细胞术检测SK- MES- 1细胞周期分布;Transwell侵袭实验检测细胞侵袭能力。结果:与空白对照siRNA组相比,Gli1和Gli2 siRNA可明显抑制SK- MES- 1细胞Gli1、Gli2 mRNA及蛋白表达,下调Cyclin D1、Cyclin E、N- cadherin蛋白的表达,增加E- cadherin蛋白表达,将细胞周期明显阻滞在G0/G1期并降低细胞的侵袭能力,差异均有统计学意义(P<0.01)。结论:Gli蛋白表达可能在肺鳞癌的发生发展中具有重要作用,Gli1和Gli2表达下调可导致肺鳞癌细胞周期分布和上皮- 间质转化能力的改变,这可能与Cyclin D1、Cyclin E、E- cadherin、N- cadherin蛋白变化相关。
肺鳞癌; Gli; 细胞周期; 上皮- 间质转化
肺癌又称支气管肺癌,是全球范围内癌症相关性死亡的首位原因[1]。非小细胞肺癌(non- small- cell carcinoma,NSCLC)包括鳞癌、腺癌和大细胞癌等多种病理类型,约占每年新发肺癌的85%,其中肺鳞癌占非小细胞肺癌总数的30%[2]。肺鳞癌的主要治疗方法仍旧采取以外科手术为主放化疗为辅的综合治疗,但晚期NSCLC患者的预后仍差强人意。
肺癌的发生发展是一个多阶段、多因素和多条基因信号传导通路参与的复杂过程,基因的异常改变可导致细胞恶性转化。近年来研究发现,Hedgehog(Hh)信号传导通路在卵巢癌[3]、非霍奇金淋巴瘤[4]、肝癌[5]和前列腺癌[6]等多种肿瘤组织中异常激活,与恶性肿瘤的发生发展及侵袭转移密切相关。Gli作为Hh信号通路的关键组分包括Gli1、Gli2和Gli3。Gli3是该通路的转录抑制因子,而Gli1和Gli2作为主要的转录激活因子在多种肿瘤中异常高表达且参与调控下游多种靶基因的表达,在肿瘤的发生及发展中发挥重要作用。目前国内外关于Hh/Gli异常激活与鳞癌细胞周期和上皮- 间质转化的关系研究极少,本研究应用siRNA下调肺鳞癌SK- MES- 1细胞中Gli1和Gli2的表达,旨在研究Gli和肺鳞癌细胞生长转移的关系,为肺鳞癌的分子靶向治疗提供新依据。
1 材料与方法
1.1 材料
1.1.1 细胞系来源 人肺鳞癌细胞系SK- MES- 1购自上海拜力生物科技有限公司。
1.1.2 主要实验仪器及试剂 RPMI- 1640培养基、胰蛋白酶购自美国Gibco公司;青霉素、链霉素购自山东鲁抗医药股份有限公司;胎牛血清购自杭州四季青生物工程材料有限公司;SilencerTMSelect Gli1、Gli2和control siRNA,TaqMan®Gli1引物和探针(Hs00171790),Gli2引物和探针(Hs01119974_m1),GAPDH(Hs02758991_g1)购自美国Life Technologies公司;LipofectamineTMRNAiMAX转染试剂购自美国Invitrogen公司;总RNA提取试剂盒购自德国Qiagen公司;iScriptTMcDNA合成试剂盒购自美国Bio- Rad公司;Pierce- BCA蛋白分析试剂盒购自美国Thermo Scientific公司;CyclinD1、CyclinE兔抗人单克隆抗体购自美国Cell Signaling公司;Gli2鼠抗人单克隆抗体、GAPDH鼠抗人单克隆抗体、N- cadherin兔抗人单克隆抗体均购自美国Santa Cruz公司;Gli1兔抗人多克隆抗体和E- cadherin鼠抗人单克隆抗体购自美国Abcam公司;ECL化学发光试剂盒购自美国Thermo Scientific公司;Matrigel胶和Transwell膜嵌套购自美国Corning公司;ABI 7900HT高通量荧光定量PCR仪购自美国Applied Biosystems公司;Epics- XL型流式细胞仪购自美国Beckman- Coulter公司。
1.2 方法
1.2.1 细胞培养和转染 SK- MES- 1细胞使用含10%胎牛血清(FCS)及青霉素/链霉素双抗各10 U·ml-1的RPMI- 1640培养基培养,于37 ℃、5% CO2培养箱中常规培养,每隔1~2 d换液1次。细胞铺满培养板底面积80%~90%时进行传代,传代时使用0.25%胰酶溶液消化。实验细胞选用对数生长期细胞,以每孔3×105个细胞接种于6孔板上,培养24 h后待细胞密度达到50%~60%更换无血清培养基,按照LipofectamineTMRNAiMAX转染试剂说明书进行Gli1和Gli2 siRNA转染,同时设立空白对照组(control SiRNA)。每组各设3个孔,每孔Gli1 & Gli2 siRNA及空白对照siRNA的浓度均为100 nmol·L-1。转染6 h后更换新的无血清培养基,转染48 h后提取各组样本的mRNA及蛋白,实验重复3次。
1.2.2 实时荧光定量PCR法检测Gli- 1和Gli- 2基因的表达 转染48 h后用PBS洗涤6孔板细胞,按照总RNA提取试剂盒说明书提取各组样本RNA,在NanoDrop 8000全光谱紫外- 可见光分光光度计检测下对每组样本的RNA浓度进行检测。采用cDNA合成试剂盒进行cDNA的反转录,每组样本的反应体系共为40 μl,包含总RNA500 ng,iScript逆转录酶2 μl和iScript反应混合液8 μl,在25 ℃ 5 min、42 ℃ 30 min和85 ℃ 5 min的条件下进行cDNA的反转录。用无R- Nase水将反转录的cDNA稀释10倍,以10 μl·孔-1的反应体系(每组样本cDNA4.5 μl,Taqman基因表达预混液5 μl,TaqMan®Gli1、Gli2、GAPDH各自的引物和探针0.5 μl)加样在384孔板,在ABI 7900HT高通量荧光定量PCR仪中进行PCR扩增,PCR扩增条件为95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,40个循环。以GAPDH的CT值作为内参,采用2-ΔCt法进行各组数据分析。
1.2.3 Western blot法检测蛋白表达 用PBS洗涤转染48 h后的6孔板细胞,每孔加入100 μl含有蛋白酶抑制剂的M- PER细胞总蛋白提取试剂,用刮匙收集各组样本的总蛋白提取液后用BCA法测定各组样本的总蛋白浓度。采用常规Western blot法蛋白上样进行凝胶电泳和转PVDF膜。再用5%脱脂奶粉/TBST液封闭PVDF膜,加入一抗Gli1(工作浓度为1∶1 000)、一抗Gli2(工作浓度为1∶250)、一抗Cyclin D1(工作浓度为1∶1 000)、一抗Cyclin E(工作浓度为1∶1 000)、一抗E- cadherin(工作浓度为1∶8 000)、一抗GAPDH(工作浓度为1∶10 000)和一抗N- cadherin(工作浓度为1∶500),于4 ℃摇床过夜孵育。用TBST液10 min·次-1洗膜,共3次,加入工作浓度均为1∶20 000的羊抗兔或羊抗鼠二抗室温孵育1 h,将膜置于ECL发光,再放到暗室经X线曝光显影,最后将显影蛋白条带通过Image软件分析灰度值。以GAPDH为内参,每组样本蛋白相对表达=目的蛋白表达量/内参蛋白表达量。实验重复3次。
1.2.4 流式细胞术检测肺鳞癌SK- MES- 1细胞周期 收集转染48 h后的SK- MES- 1细胞,将细胞制备成单细胞悬液,用4 ℃ 70%冰乙醇固定以PBS漂洗的单细胞悬液30 min。调整每组样品细胞数为1×106个·(0.1 ml)-1,再用冷PBS漂洗3次后加入50 μg·ml-1碘化吡啶1 ml,在4 ℃冰箱染色30 min后通过流式细胞仪检测DNA含量,应用MuticycleAV分析软件对DNA细胞周期进行拟合分析。实验重复3次。
1.2.5 Transwell侵袭实验检测细胞侵袭能力 将Matrigel胶按1∶4用培养基稀释后以50 μl包被Transwell小室基底膜,在37 ℃条件下放置2 h使Matrigel胶凝固为凝胶。分别加入Gli1 & Gli2 siRNA和Control siRNA转染的7.5×104个细胞在上室,在下室中加入含10%胎牛血清的培养液500 μl后在5% CO2、37 ℃的培养箱内培养。24 h后常规去除上室液体,用棉签擦去Matrigel胶和未侵袭的细胞,用甲醛固定小室基底膜,结晶紫染色,在显微镜(×400)下观察。在每张膜上随机取4个视野,计数每个视野内的穿膜细胞数的平均值。
1.3 统计学处理
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 实时荧光定量PCR结果
将Gli1 & Gli2 siRNA组与control siRNA组检测数据经标准化处理后显示:Gli1 & Gli2 siRNA组Gli1 mRNA表达水平为0.27±0.03,较control siRNA组1.00±0.03显著降低,差异有统计学意义(t=32.24,P<0.01);Gli2 mRNA表达水平为0.35±0.02,较control siRNA组1.00±0.03显著降低,差异有统计学意义(t=32.96,P<0.01),见图1。
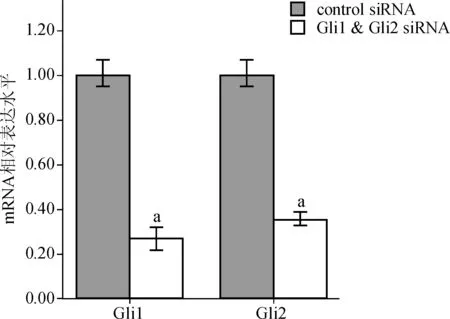
与control siRNA比较,aP<0.05
图1 实时荧光定量PCR法检测不同siRNA处理SK- MES- 1细胞的Gli1、Gli2 mRNA水平
2.2 Western blot检测蛋白表达
SK- MES- 1细胞Gli1、Gli2、CyclinD1、Cyclin E、E- cadherin和N- cadherin蛋白表达的结果显示,Gli1 & Gli2 siRNA组Gli1(t=14.81,P<0.001)、Gli2(t=16.29,P<0.01)、CyclinD1(t=15.61,P<0.01)、Cyclin E(t=6.74,P<0.01)和N- cadherin(t=21.62,P<0.01)表达较control siRNA显著减少,差异有统计学意义;E- cadherin蛋白表达明显增加,差异有统计学意义(t=-44.18,P<0.01),见图2。
2.3 流式细胞术检测细胞周期结果
流式细胞术检测结果显示:Gli1 & Gli2 siRNA组G0/G1期细胞为(63.22±5.66)%,与control siRNA组[(44.78±3.68)%]比较显著增高(t=-4.73,P=0.009);S期细胞为(32.28±4.75)%,与control siRNA组[(50.13±3.50)%]比较显著降低(t=-5.24,P=0.006),见图3。
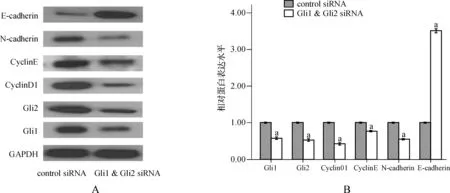
与control siRNA组比较,aP<0.05
A.电泳结果; B.SK- MES- 1细胞中蛋白相对表达
图2 Western blot法检测SK- MES- 1细胞中Gli- 1、Gli- 2、Cyclin D1、Cyclin E、N- Cadherin和E- Cadherin蛋白表达

与control siRNA组比较,aP<0.05
图3 流式细胞术检测siRNA作用下SK- MES- 1细胞周期直方图
2.4 Transwell侵袭实验
与control siRNA组穿膜细胞数(124.67±7.50)比较,Gli1 & Gli2 siRNA组穿膜细胞数(64.33±6.51)明显减少,差异有统计学意义(t=10.52,P<0.001),见图4。
3 讨 论
Hedgehog(Hh)信号通路主要由Hh配体、跨膜蛋白受体Ptch、Smo、核转录调控子Gli以及下游靶基因等构成,当Hh配体与受体复合物结合后使Ptch内化降解,从而失去对Smo的抑制,被磷酸化激活的Smo与SUFU- Gli- Kif7复合物作用释放出Gli蛋白,进而诱导Hh信号下游靶基因的表达。Gli1和Gli2具有转录激活作用,可以进入细胞核与下游靶基因启动子区结合并调控靶基因的转录,进而促进细胞增殖和上皮- 间质转化,抑制细胞凋亡,从而导致肿瘤的发生发展[7- 8]。本研究首先转染Gli1、Gli2 siRNA进入肺鳞癌SK- MES- 1细胞中,结果显示与空白siRNA比较,内源性Gli1、Gli2 mRNA和蛋白表达均显著下调,表明特异性的Gli1、Gli2 siRNA能有效下调肺鳞癌细胞中内源性Gli1、Gli2的表达。

与control siRNA组比较,aP<0.05
A.镜下结果; B.两组间穿膜细胞数比较
图4 Transwell实验检测siRNA对SK- MES- 1细胞侵袭能力的影响(×400)
细胞周期紊乱与肿瘤的发生密不可分,当细胞的增殖能力增强或对正常负性调节的刺激变弱均可导致肿瘤发生。本研究通过应用流式细胞术分析了Gli1、Gli2siRNA对SK- MES- 1细胞周期分布的影响,结果发现Gli1 & Gli2siRNA转染组将细胞阻滞于G0/G1期,S期细胞比例显著低于对照组,表明Gli的表达可以调控细胞周期,Gli1和Gli2表达下调可以使肺鳞癌细胞周期更多地静止在G0/G1期从而阻断DNA复制抑制细胞增殖。为了更进一步证实Hh/Gli通路与肺鳞癌细胞周期之间的关系,我们通过运用Western blot法对细胞周期相关蛋白Cyclin D1、Cyclin E蛋白进行了检测,结果显示Gli1、Gli2表达沉默后CyclinD1和CyclinE蛋白表达下调。Cyclin D1是细胞周期的关键因子,在正常组织中表达很低,而在许多恶性肿瘤中呈高表达,其表达可以和CDK4、CDK6形成cyclinD/CDK复合物,促进细胞由G1期进入S期,加速细胞的增殖,促进细胞癌变和进展[9- 10]。Cyclin E是调控细胞周期G1/S期的重要蛋白,其上调与结肠癌[11]、乳腺癌[12]的发展相关。本研究结果显示Gli1和Gli2表达沉默后Cyclin D1、Cyclin E蛋白的表达下降,表明Hh/Gli信号通路激活后可能通过调节Cyclin D1和Cyclin E的表达进而调节细胞周期,这与Seiler等[10]研究发现Cyclin D1作为Hh通路的靶基因被活化的结果相符。
上皮- 间质转化与肿瘤细胞的侵袭和转移有着密切关系,上皮- 间质转化是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,以上皮表型标志E- Cadherin下调、N- Cadherin和Vimentin等间质表型特征分子表达上调为特征,是肿瘤细胞获得侵袭与转移能力的有效方式之一[13- 14]。本研究运用Western blot法显示抑制Gli1和Gli2表达后E- Cadherin表达上调,N- Cadherin表达下调;Transwell实验进一步说明了沉默Gli1、Gli2表达后穿膜细胞数明显减少,结果表明通过抑制Hh/Gli通路可以抑制肺鳞癌细胞的上皮- 间质转化过程,进而限制了肿瘤的侵袭转移,而Chen等[15]研究已经证实了在肝癌细胞中可以通过下调Gli1而阻止上皮- 间质转化的过程。
本研究结果提示,Gli基因的表达下调可能通过调节Cyclin D1、Cyclin E使细胞更多的阻滞在G0/G1期,进而延缓肿瘤细胞增殖,并且Gli基因的表达下调还可以抑制上皮- 间质转化的过程进而限制肿瘤细胞的侵袭转移,这为以后抗肿瘤的治疗提过了更多的依据。
[1] JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69- 90.
[2] HEIST R S,SEQUIST L V,ENGELMAN J A.Genetic changes in squamous cell lung cancer:areview[J].J Thorac Oncol,2012,7(5):924- 933.
[3] CHEN Q,XU R,ZENG C Y,et al.Down- regulation of Gli transcription factor leads to the inhibition of migration and invasion of ovarian cancer cells via integrin β4- mediated FAK signaling[J].PloS One,2014,9(2):e88386.
[4] BERMUDEZ O,HENNEN E,KOCH I,et al.Gli1 mediates lung cancer cell proliferation and Sonic Hedgehog- dependent mesenchymal cell activation[J].PLoS One,2013,8(5):e63226.
[5] FAN Y H,DING J,NGUYEN S,et al.Aberrant hedgehog signaling is responsible for the highly invasive behavior of a subpopulation of hepatoma cells[J].Oncogene,2016,35(1):116- 124.
[6] LIN H,JACKSON G A,LU Y,et al.Inhibition of Gli/hedgehog signaling in prostate cancer cells by "cancer bush" Sutherlandia frutescens extract[J].Cell Biol Int,2016,40(2):131- 142.
[7] HIDALGO M,MAITRA A.The hedgehog pathway and pancreatic cancer[J].N Engl J Med,2009,361(21):2094- 2096.
[8] KATOH Y,KATOH M.Integrative genomic analyses on GLI1:positive regulation of GLI1 by Hedgehog- GLI,TGFbeta- Smads,and RTK- PI3K- AKT signals,and negative regulation of GLI1 by Notch- CSL- HES/HEY,and GPCR- Gs- PKA signals[J].Int J Oncol,2009,35(1):187- 192.
[9] YANG J,HUANG J,LUO L,et al.Significance of PRO2000/ANCCA expression,a novel proliferation- associated protein in hepatocellular carcinoma[J].Cancer Cell Int,2014,14:33.
[10] SEILER R,THALMANN G N,ROTZER D,et al.CCND1/CyclinD1 status in metastasizing bladder cancer:a prognosticator and predictor of chemotherapeutic response[J].Mod Pathol,2014,27(1):87- 95.
[11] CORIN I,LARSSON L,BERGSTROM J,et al.A study of the expression of Cyclin E and its isoforms in tumor and adjacent mucosa,correlated to patient outcome in early colon cancer[J].Acta Oncologica,2010,49(1):63- 69.
[12] NIU D,WANG G,WANG X.Up- regulation of cyclin E in breast cancer via estrogen receptor pathway[J].Int J Clin Exp Med,2015,8(1):910- 915.
[13] MOSNIER J F,KANDEL C,CAZALS- HATEM D,et al.N- cadherin serves as diagnostic biomarker in intrahepatic and perihilar cholangiocarcinomas[J].Mod Pathol,2009,22:182- 190.
[14] GONZALEZ D M,MEDICI D.Signaling mechanisms of the epithelial- mesenchymal transition[J].Sci Signal,2014,7(344):re8.
[15] CHEN J S,LI H S,HUANG J Q,et al.Down- regulate of Gli- 1 inhibits hepatocellular carcinoma cell migration and invasion[J].Mol Cell Biochem,2014,393:283- 291.
Effect of silencing Gli with small interfering RNA on the malignant biological behavior of lung squamous carcinoma SK- MES- 1 cells
MI Yuan1,DU Yuan- kun2,LIU Qing- yi1,LIAO Hai- jiang1,WANG Lin1,WANG Lei1
(1.DepartmentofThoracicSurgery,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China;2.DepartmentofPeriodicalMagazine,HebeiMedicalUniversity,Shijiazhuang050017,China)
Objective: To detect the expression of Gli in lung squamous carcinoma, and to analyze the effects of down- regulation of Gli expression on malignant biological behavior of lung squamous carcinoma SK- MES- 1 cells and to explore their molecular mechanisms. Methods: Gli1, Gli2 siRNA and control siRNA were transfected into SK- MES- 1 cells for 48 h respectively. The Gli- 1, Gli- 2 mRNA expression were detected by real time fluorescence quantitative PCR method. The protein expression of Gli- 1, Gli- 2, Cyclin D1, CyclinE, N- cadherin and E- cadherin were detected by Western blot assay. The cell cycle were observed by flow cytometry. Transwell assay was performed to detect cell invasion ability. Results: Compared with Control siRNA, Gli1 & Gli2 siRNA could significantly inhibit the Gli- 1, Gli- 2 mRNA and protein expression in SK- MES- 1 cells, which at last downregulated the CyclinD1, CyclinE, N- cadherin protein expression, and enhanced E- cadherin expression. Downregulation of Gli- 1, Gli- 2 could arrest cell cycle at G0/G1 phase and decrease cell invasion ability(P<0.01). Conclusion: Gli may play an important role in the development of lung squamous carcinoma. The downregulation of Gli expression can lead to changes in the cell cycle and invasion of lung squamous carcinoma, which may be associated with Cyclin D1, Cyclin E, N- cadherin and E- cadherin proteins.
lung squamous carcinoma; Gli; cell cycle; epithelial- mesenchymal transition
2016- 03- 21
2016- 07- 14
米源(1990-),男,河北廊坊人,在读硕士研究生。E- mail:394034007@qq.com
米源,杜媛鲲,刘庆熠,等.siRNA下调Gli基因表达对肺鳞癌SK- MES- 1细胞生物学行为的影响[J].东南大学学报:医学版,2016,35(6):908- 913.
R734.2
A
1671- 6264(2016)06- 0908- 06
10.3969/j.issn.1671- 6264.2016.06.016

