产脂肪酶菌株的筛选鉴定及产酶条件优化
胡珺,杜新凯,王常高,林建国,杜馨,蔡俊*
(湖北工业大学,发酵工程教育部重点实验室工业发酵湖北省协同创新中心,湖北武汉430068)
产脂肪酶菌株的筛选鉴定及产酶条件优化
胡珺,杜新凯,王常高,林建国,杜馨,蔡俊*
(湖北工业大学,发酵工程教育部重点实验室工业发酵湖北省协同创新中心,湖北武汉430068)
以橄榄油为唯一碳源,采用油脂同化平板从食堂废弃物中筛选出一株产脂肪酶菌株HFE722。通过测定与分析该菌株16SrRNA基因序列,鉴定该菌株为芽孢杆菌(Bacillussp.)。菌株HFE722在初始条件(发酵温度30℃,接种量为1%,自然pH,装液量为100mL/250mL,摇床转速为200 r/min)下培养36 h,测得发酵液上清液脂肪酶酶活为2.17 U/mL。优化后所得菌株HFE722产酶的最适发酵条件为:发酵温度30℃,发酵周期为36 h,接种量为1%(V/V),初始pH7.0,装液量为50 mL/250 mL,摇床转速为160 r/min。在最佳发酵条件下,发酵液上清液酶活可达到5.8 U/mL,酶活较优化前提高了167.28%。
脂肪酶;筛选;鉴定;发酵条件优化
脂肪酶是一类特殊酯键水解酶,是目前紧俏的生物催化剂之一,一般用于催化油脂的水解和合成反应。脂肪酶的催化活性主要在于它的蛋白质结构,在油水界面上,它催化三酰甘油的酯键的水解,水解生成甘油一酯、二酯或者直接生成甘油和脂肪酸[1]。
微生物来源(包括细菌、霉菌和酵母)的脂肪酶含量最为丰富[2]。由于微生物种类多、繁殖快,易发生遗传变异,产生的脂肪酶具有比动植物脂肪酶作用更广的pH值、反应温度范围以及底物专一性[3];而且微生物来源的脂肪酶一般都是分泌性的胞外酶,适合于工业化大生产和样品提纯,因此,微生物脂肪酶是工业用脂肪酶的重要来源,是生物技术和有机化学应用中使用最为广泛的酶类之一[4-5]。
目前,已知的大约有2%的微生物产脂肪酶。自然界中的微生物大约有65个属可产脂肪酶,其中放线菌4个属,细菌28个属,酵母10个属,其他真菌23个属,但事实上,脂肪酶在微生物群落的分布已远远超过了这个数字[6],且不同微生物来源的脂肪酶其组成成分、理化特性各不相同。产微生物脂肪酶菌种的研究主要集中在根酶[7]、黑曲霉[8]、白地霉[9]、青霉[10]、木霉[11]、毛霉、洋葱伯克霍尔德菌[12]、枯草芽抱杆菌[13]、大肠杆菌工程菌[14]、无色杆菌、酵母[15]、小球菌、发光杆菌[16]、非极端细菌[17]、假丝酵母[18]和假单胞菌[19]等具有工业应用价值的菌株和应用在临床医学上的金黄色葡萄球菌、钩状螺旋体、粉刺棒状杆菌。
本研究从食堂废弃物中筛选到一株产脂肪酶的菌株,对其进行鉴定,并对其培养条件进行了优化,得到最适产酶条件。开展这方面的研究工作,对于开发新酶种和脂肪酶扩大应用领域,具有十分现实的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
橄榄油乳化液:称取聚乙烯醇(polyvinyl alcohol,PVA)40.0 g,加水800 mL,在沸水浴中加热,搅拌,直至全部溶解,冷却后定容至1 000 mL。用干净的双层纱布过滤,取滤液备用。量取上述滤液150 mL,加橄榄油50 mL,用高速匀浆机处理6 min(分两次处理,间隔5 min,每次处理3 min),即得乳白色橄榄油乳化液。该溶液现用现配。实验中所用试剂均为国产分析纯。
1.1.2 培养基
富集培养基:K2HPO41g,MgSO4·7H2O0.5g,KCl0.5g,FeSO40.01g,(NH4)2SO42g,橄榄油乳化液120mL,水1000mL;
油脂同化平板[20]:K2HPO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO40.01 g,(NH4)2SO42 g,橄榄油乳化液120 mL,琼脂20 g,溴甲酚紫4 mL,水1 000 mL;
三丁酸甘油酯平板[21]:蛋白胨10 g,酵母粉5 g,NaCl 10 g,三丁酸甘油酯2 mL,琼脂粉20 g,水1 000 mL;
LB斜面培养基:蛋白胨10 g、酵母粉5 g、氯化钠10 g、琼脂粉20 g,水1000 mL;
种子培养基:葡萄糖20 g,(NH4)2SO45 g,K2HPO41 g,MgSO4·7H2O 0.5g,蛋白胨25g,橄榄油10mL,水1000mL;
发酵培养基:葡萄糖5 g,(NH4)2SO41 g,K2HPO41 g,MgSO4·7H2O 0.5g,蛋白胨20g,橄榄油10mL,水1000mL。
1.2 仪器与设备
PHS-25pH计:上海雷磁;3K15冷冻离心机:德国Sigma公司;SW-CJ-1D型单人净化工作台:苏州净化设备有限公司;AR1140型电子分析天平:奥豪斯国际贸易(上海)有限公司;A型立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;ZSD-1270全自动生化培养箱、ZHWY系列双层恒温培养振荡器:上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 菌种初筛
取5 g样品于100 mL生理盐水中,充分混匀后取1 mL接种于100 mL富集培养基中,30℃、200 r/min培养4 d。取富集后的菌悬液0.5 mL做适当的梯度稀释,涂布于油脂同化平板上,30℃培养3 d。挑取能使平板变黄的菌落点样于三丁酸甘油酯平板上,30℃培养2 d。以菌落直径与水解圈直径的比值作为初筛依据,将比值较大的菌落保存于LB斜面,以便复筛测酶活。
1.3.2 复筛
将上述所得到的菌落接种于种子培养基中,30℃、200 r/min培养12 h,然后将液体种子1 mL接种于发酵培养基中,30℃、200 r/min培养36 h。取发酵液8 000 r/min离心10 min,吸取上清液作为粗酶液,采用GB/T 23535—2009《脂肪酶制剂》中所述的酸碱滴定法测其脂肪酶酶活,筛选出脂肪酶酶活较高的菌株。脂肪酶酶活定义为:1 mL液体酶,在一定温度和pH条件下,1 min水解底物产生1 μmol可滴定的脂肪酸,即为1个酶活力单位,以U/mL表示。
1.3.3 菌种的鉴定与保藏
菌株鉴定和保藏由中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)执行。鉴定内容包括菌株16S rRNA基因序列的测定与分析(如图1所示)和微生物菌株的分类地位。菌株HFE722已于2015年12月10日保藏在中国典型培养物保藏中心,保藏编号为:CCTCC M 2015735。

图1 HFE722菌株16S rRNA基因序列Fig.1 Gene sequence of 16S rRNA of strain HFE722
1.3.4 发酵条件优化
(1)发酵周期的优选试验
在发酵温度30℃、接种量1.0%、自然pH、装液量100 mL/250mL和摇瓶转速200 r/min条件下,每隔6 h测一次酶活,考察发酵周期对HFE722产脂肪酶的影响。
(2)发酵温度的优选试验
在发酵周期36 h、接种量1.0%、自然pH、装液量100 mL/250 mL和摇瓶转速200 r/min条件下,分别在26℃、28℃、30℃、32℃、34℃、36℃和38℃发酵培养后测定酶活,考察发酵温度对菌株产脂肪酶的影响。
(3)接种量的优选试验
在发酵温度30℃、发酵周期36 h、自然pH、装液量100 mL/250 mL和摇瓶转速200 r/min条件下,调整接种量(V/V)分别为0.5%、1.0%、1.5%、2.0%、2.5%和3.0%,考察接种量对菌株产脂肪酶的影响。
(4)初始pH值的优选试验
在发酵温度30℃、接种量1.0%、发酵周期36 h、装液量100 mL/250 mL和摇瓶转速200 r/min条件下,调整初始pH值分别为4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0和8.5,考察初始pH值对菌株产脂肪酶的影响。
(5)装液量的优选试验
在发酵温度30℃、接种量1.0%、pH 7.0、发酵周期36 h和摇瓶转速200 r/min条件下,采用250 mL摇瓶装液,摇瓶装液量分别为25 mL、50 mL、75 mL、100 mL和125 mL,考察装液量对菌株产脂肪酶的影响。
(6)摇瓶转速的优选试验
在发酵温度30℃、接种量1.0%、pH 7.0、装液量50 mL/250 mL和发酵周期36 h条件下,摇瓶转速分别为120r/min、140r/min、160 r/min、180 r/min和200 r/min,考察摇瓶转速对产脂肪酶的影响。
2 结果与分析
2.1 菌株的筛选
利用油脂同化平板初筛出能产脂肪酶的61株菌株,然后点样于三丁酸甘油酯平板(如图2所示),将菌落直径与水解圈直径之比大的挑出来检测酶活,结果如表1所示,菌株HFE722酶活最高为2.17 U/mL,将菌株HFE722稀释涂布,分离纯化确保其为单菌落后,保存于LB斜面。

图2 产脂肪酶菌株在三丁酸甘油酯平板上形成的水解圈Fig.2 Hydrolyzation circle performed by the lipase-producing strains on tributyrin plate

表1 不同菌株的脂肪酶酶活Table 1 Lipase activity of different strains
2.2 菌种鉴定
对菌株HFE722的16S rRNA基因序列进行测定后经Blast比对部分结果如表2所示,菌株HFE722的系统发育树如图3所示。结果表明,菌株HFE722的基因序列与Bacillus siamensis、Bacillus vanillea、Bacillus methylotrophicus相似度较高,但还不能准确鉴定到种,由此鉴定菌株HFE722为芽孢杆菌属(Bacillussp.)。

表2 HFE722菌株16S rRNA基因序列部分BLAST结果Table 2 Part BLAST consequence of 16S rRNA gene sequence of strain HFE722
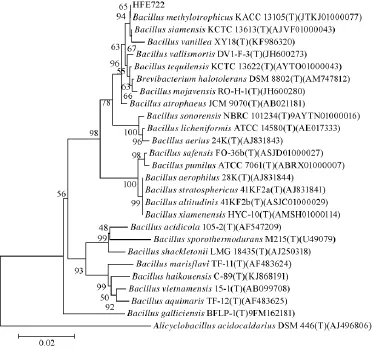
图3 菌株HFE722的系统发育树Fig.3 Phylogenetic tree of strain HFE722
2.3 发酵条件优化
2.3.1 发酵周期的优选试验

图4 发酵时间对脂肪酶酶活的影响Fig.4 Effect of fermentation time on lipase activity
发酵时间对产酶的影响(图4)可知,随着发酵时间的延长,脂肪酶酶活逐渐升高,当发酵时间为36 h时,脂肪酶酶活最高为4.7 U/mL。随着时间的继续增加,酶活呈下降趋势,可能是因为后期营养不足,菌体自溶导致的。故最佳发酵时间为36 h。
2.3.2 发酵温度的优选试验

图5 发酵温度对脂肪酶酶活的影响Fig.5 Effect of fermentation temperature on lipase activity
由图5可知,从26℃开始,随着温度的升高酶活逐渐升高,可能是因为温度升高,菌株生长和代谢加快,有利于酶的产生。当温度为30℃时,酶活最高为5.2 U/mL。而30℃过后,随着温度升高酶活逐渐降低,可能是因为过高的温度不利于菌体的生长,菌株为了能更好的在高温条件下生存,改变了代谢途径,从而脂肪酶酶活也受到影响。故最佳发酵温度为30℃。
2.3.3 接种量的优选试验
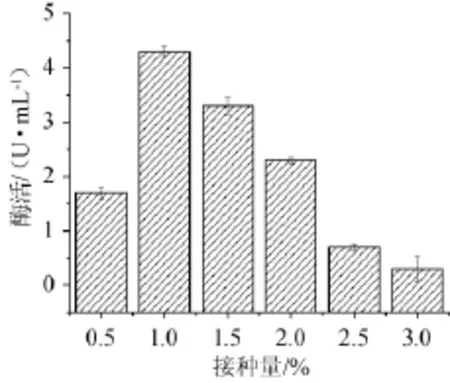
图6 接种量对脂肪酶酶活的影响Fig.6 Effect of inoculum on lipase activity
由图6可知,接种量为0.5%时酶活较低,当接种量为1.0%(V/V)时,酶活最高为4.3 U/mL。随着接种量升高,酶活反而下降,可能是因为较大的接种量使得微生物生长过快,从而培养基营养消耗过快,溶氧下降,不利于后期产酶。故最佳接种量为1.0%。
2.3.4 初始pH值的优选试验
由图7可知,当初始pH在4.5~7.0时,随着初始pH升高酶活逐渐增加。当初始pH为7.0时,酶活最高为4.8 U/mL。随着初始pH的继续升高,酶活显著下降,说明菌株HFE722在中性条件下更易产脂肪酶,过酸或过碱的环境都对菌株代谢有一定的影响,从而影响了脂肪酶的产量。故最佳初始pH值为7.0。

图7 初始pH对脂肪酶酶活的影响Fig.7 Effect of initial pH on lipase activity
2.3.5 装液量的优选试验
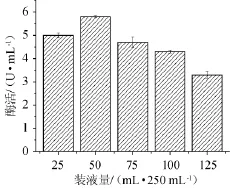
图8 装液量对脂肪酶酶活的影响Fig.8 Effect of loading volume on lipase activity
由图8可知,当装液量为50 mL/250 mL时,酶活最高为5.8 U/mL,此时发酵培养基中的溶氧量适合菌体生长和代谢产酶。随着装液量的逐渐增加,酶活呈下降趋势,说明是由于发酵体系溶氧不足,菌体生长与代谢产酶失去平衡,从而代谢产酶过程受到抑制。故最佳装液量为50 mL/250 mL。
2.3.6 摇瓶转速的优选试验
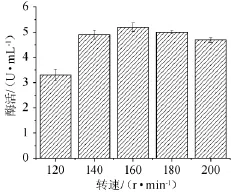
图9 摇床转速对脂肪酶酶活的影响Fig.9 Effect of rotating speed on lipase activity
由图9可知,摇床转速在120~160 r/min时,随着摇床转速的升高酶活逐渐增加,当摇床转速为160 r/min时,酶活最高为5.2 U/mL。随着摇床转速的继续增加,酶活变化很小,从节约成本和简化工艺条件着手,选择160 r/min作为最佳的摇床转速。
2.4 验证试验
在上述优化下得到的最佳发酵条件为发酵周期36 h,发酵温度30℃,接种量1%(V/V),初始pH值7.0,装液量50 mL/250 mL,摇床转速160 r/min。按此最佳发酵工艺条件发酵验证3批,每批次3次重复,测得菌株HFE722的脂肪酶活力平均值为5.8 U/mL。验证结果与优化试验结果一致,说明工艺稳定可行。
3 结论
本文以橄榄油为唯一碳源筛选到一株产脂肪酶酶活较高的菌株HFE722,酶活为2.17U/mL。通过对菌株HFE722进行菌落形态特征、显微形态结构观察和16S rRNA基因序列的测定与分析,确定该菌株HFE722为芽孢杆菌(Bacillus sp.)。通过发酵条件优化,确定了该菌株的最佳产酶条件:发酵周期36 h,发酵温度30℃,接种量1%(V/V),初始pH值7.0,装液量50 mL/250 mL,摇床转速160 r/min。优化后酶活为5.8 U/mL,较优化前提高了167.28%。
[1]张开平,惠明,田青,等.微生物脂肪酶的应用领域及研究进展[J].河南工业大学学报:自然科学版,2012,33(1):90-94.
[2]张树玫.酶制剂工业(下)[M].北京:科学出版社,1984:655-670.
[3]叶慧,冯定远.微生物脂肪酶概况及其动物营养效应的研究进展[J].饲料工业,2012,33(12):37-40.
[4]CONTESINI F J,LOPES D B,MACEDO G A,et al.Aspergillussp.lipase:potential biocatalyst for industrial use[J].J Mole Cata B-Enzym, 2010,67(3):163-171.
[5]FERNANDEZ-LAFUENTE R.Lipase fromThermomyces lanuginosus: usesandprospectsasanindustrialbiocatalyst[J].J Mole Cata B-Enzym, 2010,62(3):197-212.
[6]KOHNO M,ENATSU M,FUNATSU J,et al.Improvement of the optimum temperature of lipase activity forRhizopus niveusby random mutagenesis and its structural interpretation[J].J Biotechnol,2001,87(3): 203-210.
[7]李燕.根霉ZM-10脂肪酶发酵条件及酶学性质研究[D].泰安:山东农业大学,2007.
[8]杨江科,严翔翔,张正平,等.二步法黑曲霉脂肪酶基因lipA的全基因合成及其在毕赤酵母中的高效表达[J].生物工程学报,2009,25(3):381-387.
[9]段学辉,欧阳军梅,高鹤,等.产脂肪酶菌Geotrichum candidumNS3的固定化及其稳定性[J].食品与生物技术学报,2009,28(2):224-228.
[10]穆文侠,潘仁瑞,郑敏,等.海洋青霉碱性脂肪酶液态发酵和部分酶学性质研究[J].食品与发酵工业,2007,33(3):37-40.
[11]隋聪颖,顾金刚,徐凤花,等.产脂肪酶木霉菌株的筛选鉴定及酶学性质研究[J].生物技术通报,2008(5):189-192.
[12]贾彬,杨江科,闫云君.基于T7表达系统的洋葱伯克霍尔德菌G63脂肪酶同源高效表达[J].生物工程学报,2009,25(2):215-222.
[13]赵博,陶进,马吉胜,等.定向进化提高枯草芽孢杆菌脂肪酶的活力[J].催化学报,2009,30(4):291-296.
[14]DI LORENZO M,HIDALGO A,HAAS M,et al.Heterologous production of functional forms of Rhizopus oryzae lipase inEscherichia coli [J].Appl Environ Microbiol,2005,71(12):8974-8977.
[15]宋炜,蒋丽娟,申爱荣,等.高产脂肪酶酵母菌株的分离筛选及紫外诱变[J].中南林业科技大学学报:自然科学版,2009,29(3):55-59.
[16]林容霞,马延和,谭天伟.低温脂肪酶产生菌的筛选及鉴定[J].北京化工大学学报:自然科学版,2006,33(1):31-35.
[17]恽丽红,蔡宇杰,金永生,等.产低温脂肪酶非极端细菌的筛选、产酶发酵及粗酶性质研究[J].生物技术,2008,18(4):56-59.
[18]肖海群,段学辉,牛春铃.粗状假丝酵母(Candida validaT2)生产脂肪酶的发酵条件[J].食品与生物技术学报,2007,26(4):62-66.
[19]余琼,梁运祥.产低温脂肪酶假单胞菌的选育及产酶条件的优化[J].湖北农业科学,2006,45(5):662-665.
[20]郑小梅,伍宁丰,范云六.来源于青霉XMZ-9两个低温脂肪酶的基因克隆、原核表达与性质测定[J].生物工程学报,2012,28(4):488-497.
[21]郭晓军,郭威,袁洪水,等.一株饲用产脂肪酶芽孢杆菌的筛选及其紫外诱变育种[J].中国饲料,2015(12):27-29.
Screening and identification of lipase-producing strains and optimization of fermentation conditions
HU Jun,DU Xinkai,WANG Changgao,LIN Jianguo,DU Xin,CAI Jun*
(Key Laboratory of Fermentation Engineering(Ministry of Education),Hubei Provincial Cooperative Innovation Center of Industrial Fermentation,Hubei University of Technology,Wuhan 430068,China)
Using olive oil as unique carbon source,a lipase-producing strain HFE722 was isolated from the waste of canteen by screening plates. Through 16S rRNA gene sequence determination and analysis,results showed that strain HFE722 was identified as aBacillussp.Strain HFE722 was incubated for 36 h in the initial fermentation condition(fermentation temperature 30℃,inoculum 1%,natural pH,loading volume 100 ml/250 ml, shaking speed 200 r/min),the lipase activity of the fermentation broth was 2.17 U/ml.Single-factor method was used for optimizing the fermentation conditions,and then the optimum lipase production conditions were determined as follows:fermentation temperature 30℃,time 36 h,inoculum 1% (v/v),initial medium pH 7.0,loading volume 50 ml/250 ml,and shaking speed 160 r/min.Under these fermentation conditions,the lipase activity of fermentation broth of strain HFE722 reached 5.8 U/ml,which was 167.28%higher than that of before optimization.
lipase;screening;identification;fermentation conditions optimization
Q815
0254-5071(2016)11-0039-05
10.11882/j.issn.0254-5071.2016.11.008
2016-08-13
国家自然科学基金(31401807)
胡珺(1988-),男,硕士研究生,研究方向为发酵过程优化与放大。
*通讯作者:蔡俊(1968-),男,教授,博士,研究方向为微生物发酵工程。

