高效液相色谱法同时测定微生物酶法产L-丙氨酰-L-谷氨酰胺反应体系中5种物质及其样品处理方法对色谱峰的影响分析
魏照辉,张震宇,孙付保
(江南大学 生物工程学院 工业生物技术教育部重点实验室 糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
高效液相色谱法同时测定微生物酶法产L-丙氨酰-L-谷氨酰胺反应体系中5种物质及其样品处理方法对色谱峰的影响分析
魏照辉,张震宇*,孙付保*
(江南大学 生物工程学院 工业生物技术教育部重点实验室 糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
建立了同时测定微生物酶法产L-丙氨酰-L-谷氨酰胺反应体系中5种物质(L-丙氨酰-L-谷氨酰胺、L-谷氨酰胺、L-丙氨酸甲酯、L-谷氨酸、L-丙氨酰-L-丙氨酸)的高效液相色谱分析方法。考察了样品处理中存在的发酵液、磷酸、三氯乙酸对色谱峰的影响,建立了一种对色谱峰无干扰的样品处理方法。选用邻苯二甲醛(OPA)为衍生剂,以在线衍生的方式实现了标准品或样品的柱前自动衍生。选用C18色谱柱进行分离,柱温40 ℃,以12.5 mmol/L磷酸盐缓冲液(88%,pH 7.4)与12%乙腈为流动相进行等度洗脱,流速为1 mL/min,在λex=338 nm,λem=450 nm下进行荧光检测,外标法定量。结果显示,该色谱条件下5种物质的测定线性范围广,相关系数均大于0.999 4。低、中、高3组加标水平下的回收率为93.5%~104.9%,相对标准偏差(RSD)小于7%。1日内间隔2 h进行6次进样,5种物质保留时间的RSD均小于0.12%,峰面积RSD均小于1.2%。该方法操作简单,分离度与灵敏度高,定量精确,重复性好。
高效液相色谱法;柱前自动化衍生;L-丙氨酰-L-谷氨酰胺反应体系;样品处理方法
L-丙氨酰-L-谷氨酰胺(L-Alanyl-L-glutamine,L-Ala-L-Gln)是一种由L-丙氨酸与L-谷氨酰胺两种氨基酸缩合形成的二肽,简称丙谷二肽。作为一种条件必需氨基酸[1],L-谷氨酰胺(L-Gln)在医药临床领域应用广泛,可作为糖异生和尿素合成的原料[2]、神经递质的前体[3],可促进损伤组织的修复[4]、免疫细胞的增殖分化[5]、骨骼肌肌肉增长[6],同时可通过增加谷胱甘肽的合成,提高机体抗氧化能力[7]。由于L-谷氨酰胺存在溶解度低、热不稳定等缺陷导致其不能直接应用于临床[8]。L-丙氨酰-L-谷氨酰胺成功克服了L-谷氨酰胺理化性质上的缺陷,具有较高的溶解度与稳定性,且其在体内会迅速降解出L-谷氨酰胺,因此常作为L-谷氨酰胺的替代品以注射液的形式应用于临床[9]。
目前主要通过化学合成法生产丙谷二肽[10-11],但该方法通常存在过程复杂、成本高、易产生副产物、试剂有害等缺点,不适合大规模工业生产。本实验室率先在国内开展了有关微生物酶法生产丙谷二肽的研究,目前已构建出一系列具备产丙谷二肽能力的微生物菌种,并实现了丙谷二肽的生物制备。这些菌种能够表达α-氨基酸酯酰基转移酶,在该酶的作用下,L-丙氨酸甲酯(L-AlaOMe)的酯酰基可脱除并与L-谷氨酰胺的氨基缩合形成目标产物丙谷二肽,同时,脱除酯酰基的L-丙氨酸甲酯同样可与其自身的氨基缩合形成副产物L-丙氨酰-L-丙氨酸(L-Ala-L-Ala)[12]。此外,L-丙氨酸甲酯与L-谷氨酰胺在反应中不可能完全消耗,L-谷氨酰胺在反应过程中会部分降解为L-谷氨酸(L-Glu)。综上,整个反应体系中存在两种二肽(L-Ala-L-Gln,L-Ala-L-Ala)、两种氨基酸(L-Gln,L-Glu)和一种氨基酸衍生物(L-AlaOMe)。为了对丙谷二肽生产菌种进行性能评估,需要建立一种稳定、准确、快速的检测方法来分析反应体系中各物质的含量。
以邻苯二甲醛(OPA)为柱前衍生剂进行氨基酸HPLC测定的技术已很成熟[13-15],但运用HPLC法测定氨基酸甲酯鲜有报道,更无有关L-丙氨酰-L-丙氨酸测定的报道。而关于OPA衍生化测定丙谷二肽与谷氨酰胺的报道[16]也仅实现了两种物质的单独测定而非同时测定,且OPA衍生物极不稳定,其选用的手动衍生具有较大的测量误差。也有文献报道采用异硫氰酸苯酯(PITC)为柱前衍生化试剂,用紫外检测器进行丙谷二肽的单独检测[17]。此外,在流动相中添加如辛烷磺酸钠等离子对试剂,可无需衍生直接测定丙谷二肽[12],但离子对试剂会损伤色谱柱并带来方法的不稳定性。本研究选取邻苯二甲醛作为衍生剂进行柱前自动衍生,建立了可同时测定寡肽、氨基酸与氨基酸衍生物3类物质的高效液相色谱检测方法。微生物酶法生产丙谷二肽具有成本低、污染少、工艺简单等优势,有望取代化学合成法成为丙谷二肽的主流生产方法。该分析测定方法为丙谷二肽微生物酶法生产工艺的建立提供了必要的技术支持,具有重要的工业应用价值。此外,该方法同样适用于临床、饲料以及化学合成领域中丙谷二肽、L-谷氨酰胺等主体物质的测定。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪:Agilent 1260 Infinity与Waters 2695,其中Agilent 1260 Infinity配备Agilent荧光检测器,Waters 2695配备Waters 2475荧光检测器。L-丙氨酰-L-谷氨酰胺(TCI公司);邻苯二甲醛、巯基乙醇、L-丙氨酰-L-丙氨酸(Sigma公司);L-丙氨酸甲酯盐酸盐(安耐吉公司);L-谷氨酸、L-谷氨酰胺、磷酸氢二钾、磷酸二氢钾、乙腈、甲醇等(国药集团化学试剂有限公司)。
1.2 色谱条件
色谱柱:Agilent ZORBAX SB-Aq C18柱(250 mm × 4.6 mm,5 μm);流速:1.0 mL/min;柱温:40 ℃;进样量:20 μL;荧光检测波长:λex=338 nm,λem=450 nm;流动相:乙腈(A),12.5 mmol/L磷酸钾缓冲液(B,分别配制浓度同为12.5 mmol/L的磷酸氢二钾与磷酸二氢钾溶液,二者互调至pH 7.4);洗脱方式:磷酸盐缓冲液-乙腈(88∶12)等度洗脱。
1.3 衍生剂配制
取50 mg邻苯二甲醛和100 μLβ-巯基乙醇,加入300 μL甲醇溶解,1.6 mL 硼酸缓冲液(pH 10.0)混匀即得。硼酸缓冲液(pH 10.0):分别配制0.05 mol/L硼砂溶液与0.2 mol/L氢氧化钠溶液,准确移取50 mL硼砂溶液与23 mL氢氧化钠溶液于200 mL容量瓶中,混合均匀,并用水稀释至刻度线即得。
1.4 柱前自动化在线衍生程序
吸取2 μL样品和2 μL衍生剂混合3次,吸取16 μL硼酸缓冲液混合15次,吸取20 μL流动相混合5次,进样。该程序可表示为:2 μL样品+2 μL衍生剂+16 μL硼酸缓冲液+20 μL流动相。每次吸取完毕后,需运行洗针程序。
1.5 标准溶液的配制
精确称取21.7 mgL-Ala-L-Gln,14.6 mgL-Gln,14.7 mgL-Glu,14.0 mgL-AlaOMe,16.0 mgL-Ala-L-Ala,用适量去离子水溶解后分别定容至25 mL容量瓶中,得浓度均为4 mmol/L的5种标样母液。后续实验所需标准品以该母液稀释或搭配稀释获得。
1.6 样品的制备与处理
1.6.1 含磷酸、三氯乙酸与发酵液的样品处理方法 取500 μL菌液,加入500 μL底物溶液(100 mmol/LL-Gln,100 mmol/LL-AlaOMe·HCl,pH 9.0),混匀后置于25 ℃反应1.5 h,加入等体积的磷酸溶液(1.7%)终止反应,离心(12 000 g,10 min)后吸取上清液,用等体积三氯乙酸(10%)对上清液预处理沉降蛋白,再次离心(12 000 g,10 min)后吸取上清液将其稀释至线性范围内,上柱分析。
1.6.2 不含磷酸、三氯乙酸与发酵液的样品处理方法 取2 mL菌液,离心(8 000 g,5 min)后去上清发酵液,用生理盐水清洗细胞两次以完全清除残留在细胞壁上的发酵液,再次离心(8 000 g,5 min)去上清生理盐水,保留菌体,加入500 μL底物溶液(100 mmol/LL-Gln,100 mmol/LL-AlaOMe·HCl,pH 8.0),混匀后置于25 ℃反应1.5 h,高速离心(12 000 g,10 min)反应体系并迅速吸取上清反应液以终止酶催化反应,将上清反应液稀释至线性范围内,上柱分析。
2 结果与讨论
2.1 实验条件的优化
2.1.1 检测波长的选择 OPA衍生化法测定氨基酸一般选取激发波长(λex)为300 ~360 nm,发射波长(λem)为450 nm左右。由于本研究涉及多种类待测物,因此选取L-Ala-L-Gln(寡肽)、L-Gln(氨基酸)、L-AlaOMe(氨基酸衍生物)3种主要且具有代表性的待测物进行波长优化实验。对3种标准品进行柱前手动衍生化处理,选用Waters 2475多通道荧光检测器检测。固定发射波长为450 nm,激发波长控制在300~360 nm之间;固定激发波长为330 nm,发射波长控制在400~480 nm之间,各物质峰面积随波长的变化曲线显示,激发波长选取338 nm,发射波长选取450 nm时各物质均可获得最大吸收值,因此选其作为检测波长。
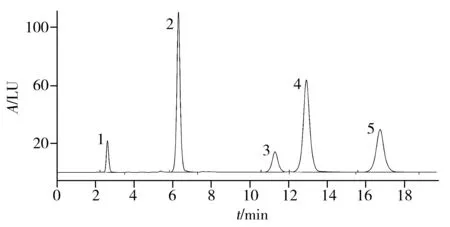
图1 5种标样衍生化产物的色谱图Fig.1 Chromatogram of derivatives of five standard substances 1.L-Glu,2.L-Gln,3.L-AlaOMe,4.L-Ala-L-Gln,5.L-Ala-L-Ala
2.1.2 流动相的选择 选取磷酸盐缓冲液(12.5 mmol/L,pH 7.4)为流动相中的无机相,乙腈为流动相中的有机相。考察了无机相与有机相配比在70∶30~95∶5之间时各物质峰之间的分离度。结果发现,L-丙氨酰-L-谷氨酰胺与L-丙氨酸甲酯之间的分离度受流动相配比的影响较大。当磷酸盐缓冲液用量少于总体积的83%时,二者不能完全分离;当磷酸盐缓冲液用量大于总体积的86%时,二者之间的分离度达1.5,可用于定量检测;当磷酸盐缓冲液用量大于总体积的95%时,流动相几乎丧失洗脱能力,各物质峰拖尾现象严重。实验最终选取两相配比为88∶12。5种标样衍生化产物在该流动相配比下的色谱图见图1。由结果可知,在该流动相下,5种物质均实现了基线分离,且峰形较好,表明该流动相适合5种物质的分离与定量分析。
2.1.3 柱温的选择 分别考察了30,35,40,45 ℃柱温条件下5种物质的色谱行为。结果显示,5种物质主峰的保留时间随柱温的升高而缩短,分离度均可满足要求。考虑到色谱柱寿命与柱效等因素,并尽可能缩短样品运行时间,柱温选取40 ℃。
2.1.4 衍生剂用量的选择 OPA衍生试剂毒性较大,不宜过量使用,但OPA衍生化产物极不稳定,用量过少则会造成衍生化不完全。考察了衍生剂与5种物质在不同摩尔比下的峰面积,结果显示当OPA与待测物的摩尔比为50∶1时,各物质峰面积均达到相对极大值;高于此比例后,峰面积无明显增加。因此,实验选择OPA与待测物的摩尔比为50∶1。
2.2 线性范围与定量下限
量取一定体积5种标准品的4 mmol/L母液,用去离子水将其各自稀释成0.08,0.16,0.20,0.24,0.32 mmol/L 的标准梯度溶液。将5种物质的标准梯度溶液经柱前在线衍生后自动稀释20倍,即得各自最终梯度浓度(4,8,10,12,16 μmol/L),而后上柱定量检测,在优化条件下考察色谱图,记录峰面积,以10倍信噪比确定定量下限(LOQ)。5种物质的线性关系与LOQ见表1。结果显示,5种物质具有较广的线性范围,且线性良好,相关系数均大于0.999 4,LOQ为0.02~0.24 μmol/L,表明该方法适合5种物质的精确定量分析。

表1 5种物质的线性关系与定量下限
*y:peak area;x:analyte concentration(μmol·L-1)
2.3 加标回收率实验
将一真实样品作为加标底样,选取低(50%左右)、中(100%左右)、高(200%左右) 3组水平进行加标实验,每个水平重复3次。加标样同样经柱前自动化衍生后上柱定量检测,考察色谱图,记录峰面积。测定结果显示,5种物质的平均回收率为93.5%~104.9%,相对标准偏差(RSD)在7%以内,表明该方法准确度及精密度良好,结果见表2。
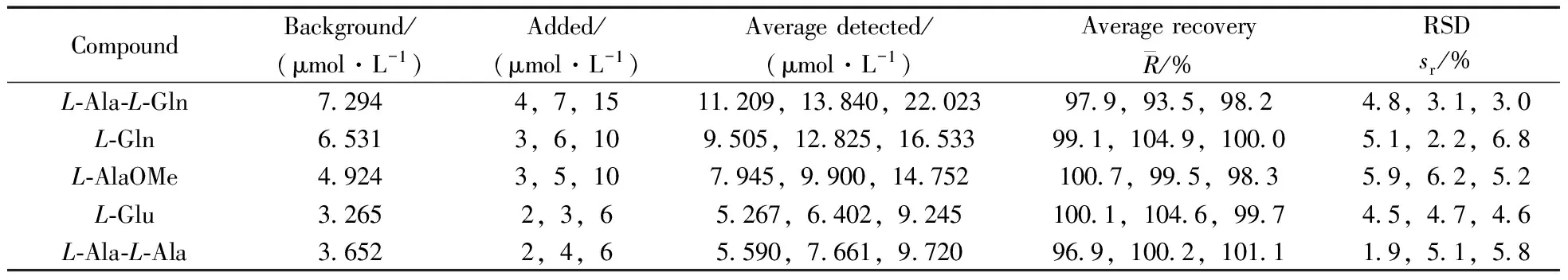
表2 5种物质的加标实验结果(n=3)
2.4 分析系统重复性实验
取混合标准样品1份,1日内间隔2 h进行6次进样,观测5种物质峰的保留时间,记录峰面积。测得L-Ala-L-Gln,L-Gln,L-AlaOMe,L-Glu和L-Ala-L-Ala 6次进样的出峰时间RSD值分别为0.05%,0.05%,0.07%,0.12%和0.04%,峰面积RSD值分别为0.61%,0.30%,1.2%,0.43%和0.60%。结果表明该方法稳定性较好,日内误差小。
2.5 样品处理方法对色谱峰的影响分析
研究初期选取“1.6.1”所述以菌液作为粗酶源的样品处理方法,发现测量值远小于预期值且杂峰较多。经分析,该样品处理方法溶剂组成为发酵液(12.5%)、水(12.5%)、磷酸(25%)与三氯乙酸(50%)。考察了如表3所示7种溶剂组成下3种物质的色谱图。分别以1号、2号溶剂配制3种主要检测物(L-Ala-L-Gln,L-AlaOMe,L-Gln)标样,两种溶剂下对应的3种物质色谱图显示,样品处理过程所用的发酵液、磷酸与三氯乙酸会打压目标峰并造成峰形混乱。分别以1号、3号、4号溶剂配制L-Ala-L-Gln标样,L-Ala-L-Gln标样色谱图说明,样品处理过程中用到的发酵液会引起峰形混乱,磷酸与三氯乙酸会打压目标峰。分别以1号、5号、6号、7号溶剂配制L-Ala-L-Gln标样,色谱图结果表明磷酸与三氯乙酸单独存在或混合存在时均会对目标峰形成打压。将另外4种标样进行相同实验,其结果与L-Ala-L-Gln类似。

表3 7种溶剂组成
发酵液中存在其他具有游离氨基的组分,因此会引起峰形混乱。推测磷酸与三氯乙酸引起目标峰打压的原因如下:①OPA衍生化反应要求体系的pH值呈碱性,两种酸的存在会大幅度降低体系的pH值从而导致衍生化反应不能正常进行;②氨基酸、氨基酸衍生物以及寡肽是两性物质,其α-氨基可与酸结合生成共价化合物,而OPA的衍生机理显示,被检测物的α-氨基必须以游离形式存在,方能衍生。而磷酸与三氯乙酸的存在会大幅度降低反应体系中游离氨基的数量,导致待测物不能被正常衍生。磷酸还可促使生物酶失活使之催化效力丧失,其常用作酶催化反应的终止剂。发酵液中存在一定的大分子蛋白,易造成色谱柱堵塞,因此含有发酵液的样品通常不可直接上柱做HPLC分析。作为一种常用的蛋白变性剂,三氯乙酸可促使蛋白质的构象发生改变,暴露出较多的疏水性基团,使之聚集沉降,其常用于发酵液中大分子蛋白的柱前沉降预处理。上述两种酸虽然在微生物发酵液检测领域有着广泛的应用,但通过本部分结果可知这两种酸不可用于OPA衍生化HPLC法检测发酵液中富含氨基的物质,因此本研究发现具有一定的现实指导意义。
2.6 样品处理方法的建立及实际样品测定
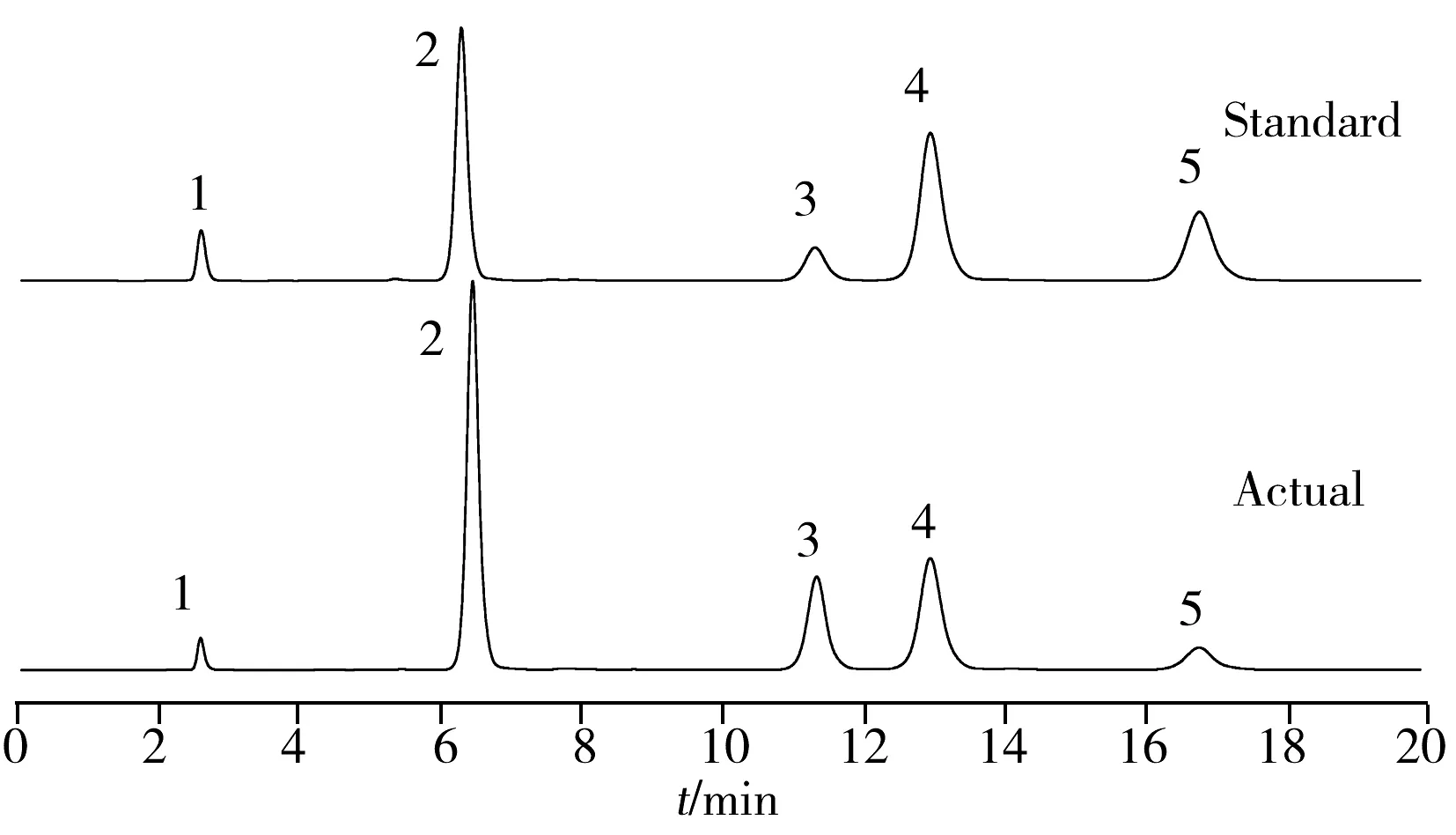
图2 实际样品与标准品的对照色谱图Fig.2 Chromatograms of actual sample and standard sample1.L-Glu,2.L-Gln,3.L-AlaOMe,4.L-Ala-L-Gln,5.L-Ala-L-Ala
由于α-氨基酸酯酰基转移酶属于微生物胞内酶,所以既可选用微生物菌液也可选用菌体自身作为粗酶源来参与催化反应。根据“2.5”结论建立了“1.6.2”所述样品处理方法。该样品处理方法与“1.6.1”相比有以下优势:以菌体代替菌液作为粗酶源参与酶催化反应,可消除发酵液造成的峰形混乱与三氯乙酸造成的峰形干扰;以高速离心的方式代替磷酸终止酶催化反应,可解除磷酸对峰形的干扰;加大酶量的同时浓缩了待测体积,便于样品制备时多种稀释倍数的选择。在该处理方法下,将样品稀释至“2.2”所述线性范围内,经柱前在线衍生后,按照“2.1”色谱条件定量检测。两种底物浓度均为100 mmol·L-1时,各丙谷二肽生产菌种的测定结果如表4所示。结果显示,pAMP质粒是SAET的最适表达载体,而E.coliJM109是这一表达载体的最适宿主。最优菌种E.coliJM109/pAMP-SAET的丙谷二肽产量可达到45.67 mmol·L-1。实际样品与标准品的对照色谱图见图2。

表4 L-Ala-L-Gln生产菌种的测定结果
3 结 论
本文建立了一种可同时测定微生物酶法产L-丙氨酰-L-谷氨酰胺反应体系中5种物质的高效液相色谱分析方法,并着重分析了样品处理方法对色谱峰的影响。结果表明,该方法具有操作简便、回收率与灵敏度高、重复性好等优点,为丙谷二肽生产菌种的性能评估与工业化放大生产提供了有力的技术支持。另外,研究发现使用柱前衍生化HPLC法测定氨基酸、氨基酸衍生物以及寡肽等具有游离氨基的物质时,磷酸与三氯乙酸会严重影响色谱峰,应尽量避免使用。
[1] Makoto Y,Shin-Ichi H.Appl.Microbiol.Biotechnol.,2008,81(1):13-22.
[2] Malcolm W,Brosnan John T.Chin.J.Clin.Nutrit.,2014,22(1):1-8.
[3] Shu X L,Wang J,Geng S S,Cai D L.Parenteral&EnteralNutrition(舒晓亮,王晶,耿珊珊,蔡东联.肠外与肠内营养),2005,12(6):329-331.
[4] Wang S S,Liang K.MedicalRecapitulate(王岁岁,梁琨.医学综述),2010,16(4):521-523.
[5] Lai Y,Yeh S,Lin M,Shang H,Yeh C,Chen W.Nutrition,2004,20(3):286-291.
[6] Wernerman J,Luo J L,Hammarqvist F.Proceed.Nutrit.Soc.,1999,58(3):677-680.
[7] Wu J,Cai W.Parenteral&EnteralNutrition(吴江,蔡威.肠外与肠内营养),2004,11(2):108-111.
[8] Zhang W R,Yang G Q,Wang H S.ChinaAnimalHusbandry&VeterinaryMedicine(张维睿,杨桂芹,王宏山.中国畜牧兽医),2004,31(7):10-12.
[9] Tabata K,Hashimoto S.Appl.Environm.Microbiol.,2007,73(20):6378-6385.
[10] Tang G,Zhao Y F,Xu P X.Xiamen University.China Patent(唐果,赵玉芬,许鹏翔.厦门大学.中国专利),CN200510054083.3.[2005-10-19].
[11] Tang G.SynthesisandMechanismStudiesonL-Alanyl-L-Glutamine.Xiamen:Xiamen University(唐果.N(2)-L-丙氨酰-L-谷氨酰胺二肽的合成与反应研究.厦门:厦门大学),2004.
[12] Yoshinori H,Yasuhiro M,Ikuo K,Isao A,Kenzo Y.Biosci.Biotechnol.Biochem.,2013,77(3):618-623.
[13] Mu D H.Chin.J.Chromatogr.(牟德海.色谱),1997,15(4):319-321.
[14] Yang W,Xian S,Li D X,Wan X C.J.TeaSci.(杨卫,鲜殊,李大祥,宛晓春.茶叶科学),2011,31(3):211-217.
[15] Zhu Z J.Chin.J.Anal.Chem.(朱智甲.分析化学),2000,28(5):609-612.
[16] Zhou R Y.FeedRes.(周荣艳.饲料研究),2004,(1):30-32.
[17] Zhang Y C,Wang D D.Chin.J.Biochem.Pharm.(张云楚,王丹丹.中国生化药物杂志),2006,27(6):364-366.
Simultaneous Determination of 5 Substances in the Microbial Enzymatic Reaction System of L-Alanyl-L-glutamine by High Performance Liquid Chromatography and the Influence of Sample Preparation on Chromatographic Peaks
WEI Zhao-hui,ZHANG Zhen-yu*,SUN Fu-bao*
(Key Laboratory of Industrial Biotechnology of the Ministry of Education,Key Laboratory of Carbohydrate Chemistry and Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
A method of high performance liquid chromatography(HPLC) with fluorescence detector(FLD) was developed for the simultaneous determination of 5 substances in the microbial enzymatic reaction system ofL-alanyl-L-glutamine,includingL-alanyl-L-glutamine,L-glutamine,L-alanine methyl ester,L-glutamic acid andL-alanyl-L-alanine.Standard substances and samples were derivated with phthaldialdehyde(OPA) by online automated precolumn derivatization.The analytes were separated on a C18column using acetonitrile(12%) and 12.5 mmol/L potassium phosphate buffer(88%,pH 7.4) as mobile phase by isocratic elution and analyzed quantitatively by the external standard method at an excitation wavelength of 338 nm and an emission wavelength of 450 nm.The flow rate was set at 1 mL/min and the column temperature was 40 ℃.The calibration curves for five standard substances were all linear in a broad range with correlation coefficients more than 0.999 4.The average recoveries of five substances at three spiked levels ranged from 93.5% to 104.9% with relative standard deviations(RSDs) less than 7%.Injecting six times every two hours one day,the RSD values of retention time for five substances were all less than 0.12%,and the RSD values of peak area of five substances were all less than 1.2%.The method was simple,sensitive,accurate and repeatable with a high resolution.
high performance liquid chromatography(HPLC);online automated precolumn derivatization;the reaction system ofL-alanyl-L-glutamine;sample preparation
2016-03-23;
2016-04-13
国家自然科学基金(30970058,21176106);江苏省自然科学基金(BK2012554)
10.3969/j.issn.1004-4957.2016.10.017
O657.72
A
1004-4957(2016)10-1317-06
*通讯作者:张震宇,博士,教授,研究方向:发酵工程与分子生物学,Tel:0510-85327026,E-mail:zhangzy@jiangnan.edu.cn
孙付保,博士,副教授,研究方向:药用氨基酸及其衍生物的微生物酶法制造,Tel:0510-85327026,E-mail:fubaosun@jiangnan.edu.cn

