基于GC-TOF/MS技术的转Bt基因大米代谢组学研究
程建华,桑志红,李海静,吴胜明,夏 晴,董方霆
(军事医学科学院生物医学分析中心,北京 100850)
基于GC-TOF/MS技术的转Bt基因大米代谢组学研究
程建华,桑志红,李海静,吴胜明,夏 晴,董方霆*
(军事医学科学院生物医学分析中心,北京 100850)
基于GC-TOF/MS技术对来源于两个不同产地的转Bt基因及其亲本大米进行了代谢组学研究。从大米样本中共检出774个色谱峰,鉴定出278种代谢产物,包括糖、氨基酸、脂肪酸及有机酸等代谢产物。对转Bt基因及其亲本大米进行主成分分析,结果表明,转Bt基因与亲本大米的代谢组之间无明显差异性,进一步对数据进行偏最小二乘判别分析和方差分析,仅甘油和鼠李糖两种代谢产物浓度在转Bt基因大米及其亲本大米间存在一定差异(分别升高1.55和3.32倍);考察了不同产地对大米代谢组的影响,结果表明武汉和海南两个产地的大米代谢组之间存在明显差异,有15种代谢产物在不同产地的亲本大米之间以及不同产地的转基因大米之间均发生显著变化。应用GC-TOF/MS技术对来源于不同产地的转Bt基因大米及其亲本大米的代谢组进行比较研究,结果表明引入外源Bt基因对实验中的水稻机体内代谢未产生明显影响,产地差异造成的大米间代谢组差异比引入外源Bt基因造成的大米间代谢组差异更为显著。
转基因大米;代谢组学;差异代谢产物;多元统计分析;气相色谱-飞行时间质谱联用(GC-TOF/MS)
转基因农作物用于生产和消费的时间相对较短,其安全性受到人们的广泛关注。外源基因的引入有可能使受体植物的能量代谢和物质代谢发生变化,并影响受体植物原有表型性状和遗传性状的改变[1],也可引起植物的营养成分和代谢产物的含量发生变化,甚至使转基因作物产生一些新的毒性物质[2]。目前,虽然缺乏足够的证据证实转基因作物对人类和环境是否存在危害,但所有学者认为转基因作物及其产品在进入消费市场前必须经过严格科学的安全评估[3]。
基于转基因作物与其亲本作物的组学比较研究是近年兴起的一个评价转基因作物安全性的有效手段。其中,代谢组学技术在转基因作物安全性评价领域具有更独到的优势,由于代谢产物的种类远少于基因和蛋白的数目,代谢物在生物体液或组织分布均匀,利用代谢组学技术可以更灵敏、更准确地监测生物体系的状态及动态变化。近年来,人们利用代谢组学技术对玉米[4]、大豆[5]、土豆[6-7]、黄瓜[8]、棉籽[9]、葡萄[10]、木瓜[11]、水稻[12]、番茄[13]等转基因农作物进行了深入研究,从代谢终端的角度对转基因作物因引入外源基因可能造成的代谢途径变化机制、农作物的非预期效应和食用安全性进行了评估。
苏云金杆菌(Bacillusthur-ingiensis,Bt)能产生一种杀虫晶体蛋白,这种蛋白被鳞翅目类昆虫取食后在消化系统中降解为活性肽,并与昆虫受体蛋白结合,引起细胞膜破裂,最终导致昆虫瘫痪或死亡。转Bt基因水稻是利用转Bt基因技术从苏云金杆菌中分离出编码这种蛋白的基因,经修饰改造后导入水稻细胞中,使其自身产生这种晶体蛋白而具有抗虫特性的水稻品种。本实验利用基于气相色谱-飞行时间质谱联用(GC-TOF/MS)的代谢组学技术对来源于两个不同产地的转Bt基因大米及其亲本大米的代谢组进行比较分析,获得转Bt基因大米与亲本大米之间的差异性代谢产物,分析水稻因引入外源Bt蛋白可能造成的代谢通路变化,从代谢终端为转Bt基因大米的安全性评价提供了新依据。
1 实验部分
1.1 实验用品
转Bt基因水稻“华恢1号”及其亲本作物“汕优63”由华中农业大学张启发和林拥军教授提供。水稻采自海南和武汉实验田,收割的水稻经去皮、精制后真空低温(-20 ℃)保存。HPLC 级甲醇、氯仿和吡啶购于北京化学试剂公司;核糖醇以及衍生剂盐酸甲氧胺、N-三甲基硅-三氟乙酰胺(MSTFA)和氯三甲基硅烷(TMCS)购于Sigma Aldrich(St.Louis,MO,USA);超纯水(18.2 MΩ·cm) 采用Millipore Milli-Q Gradient system 制备(Millipore Corp.,MA,USA)。
1.2 样品前处理
将大米粉碎后过200目筛,精确称取各种大米粉末100.0 mg,置于1.5 mL EP管中,向其中加入600 μL二氯甲烷、200 μL甲醇以及200 μL去离子水,涡旋1 min,充分混匀;再加入20 μL的0.2%核糖醇溶液,充分混匀后超声提取3次,每次15 min,并浸泡过夜,再以13 000 r/min离心15 min,取上层清液,用N2在45 ℃下吹干。每种大米各取4个平行样本。
向吹干的提取物中加入40 μL 20 mg/mL盐酸甲氧胺的吡啶溶液,涡旋30 s,充分混匀,在30 ℃下以130 r/min孵育90 min;充分反应后,再加入40 μL MSTFA(含1% TMCS),充分混匀,在37 ℃下气浴30 min,取出,室温下放置120 min后,保存于4 ℃冰箱待测。
1.3 GC-TOF/MS分析
采用LECO Pegasus 4D GC-TOF/MS系统(LECO公司,美国)进行检测分析,该系统包括:Agilent 7890 GC,串联LECO Pegasus 4D TOF/MS检测器,Gerstel MPS自动进样系统(Tegent Scientific Ltd.美国)。色谱柱Rsi-5MS(30 m×250 μm×0.25 mm)和RTX-200(1.8 m×180 μm×0.20 mm),购于瑞斯泰克公司。程序升温:初始温度为70 ℃,保持1 min;以5 ℃/min升至280 ℃,保持10 min。载气为氦气,流速为1 mL/min;进样体积:1 μL;分流比为1∶5。溶剂延迟时间设为330 s,进样口、传输线和离子源温度分别设为250,250,220 ℃。电子轰击电离(70 eV),检测器电压为1 550 V,质量扫描范围设为50~800m/z,采集速度为10 spectrum/s,信噪比设为50。
1.4 数据分析
将GC-TOF/MS采集的原始数据,经LECO Pegasus 4D ChromaTOF 4.5软件(含NIST 10谱库和Fiehn代谢产物质谱库等)进行峰对齐、去卷积、峰检索,根据相似度获得色谱峰所对应的化合物名称,再利用内标物核糖醇进行归一化处理。将处理好的数据导出,并利用Simca 10.0软件对数据进行主成分分析(PCA)和偏最小二乘-判别分析(PLS-DA)等多元统计分析。通过PCA和PLS-DA的得分图分析组内和组间样本代谢组的差异性,再根据载荷图和变量对分组贡献值的大小(VIP)筛选组间可能的差异性代谢产物。将筛选出的组间差异物及其峰面积导入SPSS 13.0软件进行方差分析(ANOVA),获得组间变化具有显著性(P<0.05)的差异代谢产物。
2 结果与讨论
2.1 大米样本的GC-TOF/MS总离子流图
利用ChromaTOF 4.5软件的统计比较功能,对GC-TOF/MS采集的16个大米样本的原始数据进行峰对齐、去卷积、峰检索等处理后,检出信噪比大于50的色谱峰共774个。利用NIST 10和Fiehn等谱库进行峰检索,指认出包括糖类、氨基酸类、有机酸类、脂肪酸类及其他代谢产物278种。各组样本的总离子流色谱图的比对分析显示,同一产地的转Bt基因大米与亲本大米样本间的色谱峰无明显的差异性,而不同产地间大米的总离子流图存在一定的差异性(见图1)。
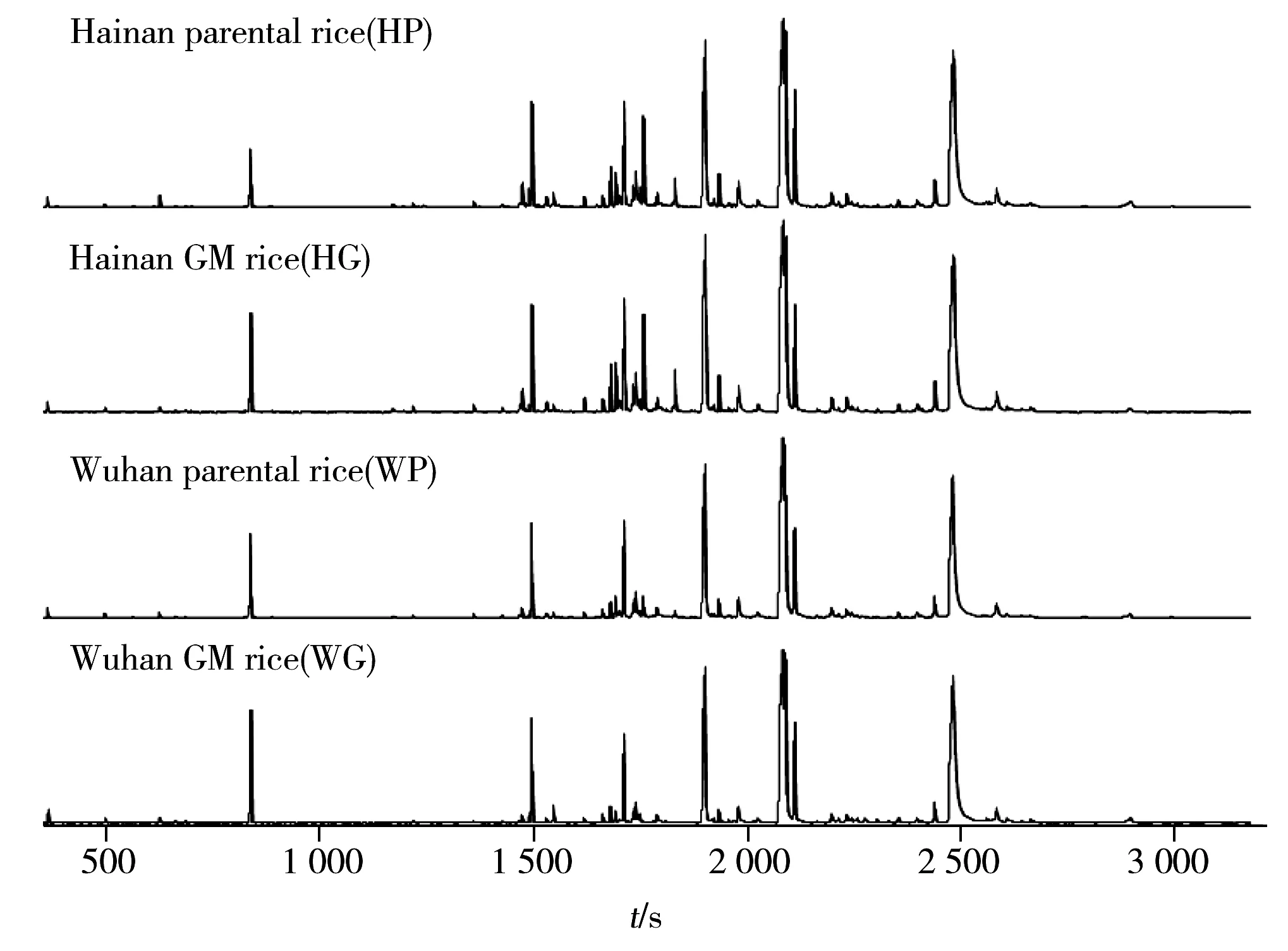
图1 大米样本的GC-TOF/MS总离子流图Fig.1 GC-TOF/MS total ion current(TIC) chromatograms of rice samples
2.2 转基因大米与其亲本大米之间代谢组学比较
原始数据经对齐、去卷积和归一化处理后导出,用SIMCA-10.0进行主成分分析(PCA),对两个不同产地的转Bt基因和亲本大米分别进行PCA分析。
对16个大米样本进行PCA分析(图2A),发现产地为武汉的转Bt基因大米和亲本大米的代谢组之间无明显的分离趋势,表明该产地的亲本大米和转基因大米的代谢组之间无明显的差异性。PCA分析得到的模型拟合度参数[14-15]R2X(cum)为0.668,说明模型的3个主成分能解释66.8%的X变量,Q2(cum)为0.224,表明模型预测能力较低。由于两种样本间没有明显的分离趋势,因此图2B中分布的代谢物也不具有一定的差异指向性,需要进一步分析。
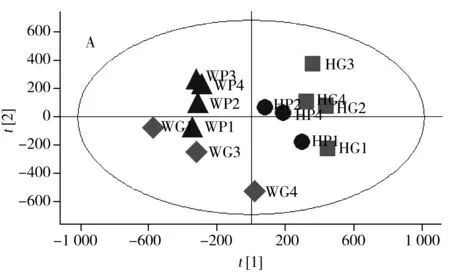
进一步对数据进行有监督的PLS-DA分析(图3A),武汉转Bt基因大米和亲本大米之间存在明显的分离和聚集趋势,而且模型参数得到进一步改善:拟合度参数R2X(cum)为0.511,R2Y(cum)为0.943,表明模型的2个主成分能解释51.1%的X变量和94.3%的Y变量,利用正交验证可通过该模型进行预测的变量达到82.7%。根据PLS-DA分析获得的载荷图和变量对分组贡献值(VIP,Variable importance in the projection)的大小,筛选出51个VIP>1.0的变量(图3B),包括糖类、有机酸类、脂肪酸类和氨基酸类等。将这51种代谢产物进一步用SPSS进行方差分析,发现29种具有显著差异(P<0.05)的代谢产物,其中,在转Bt基因大米中显著高于亲本大米的代谢物有4种,包括海藻糖、鼠李糖、麦芽糖和山梨醇,变化最大的是海藻糖和鼠李糖。在转基因大米中降低的代谢物有3种,包括半乳糖、吡喃半乳糖苷和葡萄糖酸,转Bt基因大米中的葡糖酸仅为亲本大米中的0.05倍。上述5种脂肪酸在转Bt基因大米中的浓度水平均显著高于亲本大米,变化倍数为1.27~2.53倍。而4种有机酸在转Bt基因大米中的浓度水平均低于亲本大米,仅为亲本大米的0.38~0.75倍。
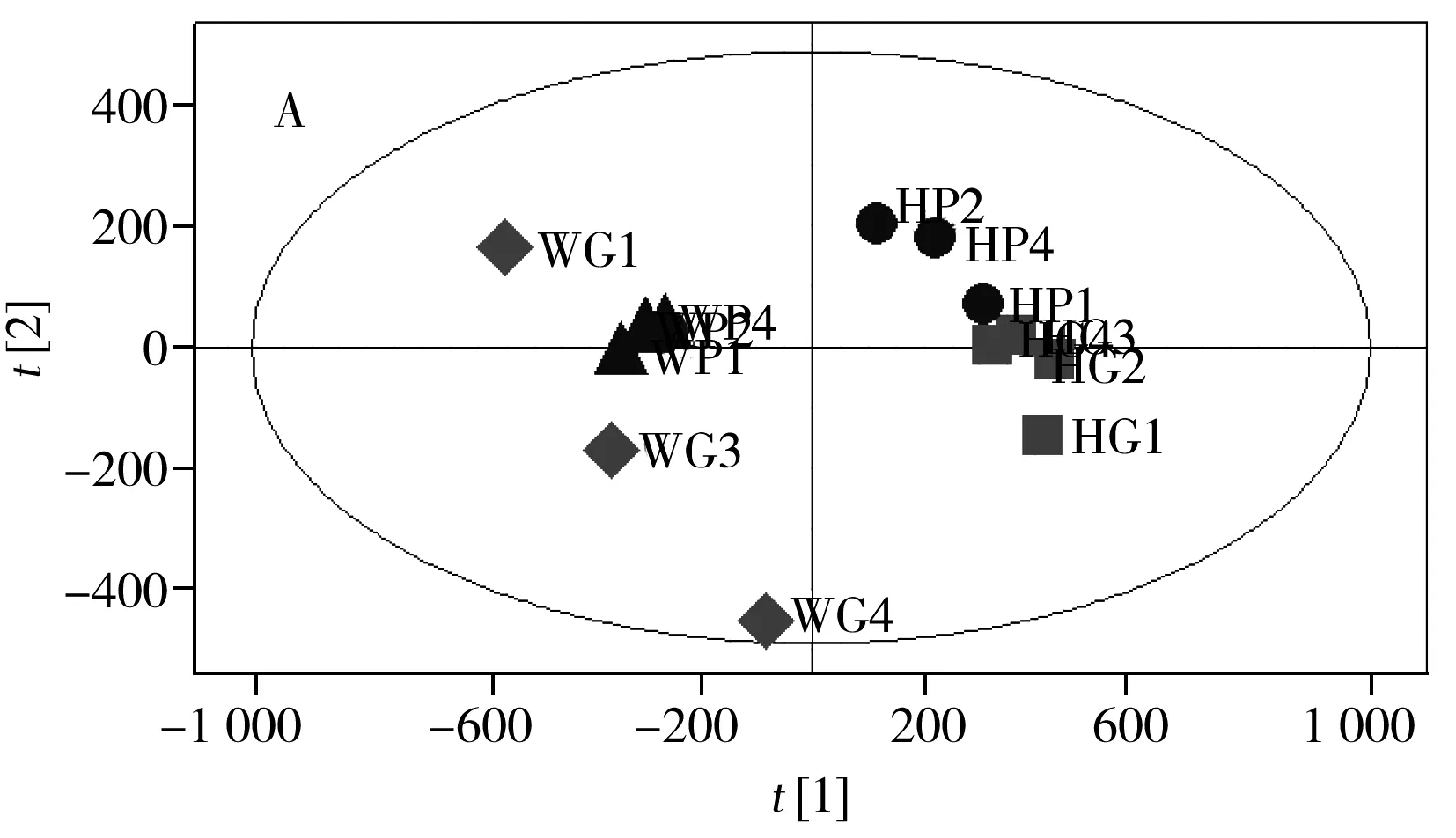
同样,将产地为海南的转Bt基因和亲本大米进行PCA和PLS-DA分析。由PCA分析可知,亲本和转Bt基因大米样本的代谢组之间无显著差异。进一步做PLS-DA分析,发现47种VIP>1.0的变量,其中经ANOVA分析获得P<0.05的差异物有23种,包括11种糖类物质、4种氨基酸、1种脂肪酸、2种有机酸和5种其他化合物。
通过分别对产地为武汉和海南的转Bt基因和亲本大米的分析表明,这两个产地的转Bt基因和亲本大米之间共有50种代谢产物发生了显著变化(见图4A),包括糖类、氨基酸类、脂类和有机酸类等,其中仅有7种代谢产物在两个不同产地的亲本和转Bt基因大米之间发生了显著变化(见表1)。而与亲本大米比较,这7种代谢产物中仅甘油和鼠李糖在两种产地的转Bt基因大米中均出现上调趋势,且上调幅度非常接近,产地为武汉的分别上调1.55倍和3.32倍,产地为海南的分别上调1.69倍和3.17倍;其他5种代谢产物在转Bt基因大米和亲本大米中也出现两种不同的变化趋势。利用MetaboAnalyst 3.0和KEGG软件分析发现,鼠李糖和甘油主要涉及多种糖代谢和甘油脂代谢途径。
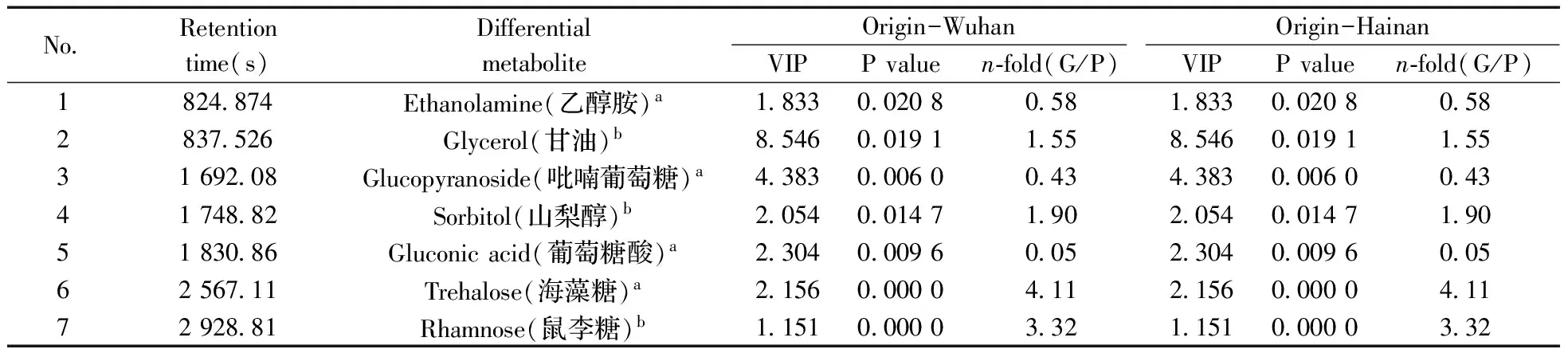
NoRetentiontime(s)DifferentialmetaboliteOrigin-WuhanOrigin-HainanVIPPvaluen⁃fold(G/P)VIPPvaluen⁃fold(G/P)1824874Ethanolamine(乙醇胺)a1833002080581833002080582837526Glycerol(甘油)b8546001911558546001911553169208Glucopyranoside(吡喃葡萄糖)a4383000600434383000600434174882Sorbitol(山梨醇)b2054001471902054001471905183086Gluconicacid(葡萄糖酸)a2304000960052304000960056256711Trehalose(海藻糖)a2156000004112156000004117292881Rhamnose(鼠李糖)b115100000332115100000332
VIP means variable importance in the projection using PLS-DA;superscript “a” means those compounds which similarities are over 800 compared with mass spectrograms from NIST 10.0,but not compared with the mass spectrograms of standard compounds;superscript “b” means those compounds which similarities are over 800 compared with mass spectrograms from NIST 10.0 and mass spectrograms of standard compounds;n-fold means changing fold;“G/P” means peak area ratios of GM rice(G) to parental rice(P)(VIP为PLS-DA分析获得的变量对分组的贡献值,值越大表明变量对分组贡献越大;a表示经质谱谱库和谱图比对分析获得相似度大于800的化合物,但这些化合物未经标准物质质谱谱图比对;b表示经质谱谱库和谱图比对分析获得相似度大于800的化合物,且经标准物质质谱谱图比对一致;n-fold表示变化倍数,“G/P”表示转Bt基因组(G)与亲本组(P)峰面积均值的比值)
2.3 不同产地大米之间代谢组学的比较
水稻生长的自然环境(如温度、湿度、光照、土壤、水等)对水稻的生长会产生重要影响,所以不同产地的大米的代谢组可能存在明显的差异性。为此,对海南和武汉产地4组大米样本按产地不同分别进行分析。
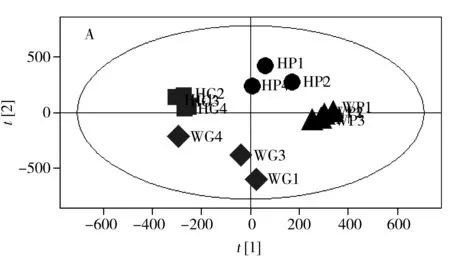
将两个产地的亲本大米进行PCA分析和PLS-DA分析,从PLS-DA得分图(图4A)可以看出,两种不同产地的大米样本具有明显的分离趋势,表明产地为武汉和海南的两组亲本大米样本的代谢组之间存在明显差异。同样从获得的模型拟合参数R2X(cum)可以发现,3个主成分能解释50.3%的X变量及96.1%的Y变量,利用正交验证可通过该模型进行预测的变量达76.9%。进一步对两组样本进行PLS-DA分析,利用载荷图(图4B)和VIP值,筛选出VIP>1.0的变量55个,且经ANOVA分析获得P<0.05的代谢产物共37种,包括14种糖类、8种脂类、2种氨基酸、2种有机酸类和11种其他化合物。
同样,对两个不同产地的转Bt基因大米进行PCA和PLS-DA分析,表明两种产地的转Bt基因大米的代谢组存在明显差异。进一步通过PLS-DA分析获得64个对分组贡献值VIP>1.0的变量,其中有46种化合物在不同产地的两组大米样本中浓度水平发生了显著变化(P<0.05)。
对仅产地不同的16个样本进行代谢组分析发现,产地为武汉的大米与海南的大米共有68种代谢产物发生了显著变化,包括糖类、有机酸类、脂类和氨基酸类物质。其中17种代谢产物在转Bt基因大米和亲本大米之间发生显著变化(见表2)。在亲本大米和转Bt基因大米中,有15种化合物在武汉来源的大米中的浓度水平均低于海南来源大米中的浓度(见图5)。
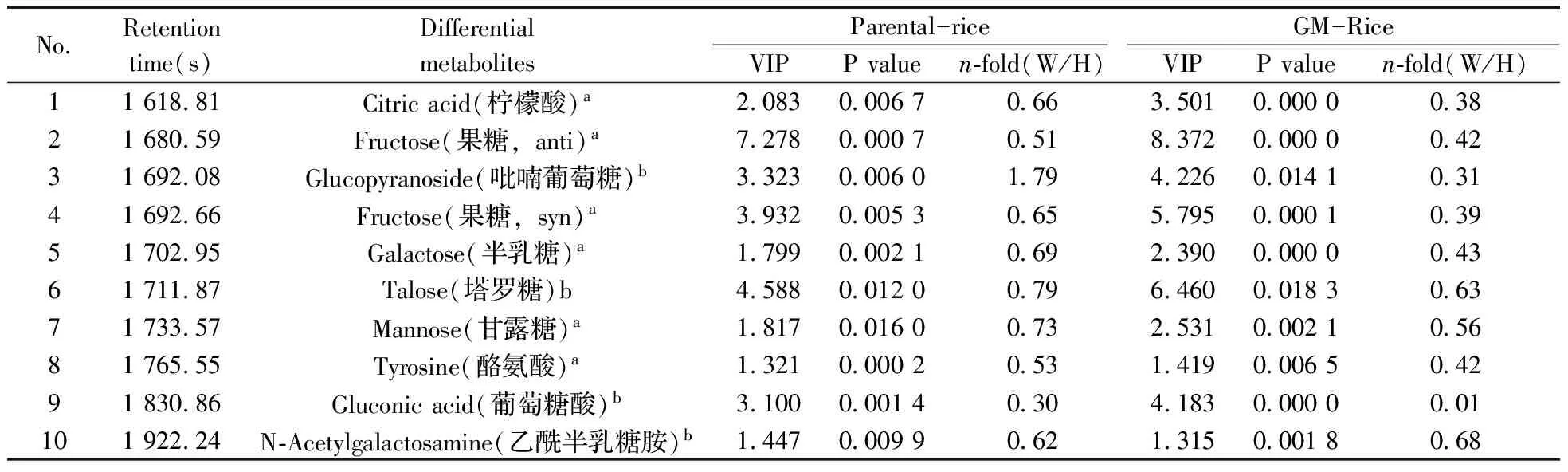
表2 两种不同产地的大米之间均发生显著性变化的代谢产物
(续表2)

NoRetentiontime(s)DifferentialmetabolitesParental-riceGM-RiceVIPPvaluen⁃fold(W/H)VIPPvaluen⁃fold(W/H)11193396Myo-inositol(肌醇)a41340005106349910000104512217103Galactinol(半乳糖醇)b10610002606814690000004713235239Mannosylglycerate(甘油甘露糖)b13590028206811810000007114239959Nicotianamine(尼克酰胺)a10750005007711560001006715256711Trehalose(海藻糖)b19770009402212120000016616264197Squalene(角鲨烯)b13720002808114300018707317299447Unknown(未知物)c102300001081152900002043
“W/H” means peak area ratios of rice samples between Wuhan and Hainan;superscript “a” and “b” have the same meaning as the words in Table 1;superscript “c” means those compounds which similarities are not more than 800 compared with mass spectrograms from NIST 10.0.(W/H”表示产地为武汉的(W)与产地为海南的(H)峰面积均值的比值,a,b,n-fold的意义与表1同,c表示经质谱谱库和谱图比对分析获得相似度小于800的化合物)
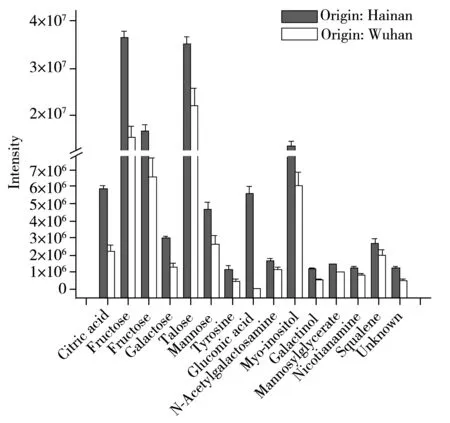
图5 不同产地大米之间的发生显著变化的代谢产物Fig.5 Significant differential metabolites between two different origins,Wuhan and Hainan
2.4 代谢途径分析
本实验基于GC-TOF/MS技术对来源于两个不同产地的转Bt基因大米及其亲本大米进行了代谢组学研究。从大米样本中共检出774个色谱峰,鉴定了包括糖、氨基酸、脂肪酸、有机酸等代谢产物在内的278种代谢产物。转Bt基因大米及其亲本大米的主成分分析结果表明,转Bt基因与亲本大米的代谢组学之间无明显差异;对产地对大米代谢组的影响的分析结果表明,武汉和海南两个产地的大米代谢组之间存在明显差异。引入外源Bt基因对实验中的水稻机体内代谢未产生明显的影响,产地差异造成的大米间代谢组差异比引入外源Bt基因造成的大米间代谢组差异更为显著。
近年来各国学者采用代谢组学技术对多种转基因农作物进行了深入研究[16-17]。根据已有文献,引入外源基因后,植物代谢终端因外源基因的引入发生了一定程度的变化,这种变化可能没有更多的生理学意义,也可能是引入外源基因所期望的功能性变化,或是农作物非预期效应的一种表现。Takahashi等[18]利用CE-MS考察了转Bt基因大米及其亲本大米中的极性代谢产物,包括糖酵解、三羧酸循环和五碳糖磷酸途径中的一些重要代谢产物。结果显示,与含潮霉素抗性基因的水稻相比,YK1(调控二氢黄酮醇-4-还原酶活性的基因)过表达水稻根系和愈伤组织中仅部分代谢产物发生了微小的变化,研究认为尽管这些发生微小变化的代谢产物与引入外源基因没有直接关系,但可能与提高愈伤组织中谷胱甘肽、根系中的NADPH和二氢黄酮醇-4-还原酶的浓度水平存在潜在的关系。Jia等[19]报道了转Bt基因水稻汕优63在生长前期可溶性糖的含量显著低于非Bt水稻,但在后期显著高于非Bt水稻。Sana等[20]对转Bt基因抗白叶枯病水稻进行代谢组学等多种方法分析时发现,多种氨基酸(酪氨酸、瓜氨酸、谷氨酸、苯丙氨酸、鸟氨酸、氧脯氨酸等)在转Bt基因水稻的稻叶中出现了显著上调,可能有助于水稻抵抗细菌感染。
本文通过对基于GC-MS的转Bt基因大米及其亲本大米的代谢组学研究,未发现转Bt基因大米与其亲本大米的代谢组之间具有明显的差异性。所检测的278种代谢产物中,仅甘油和鼠李糖两种代谢产物的浓度在转Bt基因大米中显著高于其亲本大米。甘油是甘油脂代谢通路中的重要产物[21]。利用MetaboAnalyst软件进行富集分析,并基于KEGG进行代谢通路检索,可知鼠李糖涉及多个代谢途径[22],包括半乳糖代谢、聚酮糖单元的合成、果糖和甘露糖的代谢以及氨基糖和核苷酸糖的代谢等。由于上述两种代谢产物在转Bt基因的大米中变化幅度不大,分别是其亲本大米中的1.55倍和3.32倍,且本研究未获得在两个不同产地均具有相同变化趋势并且发生显著变化的更多的差异性代谢产物,甘油和鼠李糖两种代谢产物是否能够确切地反映引入外源Bt蛋白后机体中终端代谢真实发生的变化,这些代谢产物是否与外源Bt基因的引入存在关联,还需更多的实验加以证实。
利用MetaboAnalyst中的富集分析和KEGG代谢通路检索,对两种不同产地的大米中变化趋势相似的15种差异代谢产物进行分析,发现这些代谢产物涉及的代谢通路非常广泛,主要包括:果糖和甘露糖降解、半乳糖代谢、淀粉和蔗糖代谢、核苷酸糖代谢、酪氨酸代谢、苯丙氨酸和酪氨酸代谢、固醇类生物合成、蛋白生物合成、肌醇代谢、三羧酸循环等代谢途径。这表明产地的差异对水稻机体的多种终端代谢途径造成了非常明显的影响。
影响水稻生长的因素非常复杂,其中温度与光照是两个最为重要的因素[23]。本实验中的两种大米来源于两个完全不同的气候带,海南属于热带季风气候,而武汉属于亚热带季风气候。水稻的整个生长阶段(包括:苗期、分蘖期、有穗分化期、抽穗扬花期和灌浆成熟期)都适宜在高温(30 ℃左右)、多湿的环境,对土壤的要求相对较低[24]。高温条件能增强水稻的光合作用和根叶的呼吸作用,温度过高和过低会影响光合作用的效率和根叶的呼吸作用。本实验的15种差异性代谢产物在产地为海南的大米中的浓度水平高于武汉大米中的浓度水平,这可能是由于海南具备更好的温度和湿度条件满足水稻的生长,其机体的代谢机能更为活跃。
3 结 论
本文基于GC-MS的代谢组学技术对两种不同产地的转Bt大米及其亲本大米进行了代谢组学分析。PCA分析表明,转Bt基因大米和亲本大米的代谢组之间无明显差异,进一步的PLS-DA分析结果表明,转Bt基因大米中仅甘油和鼠李糖两种代谢产物高于其亲本大米中的浓度水平,但差异性较小,变化幅度不超过3.5倍;对水稻生长地域差异性的分析表明,两种产地的大米中有15种代谢产物发生了显著变化,且产地为海南的大米中的浓度水平均高于产地为武汉的大米,这可能是海南的海洋性热带季风气候更适合于水稻的生长。从以上分析结果可以看出,产地的不同(武汉和海南)对大米机体代谢造成的差异性大于引入外源Bt基因造成的差异性。
[1] Cellini F,Chesson A,Colquhoun I,Constable A,Davies H V,Engel K H,Gatehouse A M,Kärenlampi S,Kok E J,Leguay J J,Lehesranta S,Noteborn H P,Pedersen J,Smith M.FoodChem.Toxicol.,2004,42:1089-1125.
[2] Kuiper H A,Kleter G A,Noteborn H P,Kok E J.PlantJ.,2001,27:503-528.
[3] Yang X G.J.HuazhongAgric.Univ.(杨晓光.华中农业大学学报),2014,33:110-111.
[4] Zhou Y M,Gou X S,Huang X,Zhu S F.Lett.Biotechnol.(周艳明,郭欣硕,黄新,朱水芳.生物技术通讯),2010,21:851-860.
[5] Inaba Y,Brotherton J E,Ulanov A,Widholm J M.PlantCellRep.,2007,26:1763-1771.
[6] Catchpole G S,Beckmann M,Enot D P,Mondhe M,Zywicki B,Taylor J,Hardy N,Smith A,King R D,Kell D B,Fiehn O,Draper J.Proc.Natl.Acad.Sci.USA,2005,102:14458-14462.
[7] Shepherd L V T,McNicol J W,Razzo R,Taylor M A,Davies H V.TransgenicRes.,2006,15:409-425.
[9] Sun C X,Wang Y,Wu X F,Chen L J,Wu Z J.Chin.Biotechnol.(孙彩霞,汪莹,吴晓菲,陈利军,武志杰.中国生物工程杂志),2012,32(11):35-41.
[10] Tesniere C,Torregrosa L,Pradal M,Souquet J M,Gilles C,Dos S K,Chatelet P,Gunata Z.J.Exp.Bot.,2006,57:91-99.
[11] Jiao Z,Deng J C,Li G K,Zhang Z M,Cai Z W.J.FoodCompos.Anal.,2010,23:640-647.
[12] Kim J K,Park S Y,Lee S M,Lim S H,Kim H J,Oh S D,Yeo Y,Cho H S,Ha S H.PlantBiotechnol.Rep.,2013,7:121-128.
[13] Kusano M,Redestig H,Hirai T,Oikawa A,Matsuda F,Fukushima A,Arita M,Watanabe S,Yano M,Hiwasa-Tanase K,Ezura H,Saito K.PLoSOne,2011,16:e16989.
[14] Kou P M,Pallassana N,Bowden R,Cunningham B,Joy A,Kohn J,Babensee J E.Biomaterials,2012,33(6):1699-1713.
[15] Eriksson L,Johansson E,Kettaneh-Wold N,Trygg J,Wikstrom C,Wold S.Multi-andMegavariateDataAnalysis.2nd ed.Umea,Sweden:Umetrics AB,2006.
[16] Ricroch A E,Berge J B,Kuntz M.PlantPhysiol.,2011,155:1752-1761.
[17] Simó C,Ibáez C,Valdés A,Cifuentes A,García-Caas V.Int.J.Mol.Sci.,2014,15:18941-18966.
[18] Takahashi H,Hayashi M,Goto F,Sato S,Soga T,Nishioka T,Tomita M,Kawai-Yamada M,Uchimiya H.Ann.Bot.,2006,98:819-825.
[19] Jia Q T,Shi S B,Yang C J,Peng Y F.Sci.Agric.Sin.,2005,38(10):2002-2006.
[20] Sana T R,Fischer S,Wohlgemuth G,Katrekar A,Jung K,Ronald P C,Fiehn O.Metabolomics,2010,6:451-465.[21] Jiang P Y.NewTechnologyinRiceCultivation.Beijing:Shield Press(蒋彭炎.科学种稻新技术.北京:金盾出版社),1998:123-130.
[22] Environment of Rice Growth(水稻生长环境). http://nzw.funonglu.com/shuidao/szhj.html
Metabolomic Analysis of Bt-transgenic and Parental Rice Based on Gas Chromatography-Mass Spectrometry
CHENG Jian-hua,SANG Zhi-hong,LI Hai-jing,WU Sheng-ming,XIA Qing,DONG Fang-ting*
(Center of Biomedical Analysis,Academy of Military Medical Sciences,Beijing 100850,China)
In this study,Bt-transgenic and parental rice from two places(Wuhan and Hainan) was analyzed using gas chromatography-mass spectrometry-based metabolomics.774 chromatographic peaks were detected using GC-TOF/MS.Among them,278 metabolites,including carbohydrates,amino acids,fatty acids,organic acids and other compounds,were identified.The results showed that the difference of metabolome was not significant between the Bt-transgenic and parental rice using the principal component analysis method.Further partial least squares discriminant analysis,only two concentrations of glycerol and rhamnose were changed between Bt-transgenic and parental rice,rising 1.55 times and 3.32 times,respectively,compared to that of parental rice.The factor of producing origins of rice was investigated.15 metabolites have significant between two origins rice from Wuhan and Hainan.GC-TOF/MS-based metabolomic method was successfully used in comparative analysis of Bt-transgenic and parental rice,which suggested that it has no significant effect to transform exogenous Bt gene into rice cells,and the factor of rice producing origin is more noticeable.
genetically modified rice;metabolomics;differential metabolites;multivariate statistical analysis;GC-TOF/MS
2016-03-03;
2016-06-14
国家科技重大专项-转基因生物新品种培育(2014ZX08011007,2016ZX08011007);国家重大科学仪器设备开发专项(2012YQ180117)
研究报告
10.3969/j.issn.1004-4957.2016.10.001
O657.63;X503.231
A
1004-4957(2016)10-1217-08
*通讯作者:董方霆,研究员,研究方向:代谢组学,Tel:010-66930338,E-mail:dft@proteomics.cn

