酶功能化聚多巴胺包覆纳米普鲁士蓝的制备及电化学分析应用
王海宁,齐 誉,孙 昭,冯涛涛,洪成林
(石河子大学 化学化工学院 新疆兵团材料化工工程技术研究中心,新疆维吾尔自治区教育厅高校材料化工重点实验室,新疆 石河子 832003)
酶功能化聚多巴胺包覆纳米普鲁士蓝的制备及电化学分析应用
王海宁,齐 誉*,孙 昭,冯涛涛,洪成林*
(石河子大学 化学化工学院 新疆兵团材料化工工程技术研究中心,新疆维吾尔自治区教育厅高校材料化工重点实验室,新疆 石河子 832003)
在纳米金表面原位沉积普鲁士蓝,然后在核壳结构纳米金-普鲁士蓝的表面包覆一层易氧化聚合的多巴胺保护膜,利用多巴胺聚合表面残留的大量氨基和羟基进一步将纳米铂粒子修饰于聚多巴胺膜表面制得普鲁士蓝-聚多巴胺-纳米铂多层纳米复合材料。将此复合材料修饰于金电极表面,协同使用辣根过氧化物酶用于H2O2浓度的检测。结果表明:聚多巴胺的引入有效增加了普鲁士蓝的稳定性,增大了纳米铂的负载量以及辣根过氧化物酶的生物活性;由于普鲁士蓝、纳米铂和辣根过氧化物酶的多重信号放大作用,酶功能化纳米复合材料修饰电极对H2O2表现出良好的电还原活性。优化条件下,对H2O2的检测范围为2.0×10-7~1.0×10-3mol·L-1,检出限(S/N=3)为1.2×10-7mol·L-1。
过氧化氢传感器;纳米复合材料;普鲁士蓝;聚多巴胺;辣根过氧化物酶
新型纳米复合材料由于具有较大的比表面积,较高的表面反应活性和催化效率等特性[1-2]而被越来越多地应用于催化和电催化研究[3-4]。纳米材料具有良好的生物相容性,酶功能化的纳米复合材料具有特异性和高效的催化活性,因此其在电化学分析方面有着极大的应用前景[5-6]。酶或酶功能化的纳米电活性材料修饰于电极表面后其稳定性和电催化活性的保持已经成为当前研究的热点之一[7-8]。
研究表明,纳米普鲁士蓝(PB)具有优良的电化学氧化还原活性,且对H2O2具有极强的催化活性,被誉为“人工过氧化物酶”[9-10]。然而,立方体结构的PB容易流失,不易进一步修饰,且pH值适应范围窄,使其应用受到很大限制。多巴胺(DA)具有良好的氧化自聚合能力和优良的生物相容性[11-13],能够阻止PB的流失并增大其pH值适应范围,DA聚合成膜后表面残留有大量的羟基和氨基[14],可与纳米铂粒子(Pt NPs)结合。Pt NPs不仅具有较大的比表面积和优良的生物相容性,而且其对H2O2也有着独特的催化活性[15-16]。
本文首先在纳米金表面原位沉积PB,然后利用DA易氧化自聚合的特性,在核壳结构Au-PB的表面包覆一层聚多巴胺(PDA)保护膜,有效增强了PB的稳定性和pH值适应范围。利用DA聚合表面残留的大量氨基和羟基进一步将Pt NPs修饰于PDA表面制得Au-PB-PDA-Pt多层纳米复合材料,并对辣根过氧化物酶(HRP)功能化的Au-PB-PDA-Pt复合材料的电化学性能进行了探究。由于PB,Pt NPs和HRP对H2O2的协同催化作用,该复合材料修饰电极对H2O2表现出良好的电还原活性。
1 实验部分
1.1 仪器与试剂
三氯化铁(FeCl3·6H2O)、二氯化铁(FeCl2·4H2O)、铁氰化钾(K4[Fe(CN)6]·3H2O)、硼氢化钠、多巴胺(DA)、氯金酸(HAuCl4)、氯铂酸(H2PtCl6·6H2O)购于Alfa Aesar公司;辣根过氧化物酶(HRP)购于上海江莱生物科技有限公司;其它试剂均为分析纯试剂,购于成都市科隆化学品有限公司;实验用水为超纯水。
Spectrumlab-54型紫外可见分光光度计(UV-Vis,上海谱元仪器有限公司);Hitachi H-600型透射电镜(TEM,日本日立公司);D8 Advance型X射线衍射仪(XRD,德国布鲁克公司)。化学实验采用三电极系统:工作电极为金电极(天津艾达科技发展有限公司,直径4.0 mm),对电极为铂丝电极,参比电极为饱和甘汞电极(SCE);循环伏安法(CV)、电流-时间法和电化学交流阻抗谱(EIS)测定均在Potentiostat/Galvanostat Model 283 型电化学综合分析仪(美国阿美特克有限公司)上完成。
1.2 Au-PB-PDA-Pt纳米复合材料的制备
Au NPs溶胶的制备:取0.6 mL 1%氯金酸水溶液分别加入40 mL预冷(4 ℃)的水和0.2 mL 0.2 mol ·L-1K2CO3溶液,在搅拌下加入适量新鲜配制的0.5 mg·mL-1NaBH4溶液,持续搅拌至溶液由蓝紫色变为橙红色止,即制得Au NPs溶胶。
Au-PB的制备:配制10 mL含有0.05 mol·L-1K3[Fe(CN)6]和10 mmol·L-1HCl的混合溶液,将其缓慢加入10 mL Au NPs溶胶中,持续超声形成均一的混合溶液。再将2 mL 0.05 mol·L-1FeCl3溶液缓慢滴加至上述混合溶液中,并加入过量的H2O2溶液。室温下超声反应1 h后离心分离,用超纯水洗至中性,定容至10 mL,于4 ℃冰箱保存备用。
Au-PB-PDA的制备:取0.5 mL Au-PB悬浊液超声10 min,加入40 mL含有60 mg多巴胺的pH 6.5 PBS溶液。在冰水浴中快速搅拌8 h以使多巴胺聚合在Au-PB纳米粒子表面。离心分离后,用水洗至中性,定容至5 mL,于4 ℃冰箱保存备用。
Au-PB-PDA-Pt的制备:采用硼氢化钠还原氯铂酸制备Pt NPs。将4 mL质量分数为0.1%的氯铂酸水溶液在搅拌下缓慢滴加0.5 mL新鲜配制的0.1 mol·L-1NaBH4溶液,强搅拌反应30 min后10 000 r/min离心分离,定容至4 mL得Pt NPs溶胶。将5 mL制备好的Au-PB-PDA溶液超声10 min后,加入2 mL Pt NPs溶胶再次超声10 min,离心分离后定容至2 mL得Au-PB-PDA-Pt溶胶,于4 ℃冰箱保存备用。Au-PB-PDA-Pt的制备流程如图1A所示。
本实验还制备了Au-PB-Pt和Au-PDA-Pt两种纳米复合材料以对比电化学性能差异。
Au-PB-Pt的制备:取4 mL质量分数为0.1%的氯铂酸水溶液,搅拌下缓慢滴加0.5 mL新鲜配制的0.1 mol·L-1NaBH4溶液,强搅拌反应30 min后10 000 r/min离心分离,定容至4 mL得Pt NPs溶胶。将5 mL制备好的Au-PB溶液超声10 min后,加入2 mL Pt NPs溶胶再次超声10 min,离心分离后定容至2 mL得Au-PB-Pt溶胶,于4 ℃冰箱保存备用。
Au-PDA-Pt的制备:取0.5 mL制备的Au溶胶,加入至40 mL含有60 mg多巴胺的pH 6.5 PBS溶液中。在冰水浴中快速搅拌8 h以使多巴胺聚合在Au NPs表面。离心分离,用超纯水洗至中性,定容至5 mL。将5 mL制备好的Au-PDA溶液超声10 min后,加入2 mL Pt NPs溶胶再次超声10 min,离心分离后定容至2 mL得Au-PDA-Pt溶胶,于4 ℃冰箱保存备用。

图1 Au-PB-PDA-Pt(A)和修饰电极(B)的制备过程Fig.1 Procedures for the fabrication of Au-PB-PDA-Pt nanocomposites(A) and the modified electrode(B)
1.3 修饰电极的制备
将金电极(GE,Φ=4 mm)分别用0.3 μm和0.05 μm的Al2O3粉末抛光成镜面后,放入Piranha溶液(H2O2与H2SO4体积比为3∶7)中浸泡10 min,再依次用无水乙醇和水超声清洗2 min[17-20]。取15 μL预先充分超声分散的Au-PB-PDA-Pt溶胶滴在处理好的GE表面,于4 ℃冰箱放置晾干,水洗后移取15 μL 5 mg·mL-1的HRP溶液滴涂于修饰电极表面,放置在盛有少量水的烧杯上方于4 ℃冰箱吸附6 h。将电极取出后用水从电极侧面冲洗掉表面的物理吸附粒子,得到GE/Au-PB-PDA-Pt/HRP,其制备过程如图1B所示。本实验所用的其它纳米粒子修饰电极均与GE/Au-PB-PDA-Pt/HRP的制备方法相同。

图2 不同纳米复合材料的紫外可见光谱图Fig.2 UV-Vis spectra of different nanocompositesa:Au;b:PB;c:Au-PB;d:Au&PB;e:Au-PB-PDA
2 结果与讨论
2.1 纳米复合材料的表征
2.1.1 纳米复合材料的UV-Vis表征 采用紫外可见光谱对复合材料制备过程中不同阶段的纳米材料进行分析,结果见图2。图2a在530 nm处出现了Au NPs的特征吸收峰,图2b在700 nm处出现了PB的特征吸收峰,且无其他杂峰,表明实验制备出较纯的Au NPs和PB。Au-PB纳米颗粒的紫外可见光谱(图2c)只在700 nm处观察到PB的特征吸收峰,作为对照Au NPs和PB混合溶胶的紫外可见光谱图(图2d)分别显示出Au NPs和PB的特征吸收峰,说明实验得到的Au-PB并非二者简单的混合物,可能是核壳型的Au-PB纳米颗粒。图2e在280 nm处出现了PDA的特征吸收峰,证明制备的Au-PB-PDA材料中PDA的存在。

图3 纳米复合材料的TEM表征图Fig.3 TEM images of different nanocompositesA:Au;B:Au-PB;C:Au-PB-PDA;D:Au-PB-PDA-Pt
2.1.2 纳米复合材料的TEM表征 图3为纳米复合材料制备过程的透射电镜表征图。由图3A可以看出所制备的纳米金粒径分布在5~8 nm。所制备的Au-PB粒径则明显增大,达到70 nm左右,且主要为球形(图3B),说明PB成功包裹在Au NPs的表面。Au-PB进一步包覆上PDA膜后,形貌有所改变,PDA膜清晰可见(图3C)。由图3D可以看出Au-PB-PDA表面已负载上一定量的Pt NPs,表明已成功制备了Au-PB-PDA-Pt纳米复合材料。

图4 Au-PB(a)与Au-PB-PDA-Pt(b)的 XRD 表征图Fig.4 XRD patterns of Au-PB(a) and Au-PB-PDA-Pt(b)

图5 不同纳米材料修饰电极的循环伏安图Fig.5 CV curves of different electrodes insert:EIS curves of different electrodes;0.1 mol/L PBS buffer(pH 6.5);a:bare GE;b:GE/Au-PB-PDA;c:GE/Au-PB-PDA-Pt;d:GE/Au-PB-PDA-Pt/HRP
2.1.3 纳米复合材料的 XRD 表征 图4为纳米复合材料的XRD表征结果。其中,图 4a为 Au-PB复合材料的XRD图,PB在 2θ为 17.54°,24.74°,35.52°和39.61°处出现了特征衍射峰,对应PB晶面为(200),(220),(400) 和(420);未出现明显的Au NPs特征峰,可能是由于Au NPs的量相对较少,被较强的PB特征峰掩盖。图4B为 Au-PB-PDA-Pt的XRD图,除了PB的特征衍射峰外,新出现了 2θ为 46.29°,67.47°,81.36°和85.72°的衍射峰,同时2θ=39.61°处的衍射峰明显增强,分别对应于Pt NPs的(200),(311),(222) 和(111)晶面,表明Pt NPs已在Au-PB-PDA复合物表面成功负载。
2.2 修饰电极的电化学行为
2.2.1 不同纳米材料修饰电极的CV表征 图5为纳米材料修饰电极过程的循环伏安表征。由图可见,裸金电极表面无电活性材料,故未观察到氧化还原峰(图5a);而GE/Au-PB-PDA的CV曲线在PBS缓冲溶液中出现1对明显的氧化还原峰(图5b),其原因是修饰在金电极表面的Au-PB-PDA含有电化学活性物质PB和导电性能优良的Au NPs;GE/Au-PB-PDA-Pt产生的氧化还原峰电流进一步增大(图5c),这也是由于Pt NPs良好的导电性能及其较大的比表面积提高了复合材料的性能;而当HRP被固载在电极表面后,HRP阻碍了电子在电极表面的传递,致使峰电流有所降低(图5d)。
2.2.2 不同纳米材料修饰电极的EIS表征 进一步考察了不同纳米材料修饰电极的电化学交流阻抗谱图(图5插图)。结果显示,裸金电极表现出非常小的交流阻抗,当被修饰上Au-PB-PDA之后,虽然有Au NPs的存在,但PDA较弱的导电性能依然使电极的阻抗出现较大增加。加入了Pt NPs的复合材料Au-PB-PDA-Pt修饰于电极表面之后,由于Pt NPs较大的比表面积与良好的电子传递性能使得交流阻抗值有所降低。HRP修饰于电极表面后由于其较弱的导电性能使得交流阻抗进一步增大。这与纳米材料修饰电极的CV表征结果一致。

图6 不同修饰电极对H2O2的循环伏安图Fig.6 CV curves of different electrodes in 0.1 mol ·L-1pH 6.5 PBS with 0.1 mmol·L-1 H2O2a:GE/ Au-PB;b:GE/Au-PB-Pt;c:GE/Au-PB-PDA-Pt;d:GE/Au-PB-PDA-Pt/HRP
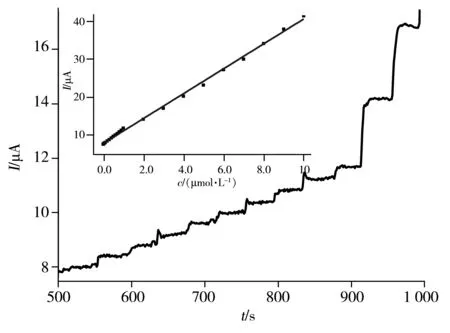
图7 GE/Au-PB-PDA-Pt/HRP修饰电极对H2O2的I~t响应曲线Fig.7 Chronoamperometric response to H2O2additions on GE/Au-PB-PDA-Pt/HRP
2.2.3 不同修饰电极对H2O2的CV响应 考察了不同修饰电极对H2O2的CV响应(图6)。图6a为GE/Au-PB在含有0.1 mmol·L-1H2O2的pH 6.5 PBS溶液中的CV曲线。在GE/Au-PB电极中引入对H2O2具有强催化性能的Pt NPs后表现出更强的催化活性(图6b)。在电极中进一步引入聚多巴胺(GE/Au-PB-PDA-Pt)后,增大了Pt NPs的分散性与负载量,同时增强了PB的稳定性,因此表现出更强的催化活性(图6c)。而具有生物催化活性的HRP的使用使还原峰电流进一步增大(图6d),表明该修饰电极对H2O2的催化还原能力得到了进一步增强。
2.2.4 pH值对电极性能的影响 检测液的pH值是影响生物酶分子HRP活性和电子媒介体PB稳定性的重要因素。因此,考察了GE/Au-PB-PDA-Pt/HRP在 pH 4.0~9.0范围内 PBS 缓冲液中的CV响应情况。结果显示,还原峰电流随着pH值的增加而增大,pH 6.0时峰电流达到最大值,此后还原峰电流随着pH值的增加而降低,故选择pH 6.0的PBS为传感器的检测底液。
2.2.5 工作电位对响应电流的影响 在-0.45~0.05 V范围内,考察了工作电位对修饰电极性能的影响,绘制了不同电位下传感器在每次加入0.1 mmol·L-1H2O2的I~t曲线。不同工作电位下对应的标准曲线以及标准曲线斜率与其对应电位的折线图显示,工作电位在-0.35 V时修饰电极表现出最大的灵敏度。因此实验选择工作电位为-0.35 V。
2.2.6 不同修饰电极对H2O2电催化活性的比较 比较了GE/ Au-PDA-Pt,GE/ Au-PB-PDA,GE/Au-PB-PDA-Pt和GE/Au-PB-PDA-Pt/HRP对 H2O2的I~t响应曲线。结果表明,PB NPs和Pt NPs对H2O2均有一定的电催化活性,两者的协同作用表现出更强的催化活性,传感器灵敏度有了很大的提高,而HRP作为一种具有高催化活性的生物酶,其应用进一步提高了传感器的灵敏度。
2.2.7I~t法检测H2O2浓度 在最佳检测条件下,考察了传感器对H2O2的检测性能。由图7可见,传感器对H2O2的线性回归方程为I=7.753+32 913cH2O2,r2=0.998 0 。线性范围为2.0×10-7~1.0×10-3mol ·L-1,检出限(S/N=3)为1.2×10-7mol·L-1。该传感器性能优良,这主要得益于PB NPs优良的电化学活性,PDA良好的生物相容性和对Pt NPs良好的分散吸附性能;而Pt NPs的引入不仅增强了修饰电极表面的电子传导能力,还极大提高了对H2O2的催化活性。由于PB,Pt NPs和HRP对H2O2的协同催化作用,该复合材料构建的H2O2传感器具有更高的灵敏度。
3 结 论
本文成功制备了Au-PB-PDA-Pt多层纳米复合材料,并将HRP功能化的Au-PB-PDA-Pt修饰电极用于H2O2浓度的检测。实验发现,PDA的引入有效增加了PB的稳定性、Pt NPs的负载量和后续HRP的生物活性;由于PB,Pt NPs和HRP对H2O2的协同催化作用,酶功能化纳米复合材料修饰电极对H2O2表现出良好的电还原活性。该H2O2传感器成本低廉,所使用的纳米复合材料制备过程简便,有望应用于生物体中H2O2的分析检测。
[2] Rawal R,Chawla S,Pundir C S.Biosens.Bioelectron.,2012,31(1):144-150.
[3] Kleijn S E F,Lai S C S,Koper P T M,Unwin P R.Angew.Chem.Int.Ed.,2014,53(1):3558-3586.
[4] Kaçar C,Dalkiran B,Erden P E,Kiliç E.Appl.Surf.Sci.,2014,311(9):139-146.
[5] Abdollah S,Layla M,Rahman H.Talanta,2008,75(1):147-156.
[7] Liang W,Yi W S.Clin.Biochem.,2009,42(15):1524-1530.
[8] Kumar D R,Manoj D,Santhanalakshmi J.Sens.ActuatorsB,2013,188(11):603-612.
[9] Yao Y,Bai X,Shiu K K.Nanomaterials,2012,2(4):428-444.
[10] Zhai C,Sun X,Zhao W,Gong Z,Wang X.Biosens.Bioelectron.,2013,42:124-130.
[11] Hong S,Kim K Y,Wook H J,Park S Y,Lee K D,Lee D Y,Lee H.Nanomedicine,2011,6(5):793-801.
[12] Lee H,Dellatore S M,Miller W M,Messersmith P B.Science,2007,318(5849):426-430.
[13] Lee H,Rho J,Messersmith P B.Adv.Mater.,2009,21(4):431-434.
[14] Hong S,Na Y S,Choi S,Song I T,Kim W Y,Lee H.Adv.Funct.Mater.,2012,22(22):4711-4717.
[15] Lin M,Huang H,Liu Y,Liang C,Fei S,Chen X,Ni C.Nanotechnology,2013,24(6):065501-065509.
[16] Yan L,Bo X,Zhu D,Guo L.Talanta,2014,120:304-311.
[17] Li N,Yuan R,Chai Y Q,Chen S H,Tang D P,An H Z.J.Instrum.Anal.(李娜,袁若,柴雅琴,陈时洪,唐点平,安海珍.分析测试学报),2007,26(6):769-773.
[18] Hong C,Yuan R,Chai Y,Zhuo Y.Electroanalysis,2008,20(20):2185-2191.
[19] Li Z G,Dai J Y,Shi Y Q,Bi S P.J.Instrum.Anal.(李志果,戴建远,史艳青,毕树平.分析测试学报),2012,31(9):1170-1177.
[20] Zhu Y P,Yuan R,Chai Y Q,Qin S,Yuan Y L.Chin.J.Anal.Chem.(朱宇萍,袁若,柴雅琴,覃松,袁亚利.分析化学),2012,40(3):359-364.
Preparation and Electrochemical Analysis Application of Enzyme-functionalized Prussia Blue-Polydopamine-Platinum Nanocomposites
WANG Hai-ning,QI Yu*,SUN Zhao,FENG Tao-tao,HONG Cheng-lin*
( Key Laboratory of Materials-Oriented Chemical Engineering of Xinjiang Uygur Autonomous Region,Engineering Research Center of Materials-Oriented Chemical Engineering of Xinjiang Bingtuan,School of Chemistry and Chemical Engineering,Shihezi University,Shihezi 832003,China)
In this paper,prussian blue(PB) coated gold nanoparticles(Au NPs) were firstly prepared by in situ method.Then,polydopamine(PDA) wrapped Au-PB was synthesized based on the characteristic of one-step oxidative polymerization of dopamine.The bioinspired surface enriched amino and hydroxyl groups were further used as a support to anchor active platinum nanoparticles(Pt NPs).Horseradish peroxidase(HRP) functionalized Au-PB-PDA-Pt nanocomposites was also used for the fabrication of H2O2biosensor.By taking advantages of the excellent biocompatibility and film forming ability of PDA,the large surface area and high biocompatibility of Pt NPs,and the synergistic employ of PB,Pt and HRP,the HRP functionalized nanocomposites modified electrode exhibited an excellent electroreduction activity to H2O2.Under the optimum conditions,the linear detection range from 2.0×10-7-1.0×10-3mol·L-1was observed,and a detection limit was 1.2×10-7mol·L-1.
H2O2sensor;nanocomposites;prussia blue;polydopamine;horseradish peroxidase
2016-04-02;
2016-05-09
国家自然科学基金资助项目(21065009);教育部重点资助项目(210251);兵团重点领域创新团队计划(2015BD003)
10.3969/j.issn.1004-4957.2016.10.012
O657.1;O625.524
A
1004-4957(2016)10-1289-06
*通讯作者:洪成林,教授,研究方向:纳米材料和电化学分析,Tel:0993-2057270,E-mail:hcl_tea@shzu.edu.cn
齐 誉,研究方向:有机及电化学分析,Tel:0993-2057270,E-mail:qy_01tea@shzu.edu.cn

