二苯基庚烷A干预RAW264.7细胞炎症模型甘油磷脂的UPLC-Q/TOF MS分析
肖雪蓉,佘玉奇,张国改,吴 霞,冯毅凡
(广东药科大学 中心实验室,广东 广州 510006)
二苯基庚烷A干预RAW264.7细胞炎症模型甘油磷脂的UPLC-Q/TOF MS分析
肖雪蓉,佘玉奇,张国改,吴 霞,冯毅凡*
(广东药科大学 中心实验室,广东 广州 510006)
对RAW264.7细胞在不同状态(正常、炎症、给药)下的甘油磷脂成分进行分析,寻找相关的潜在病理药理标志物,阐明二苯基庚烷A在抗炎过程中对甘油磷脂代谢的影响。实验分为空白组(C)、炎症模型组(L)、二苯基庚烷A给药组(D)和布洛芬给药组(B,阳性对照药组)4组。空白组和炎症组给予新鲜培养基,给药组分别给予新配含20 μg/mL二苯基庚烷A和100 μg/mL布洛芬的培养基,1 h后,炎症模型组和给药组按终浓度为0.5 μg/mL加入脂多糖(LPS)培养,24 h后,运用修饰后的Bligh-Dyer方法提取不同状态下RAW264.7细胞的甘油磷脂成分,并通过超高效液相色谱-四极杆飞行时间质谱联用技术(UPLC-Q/TOF MS)在正负离子模式下对甘油磷脂进行一级(MS)和二级(MS/MS)质谱分析。结合二级质谱裂解数据、元素组成、数据库比对等方法鉴定磷脂成分,再通过主成分分析法(PCA)、偏最小二乘判别分析(PLS-DA)、正交偏最小二乘判别分析(OPLS-DA)以及t检验筛选潜在的甘油磷脂生物标志物。结果显示,炎症组与空白组比较得到27个潜在病理标志物,二苯基庚烷A给药组与炎症组比较得到23个潜在药理标志物,布洛芬给药组与炎症组比较得到17个潜在药理标志物,主要包括磷脂酰胆碱(PC)、溶血磷脂酰胆碱(lysoPC)、磷脂酰乙醇胺(PE)、溶血磷脂酰乙醇胺(lysoPE)。研究表明二苯基庚烷A在抗炎过程中引起了甘油磷脂代谢的明显变化,而这些代谢变化与炎症的发生发展密切相关。
炎症;甘油磷脂;二苯基庚烷A;布洛芬;生物潜在标志物;超高效液相色谱-四极杆飞行时间质谱(UPLC-Q/TOF MS)
炎症是机体对致炎因子的损伤所发生的一种以防御反应为主的基本病理过程。在正常情况下,炎症的发生可杀灭病原体、限制感染扩散及修复组织损伤等。然而,过度的炎症反应会造成组织损伤,器官功能障碍等危害机体[1-2]。如动脉粥样硬化[3]、缺血/再灌注损伤[4]、支气管哮喘[5]、糖尿病[6]、老年性痴呆[7]等均伴有炎症的发生。因此,对炎症机制的研究,对于各种炎症性疾病的治疗具有重要意义。
随着脂质组学的诞生,对炎症机制的研究逐渐转移到脂质层面。脂质作为细胞膜的结构成分具有广泛的生物功能,如激活和参与信号转导途径、维持电化学梯度和转运蛋白等[8-9]。甘油磷脂作为脂质中的主要成分以及花生四烯酸的前体物质,其代谢紊乱也会导致炎症的发生[10]。然而,目前从磷脂方面探讨药物对发生炎症的影响并不多见。
二苯基庚烷类是山姜属植物的主要有效成分,药理作用广泛,包括抗炎镇痛、抗肿瘤、抗氧化等[11]。有文献证明二苯基庚烷A可通过抑制NF-κB活性进而抑制诱导型一氧化氮合酶(iNOS)、环氧合酶2(COX-2)的表达,最终达到抗炎镇痛的作用[12-13]。布洛芬是临床上广泛应用的非甾体抗炎药,其被认为主要通过抑制COX-2的活性而产生抗炎机制[14-15],然而,Manrique-Moreno等[16]也证明了布洛芬可与细胞膜上脂质层反应,从而影响细胞膜上的离子通道、受体和酶等。但是,对于二苯基庚烷A和布洛芬在抗炎过程中对甘油磷脂代谢的影响却鲜见报道。
为阐明二苯基庚烷A在抗炎过程中对甘油磷脂代谢的影响,本文应用超高效液相色谱-四极杆飞行时间质谱联用技术(UPLC-Q/TOF MS),分别对正常状态、炎症状态、给药状态下RAW264.7细胞甘油磷脂成分进行快速分析鉴定,利用PCA,PLS-DA,OPLS-DA以及t检验等化学计量学方法进行数据分析,筛选出潜在的病理药理标志物,初步探讨了二苯基庚烷A在抗炎过程中对甘油磷脂代谢的影响。
1 实验部分
1.1 仪器与试剂
UPLC-Q/TOF MS液质联用仪和UPLC BEH-C18柱(2.1 mm×50 mm,1.7 μm)均为美国Waters公司产品;-86 ℃超低温冰箱(中科美菱公司);HF90CO2培养箱(上海力申科学仪器有限公司);SW-CJ-1FD超净台(苏净安泰);显微镜。
高糖培养基(DMEM)、胎牛血清(FBS)、0.25%胰蛋白酶(Gibco公司);双抗(北京康贝源科技有限责任公司);磷酸盐缓冲液(PBS,Hyclone公司);甲醇(色谱纯,CNW公司);乙腈(色谱纯,CMY公司);异丙醇(色谱纯,Merk公司);乙酸(色谱纯,Aladdin公司);醋酸铵、氯仿(分析纯);二苯基庚烷A(本课题组前期分离纯化获得);布洛芬、脂多糖(LPS)、亮氨酸脑啡肽(Sigma公司);甘油磷脂标准品:PC(16∶0/18∶1),PC(16∶0/0∶0),PE(18∶0/0∶0),PC(18∶1/0∶0)(Avanti polar lipids公司)。
1.2 溶液的配制
含二苯基庚烷A或布洛芬培养基的配制:精密称取适量二苯基庚烷A和布洛芬粉末,移取少量DMSO溶解,加入空白培养基,配制成1 mg/mL的含药培养基母液。精密移取适量含药培养基母液,加空白培养基配制成浓度为20 μg/mL的二苯基庚烷A培养基以及100 μg/mL的布洛芬培养基(DMSO不超过药物培养基总体积的0.1%)。
LPS的配制:精密移取1 mL PBS加入装有1 mg LPS的棕色玻璃瓶中,超声溶解混匀,完全转移至50 mL无菌离心管中,加入39 mL PBS,超声混匀,即配成25 μg/mL的LPS母液,用Eppendorf管分装,-20 ℃保存备用。
磷脂标准品溶液的配制:精密称取各甘油磷脂标准品,用甲醇溶解配成10 μg/mL的溶液,转移至进样瓶中备用。
1.3 细胞样品的制备
本实验分为空白组(C)、炎症模型组(L)、二苯基庚烷A给药组(D)和布洛芬给药组(B,阳性对照药组),共4组,每组6个平行样。以2×106/皿将细胞接种至60 mm培养皿中,轻轻摇匀,置CO2培养箱培养12 h后进行换液,给药组分别更换为新配含20 μg/mL的二苯基庚烷A以及100 μg/mL的布洛芬培养基,对照组及炎症模型组更换为新鲜的空白培养基(含与给药组等量的DMSO),药物干预1 h后,炎症模型组及给药组加入LPS,使其终浓度为0.5 μg/mL,空白组加入等量的PBS,培养24 h后,进行细胞甘油磷脂的提取。
1.4 脂类成分的提取
采用修饰后的Bligh-Dyer方法提取RAW264.7细胞的脂质成分,整个提取过程需在4 ℃以下操作。具体提取过程如图1。
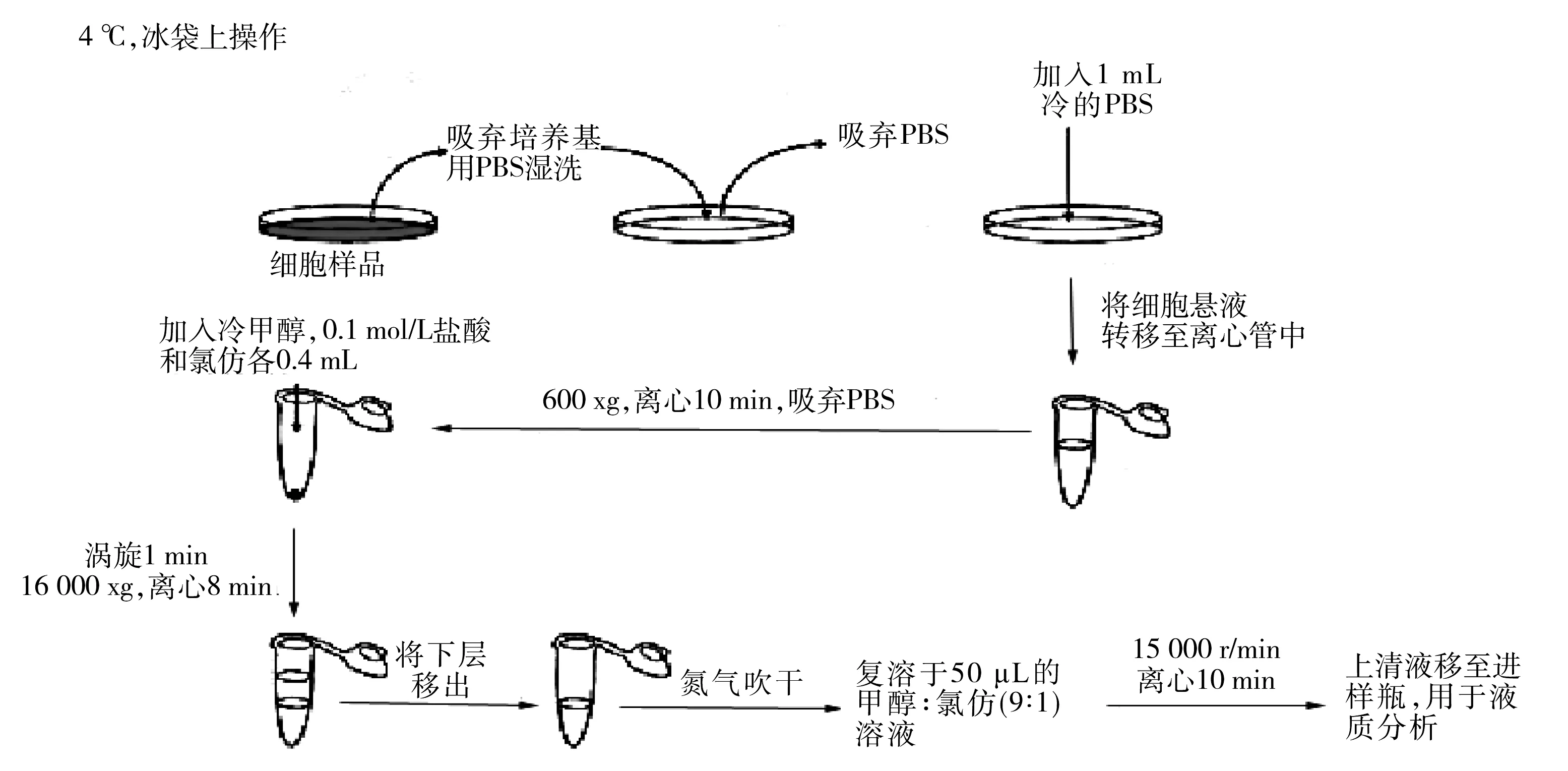
图1 RAW264.7细胞脂类成分的提取Fig.1 The extraction of lipids of RAW264.7 cells
1.5 UPLC-Q/TOF MS
色谱条件:UPLC BEH-C18柱(2.1 mm×50 mm,1.7 μm);柱温:50 ℃;进样量:5 μL;流速0.3 mL/min;curve=7。流动相:A为含10 mmol/L乙酸铵的0.25%乙酸水溶液,B为含10 mmol/L乙酸铵和0.25%乙酸的乙腈-异丙醇(1∶1) 混合溶液。梯度洗脱条件:0~4 min,61%~81.4% B;4~20 min,81.4%~90% B;20~21 min,100% B;21~24 min,100% B。
质谱条件:以ESI为离子源在正、负离子模式下采集数据,以500 ng/mL亮氨酸-脑啡肽为参照进行实时质量数校正,其在正、负离子模式下的质荷比分别为m/z556.277 1和m/z554.261 5。质量扫描范围为420~950 Da。正、负离子一级质谱参数:毛细管电压:3 000 V;锥孔电压:30 V;萃取锥孔电压:1.0 V;离子源温度:100 ℃;去溶剂温度:300 ℃,碰撞能量:6 V;离子能量:1.0 V,锥孔气体流速:50 L/h,脱溶剂气体流速:500 L/h。二级质谱参数:不同种类的甘油磷脂成分所需碰撞能量不同,需根据其种类选择合适的碰撞能量。
1.6 甘油磷脂成分的鉴定
借助Masslynx 4.1数据处理系统对目标分子量进行元素组成分析,限定误差范围为5 ppm以内,再结合二级质谱信息以及数据库比对的方法鉴定RAW264.7细胞甘油磷脂成分。
1.7 数据处理
采用centroid模式进行数据采集,获得直观的总离子流色谱图,通过Masslynx对数据进行预处理,将总离子流图转换成包含保留时间、质荷比、峰面积的数据矩阵,用于后续的数据处理。
经Masslynx预处理的数据导入Simca-p软件进行PCA,PLS-DA,OPLS-DA分析。利用PCA,PLS-DA,OPLS-DA分别对空白组-炎症模型组(C-L)、炎症模型组-布洛芬给药组(L-B)、炎症模型组-二苯基庚烷A给药组(L-D)进行两两比较分析,筛选出具有显著变化的变量,并以能被上述3种分析方法重复提取的显著变量作为潜在的磷脂标志物,再通过t检验,筛选出符合P<0.05的变量作为潜在的磷脂标志物。
2 结果与讨论
2.1 RAW264.7细胞甘油磷脂的UPLC-Q/TOF MS
在正、负离子模式下对RAW264.7细胞甘油磷脂进行UPLC-Q/TOF MS扫描。由于磷脂成分的极性基团、Sn-1和Sn-2脂肪酸链复杂多样,同一类中不同的磷脂可能保留时间相同或相近,色谱很难将其很好的分离,图2为正离子模式下RAW264.7细胞甘油磷脂的总离子流色谱图。由于所得到的每个色谱峰涵盖多个甘油磷脂成分的信息,并且在每个样品组的含量差异较大,人工处理数据较为困难,因此引入化学计量方法对数据进行处理,简化了数据处理过程,极大地提高了数据处理效率。
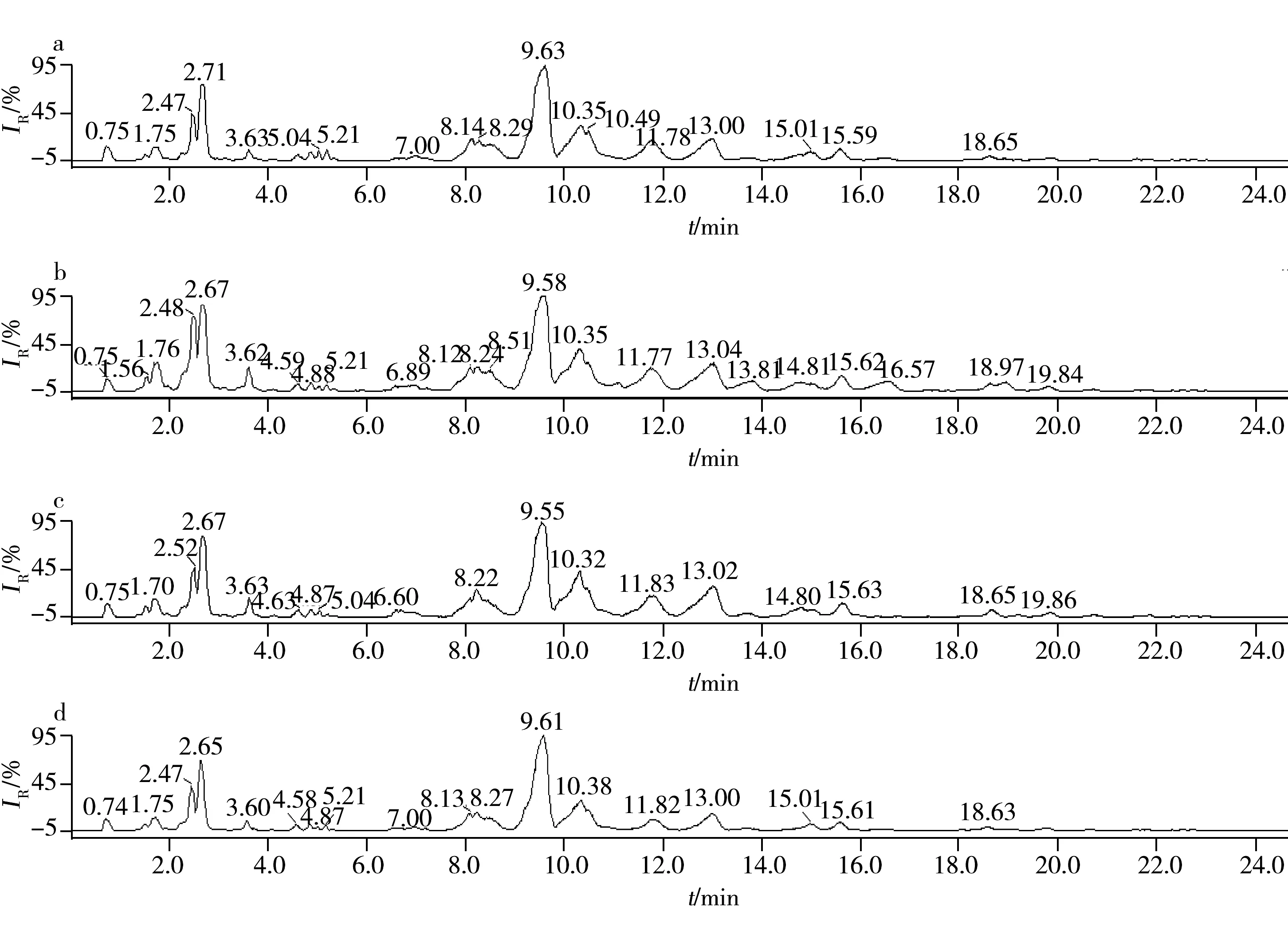
图2 4组细胞样品甘油磷脂在正离子模式下的总离子流色谱图
2.2 数据处理
2.2.1 主成分分析(PCA) PCA是无监督分析方法,可对多维空间的变量进行降维,并在最大限度减少信息丢失的情况下,有效提取发挥作用的主要成分[17]。通过优化,选择最佳的标度化方法,对空白组-炎症模型组(C-L)、炎症模型组-二苯基庚烷A给药组(L-D)、炎症模型组-布洛芬给药组(L-B)进行PCA分析。结果显示,正、负离子模式下,组与组之间基本得以分离,表明组间样品存在差异。图3为正离子模式下各组的得分图。
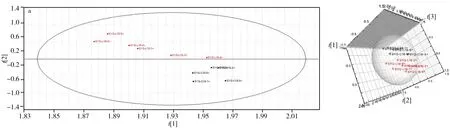
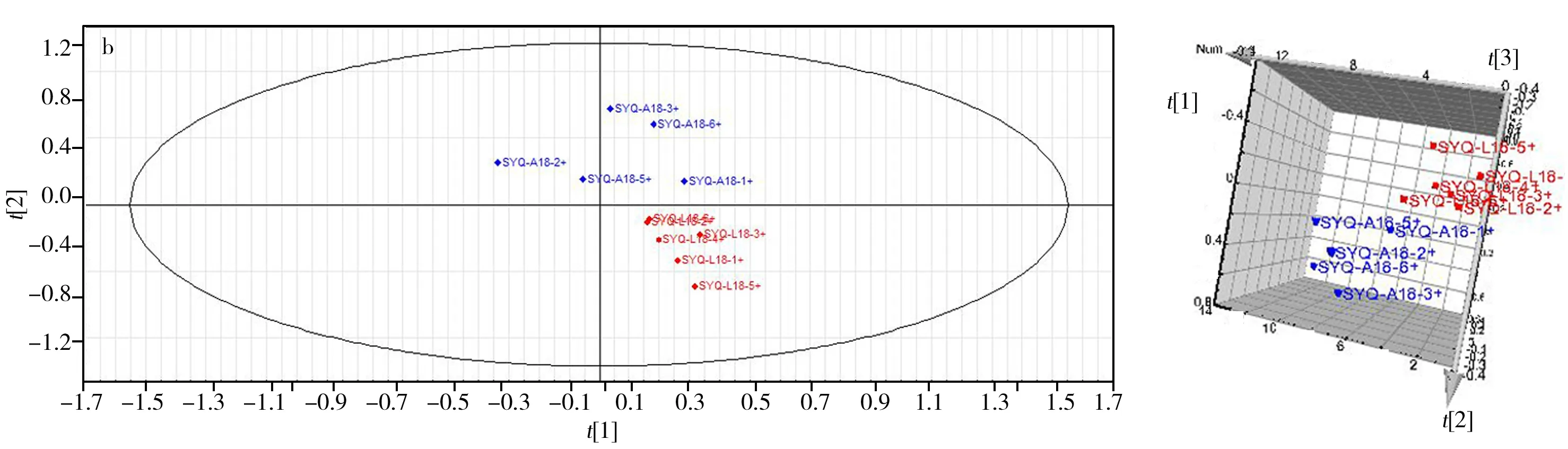

图3 ESI+模式下最佳标度化处理的PCA得分图
2.2.2 抗炎药物干预RAW264.7细胞的甘油磷脂潜在标志物 PCA分析只能达到粗略的分型,获得直观可见的分型图,为进一步具体化地筛选出造成组间差异的变量,需进行有监督的PLS-DA和OPLS-DA分析,在PLS-DA和OPLS-DA分析中,选择在两种方法中VIP值均大于1的变量作为候选标志物。将候选标志物进行t检验,筛选P值小于0.05的变量作为最终的潜在甘油磷脂生物标志物。通过空白组与炎症模型组的对比,筛选得到潜在病理标志物,将二苯基庚烷A给药组和布洛芬给药组分别与炎症模型组对比,筛选得到其潜在药理标志物如表1~3所示。
从表1~3可以看到,炎症模型组与空白组之间的潜在病理标志物和给药组(二苯基庚烷A和布洛芬)与炎症模型组之间的潜在药理标志物主要包括磷脂酰胆碱(PC)、溶血磷脂酰胆碱(LysoPC)、磷脂酰乙醇胺(PE)、溶血磷脂酰醇胺(LysoPE)。炎症状态下,有27个甘油磷脂类成分发生了显著变化,而在二苯基庚烷A和布洛芬干预下分别有23个和17个潜在药理标志物。通过潜在病理标志物和潜在药理标志物的对比可得,两者存在共同的磷脂类成分,并且在炎症状态和给药状态下的变化趋势相反,说明RAW264.7细胞炎症模型在药物干预下,炎症状态下发生显著变化的甘油磷脂类成分得以回调,恢复到正常状态。同时也表明二苯基庚烷A在磷脂组学层面的抗炎作用机制与布洛芬相近。
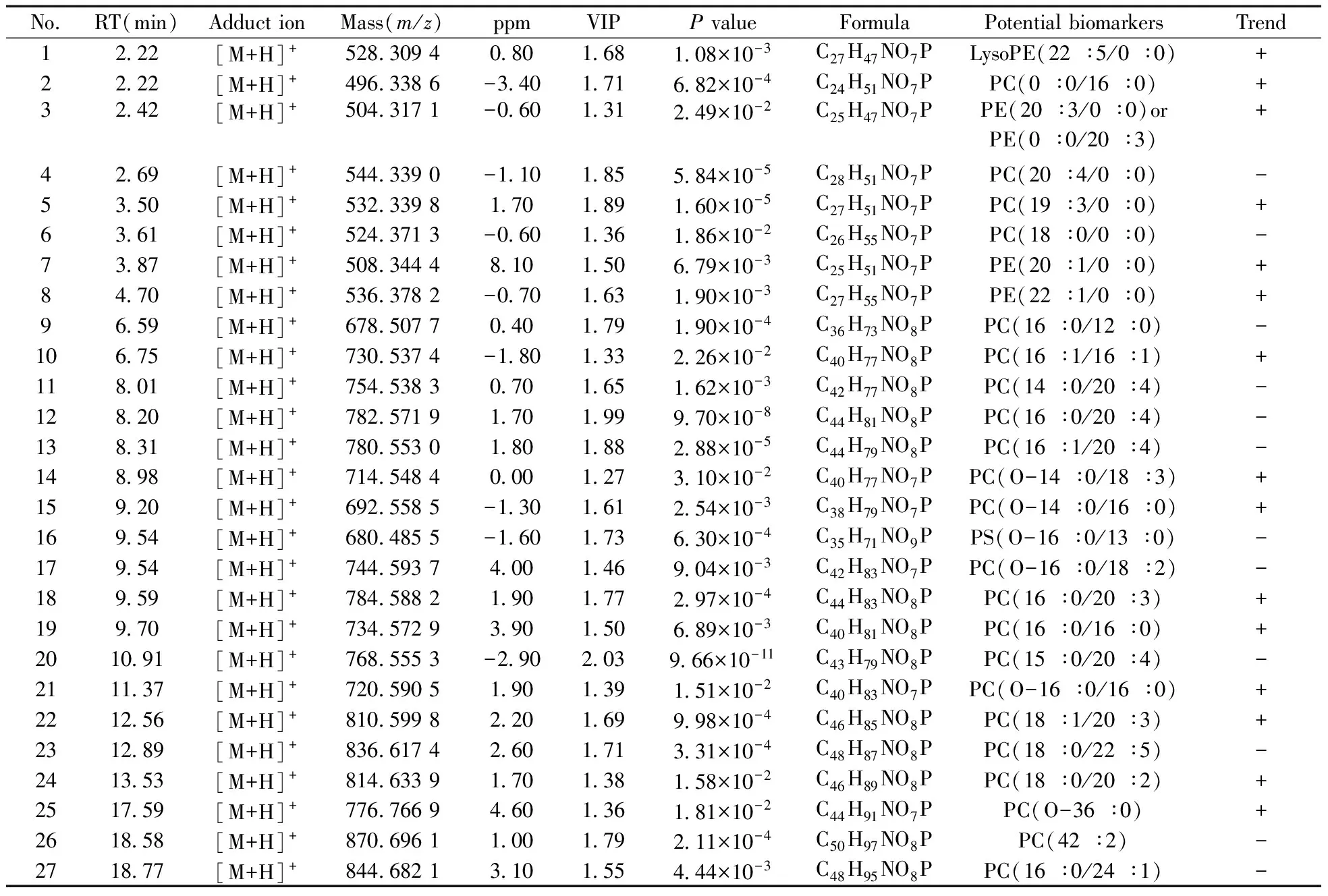
表1 空白组与炎症模型组之间的潜在病理标志物信息(C vs.L)
+:increase in content for the inflammation model group compared with control group;-:decrease in content for the inflammation model group compared with control group(+:与空白组相比,该物质在炎症模型组呈上升趋势;-:与空白组相比,该物质在炎症模型组呈下降趋势)
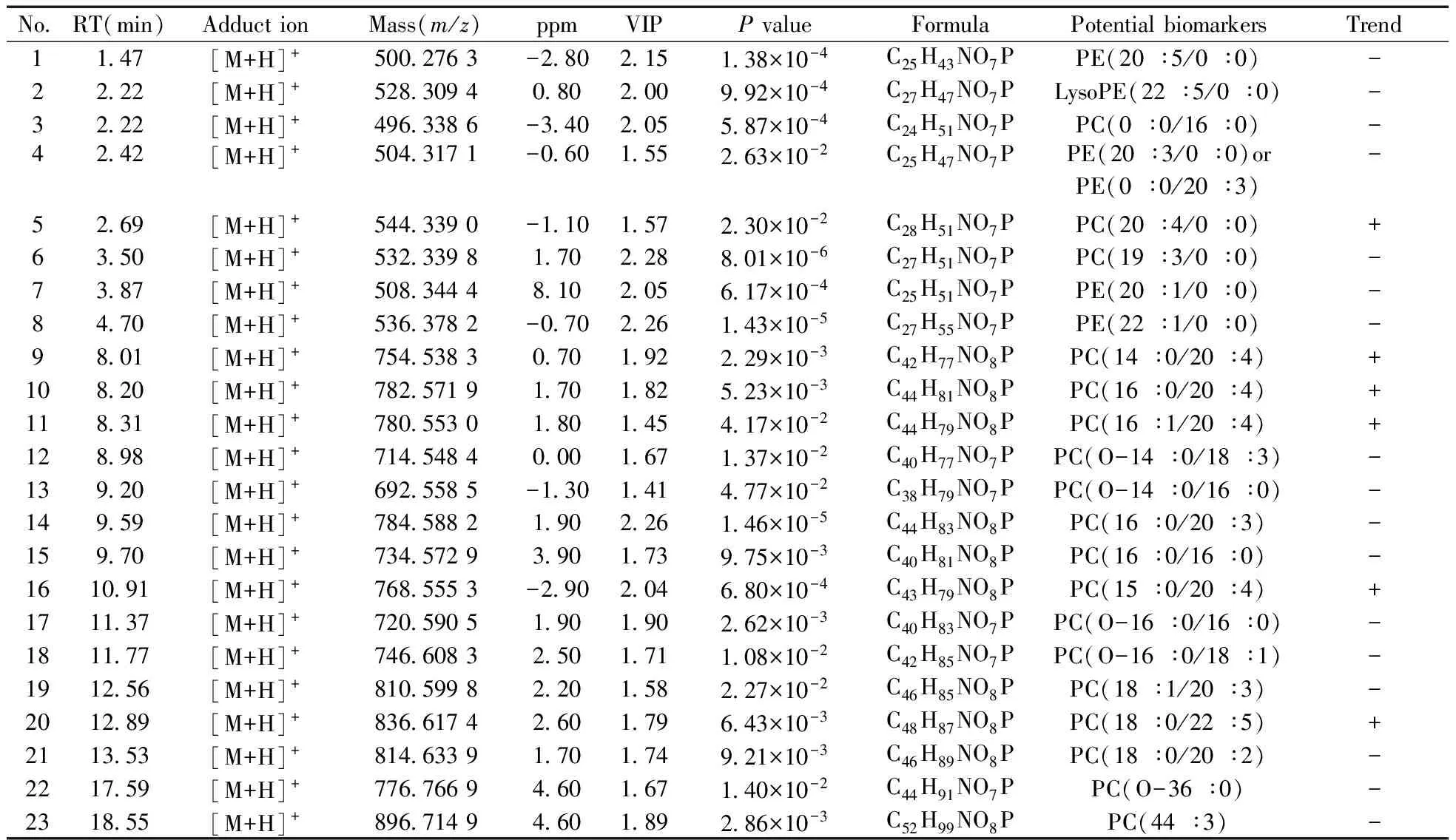
表2 炎症模型组与二苯基庚烷A给药组之间的潜在药理标志物信息(L vs.D)
+:increase in content for the diphenylheptane A group compared with inflammation model group;-:decrease in content for the diphenylheptane A group compared with inflammation model group(+:与炎症模型组相比,该物质在二苯基庚烷A给药组呈上升趋势;-:与炎症模型组相比,该物质在二苯基庚烷A给药组呈下降趋势)
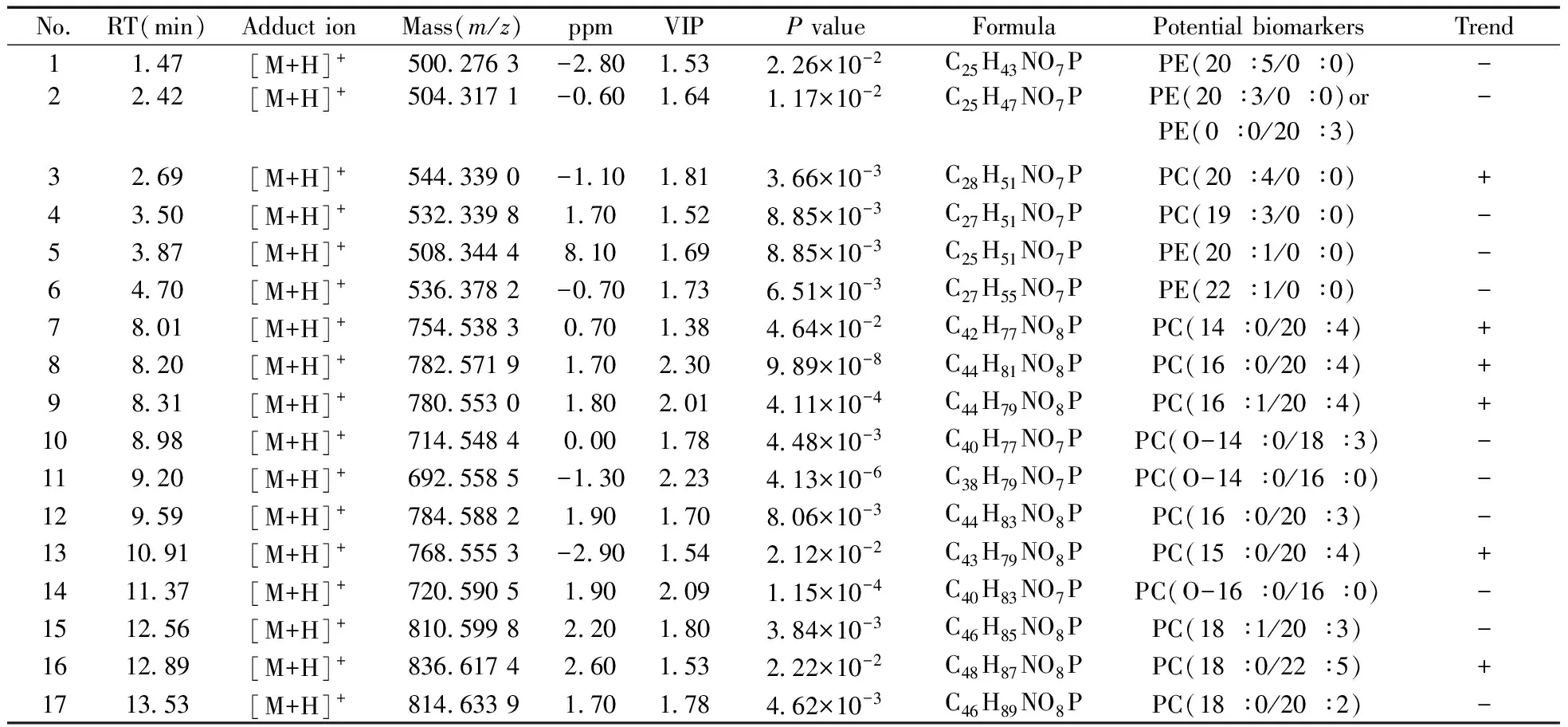
表3 炎症模型组与布洛芬给药组之间的潜在药理标志物信息(L vs.B)
+:increase in content for the ibuprofen group compared with inflammation model group;-:decrease in content for the ibuprofen group compared with inflammation model group(+:与炎症模型组相比,该物质在布洛芬给药组呈上升趋势;- :与炎症模型组相比,该物质在布洛芬给药组呈下降趋势)
2.3 讨 论
炎症过程中,炎症介质主要由花生四烯酸(AA)代谢产生。正常情况下,游离AA的含量非常低,主要以磷脂的形式存在,而当细胞受到刺激时,AA会在磷脂酶A2的作用下从磷脂中释放,发生级联反应,产生大量的前列腺素类炎症介质。然而,游离出的AA只有小部分用于合成前列腺素类物质,大部分在酰基转移酶的作用下重新与溶血磷脂生成磷脂[18]。Rouzer等[19]测定了LPS诱导前后,与C20∶4代谢有关的甘油磷脂的结构以及RPMS巨噬细胞和RAW264.7巨噬细胞的脂质组成,进一步研究表明,含有C20∶4碳链的PC类是AA的主要来源,而烷酰基的PE类作为一种瞬时来源,可被快速补充。表1~3显示,炎症状态下,含20∶4的甘油磷脂类,如LysoPC(20∶4/0∶0),PC(14∶0/20∶4),PC(16∶0/20∶4),PC(16∶1/20∶4),PC(15∶0/20∶4)的含量减少,给药(二苯基庚烷A或者布洛芬)干预后,其含量增加。这主要是因为在LPS刺激下,花生四烯酸在环氧合酶的作用下生成大量的前列腺素类物质,而含有C20∶4碳链的PC和PE类作为花生四烯酸的前体物质在磷脂酶的作用下水解产生大量的AA,导致炎症的持续发生。而当给药干预之后,布洛芬和二苯基庚烷A通过干预COX2进而阻碍了AA的代谢,使得20∶4脂肪酸链合并入溶血磷脂形成含20∶4脂肪酸链的甘油磷脂类的含量增加。此外,研究表明[19-20],受到适当的刺激,体内含20∶4的甘油磷脂成分减少时,伴随着含16-C和18-C脂肪酸链的甘油磷脂类含量的增加。通过病理和药理潜在标志物的对比分析发现,炎症模型组中含16-C和18-C的甘油磷脂类,如PC(O-14∶0/18∶3),PC(O-14∶0/16∶0),PC(16∶0/20∶3),PC(O-16∶0/16∶0),PC(18∶1/20∶3),PC(18∶0/20∶2)的含量增加,给药(二苯基庚烷A或者布洛芬)干预之后,其含量减少。
3 结 论
本实验通过对不同状态下的RAW264.7细胞进行甘油磷脂的UPLC-Q/TOF MS分析,并结合化学计量学进行数据处理发现,二苯基庚烷A和布洛芬在发挥抗炎作用的过程中导致细胞甘油磷脂发生显著变化,而这些甘油磷脂成分的代谢与炎症的发生发展密切相关。因此,这些磷脂可以作为抗炎药物发挥作用的潜在标志物。
[1] Yao L B.MedicalMolecularBiology.2nd ed.Beijing:People's Medical Publishing House(药立波.医学分子生物学.2版.北京:人民卫生出版社),2004:180.
[2] Wu X,Zhao L L,Peng H B,She Y Q,Feng Y F.Chromatographia,2015,78(3/4):211-220.
[3] Chang G R,Chen P L,Hou P H,Mao F C.IranJ.BasicMed.Sci.,2015,18(11):1063-1071.
[4] Xian W J,Wu Y,Xiong W,Li L Y,Li T,Pan S W,Song L M,Hu L S,Pei L,Yao S L,Shang Y.Biochem.Biophys.Res.Commun.,2016,472(1):175-181.
[5] Lin J T,Yin K S,Su N,Huang M,Qiu C,Liu C T,Cai S X,Hao C L.Ann.Trans.Med.,2015,7(11):2061-2078.
[6] Pereira S S,Alvarez-Leite J I.CurrentObesityReports,2014,3(4):422-431.
[7] Candore G,Bulati M,Caruso C,Castiglia L,Colonna-Romano G,Di Bona D,Duro G,Lio D,Matranga D,Pellicano M,Rizzo C,Scapagnini G,Vasto S.Rejuv.Res.,2010,13(2/3):301-313.
[8] Gupta S,Maurya M R,Stephens D L,Dennis E A,Subramaniam S.Biophys.J.,2009,96(11):4542-4551.
[9] Watson A D.J.LipidRes.,2006,47(10):2101-2111.
[10] Fitzpatrick F A,Soberman R.J.Clin.Invest.,2001,107:1347-1351.
[11] An N,Yang S L,Xu L Z,Zou Z M.WorldNotesPlantMedicine(安宁,杨世林,徐丽珍,邹忠梅.国外医药· 植物药分册) ,2006,21(5):185-189.
[12] Lee S L,Huang W J,Lin W W,Lee S S,Chen C H.Bioorg.Med.Chem.,2005,(13):6175-6181.
[13] Chun K S,Kang J Y,Kim O H,Kang H,Surh Y J.Toxicol.Oncol.,2002,21(2):131-139.
[14] Zhang B,Du G H.Chin.Pharmacol.Bull.(张斌,杜冠华.中国药理学通报),2005,21(8):905-910.
[15] Xu Q,Ran Z H.Chin.J.Gastroenterol.(许琦,冉志华.胃肠病学),2005,10(2):119-122.
[16] Manrique-Moreno M,Villena F,Sotomayor C P,Edwards A M,Muoz M A,Garidel P,Suwalsky M.Biochim.Biophys.
Acta,2011,1808(11):2656-2664.[17] Jolliffe I T,Cadima J.Philos.Trans.A,2016,374:1-16.
[18] Pérez-Chacón G,Astudillo A M,Balgoma D,Balboa M A,Balsinde J.Biochim.Biophys.Acta,2009,1791(12):1103-1113.
[19] Rouzer C A,Ivanova P T,Byrne M O,Brown H A,Marnett L J.Biochemistry,2007,46(20):6026-6042.
[20] Rouzer C A,Ivanova P T,Byrne M O,Milne S B,Marnett L J,Brown H A.Biochemistry,2007,45(49):14795-14808.
Analysis of Glycerophospholipids in RAW264.7 Cell Inflammation Model Interfered by Diphenylheptane A with UPLC-Q/TOF MS
XIAO Xue-rong,SHE Yu-qi,ZHANG Guo-gai,WU Xia,FENG Yi-fan*
(Central Laboratory,Guangdong Pharmaceutical University,Guangzhou 510006,China)
The study aims to illustrate the effect of diphenylheptane A on the glycerophospholipids metabolism in the inflammatory process through analyzing glycerophospholipids components of RAW264.7 cells under different status(control,inflammation,administration) and screening potential pathological and pharmacological biomarkers.RAW264.7 cells were randomly divided into four groups:control group(C),inflammation group(L),diphenylheptane A(D),ibuprofen(B,positive control).C and L were treated with fresh medium while D and B were treated with medium containing 20 μg/mL diphenylheptane A or 100 μg/mL ibuprofen,respectively.1 h later,lipopolysaccharide(LPS) was added to L,D and B at a final concentration of 0.5 μg/mL.24 h later,glycerophospholipids in RAW264.7 cells of four groups were extracted by modified Bligh-Dyer method and analyzed by ultra performance liquid chromatography tandem quadrupole time-of-flight mass spectrometry(UPLC-Q/TOF MS) in both positive and negative ion modes.Then,glycerophospholipids components were identified by combination of MS/MS fragment ions information,element composition in MassLynx 4.1 and the Lipid Maps database.Finally,potential pathological and pharmacological biomarkers were screened by unsupervised principal component analysis(PCA),supervised partial least squares-discriminate analysis(PLS-DA),supervised orthogonal partial least squares discriminate analysis(OPLS-DA),and Student'st-test(P<0.05).The results showed that 27 potential pathological biomarkers were found by comparing C and L,23 potential pharmacological biomarkers were found by comparing D and L,and 17 potential pharmacological biomarkers were found by comparing B and L.The biomarkers mainly included phosphatidylcholine(PC),lysophosphatidylcholine(lysoPC),phosphatidylethanolamine(PE) and lysophosphatidylethanolamine(lysoPE).It was found that diphenylheptane A led to obvious changes of glycerophospholipids metabolism during the process of inflammation,which were closely related to the occurrence and development of inflammation.Key words:inflammation;glycerophospholipids;diphenylheptane A;ibuprofen;biomakers;ultra performance liquid chromatography tandem quadrupole time-of-flight mass spectrometry(UPLC-Q/TOF MS)
2016-03-30;
2016-04-26
国家自然科学基金资助项目(21275036,81202429)
10.3969/j.issn.1004-4957.2016.10.002
O657.63;Q54
A
1004-4957(2016)10-1225-08
*通讯作者:冯毅凡,教授,研究方向:现代仪器分析技术在药物分析中的应用,Tel:020-39352522,E-mail:tfengyf@163.com

