核磁共振技术结合化学计量学方法用于蜂蜜的掺假鉴别
刘 芸,丁 涛*,吴 斌,张 睿,沈崇钰,费晓庆,张阔海,刘建红,邓晓军,郭德华
(1.江苏出入境检验检疫局,江苏 南京 210001;2.北京同仁堂蜂业有限公司,北京 102400;3.上海出入境检验检疫局,上海 200000)
核磁共振技术结合化学计量学方法用于蜂蜜的掺假鉴别
刘 芸1,丁 涛1*,吴 斌1,张 睿1,沈崇钰1,费晓庆1,张阔海2,刘建红2,邓晓军3,郭德华3
(1.江苏出入境检验检疫局,江苏 南京 210001;2.北京同仁堂蜂业有限公司,北京 102400;3.上海出入境检验检疫局,上海 200000)
采用核磁共振技术(NMR)结合化学计量学分析手段研究了真蜂蜜和掺假蜂蜜的指纹图谱变化情况。采用无监督的主成分分析(PCA)和有监督的偏最小二乘判别分析(PLS-DA)、正交偏最小二乘判别分析(OPLS-DA)等多元统计分析方法从核磁信号中提取各组的分类信息。结果表明:建立的OPLS-DA模型能够区分真假蜂蜜,所建模型对蜂蜜真假判别的解释能力为90.5%,对未知样本的预测能力为75.5%、识别率为89.7%。置换测试验证表明,化学计量学模型具有很好的稳定性和预测性,可信赖性强,且模型稳健。通过OPLS-DA模型的载荷图和相关系数分析找到了对区分掺假蜂蜜有显著作用的标志物。结合相关系数分析,建立了辨别真假蜂蜜的多元线性回归方程。该方法可简单、快速地用于未知蜂蜜的掺假鉴别,为规范蜂蜜市场提供有利的依据。
核磁共振技术;化学计量学方法;模式识别技术;蜂蜜掺假
蜂蜜是由蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物结合后,经充分酿造而成的天然甜味物质,是一种营养丰富的天然滋养食物[1]。其主要成分为糖类,其中60%~80%是人体易吸收的葡萄糖和果糖。此外,还含有与人体血清浓度相近的多种无机盐、维生素、有机酸及有益人体健康的微量元素和多种氨基酸,并含有生物活性很强的蔗糖转化酶和淀粉酶等[2],具有极高的保健作用和营养价值,深受消费者的喜爱。我国蜂蜜国家标准规定,不得在蜂蜜中添加或混入任何淀粉类、糖类或代糖类物质[3]。近年来,国内和国际市场对蜂蜜的需求量不断增加,然而蜂蜜的产量难以满足市场需求[4-6]。在巨大经济利益的驱使下,不法分子在高品质蜂蜜中加入其它低品质的蜂蜜以次充好,或者在蜂蜜中掺入果葡糖浆等甜味物质以假乱真,影响了蜂蜜产品的市场秩序和我国蜂蜜产品的出口贸易。蜂蜜检测技术遇到了很大的挑战。
如何鉴别蜂蜜的掺假问题,成为人们普遍关心的问题。目前,国家制定了相关标准对蜂蜜掺假进行有效判断,以保障消费者合法权益。薄层色谱(TLC)是测定高果淀粉糖浆的有效方法[7]。通过高效液相色谱示差折光法测定蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖的含量,可以判断蜂蜜中糖是否符合国家标准[8],该法可检测蜂蜜中掺杂的麦芽糖浆,而对于掺杂果葡糖浆的蜂蜜,该方法无效。碳同位素质谱法可以有效鉴定天然蜂蜜产品中是否掺入碳4 植物的糖浆[9-10],但该方法只能用于证明掺杂物超过7%的蜂蜜,而对于蜂蜜掺入利用水稻、小麦、大豆等碳3 植物淀粉制备的糖浆则无法辨别其真伪[11]。目前这些现有的国家标准对蜂蜜掺假检测的主要原理是对蜂蜜中某一种或某一类物质进行分析。但造假者若根据国家标准的技术指标要求进行调配,掺入后各项理化检测指标可完全符合国家标准,这样很难和真正的蜂蜜进行区分。已有的检测方法多针对已有的掺假造假技术而开发,必然落后于造假掺假技术的发展。现有检测手段自身的不足和缺陷给不法分子提供了蜂蜜掺假的可乘之机。综上所述,开发出多指标多组分鉴别蜂蜜真伪的方法迫在眉睫。
核磁共振技术(NMR)能够无损地检测含量在检出限内的所有小分子化合物,在特定的条件下对样品中所含各化合物的检测灵敏度相同[12],是一种无偏向性分析手段。核磁共振技术结合化学计量学分析方法已运用于蜂蜜和其它食品分析[13]。Boffo等[14]通过1H NMR技术结合化学计量学方法区分了巴西蜂蜜的原产地,且明确了对分类起关键作用的核磁信号。野生蜂蜜含有高浓度的苯丙氨酸和酪氨酸,掺假的蜂蜜核磁谱中有5-HMF、柠檬酸和乙醇的信号。该研究分别选用近邻分类算法(KNN)和有监督的偏最小二乘判别分析(PLS-DA)算法建立蜂蜜的分类模型,对蜂蜜分类的正确率分别为66.7%和72.2%。Ribeiro等[15]运用LF-1H NMR建立了80个蜂蜜样品的物理化学参数与弛豫时间的关系,弛豫时间T1和T2分别在0.6~1.8 ms和2.3~5.4 ms之间。结果表明,弛豫时间可用来区分不同类型的蜂蜜。Ribeiro等[16]运用LF-1H NMR建立了蜂蜜中掺入高果淀粉糖浆的鉴定方法,所有样品的横向弛豫时间和纵向弛豫时间分别在1.26~1.60 ms和3.33~7.38 ms范围内,且在掺假蜂蜜中,随着高果淀粉糖浆含量的增加,弛豫时间也增加。Simova等[17]基于NMR技术建立了快速区分橡树蜂蜜与其它蜂蜜的方法,结合氢谱和碳谱的信息,确定了槲皮醇的结构,所有的橡树蜂蜜都含有该标志物,而其它类型的蜂蜜则不存在。Sandusky等[18]运用选择性的TOCSY方法测定蜂蜜中微量的氨基酸,结合多维数据统计分析方法能够区分不同产地的蜂蜜,与传统分析方法相比,更为灵敏、快速,能够明确化合物的结构。由于蜂蜜具有成分复杂,且不同地域蜂蜜的内部组分含量变化范围大等特点,以上所建立的方法对我国蜂蜜是否适用还不得而知,而且目前国内尚无运用NMR技术结合化学计量学方法判断蜂蜜真伪的方法报道。本研究采用核磁共振技术对蜂蜜中多组分进行分析,结合化学计量学方法,以期能够从获得的多核磁信号中提取出对掺假蜂蜜有显著性影响的标记物,从而为蜂蜜真伪判别提供切实可行的方法。
1 实验部分
1.1 仪器与试剂
Advance 400 M型核磁共振仪(瑞士布鲁克公司),5 mm双核z-梯度探头及Topspin 2.3 试验控制及数据处理软件;5 mm核磁共振样品管(美国Norell公司);高速离心机(德国Sigma公司);XW-80A型涡旋混合器(上海医科大学仪器厂);LP403分析天平(德国赛多利斯公司)。
溶剂:重水(D2O,氘带度为99.8% ,Cambrideg Isotope Laboratories公司);3-三甲基硅烷基-1-丙基磺酸钠(纯度大于99.9%)、磷酸氢二钾和磷酸二氢钠(优级纯)购于Aldich-Sigma公司;NaN3(分析纯,天津福晨化学试剂厂)。
1.2 蜂蜜样品信息
61个蜂蜜样品包括:杨槐蜜、油菜蜜、椴树蜜、荆条蜜、紫云英蜜、荔枝蜜、龙眼蜜、枣花蜜、枸杞蜜、葵花蜜、黄芪蜜、益母草蜜、枇杷蜜、党参蜜、小茴香蜜和杂花蜜;蜂蜜的加工工艺包括脱水、脱色、脱抗生素;蜂蜜的产地包括:江苏、河南、新疆、四川、内蒙、湖北、辽宁、吉林、陕西、山东、甘肃;所有的蜂蜜样品经实验室掺假检测后指标均合格。糖浆样品包括甜菜糖浆、大米糖浆、木薯糖浆、小麦糖浆、果葡糖浆或其混合糖浆,其加工工艺及储存时间有详细记录;掺假蜂蜜样品主要来自市场上销售的经实验室掺假指标检验合格样品、糖浆样品和蜂蜜样品的任意比例混合;糖浆及掺假蜂蜜样本总数共82个。
1.3 样品制备
对无结晶的蜂蜜样品,将其搅拌均匀。对有结晶的样品,在密闭情况下,置于不超过60 ℃的水浴中温热,振荡,待样品全部融化后搅匀,迅速冷却至室温,分出0.5 kg作为试样。将制备好的试样置于样品瓶中,密封,并标明标记,于室温下保存。
1.4 样品前处理及数据采集过程
蜂蜜样品经0.10~0.14 mm孔径尼龙滤布过滤除去蜂蜜中的固体杂质后,准确称取0.25 g样品于离心管中,加入1 mL 重水,溶解完全;加入200 μL浓度为1.5 mol/L的磷酸盐缓冲溶液(pH 4.0)和100 μL含体积分数为0.05%的3-三甲基硅烷基-1-丙基磺酸钠内标溶液,涡旋振荡3 min至均匀混合,离心10 min,取上清液于核磁管中。每个样品制备2份以供测定分析。
所有真蜂蜜和掺假蜂蜜样品按随机顺序进样分析以避免在分析过程中可能产生的仪器误差。为了抑制蜂蜜中水的共振信号,所有蜂蜜样本的1H NMR分析均采用noesypr1d脉冲序列。在400 MHz核磁共振波谱仪上进行1H NMR测试,实验温度为298 K,利用D2O进行锁场,采用预饱和方法压制水峰;其中在Topspin软件中各参数设置如下:PULPROG=noesypr1 d,AQ_mod=DQD,TD=32 K,NS=8*N,DS=4,TD0=1,SW=6 000 Hz,D1=3 s,DE=4 μs,D8=0.1 s,信号累加240次。
1.5 数据处理
对得到的一维1H NMR谱图进行基线校正和相位校正。基线校正选择polynomial fit拟合方式,相校正选择global和metabonomics算法先自动优化,后针对特定区域进行手动校正,使尽可能多的积分值为正值。为消除残留水信号和内标物信号对分析结果的影响,其中,蜂蜜1H NMR谱参照3-三甲基硅烷基-1-丙基磺酸钠定标,化学位移定为δ= 0.000 ppm,将1H NMR谱中化学位移在δH4.69 ~ 5.20 区间的数据和内标物信号在δH0.00 ~0.10之间的数据从数据矩阵中剔除。按每段宽度δ为0.02 ppm进行分段积分,共得到470段积分数据。积分后的核磁数据峰面积在不同组分之间和不同样品之间的差异较大。为了减小这些差异的影响,按每张核磁谱的总积分强度进行归一化处理,原始数据经数据归一化处理后,各积分处于同一数量级,适合进行综合对比评价,所得积分数据输出并转换为Excel文件保存。在数据集中,行代表某一化学位移区间的峰面积,列为样本的种类。将数据输入SIMCA-P 12.0 软件(Umetrics AB,Umeå,Sweden)进行多维统计分析。
2 结果与讨论
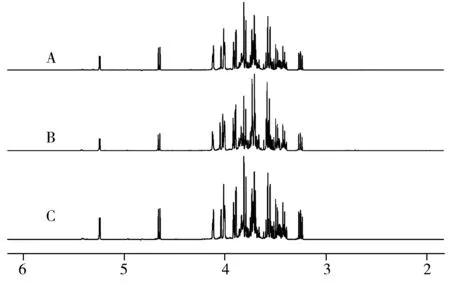
图1 正常蜂蜜(A)、掺假蜂蜜(B)和大米糖浆(C)的1H NMR谱(D2O,400 MHz)Fig.1 Representative 400 MHz 1H NMR spectra from pure honey(A),adulterated honey(B) and rice syrup sample(C)
2.11H NMR代谢指纹图谱
利用Topspin 2.3软件对样品的核磁共振信号进行傅立叶变换,得出蜂蜜样品、掺假蜂蜜和糖浆样品典型的1H NMR指纹图谱(如图1)。由图1可见,通过典型的指纹图谱很难直观地看出纯天然蜂蜜和掺假蜂蜜之间的显著性差异谱峰,因此,必须对所有数据进行化学计量学分析,以从细微的差别中提取出对天然蜂蜜和掺假蜂蜜显著的生物标志物。
首先对方法学进行考察,以确保结果的准确性和可靠性。日内精密度考察结果显示,选取响应值较大的前5个峰积分,其峰面积和对应化学位移的相对标准偏差(RSD,n= 6)分别为0.39%~2.12%和0.25%~0.80%。基于NMR方法的蜂蜜样品的稳定性结果表明,实验过程中,蜂蜜在4 ℃冰箱条件下存储5 d,共有峰的峰面积和化学位移的RSD(n= 6)分别为(4.25 ± 0.98)% 和(1.34 ± 0.67)%,表明在该核磁条件下,建立的指纹分析方法准确、可靠。
2.2 多元统计分析
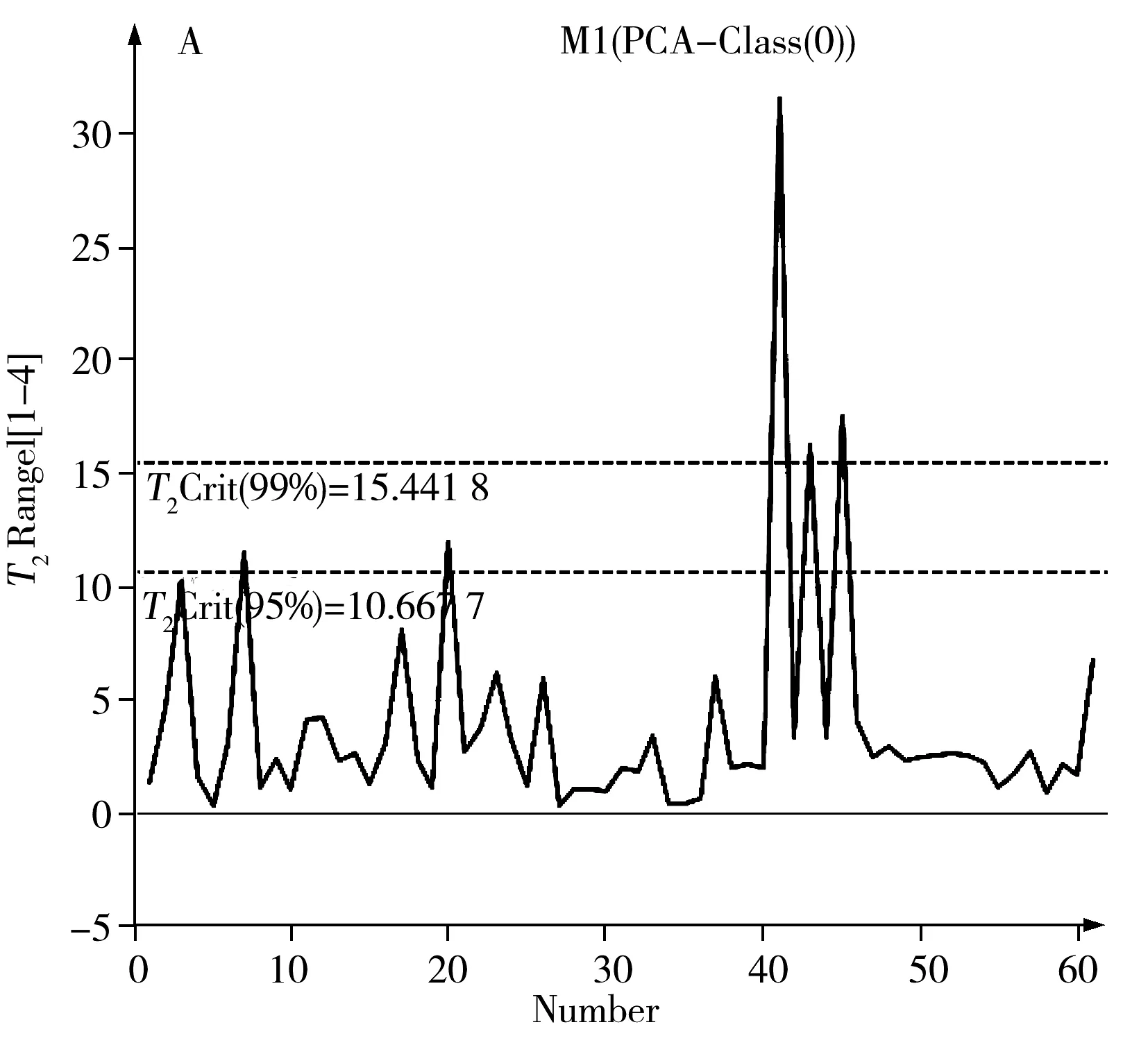
2.2.1 观察变量的选择 在选择观察变量时,强烈界外的观察变量由Hotelling'sT2Range算法得到。对于多维正常分布,所有样本的T2值形成Hotelling'sT2Range图。当T2超过临界值时(0.01作为置信区间),该观察变量被认为是强烈的界外值,应预以剔除(如图2)。因此真蜂蜜组中剔除5个样本,假蜂蜜组中剔除7个样本,其余所有样本用于下一步的模型建立。
2.2.2 主成分分析与偏最小二乘判别分析 从核磁指纹图谱可见真蜂蜜、掺假蜂蜜及糖浆核磁信号的差异。然而仅从单一几个信号的改变很难全面揭示掺假蜂蜜和真蜂蜜的差异。首先采用非监督的主成分分析(PCA)方法对两组蜂蜜样品进行分类,从PCA得分图(图3A)可以看到掺假蜂蜜和真蜂蜜样品有明显的分离趋势,但存在过重合的现象,可能是掺假蜂蜜含有真蜂蜜的成分,与真蜂蜜的性质有相似之处。而且,在样品收集过程中,蜂蜜的蜜种、产地、成熟度等因素会影响分类的准确性。为避免不必要的变量给样品分类带来较大的误差和分析样本间个体差异的影响,进一步采用有监督的偏最小二乘判别分析(PLS-DA)方法用于分类(如图3B),较PCA模型,PLS-DA模型中真假蜂蜜有了明显的分离。为了提高分类和判别的准确性,常采用正交信号滤噪技术(OSC)与PLS相结合,以除掉分类信息中包含的不相干影响因素,找到个体间更加细微的差异。因此,本研究又建立了正交偏最小二乘判别分析(OPLS-DA)模型(如图3C),可观察到两组样品分散在得分图中的不同区域,获得了更好的分类结果。
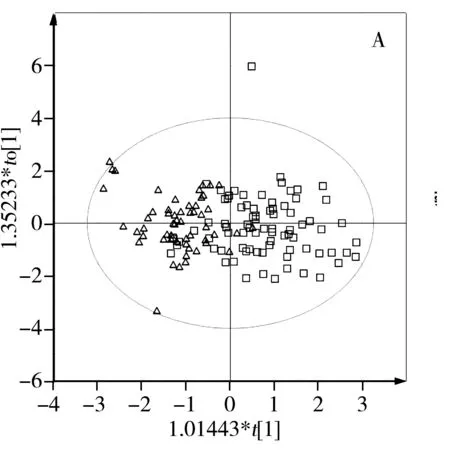
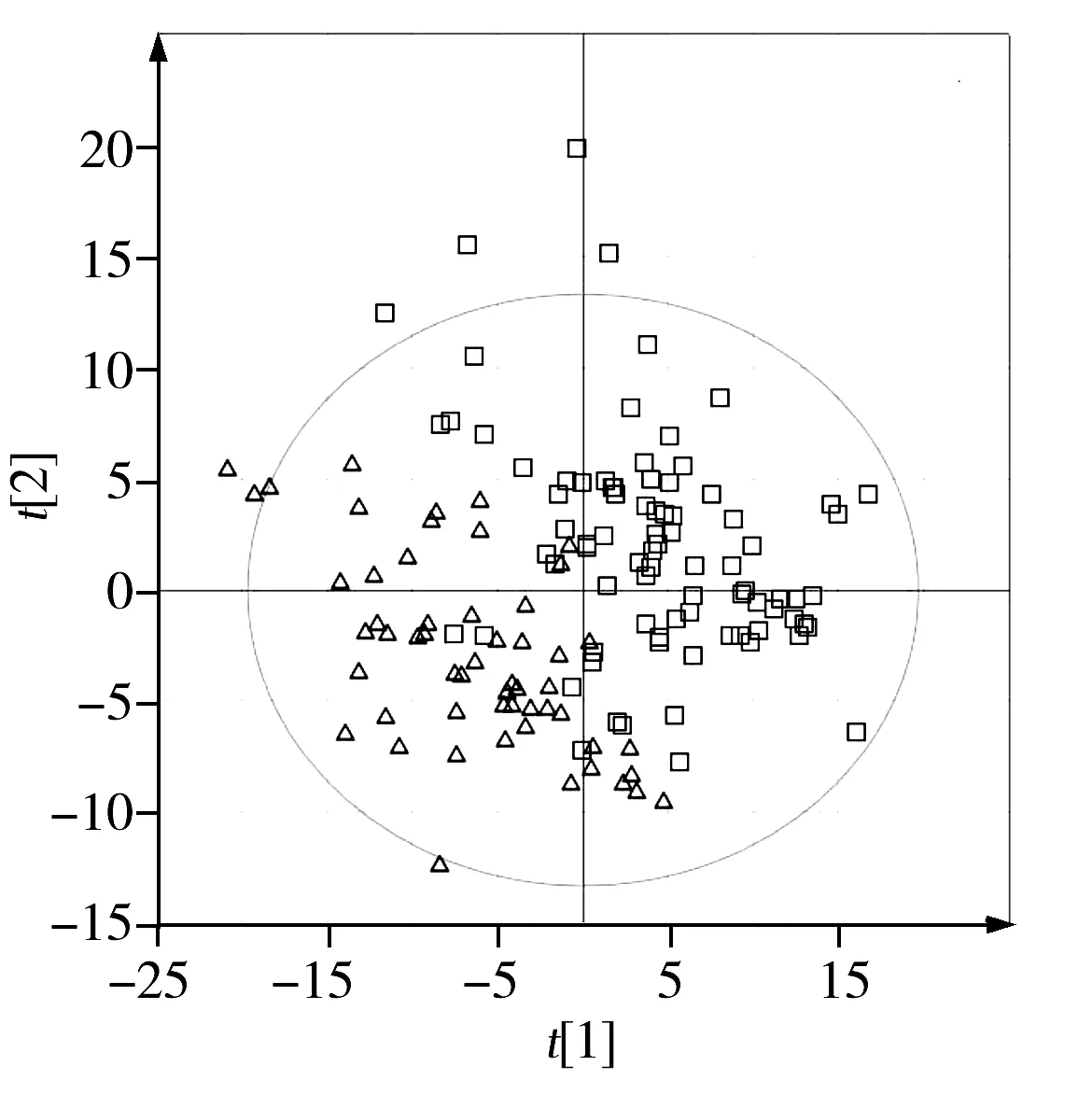
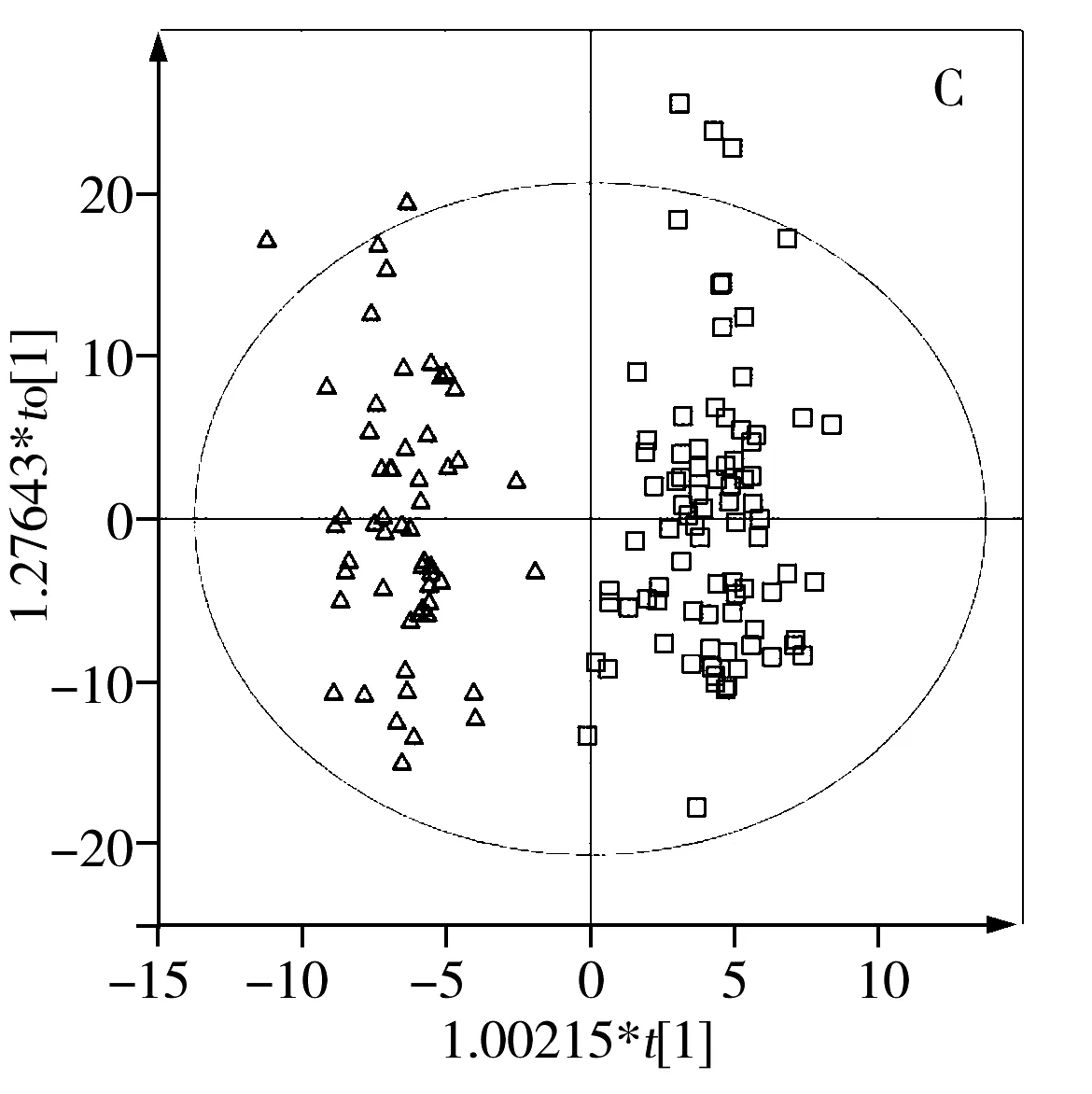
图3 真假蜂蜜的模型得分图
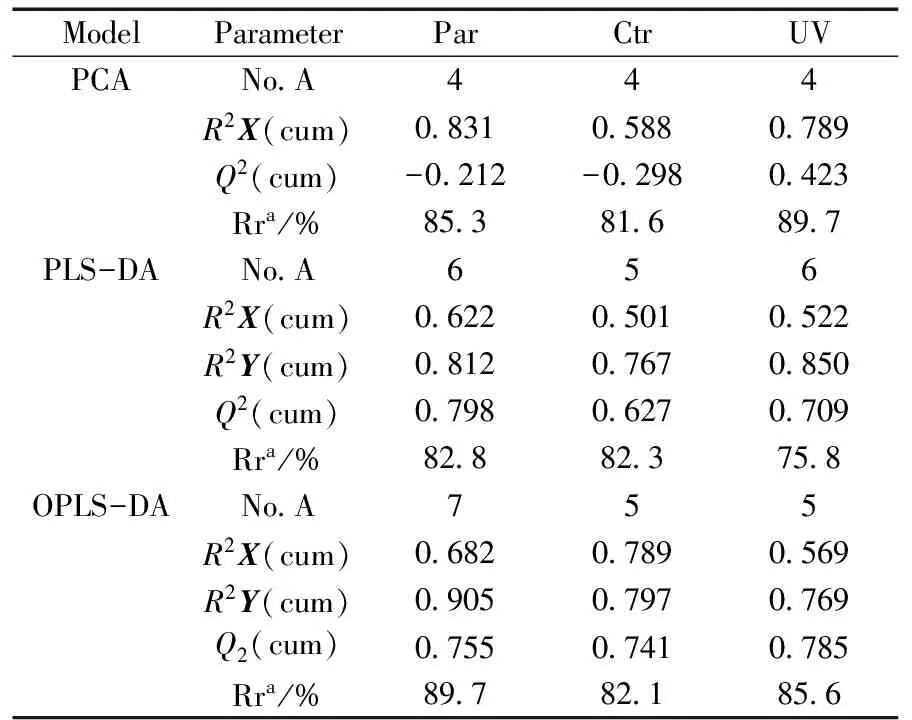
ModelParameterParCtrUVPCANoA444R2X(cum)083105880789Q2(cum)-0212-02980423Rra/%853816897PLS-DANoA656R2X(cum)062205010522R2Y(cum)081207670850Q2(cum)079806270709Rra/%828823758OPLS-DANoA755R2X(cum)068207890569R2Y(cum)090507970769Q2(cum)075507410785Rra/%897821856
aRr is the abbreviation of the reorganization rate(Rr为识别率的缩写);No.A denotes number of principle components calculated by cross validation(No.A为置换测试得到的主成分个数)
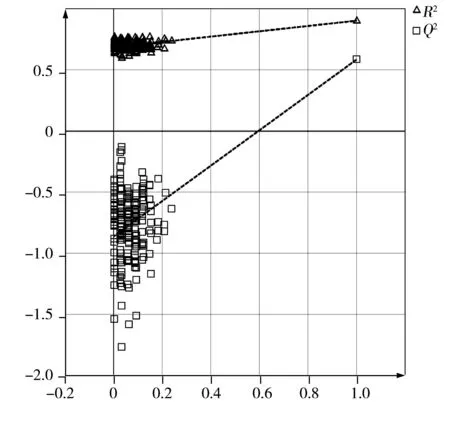
图4 OPLS-DA模型前两个主成分置换200次对应的模型验证图Fig.4 Corresponding validate model plot from the OPLS-DA models based on 200 permutations test for the first two components
多元统计分析时需优化数据预处理方法,以确保所建立模型为最佳模型。常见的标度化方法有中值标度化(Mean-centred,Ctr)、自标度化(Autoscaled,UV)和Parto variance(Par) 3种。Ctr更加注重分析数据波动部分,缺点是可能导致低含量的变量信息受到高含量信号的抑制[19];UV可以消除由于含量差异导致的数据掩盖,缺点是小峰的测量误差被同步放大[20];Par能够削减较大数据的相对重要性,保持数据集的部分完整性,缺点是造成变化相对较小的重要组分不能被选为标记物[21]。3种方法各有优缺点,实际分析中需要依据具体数据进行筛选。在SIMCA-P中评价模型质量的参数有R2X,R2Y和Q2Y,其中R2X和R2Y分别表示模型对X和Y矩阵的解释能力,Q2Y表示模型的预测能力,R2和Q2越接近1则说明模型越稳定可靠,一般情况下该值高于0.5即说明模型较好。
依据3个标度化方法,对真假蜂蜜的核磁信息建立3个数学模型(PCA,PLS-DA和OPLS-DA),具体的模型参数如表1所示。由此可见,Par作为标度化方法所建模型的R2Y和Q2均较高,因此选择Par作为建模前数据预处理的方法,选择OPLS-DA作为真假蜂蜜分类的化学计量学模型,所建模型对蜂蜜真假判别的解释能力为90.5%,对未知样本的预测能力为75.5%,识别率为89.7%。
2.2.3 模型有效性确定 为避免模型获得分类的偶然性,采用置换测试(Permutation test)法对所建模型进行验证。保持X变量不变,通过随机置换Y变量的顺序,观察多个Y变量的顺序随机排列的模型与原始Y变量模型之间的差异。排列置换后,以得到的对Y变量顺序随机排列模型的R2值、Q2值与原始模型的R2值、Q2值之间作回归曲线,以作为衡量模型是否过拟合的标准。通常要求最右端原始鉴别模型的Q2值大于左边任何一个Y变量随机排列模型的Q2值。前两个主成分置换200次对应的模型验证图如图4所示。结果表明,建立的OPLS-DA模型的R2和Q2分别为0.670和-0.778 9,表明模型具有很好的稳定性和预测性,且可信赖性强,模型稳健。
2.2.4 标记物的发现 基于建立的OPLS-DA模型,采用模型的载荷图来筛选区分真假蜂蜜潜在的生物标记物。对不同组的样本分类贡献较大的代谢物质通常是在载荷图中远离中心原点的物质,即离中心的距离越远,对分类的影响越大。如图5A所示,离中心距离远的变量可能代表着潜在的生物标记物。同时结合相关系数分析(图5B),可更直观地反映出各变量对分类贡献的大小,以相关系数绝对值大于0.05为选择依据。最终依次选取P130,P152,P297,P319,P357和P363对应的核磁分段位移作为对真假蜂蜜分类影响最大的变量。这些变量可作为潜在的标记物,然而目前对其结构的解析存在困难,后续将针对这些标记物开展结构鉴定研究。
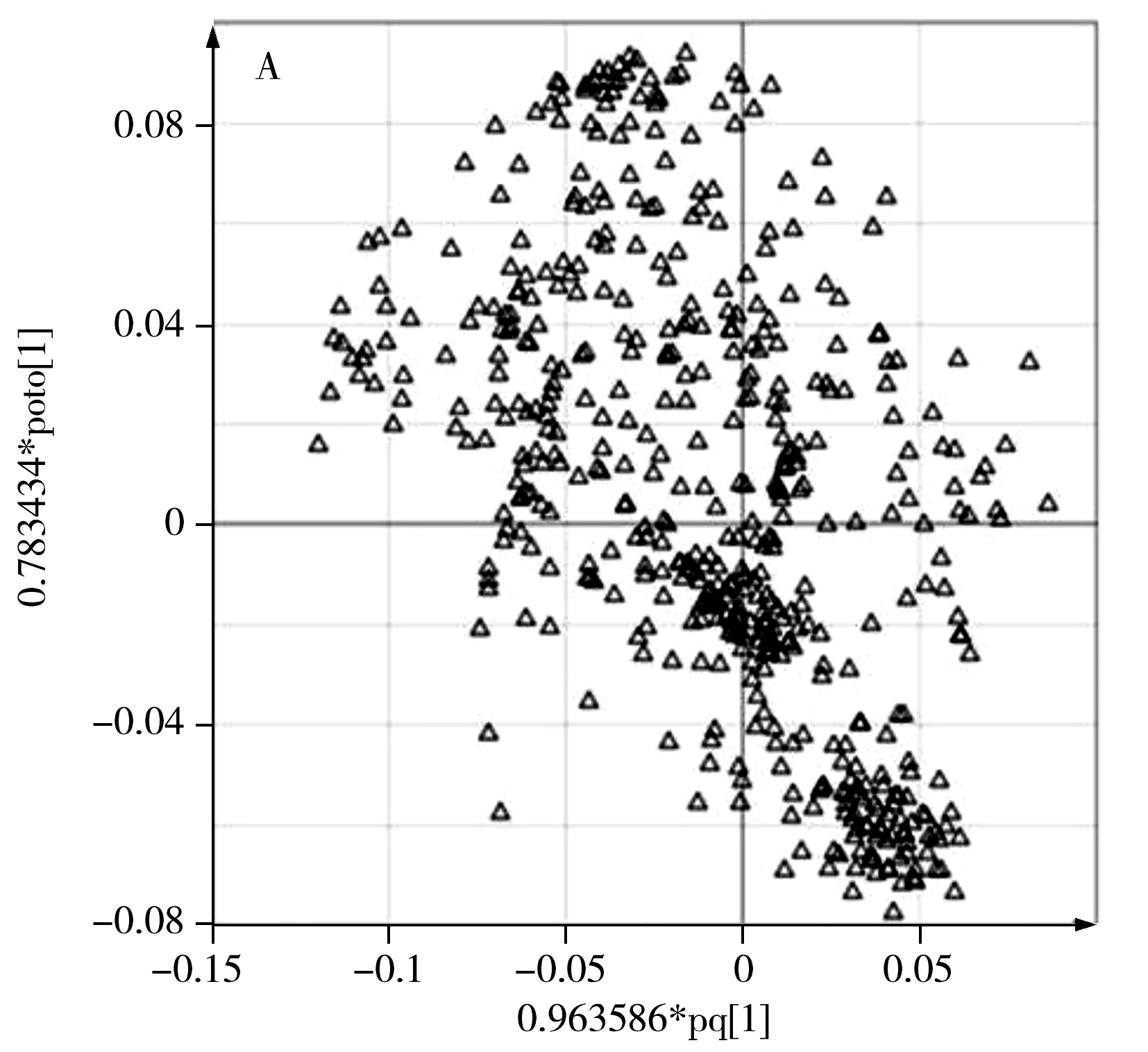
通过相关系数分析,得到各变量的因子相关性系数值。类别变量Y代表样品的类型,将纯蜂蜜样品数值设定为“1”,将糖浆和掺假蜂蜜样品的类型变量数值设为“0”,阈值设为0.5。据此,得到辨别真假蜂蜜判别函数的线性回归方程为:Y=-0.062 90X1-0.074 38X2+0.089 85X3-0.091 60X4-0.078 96X5+0.078 28X6+0.859 5,式中Y表示真蜂蜜或假蜂蜜,X1,X2,X3,X4,X5和X6分别表示第130,152,297,319,357和363个分段积分的峰面积。对于未知样品,分别提取上述6个核磁分段积分的峰面积,代入线性回归方程,若Y值接近1±0.5,则判别为真蜂蜜,若Y值接近0±0.5,则判别为假蜂蜜。
3 结 论
本文建立了核磁共振技术结合化学计量学模型鉴别蜂蜜真假的方法。针对现行的蜂蜜质量检测方法只关注一种或几种成分的含量和变化,该方法首先建立了纯蜂蜜和掺假蜂蜜的OPLS-DA模型,由置换测试方法对模型进行可靠性验证,避免发生过拟合现象。OPLS-DA模型的载荷图和相关系数分析用于蜂蜜掺假标志物的筛查,并找到了相应的核磁分段位移作为对真假蜂蜜分类影响最大的变量。基于找到的掺假标志物,建立了辨别真假蜂蜜的多元线性回归方程。该方法可简单、快速地对未知蜂蜜进行掺假鉴别,具有分析时间短、完整性强、专属性好、可控性强、准确性高等优点,可以弥补目前蜂蜜掺假鉴别方法存在的缺陷。本研究的实施对推动行业科技进步、规范蜂产品市场、保障消费者合法权益以及促进我国蜂产品事业的健康发展具有重要意义。
[1] EU-Council Council Directive 2001/110/EC of 20 December 2001 Relating to Honey.Off.J.Eur.Commun.,2002,47-52.[2] Janiszewska K,Aniolowska M,Nowakowski P.PolishJ.FoodNutrit.Sci.,2012,62(2):85-89.
[3] GB/T 18796- 2012.Honey.National Standards of the People's Republic of China(蜂蜜.中华人民共和国国家标准).
[4] Xue X F,Wang Q,Li Y,Wu L,Chen L,Zhao J,Liu F M,Liu F M.J.Agric.FoodChem.,2013,61(31):7488-7493.[5] Truchado P,Ferreres F,Tomas-Barberan F A.J.Chromatogr.A,2009,1216(43):7241-7248.
[6] Shen C Y,Wu B,Fei X Q,Ding T,Li S Y.ApicultureChina(沈崇钰,吴斌,费晓庆,丁涛,李宋钰.中国蜂业),2011,S7:61-64.
[7] GB/T 18932.2-2002.Method for the Determination of High Fructose Corn Syrup in Honey-Thin Layer Chromatography.National Standards of the People's Republic of China(蜂蜜中高果淀粉糖浆测定方法-薄层色谱法.中华人民共和国国家标准).
[8] GB/T 18932.22-2003.Method for the Determination of Fructose,Glucose,Sucrose,Maltose in Honey-Liquid Chromatography Refractive Index Detection Method.National Standards of the People's Republic of China(蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定方法-液相色谱示差折光检测法.中华人民共和国国家标准).
[9] AOAC Official Method 998.12 C-4 Plant Sugars in Honey.2010:33-36.
[10] Fei X Q,Wu B,Shen C Y,Ding T,Li L H,Lu Y.Chin.J.Chromatogr.(费晓庆,吴斌,沈崇钰,丁涛,李丽花,路颖.色谱),2011,29(1):15-19.
[11] He R,Li J S ,Hou G F .FoodFerment.Ind.(何仁,李军生,侯革非.食品与发酵工业),2004,30(2):115-117.
[12] Donarski J A,Roberts D P T,Charlton A J.Anal.Method,2010,2(10):1479-1483.
[13] Monakhova Y B,Kuballa T,Lachenmeier D W.J.Anal.Chem.,2013,68(9):755-766.
[14] Boffo E F,Tavares L A,Ferreira M M C,Ferreira A G.LWT-FoodSci.Technol.,2009,42(9):1455-1460.
[15] Ribeiro R O R,Mársico E T,Carneiro C S,Monteiro M L G,Júnior C A C,Mano S,Jesus E F O.LWT-FoodSci.Technol.,2014,55:90-95.
[16] Ribeiro R O R,Mársico E T,Carneiro C S,Monteiro M L G,Júnior C C,Jesus E F O.J.FoodEng.,2014,135:39-43.
[17] Simova S,Atanassov A,Shishiniova M,Bankova V.FoodChem.,2012,134(3):1706-1710.
[18] Sanduskg P,Raftery D.Anal.Chem.,2005,77(8):2455-2463.
[19] Gorji S,Bahram M,Golshan A.J.IranianChem.Soc.,2010,7(4):946-956.
[20] Saccenti E,Smilde A K,Westerhuis J A,Hendriks M M.J.Chemom.,2011,25(12):644-652.
[21] Wang X J ,Liu Y R,Xiao B K,Yang J Y,Zhao A D,Yang Y,Huang R Q.Mod.Instrum.(王小娟,刘研如,肖炳坤,杨建云,赵安东,杨雁,黄荣清.现代仪器),2011,17(2):28-30.
Identification of Honey Adulteration by Nuclear Magnetic Resonance Technology and Chemometrics Method
LIU Yun1,DING Tao1*,WU Bin1,ZHANG Rui1,SHEN Chong-yu1,FEI Xiao-qing1,ZHANG Kuo-hai2,LIU Jian-hong2,DENG Xiao-jun3,GUO De-hua3
(1.Jiangsu Entry-Exit Inspection and Quarantine Bureau,Nanjing 210001,China;2.Beijing Tongrentang Bee Industry Co.,Ltd.,Beijing 102400,China;3.Shanghai Entry-Exit Inspection and Quarantine Bureau,Shanghai 200000,China)
Currently existing national standards for honey adulteration are based on one type or certain types of compounds.Therefore,it is necessary to develop a multi-component and multi-index method to identify the honey adulteration.In this research,the changes of fingerprint between pure and adulterated honey were explored based on the NMR fingerprinting analysis and chemometrics method.Unsupervised method of principal component analysis(PCA),supervised method of partial least squares discriminant analysis(PLS-DA) and orthogonal-PLS-DA(OPLS-DA) were all used to extract the useful information from NMR signals.The results showed that OPLS-DA model could distinguish the adulterated honey from pure honey.The explanation abilities based on the OPLS-DA model was 90.5%.The prediction and recognition abilities were 75.5% and 89.7%,respectively.Through permutation test,the chemometric model showed good stability,accurate predictability and high reliability.Several significant markers were found to distinguish honey from the loading plot and correlation coefficient analysis of OPLS-DA model.Combined with the correlation coefficient analysis,multiple linear regression equation was established to distinguish the adulterated honey from pure honey.The proposed method was simple and sensitive.This method provided an effective approach to control the honey quality and detect the honey adulteration.
nuclear magnetic resonance technology(NMR);chemometrics method;pattern recognition technology;honey adulteration
2016-03-09;
2016-05-21
江苏出入境检验检疫局科技计划(2015KJ29,2016KJ05);上海长三角科技合作项目(15395810100)
10.3969/j.issn.1004-4957.2016.10.005
O482.532;S896.1
A
1004-4957(2016)10-1248-07
*通讯作者:丁 涛,硕士,高级工程师,研究方向:食品安全分析与质量控制,Tel:025-52345183,E-mail:dingt@jsciq.gov.cn

