丹参酮ⅡA对大鼠心肌缺血再灌注后细胞凋亡的机制研究*
韩 平冯 俊陈华文
(1.湖北省秭归县人民医院,湖北 秭归 443600;2.华中科技大学同济医学院附属同济医院,湖北 武汉 430030)
·研究报告·
丹参酮ⅡA对大鼠心肌缺血再灌注后细胞凋亡的机制研究*
韩 平1冯 俊2△陈华文2
(1.湖北省秭归县人民医院,湖北 秭归 443600;2.华中科技大学同济医学院附属同济医院,湖北 武汉 430030)
目的 探索丹参酮ⅡA对大鼠心肌缺血再灌注后细胞凋亡的机制。方法 选取32只SD大鼠,按随机数字表法分为假手术组、模型组、丹参酮ⅡA 20 mg组、丹参酮ⅡA 40 mg组,每组8只。丹参酮ⅡA 20 mg组、丹参酮ⅡA 40 mg组分别于术前7 d开始给予20 mg/(kg·d)、40 mg/(kg·d)的丹参酮ⅡA磺酸钠注射液腹腔注射。假手术组、缺血再灌注模型组均给予等量蒸馏水腹腔注射。采用结扎左前降支法建立大鼠心肌缺血再灌注损伤模型。各组于造模后3 h剪取心脏组织,采用TUNEL法检测心肌细胞凋亡,Western bolt法检测p-Akt表达,免疫组化法检测Mfn2表达。结果 与假手术组相比较,模型组心肌细胞凋亡指数、Mfn2表达显著升高,p-Akt表达显著降低(P<0.05);与模型组相比较,丹参酮ⅡA 20 mg组、丹参酮ⅡA 40 mg组心肌细胞凋亡指数、Mfn2表达显著降低,p-Akt表达显著升高(P<0.05),并显示出明显剂量依赖性。结论 丹参酮ⅡA可有效抑制心肌缺血再灌注损伤后的心肌细胞凋亡,抑制Mfn2表达是其可能的作用机制。
丹参酮ⅡA 缺血再灌注 心肌细胞 细胞凋亡 线粒体融合素2
心肌细胞凋亡是导致心肌缺血再灌注(I/R)后心功能不全及心律失常的主要因素[1]。线粒体融合素(Mfn2)及其产物具有负向调控磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/Akt)信号通路的作用,从而在细胞凋亡过程中发挥重要作用[2]。丹参酮ⅡA可通过激活PI3K/Akt信号通路,介导细胞增殖、凋亡过程,从而发挥心肌保护、抗动脉粥样硬化等作用[3]。但丹参酮ⅡA对Mfn2的调控作用尚未明确。针对上述问题,研究选取心肌缺血再灌注损伤模型大鼠为研究对象,观察辛伐他汀对心肌凋亡及Mfn2表达的影响,探讨丹参酮ⅡA抗心肌细胞凋亡的作用机制,为临床应用提供可靠依据。现报告如下。
1 材料与方法
1.1 材料 丹参酮ⅡA磺酸钠注射液(诺新康;上海第一生化药业有限公司产品,国药准字H31022558);DMEM培养基、PBS缓冲液、胰蛋白酶(美国Gibco公司);Mfn2抗体、p-Akt抗体、Akt抗体(美国Santa Cruz公司);免疫组化试剂盒(武汉博士德生物有限公司);凋亡检测试剂盒(TUNEL法,德国Roche公司)。
1.2 实验动物 健康成年SD大鼠32只,雄性,SPF级,体质量220~270 g,购于同济医学院动物实验中心(动物合格证号:SCXK鄂2009-0003)。
1.3 分组与造模 将受试大鼠按随机数字表法分为4组,即假手术组、模型组、丹参酮ⅡA 20 mg组、丹参酮ⅡA 40 mg组,每组8只。丹参酮ⅡA 20 mg组、丹参酮ⅡA 40 mg组分别于术前7 d开始给予20 mg/(kg·d)、40 mg/(kg·d)的丹参酮ⅡA磺酸钠注射液腹腔注射。假手术组、缺血再灌注模型组均给予等量蒸馏水腹腔注射。大鼠采用3%戊巴比妥钠腹腔注射进行麻醉,采用小动物呼吸机鼻面罩辅助通气,常规开胸,逐层分离胸膜、心包,于左心耳下缘、肺动脉圆锥水平纵轴上,以缝线穿圆形塑料套管结扎模型组、5 mg辛伐他汀组、10 mg辛伐他汀组大鼠左前降支并阻断血流。血流阻断成功标准:1)远端心肌出现苍白;2)心电图标准Ⅱ导联ST段出现弓背向上型抬高。阻断成功30 min后,剪开空心塑管,恢复血流,之后逐层关闭胸腔。假手术组开胸后于左前降支下穿线,但并不结扎。再灌注3 h后,常规取出心脏标本。
1.4 标本采集与检测 1)TUNEL染色检测心肌细胞凋亡。上述心脏标本以4%多聚甲醛固定24 h,梯度酒精脱水,石蜡包埋后切片。采用TUNEL法对切片进行染色,操作严格按试剂盒说明书进行,以细胞核染成棕黄色为阳性,每张切片于缺血再灌注损伤区域(假手术组于左室前壁区域)随机选取5个视野,记录阳性细胞数,并计算细胞凋亡指数(AI),AI(%)=(凋亡细胞数/总细胞数)×100%。2)Western bolt法检测p-Akt表达。采用Western blot法检测心肌组织中p-Akt蛋白表达。常规提取组织蛋白,行SDS-PAGE电泳,转至硝酸纤维膜,5%封闭液4℃封闭4 h,TBS缓冲液漂洗3次,加入相应一抗(抗p-Akt、抗Akt、抗α-actin)(1∶1000),4℃孵育过夜,TBS缓冲液漂洗3次,加入相应二抗(1∶500),室温孵育2 h,增强化学发光显色系统显色。3)免疫组化法检测 Mfn2表达。上述心脏标本以4%多聚甲醛固定24 h,梯度酒精脱水,石蜡包埋后切片,采用免疫组化法检测Mfn2表达。严格按试剂盒操作说明进行,每张切片于缺血再灌注损伤区域(假手术组于左室前壁区域)随机选取5个视野,采用虚拟显微镜拍摄图片,使用图像分析软件测定Mfn2表达平均吸光度值。
1.5 统计学处理 应用SPSS18.0统计软件处理。计量资料以(±s)表示,多组间比较用单因素方差检验,两两间比较用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组心肌细胞凋亡情况比较 见表1、图1。TUNEL染色结果显示,正常心肌细胞核呈蓝色,凋亡心肌细胞核呈棕黄色。假手术组未见心肌细胞凋亡;与假手术组相比较,模型组心肌细胞AI显著升高(P<0.05);与模型组相比较,丹参酮ⅡA组心肌细胞AI显著降低,且丹参酮ⅡA40mg组较丹参酮ⅡA 20 mg组变化更为显著(P<0.05)

图1 各组心肌细胞凋亡情况比较(TUNEL染色,400倍)
表1 各组心肌细胞凋亡情况比较(%,±s)

表1 各组心肌细胞凋亡情况比较(%,±s)
与假手术组比较,*P<0.05;与模型组比较,△P<0.05;与丹参酮ⅡA 20 mg组比较,▲P<0.05。下同。
?
2.2 各组p-Akt蛋白表达水平比较 见表2,图2。Western bolt检测结果显示,与假手术组相比较,模型组心肌p-Akt蛋白表达显著降低(P<0.05);与模型组相比较,丹参酮ⅡA组心肌p-Akt蛋白表达显著增高,且丹参酮ⅡA 40 mg组较丹参酮ⅡA 20 mg组变化更为显著(P<0.05)。
2.3 各组Mfn2蛋白表达水平比较 见表3,图3。免疫组化检测结果显示,与假手术组相比较,模型组心肌Mfn2蛋白表达显著增高(P<0.05);与模型组相比较,丹参酮ⅡA组心肌Mfn2蛋白表达显著降低,且丹参酮ⅡA 40 mg组较丹参酮ⅡA 20 mg组变化更为显著(P<0.05)。
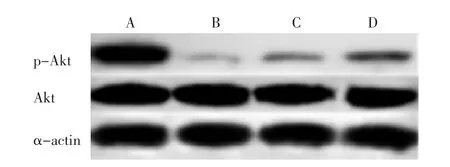
图2 各组心肌p-Akt蛋白表达水平比较
表2 各组心肌p-Akt蛋白表达水平比较(±s)

表2 各组心肌p-Akt蛋白表达水平比较(±s)
?

图3 各组心肌Mfn2蛋白表达水平比较(免疫组化,200倍)
表3 各组心肌Mfn2蛋白表达水平比较(±s)

表3 各组心肌Mfn2蛋白表达水平比较(±s)
?
3 讨 论
心肌细胞凋亡是心肌缺血再灌注损伤过程中的标志性事件,其发生机制较为复杂,主要由缺血、缺氧及氧化应激等多种因素激活促凋亡基因、调控相关信号通路引起[4]。Ras-PI3K/Akt信号通路作为关键路径在促发心肌细胞凋亡中发挥重要作用,调节该信号通路相关基因表达,抑制心肌细胞凋亡,已成为预防心肌缺血再灌注损伤的新方向[5]。
丹参酮ⅡA作为传统中药丹参的有效成分之一,具有调节血脂、抗血栓及延缓动脉粥样硬化等作用,并被广泛应用于心血管疾病的治疗。近年来随着研究的深入,丹参酮ⅡA的细胞保护作用也日益受到关注[6]。研究证实,丹参酮ⅡA可通过抑制甲羟戊酸合成,阻碍小三磷酸鸟苷结合蛋白Ras异戊二烯化,调控Ras-PI3K/Akt信号通路及丝裂原活化蛋白激酶(MAPK)信号通路,促进一氧化氮(NO)释放,减少活性氧(ROS)生成,具有显著的抗氧化、抗炎及抑制血管内皮细胞和心肌细胞凋亡的作用[7]。但丹参酮ⅡA对Mfn2信号通路上游信号分子的调控作用尚未完全明确。
Mfn2属于线粒体外膜蛋白,是近年来新发现的细胞信号通路调控点[8]。周炜等研究显示,血管平滑肌细胞中的Mfn2可通过线粒体途径对原癌基因Ras起到直接负调控作用,从而阻滞Ras-PI3K/Akt信号通路,抑制Akt磷酸化,进而抑制包括Bcl-2在内的促凋亡基因表达,促进包括Bax在内的抑凋亡基因表达,提示Mfn2在Ras-PI3K/Akt上游信号通路中起着关键的促凋亡作用[9]。但Mfn2在缺血再灌注损伤后心肌凋亡中的调控作用尚未明确。
本研究结果显示,急性心肌缺血再灌注损伤后,大鼠心肌组织切片缺血再灌注损伤区域可见Mfn2呈现高表达,而p-Akt呈现低表达,同时该区域内心肌细胞大量凋亡,提示心肌缺血再灌注损伤可能通过激活Mfn2表达,抑制Akt磷酸化,从而促进心肌细胞凋亡[10]。与模型组相比较,于术前采用丹参酮ⅡA进行干预,可显著抑制心肌细胞凋亡、下调Mfn2表达、上调p-Akt表达,且丹参酮ⅡA的调控作用呈现明显剂量依赖性,提示丹参酮IIA可能通过抑制促凋亡基因Mfn2表达,调控Ras-PI3K/Akt信号通路,进而达到抑制心肌细胞凋亡的作用[11-15]。
综上所述,Mfn2可能在心肌缺血再灌注损伤过程中起到促心肌细胞凋亡作用,而丹参酮ⅡA可通过抑制Mfn2表达,抑制心肌缺血再灌注损伤后的心肌细胞凋亡,从而实现其心肌保护作用。丹参酮ⅡA是否还通过其他信号分子或信号通路发挥心肌保护作用,仍有待进一步深入研究。
[1] Liao YH,Xia N,Zhou SF,et al.Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration[J].Journal ofthe American College of Cardiology,2012,59(4):420-429.
[2] Papanicolaou KN,Khairallah RJ,Ngoh GA,et al.Mitofusin-2 maintains mitochondrial structure and contributes to stressinduced permeability transition in cardiac myocytes[J]. Molecular and cellular biology,2011,31(6):1309-1328.
[3] Huimin Dong,Shanpin Mao,Jiajun Wei,et al.TanshinoneⅡA protects PC12 cells from β-amyloid 25-35-induced apoptosis via PI3K/Akt signaling pathway[J].Molecular Biology Reports,2012,39(6):6495-6503.
[4] Gerczuk PZ,Breckenridge DG,Liles JT,et al.An apoptosis signal-regulating kinase 1 inhibitor reduces cardiomyocyte apoptosis and infarct size in a rat is chemia-reperfusion model[J].Journal of cardiovascular pharmacology,2012,60(3):276-282.
[5] Ding HS,Yang J,Chen P,et al.The HMGB1-TLR4 axis contributes to myocardial ischemia/reperfusion injury via regulation of cardiomyocyte apoptosis[J].Gene,2013,527(1): 389-393.
[6] D Jian-Ping,Z Dan-Xia,S Jiang-Tao,et al.Inhibition of TanshinoneⅡA,salvianolic acid A and salvianolic acid B on Areca nut extract-induced oral submucous fibrosis in vitro[J].Molecules,2015,20(4):6794-6807.
[7] Mei-Qi Zhang,Yue-Liang Zheng,Huan Chen,et al.Sodium tanshinoneⅡA sulfonate protects rat myocardium against ischemia-reperfusion injury via activation of PI3K/Akt/FOXO3A/Bim pathway[J].Acta pharmacologica Sinica,2013,34(11):1386-1396.
[8] 周杰,严凌,黄多新.线粒体融合素2通过Ras-PI3K-Akt信号途径抑制缺血再灌注诱导的乳鼠心肌细胞凋亡[J].中国临床药理学与治疗学,2014,19(9):973-979.
[9] 周炜,曹文静,陈莉莉,等.去除蛋白激酶A磷酸化位点的线粒体融合素2基因对血管平滑肌细胞凋亡的影响[J].中国动脉硬化杂志,2012,20(11):968-971.
[10]周炜,陈玲,陈曼华.阿托伐他汀通过下调线粒体融合素2表达抑制大鼠心肌缺血再灌注后细胞凋亡[J].细胞与分子免疫学杂志,2014,30(4):388-390.
[11]杨世明,孙瑜,涂志业,等.EPO对缺血/再灌注损伤大鼠心肌细胞Mfn2蛋白表达及心肌细胞凋亡的影响[J].中国组织化学与细胞化学杂志,2009,18(6):32-34.
[12]Elezaby A,Sverdlov AL,Tu VH,et al.Mitochondrial remodeling in mice with cardiomyocyte-specific lipid overload[J].J Mol Cell Cardiol,2015,79:275-283.
[13]Parra V,Verdejo HE,Iglewski M,et al.Insulin stimulates mitochondrial fusion and function in cardiomyocytes via the Akt-mTOR-NFκB-Opa-1 signaling pathway[J].Diabetes,2014,63(1):75-88.
[14]Zhou W,Chen L,Chen M.Atorvastatin inhibits cardiomyocyte apoptosis via down-cegulation the expression mitofusin 2 after myocardial ischemia/reperfusion injury in rats[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2014,30(4):388-390.
[15]Yu H,Guo Y,Mi L,et al.Mitofusin 2 inhibits angiotensin II-induced myocardial hypertrophy[J].J Cardiovasc Pharmacol Ther,2011,16(2):205-211.
The Effect of TanshinoneⅡA on Cardiomyocyte Apoptosis after Myocardial Ischemia/Reperfusion Injuryin Rats
HAN Ping,FENG Jun,CHEN Huawen.Zigui People′s Hospital,Hubei,Zigui 443600,China.
Objective:To evaluate the effect of TanshinoneⅡA on cardiomyocyte apoptosis after myocardial ischemia/reperfusion injury in rats.Methods:32 SD rats were randomly divided into sham-operation group,model group,20 mg TanshinoneⅡA group and 40mg TanshinoneⅡA group,8 rats in each group.The 20mg TanshinoneⅡA group and the 40mg TanshinoneⅡA group respectively were given 20 mg/(kg·d)and 40 mg/(kg·d)TanshinoneⅡA intraperitoneal injection 7d before the operation.The sham-operation group and the model group were given equivalent normal saline intraperitoneal injection.The myocardial ischemia/reperfusion injury model was induced by ligation of left anterior descending artery.In 3h after reperfusion,the hearts of each group rats were harvested.The cardiomyocyte apoptosis was detected by TUNEL method,the p-Akt expression was detected by western bolt,and the Mfn2 expression was detected by immunohistochemistry method.Results:Compared with the sham-operation group,the cardiomyocyte apoptosis index and Mfn2 expression of model group significantly increased,and the p-Akt expression significantly decreased(P<0.05).Compared with the model group,the cardiomyocyte apoptosis index and Mfn2 expression of the 20 mg TanshinoneⅡA group and the 40 mg TanshinoneⅡA group significantly decreased,and the p-Akt expression significantly increased(P<0.05),and showed significantly dose-dependent manner(P<0.05).Conclusion:TanshinoneⅡA can inhibit the cardiomyocyte apoptosis after myocardial ischemia/reperfusion injury,and down-regulating the expression of Mfn2 may be its mechanism.
TanshinoneⅡA;Ischemia/reperfusion;Cardiomyocyte;Apoptosis;Mitofusin
·研究报告·
R285.5
A
1004-745X(2016)10-1844-04
10.3969/j.issn.1004-745X.2016.10.004
国家自然科学基金项目(81202825)
△(电子邮箱:andyterry555@163.com)
(2016-02-13)

