间充质干细胞促进Luminal B型乳腺癌细胞生长增殖及其分子机制
左伟敏祝玲林婷婷王瑾林榕雷艳付云烽路君黄梁浒王庆华谭建明王水良,
间充质干细胞促进Luminal B型乳腺癌细胞生长增殖及其分子机制
左伟敏1祝玲2林婷婷1王瑾2林榕2雷艳2付云烽2路君2黄梁浒2王庆华2谭建明2王水良1,2
目的 分析人脐带间充质干细胞(hUC-MSCs)对Luminal B型乳腺癌细胞生长增殖的影响,并初步探讨其可能的分子机理。方法 绿色荧光蛋白(GFP)和荧光素酶共表达慢病毒感染人Luminal B型乳腺癌细胞BT474,并经嘌呤霉素筛选两周后,于荧光显微镜下观察GFP的表达情况,IVIS Kinetic成像系统拍照以观察和记录慢病毒感染后BT474细胞荧光素酶的表达情况;荧光显微镜下直接观察,结合MTS实验分析hUC-MSCs共培养或其浓缩上清处理对GFP和荧光素酶共表达BT474细胞生长增殖的影响;Western blot法检测hUC-MSCs浓缩上清处理对BT474细胞Akt和MAPK信号通路激活情况以及下游细胞周期调控蛋白Cyclin D1表达的影响;常规RT-PCR法检测hUC-MSCs中NRG-1、NRG-2、IGF-Ⅰ、IGF-Ⅱ和EGF等配体的表达。荧光素酶表达强度与细胞数量的相关性经由Excel软件行统计学分析,MTS实验数据则经由SPSS13.0统计软件行统计学分析。结果 荧光显微镜和IVIS Kinetic成像系统的观察结果分别证实,GFP和荧光素酶经慢病毒载体系统的介导可在BT474细胞中成功地共表达,且荧光素酶的表达强度与细胞数量呈直线相关。MSCs共培养或其浓缩上清处理均可显著促进Luminal B型乳腺癌细胞BT474的生长增殖,其细胞存活比例分别为各自对照组的148.06%(P< 0.005)和147.99%(P < 0.001);MSCs浓缩上清处理同时激活BT474细胞内Akt和MAPK信号通路,并上调细胞周期调控蛋白Cyclin D1表达。此外,RT-PCR结果显示,hUC-MSCs中NRG-1和EGF的mRNAs水平呈高表达,而NRG-2、IGF-Ⅰ和IGF-Ⅱ等配体的mRNAs表达也可见。结论 MSCs可通过表达并分泌NRG-1等配体,从而激活Luminal B型乳腺癌细胞BT474的下游Akt和MAPK信号转导通路以上调细胞周期调控蛋白Cyclin D1的表达,进而促进其生长增殖。
间质干细胞; 乳腺肿瘤; 细胞增殖
乳腺癌是世界范围内严重危害女性健康的重大疾病,在西方一些国家,其发病率一直高居女性各器官恶性肿瘤发病率之首,病死率仅低于肺和支气管癌[1-3]。在我国,最新统计数据显示,乳腺癌也已跃居女性恶性肿瘤发病率首位,2015年新发病达26.86万例,约占女性全部新发肿瘤的16.81%,且发病年龄呈年轻化趋势[4]。
乳腺癌是一类源自乳腺小叶导管上皮的恶性实体肿瘤,具高度的异质性。依雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和表皮生长因子受体2(ErbB2/HER2)等分子的表达差异可将乳腺癌分为以下5种分子亚型:即Luminal A型、Luminal B型、ErbB2/HER2过表达型、基底样型(Basal-like)和正常样型(Normal-like);其中Luminal B型乳腺癌具ER和HER2共表达,约占全部乳腺癌的7.8%[5-6]。不同亚型乳腺癌其分子发病机理、临床治疗方案的选择以及预后均有所不同。间充质干细胞(mesenchymal stem cells,MSCs)作为肿瘤微环境中重要的组成成分之一,其在肿瘤发生发展过程中的作用吸引了众多研究人员的目光[7-9]。本研究通过细胞与细胞间的共培养或浓缩上清处理,初步分析了人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)对Luminal B型乳腺癌细胞生长增殖的影响,并对其可能的分子机理作了简单的探讨。
材料和方法
一、材料
1.细胞和质粒:hUC-MSC来源于福州总医院泌尿外科实验室干细胞组,取P4代细胞;人Luminal B型乳腺癌细胞BT474购自美国典型培养物保藏中心(ATCC)。慢病毒包装质粒psPAX2和pMD2.G购自Addgene公司,绿色荧光蛋白(green fl uorescence protein,GFP)和荧光素酶共表达慢病毒载体pLEX-GFP-Luc由美国杜克大学李博士(Dr. Chuan-Yuan Li)惠赠。
2.酶和试剂:胎牛血清、DMEM/F12培养基、低糖DMEM购自美国Hyclone公司;Polybrene和聚乙烯亚胺(PEI)购自美国Sigama公司;嘌呤霉素购自美国ACROS公司;细胞增殖分析试剂MTS和PMS、ECL化学发光显色试剂购自美国Promega公司;TRIzol购自美国Life technolgies公司;逆转录试剂、PCR试剂盒及DNA marker购自美国Fermentas公司;质粒小提试剂盒和质粒大提试剂盒购自美国ROCHE公司;浓缩上清收集用Amicon Ultra(3K)超滤离心管(50 ml)和细胞共培养用Transwell小室(0.4 μmol/L规格)为美国Millipore公司产品;PCR引物由上海生工生物工程公司合成(序列见表1);兔抗人pAkt(Ser473)抗体(#9271)、兔抗人Akt抗体(#9272)、兔抗人pMAPK(Thr202,Tyr204)抗体(#4370)、兔抗人MAPK抗体(#9102)、兔抗人Cyclin D1抗体(#2922S)购自美国Cell Signaling公司,鼠抗人β-actin抗体购自美国Sigma公司,辣根过氧化物酶标记抗兔或抗鼠二抗购自美国Jackson Immuno Research Laboratories公司。

表1 RT-PCR扩增引物序列、扩增片段及退火温度
二、方法
1.细胞培养:人胚肾上皮细胞系HEK293T和Luminal B型乳腺癌细胞系BT474的培养使用含10%胎牛血清的DMEM/F12培养基;hUCMSCs的培养使用含10%胎牛血清的低糖DMEM培养基,置于含5% CO2饱和湿度的37℃温箱中。
2.慢病毒的包装与细胞感染:GFP和荧光素酶共表达慢病毒的包装和感染人Luminal B型乳腺癌BT474细胞实验参考文献[10-11]中所描述的方法。
3.荧光显微镜及IVIS Kinetic成像系统观察:慢病毒感染24 h并经嘌呤霉素进一步筛选两周后的人Luminal B型乳腺癌细胞BT474置荧光倒置显微镜下直接观察GFP的表达情况。同时,胰酶消化一部分细胞,离心后去上清,普通光学显微镜下计数细胞,一定细胞数量于200 μl无血清的DMEM/F12培养基重悬细胞后,再与200 μl的Luciferin(300 μg/ml)充分混匀,置IVIS Kinetic成像系统观察并拍照记录荧光素酶的表达情况;荧光素酶表达强度与细胞数量的相关性经由Excel软件行统计学分析。将经鉴定携有GFP和荧光素酶稳定共表达的Luminal B型乳腺癌细胞BT474命名BT474_GFPFluc。
4. hUC-MSC浓缩培养上清的收集:正常培养的P4代hUC-MSCs接种至100 mm培养皿,待细胞长至80%左右汇合度时吸去培养基,每皿细胞换不含血清和抗生素的低糖DMEM培养基5 ml,48 h后收集培养上清,置Amicon Ultra(3K)超滤离心管(50 ml)中,于4 696×g离心力下4℃离心30 min,收集经浓缩后的培养上清并命名为CM_hUCMSC;同时收集未经任何细胞培养用的浓缩培养基为对照,置于-80℃保存待用。
5. hUC-MSC与Luminal B型乳腺癌细胞的共培养:正常培养的携有GFP和荧光素酶稳定共表达的Luminal B型乳腺癌细胞BT474_GFP-Fluc经胰酶消化后,显微镜下细胞计数,以每孔10 000个细胞的密度接种至24孔板中。待细胞过夜贴壁后,弃去培养基,每孔换700 μl含双抗和0.5%胎牛血清的DMEM/F12培养基;同时胰酶消化正常培养的P4代hUC-MSCs,同样经细胞计数后,将10 000个P4代hUC-MSCs细胞稀释至200 μl含10%胎牛血清的低糖DMEM培养基中,并接种至经100 μl相同培养基预浸润的Transwell小室(0.4 μmol/L规格)上层以行共培养实验,并于共培养72 h后,细胞置于荧光倒置显微镜下直接观察并拍照记录,同时行MTS实验分析hUC-MSCs共培养对Luminal B型乳腺癌细胞生长增殖的影响。
6.细胞生长増殖分析实验:正常培养的人Luminal B型乳腺癌细胞BT474_GFP-Fluc经胰酶消化后,显微镜下细胞计数,以每孔10 000个细胞的密度接种至96孔板中;次日,换含双抗和0.5%胎牛血清的DMEM/F12培养基(100 μl/孔),同时将收集的hUC-MSCs浓缩培养上清CM_hUCMSC以1:10稀释入上述培养基中,常规培养72 h后,行MTS实验分析hUC-MSCs浓缩上清处理对Luminal B型乳腺癌细胞BT474_GFP-Fluc生长增殖的影响。MTS实验简要流程为:弃去细胞培养上清,细胞经生理盐水洗1遍后,将MTS/PMS稀释至含0.5%胎牛血清的DMEM/F12培养基中并加至96孔板中,继续培养箱中温育1 h后,将96孔板置入酶标仪,测490 nm吸光度值。计算细胞存活比率时,取对照组为100%,(实验组490 nm吸光度值/对照组490 nm吸光度值)×100%则为实验组相对于对照组的细胞存活比率。
7. Western blot实验:正常培养的人Luminal B型乳腺癌细胞BT474_GFP-Fluc经胰酶消化后接种至100 mm培养皿,待细胞长至80%左右汇合度时吸去培养基,换含双抗和0.5%胎牛血清的DMEM/ F12培养基(10 ml),同时,将收集的hUC-MSCs浓缩培养上清CM_hUC-MSC以1:10稀释入上述培养基中。细胞培养24 h后,常规法抽提细胞总蛋白并经Bradford法定量,每一样本取30 μg蛋白,加热变性后经SDS-PAGE凝胶电泳分离后转移至PVDF膜;含蛋白的PVDF膜经5%的脱脂牛奶于4℃封闭1 h后,分别加入兔抗人pAkt(Ser473)抗体、兔抗人Akt抗体、兔抗人pMAPK抗体、兔抗人MAPK抗体、兔抗人Cyclin D1抗体、或鼠抗人β-actin抗体(1:1000稀释,终浓度1 μg/ml)于4℃缓慢摇振过夜;收取一抗,5%的脱脂牛奶洗膜3次每次10 min后加入辣根过氧化物酶标记的二抗(1: 5 000稀释于5%的脱脂牛奶中),室温缓慢摇振1.5 h;弃去二抗,1×TBST洗膜3次每次10 min后,再PBS洗膜3次每次10 min,ECL显色,暗室曝光。
8. RT-PCR:依TRIzol法抽提培养细胞的总RNA;取各样本2 μg 总RNA,经逆转录制备cDNA。以β-actin为内参,行常规RT-PCR法分析中NRG-1、NRG-2、IGF-Ⅰ、IGF-Ⅱ和EGF等配体mRNAs在hUC-MSC中的表达情况。各基因RTPCR扩增引物及PCR退火温度见表1,常规PCR扩增体系含:2.5 μl 10×buffer、上下游引物各100 pmol、1.5 μl dNTP(2.5 mmol/L each)、Taq酶1.25 U、cDNA 1 μl,ddH2O补足至25 μl。PCR反应条件,94℃预变性3 min;94℃变性30 s,特定温度退火30 s,72℃延伸30 s的条件下循环30次;最后72℃延伸5 min。PCR产物1.5%琼脂糖凝胶电泳鉴定,凝胶成像仪成像。
三、统计学分析方法
采用SPSS 13.0统计软件进行统计学分析;MTS实验重复3次,每次做3个重复孔,取各次实验的均值± s为最后结果,两组数据比较时以t检验行差异显著性分析;三组数据比较时,先行单因素方差分析,发现有统计学差异后,再行两组比较的dunnt-t检验分析。以P < 0.05为差异具有统计学意义。
结 果
一、GFP和荧光素酶稳定共表达的Luminal B型乳腺癌细胞BT474_GFP-Fluc的建立
人Luminal B型乳腺癌细胞BT474经GFP和荧光素酶共表达慢病毒感染并筛选后,荧光显微镜和IVIS Kinetic成像系统的观察结果分别证实,该细胞已稳定表达GFP(图1)和荧光素酶(图2a),且荧光素酶的相对表达强度与细胞数量呈良好的线性相关(图2b);所建立的细胞命名为BT474_GFPFluc,该细胞适用于后续表型的直观分析,以及未来动物实验中活体水平的示踪。
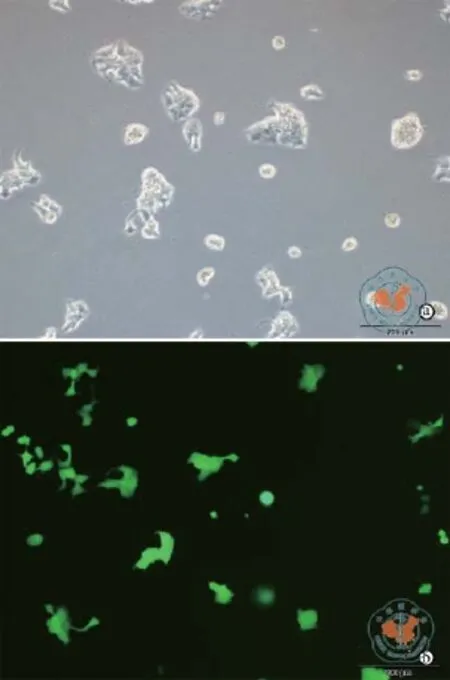
图1 稳定表达绿荧光蛋白和荧光素酶的人Luminal B型乳腺癌细胞BT474_GFP-Fluc的鉴定结果 (× 100)
二、hUC-MSC共培养或浓缩上清处理显著促进Luminal B型乳腺癌细胞的生长增殖
荧光显微镜下直接的观察结果显示,与对照相比,经与hUC-MSC共培养72 h后,BT474_GFPFluc细胞密度明显增加(图3)。MTS结果则进一步表明,与hUC-MSC共培养后BT474_GFP-Fluc的存活比例为无共培养对照组的148.06%,二者间差异经两组数据比较的t检验分析证实具明显的统计学意义(P < 0.005,表2,图4)。同样的MTS分析还发现,单纯浓缩培养基处理或hUC-MSC浓缩上清处理后BT474_GFP-Fluc的存活比例分别为空白处理对照组的101.09%和147.99%(表2,图4);三组数据先行单因素方差分析,发现具明显的统计学差异后(F = 814.51,P < 0.001),再行两组比较的dunnt-t检验分析,结果表明单纯浓缩培养基处理组或hUC-MSC浓缩上清处理组与空白处理对照组比较的95%可信区间分别为(0.013190,0.023663)和(0.212854,0.249713)。上述综合结果表明,hUC-MSC共培养或其浓缩上清处理均可显著促进Luminal B型乳腺癌细胞的生长增殖。

图2 人Luminal B型乳腺癌细胞BT474经绿色荧光蛋白和荧光素酶共表达慢病毒感染并筛选后在IVIS Kinetic成像系统的观察结果

图3 人脐带间充质干细胞共培养对BT474_GFP-Fluc细胞生长增殖的影响
三、hUC-MSC浓缩上清处理对Luminal B型乳腺癌细胞信号转导通路及下游蛋白表达的影响
为初步探讨hUC-MSC共培养或其浓缩上清处理促进Luminal B型乳腺癌细胞生长增殖可能的分子机理,本研究首先通过Western blot法检测了hUC-MSC浓缩上清处理对BT474_GFP-Fluc细胞中与生长增殖调控密切相关的Akt和MAPK两条信号转导通路的影响,结果表明:该两条信号通路同时为hUC-MSCs浓缩上清处理所激活,同时下游靶蛋白Cyclin D1的表达也显著上调(图5)。这些结果提示,MSCs可能通过旁分泌一些生长因子等配体以同时激活Luminal B型乳腺癌细胞下游Akt和MAPK两条信号转导通路,进而诱导下游细胞周期调控蛋白Cyclin D1的表达上调,从而促进其生长增殖。
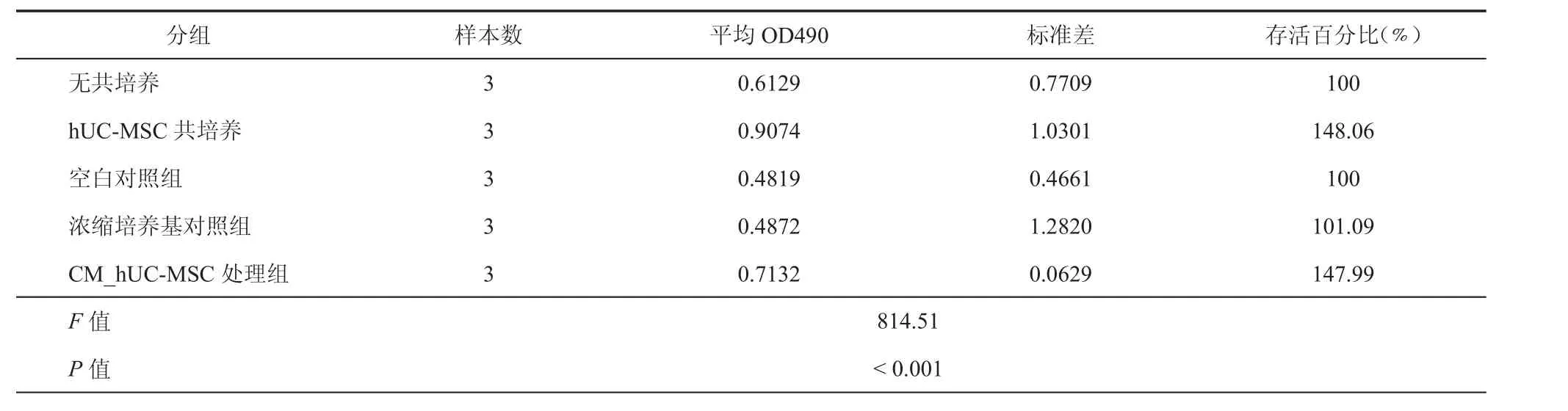
表2 人脐带间充质干细胞共培养或浓缩上清处理对BT474_GFP-Fluc细胞生长增殖影响的MTS实验结果
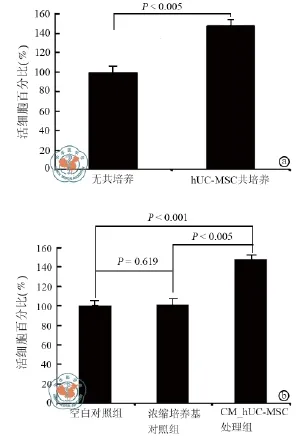
图4 人脐带间充质干细胞共培养(a图)及浓缩上清处理(b图)对Luminal B型乳腺癌细胞生长增殖影响的MTS分析结果
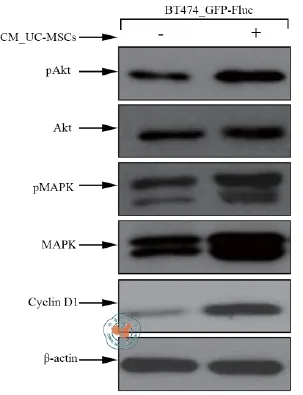
图5 人脐带间充质干细胞浓缩上清处理对Luminal B型乳腺癌细胞信号转导通路激活及Cyclin D1蛋白表达的影响
四、hUC-MSC中NRG-1等配体mRNA水平的表达分析
鉴于MSC中多种生长因子等配体的表达已有诸多文献报道,本研究采用常规RT-PCR以资验证是否上述配体在本实验中所用的hUC-MSC中也有表达。初步的RT-PCR结果显示,NRG-1和EGF的mRNAs在hUC-MSCs中呈高水平表达,而NRG-2、IGF-Ⅰ和IGF-Ⅱ等配体的mRNAs表达也明显可见(图6)。

图6 人脐带间充质干细胞中NRG-1等配体表达的RT-PCR分析结果
讨 论
肿瘤微环境包括巨噬细胞、免疫细胞和其它间质细胞等细胞成份,以及由它们产生并分泌的生长因子、细胞因子、促进血管生成因子等,这些因素协同作用以影响肿瘤的发生发展和转归[12-14]。MSC作为肿瘤微环境中的重要细胞成份,是一种来源于中胚层的多能干细胞;MSCs具有多项分化潜能和高度自我更新能力,并可诱导分化为肌肉细胞、脂肪细胞、骨细胞、软骨细胞和神经细胞等,同时具备良好的组织迁移能力和肿瘤靶向趋附性[15-17]。鉴于肿瘤自身高度的异质性、以及肿瘤发生发展的多因素和多阶段过程,募集至肿瘤微环境中的MSC其生物学功能依肿瘤类型及进展的阶段不同而各异,既有抑制肿瘤发生和发展的报道[8],也有研究证实其具有促进肿瘤恶性进展的作用[9,18-20],其发挥作用方式也有所不同[21-22]。例如,Wang等[21]发现,骨髓来源的MSCs即可通过旁分泌IL-8以促进结直肠癌的血管新生和肿瘤的生长;新近,Xu等[23]研究则表明,低氧诱导的脂肪来源的MSCs可通过旁分泌IL-10以促进伯基特淋巴瘤细胞的生长并增强其肿瘤干细胞特性。此外,已有研究还表明,乳腺癌细胞可通过释放系统信号招募MSCs到肿瘤间质,肿瘤间质中的MSCs则可通过调控乳腺癌细胞的细胞-间质转换(EMT)以促进其侵袭性生长和转移[24-25]。
乳腺癌作为世界范围内女性第一高发肿瘤[1-3],其分子分型已相对清楚[5-6],各亚型乳腺癌的分子发病机理方面的研究也很深入,但MSC在各分子亚型乳腺癌中可能的不同的生物学作用尚未见太多文献报道。为便于直观地观察MSCs对人Luminal B型乳腺癌生长增殖等恶性表型的影响,以及后续动物实验中活体水平的细胞示踪,本研究通过慢病毒载体系统介导,成功地构建了携有GFP和荧光素酶共表达的人Luminal B型乳腺癌细胞BT474_GFPFluc。荧光显微镜下观察的结果也清楚地显示,与hUC-MSC共培养可显著促进BT474_GFP-Fluc细胞的生长增殖,该现象也为进一步的MTS结果所证实;同时,hUC-MSC浓缩培养上清处理后的MTS结果也显示其具有与共培养相似的促BT474_GFPFluc细胞生长增殖的作用。此外,本研究初步的分子机理探讨结果表明,hUC-MSC浓缩培养上清处理可同时激活BT474_GFP-Fluc下游的Akt和MAPK两条信号转导通路,并显著上调Cyclin D1蛋白的表达,hUC-MSC中NRG-1、EGF、NRG-2、IGF-Ⅰ和IGF-Ⅱ等配体的mRNAs的表达也为RTPCR结果所证实。基于本实验结果,笔者认为MSC可能通过表达并旁分泌NRG-1等配体,从而介导细胞表面酪氨酸激酶生长因子受体ErbB2/ErbB3的二聚化以激活Luminal B型乳腺癌细胞BT474的下游Akt和MAPK信号转导通路,进而上调细胞周期调控蛋白Cyclin D1的表达并促进其生长增殖。
基于MSC的细胞治疗作为一种新的治疗手段,迄今已在包括自身免疫性疾病在内的多种疾病中得以广为应用[26-29]。鉴于MSC本身功能的多样性,以及肿瘤多步骤多阶段发生发展过程中多因素参与等复杂性,充分阐明MSC在某一特定肿瘤发生发展的特定阶段所起作用的确切分子机理无疑对规避其促肿瘤发生发展的作用具重要的临床指导意义。本研究以人Luminal B型乳腺癌为模型,在MSC影响肿瘤恶性表型及其分子机理方面作了些初步探讨,这将为下一步MSC在其它分子亚型乳腺癌中可能的作用的研究提供有益的启示。
志谢 感谢实验室王萍在实验数据的统计学分析中给予的建设性意见和热情相助
1 Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
2 Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1):5-29.
3 Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1):7-30.
4 Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
5 Perou CM, Sørlie T, Eisen MB, et al. Molecular portraits of human breast tumours[J]. Nature, 2000, 406(6797):747-752.
6 Kao J, Salari K, Bocanegra M, et al. Molecular profiling of breast cancer cell lines defi nes relevant tumor models and provides a resource for cancer gene discovery[J]. PLoS One, 2009, 4(7):e6146.
7 Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease[J]. Nat Rev Immunol, 2008, 8(9):726-736.
8 Lee RH, Yoon N, Reneau JC, et al. Preactivation of human MSCs with TNF-α enhances tumor-suppressive activity[J]. Cell Stem Cell, 2012,11(6):825-835.
9 Ren G, Zhao X, Wang Y, et al. CCR2-dependent recruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFα[J]. Cell Stem Cell, 2012,11(6):812-824.
10 林凤锦, 王水良, 黄粱浒, 等. 慢病毒载体系统介导hUC-MSC绿荧光蛋白和荧光素酶共表达技术体系的建立[J/CD]. 中华细胞与干细胞杂志:电子版, 2013, 3(3):118-125.
11 林榕, 左伟敏, 祝玲, 等. 人肿瘤坏死因子相关凋亡诱导配体稳定过表达基因工程修饰人脐带间充质干细胞亚细胞系的建立[J/CD]. 中华细胞与干细胞杂志:电子版, 2015, 5(4):12-17.
12 Albini A, Sporn MB. The tumour microenvironment as a target for chemoprevention[J]. Nat Rev Cancer, 2007, 7(2):139-147.
13 Whiteside TL. The tumor microenvironment and its role in promoting tumor growth[J]. Oncogene, 2008, 27(45):5904-5912.
14 Hu M, Polyak K. Molecular characterisation of the tumour microenvironment in breast cancer[J]. Eur J Cancer, 2008, 44(18):2760-2765.
15 Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and biological characterization[J]. Int J Biochem Cell Biol, 2004,36(4):568-584.
16 Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006,8(4):315-317.
17 Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease[J]. Nat Rev Immunol, 2008, 8(9):726-736.
18 De Boeck A, Pauwels P, Hensen K, et al. Bone marrow-derived mesenchymal stem cells promote colorectal cancer progression through paracrine neuregulin 1/HER3 signalling[J]. Gut, 2013, 62(4):550-560.
19 Momeny M, Saunus JM, Marturana F, et al. Heregulin-HER3-HER2 signaling promotes matrix metalloproteinase-dependent blood-brainbarrier transendothelial migration of human breast cancer cell lines[J]. Oncotarget, 2015, 6(6):3932-3946.
20 Jeong H, Kim J, Lee Y, et al. Neuregulin-1 induces cancer stem cell characteristics in breast cancer cell lines[J]. Oncol Rep, 2014,32(3):1218-1224.
21 Wang J, Wang Y, Wang S, et al. Bone marrow-derived mesenchymal stem cell-secreted IL-8 promotes the angiogenesis and growth of colorectal cancer[J]. Oncotarget, 2015, 6(40):42825-42837.
22 Ono M, Kosaka N, Tominaga N, et al. Exosomes from bone marrow mesenchymal stem cells contain a microRNA that promotes dormancy in metastatic breast cancer cells[J]. Sci Signal, 2014, 7(332):ra63.
23 Xu L, Wang X, Wang J, et al. Hypoxia-induced secretion of IL-10 from adipose-derived mesenchymal stem cell promotes growth and cancer stem cell properties of Burkitt lymphoma[J]. Tumour Biol, 2016,37(6):7835-7842.
24 El-Haibi CP, Karnoub AE. Mesenchymal stem cells in the pathogenesis and therapy of breast cancer[J]. J Mammary Gland Biol Neoplasia,2010, 15(4):399-409.
25 Martin FT, Dwyer RM, Kelly J, et al. Potential role of mesenchymal stem cells (MSCs) in the breast tumour microenvironment: stimulation of epithelial to mesenchymal transition(EMT)[J]. Breast Cancer Res Treat, 2010, 124(2):317-326.
26 Wang J, Liao L, Wang S, et al. Cell therapy with autologous mesenchymal stem cells-how the disease process impacts clinical considerations[J]. Cytotherapy, 2013, 15(8):893-904.
27 Ramdasi S, Sarang S, Viswanathan C. Potential of mesenchymal stem cell based application in cancer[J]. Int J Hematol Oncol Stem Cell Res,2015, 9(2):95-103.
28 Hoffman AM, Dow SW. Concise review:stem cell trials using companion animal disease models[J]. Stem Cells, 2016, 34(7):1709-1729.
29 Yan C, Song X, Yu W, et al. Human umbilical cord mesenchymal stem cells delivering sTRAIL home to lung cancer mediated by MCP-1/ CCR2 axis and exhibit antitumor effects[J]. Tumour Biol, 2016,37(6):8425-8435.
(本文编辑:李少婷)
左伟敏,祝玲,林婷婷,等.间充质干细胞促进Luminal B型乳腺癌细胞生长增殖及其分子机理初探[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(4):228-235.
Promotion of proliferation of luminal B breast cancer cells by mesenchymal stem cells and its underlying molecular mechanism
s Zuo Weimin1, Zhu Ling2, Lin Tingting1, Wang Jin2, Lin Rong2,Lei Yan2, Fu Yunfeng2, Lu Jun2, Huang Lianghu2, WangQinghua2, Tan Jianming2, Wang Shuiliang1,2.
Fujian Key Laboratory of Transplant Biology, Fuzhou General Hospital, Xiamen University, Fuzhou 350025, China
Wang Shuiliang, Email:shuiliang.wang@xmu.edu.cn
Objective To investigate the effect of human umbilical cord mesenchymal stem cells (hUC-MSCs) on proliferation of luminal B breast cancer cells and its underlying molecular mechanisms. Methods Human luminal B breast cancer cells BT474 were infected with GFP and luciferase co-expressing lentiviruses and then subjected for selection with Puromycin for 2 weeks. The expression of GFP and luciferase was detected by fluorescent microscopy and IVIS Kineticimage system, respectively. The effect of coculture or treatment with conditioned medium of hUCMSCs on proliferation of BT474 was analyzed with MTS assay. Western blot was carried out to detect the effect of treatment with conditioned medium of hUC-MSCs on the activation of both Akt and MAPK signalings in BT474, as well as the expression of downstream cell cycle regulator Cyclin D1. Regular RT-PCR was applied to analyze the mRNAs expression of ligands such as NRG-1,NRG-2, IGF-I, IGF-II, and EGF in hUC-MSCs. The correlation between relative luciferase activity and cell number was analyzed with Excel software, while MTS assay data was statistically analyzed with SPSS 13.0 software. Results The co-expression of GFP and luciferase in BT474 via lentiviral expression system was visualized by fluorescent microscopy and IVIS Kinetic image system. The linear correlation between relative luciferase activity and cell number was determined by curve fitting analysis. Coculture or treatment with conditioned medium of hUC-MSC significantly promoted the proliferation of BT474, with survival rates being 148.06%(P < 0.005)and 147.99%(P < 0.001)of control, respectively. In addition, treatment with conditioned medium of hUC-MSC was shown to induce activation of both Akt and MAPK signalings, which further upregulated the expression of Cyclin D1. Moreover, high mRNAs expression levels of both NRG-1 and EGF, as well as moderate mRNAs expression levels NRG-2, IGF-I, and IGF-II were showed by RT-PCR. Conclusion Our results here demonstrated that MSCs may promote the proliferation of luminal B breast cancer cells through paracrine of ligands such as NRG-1, which in turn results in the activation of both Akt and MAPK signalings and upregulation of the expression of Cyclin D1.
作者单位:361005 厦门大学医学院1;350025福州,南京军区福州总医院福建省移植生物学重点实验室2
前两位作者对本文有同等贡献,均为第一作者
Mesenchymal stem cells; Breast Neoplasms; Cell Proliferation
10.3877/cma.j.issn.2095-1221.2016.04.006
国家自然科学基金面上项目(81272922);福建省自然科学基金面上项目(2016J01577);福州总医院院内课题国际合作研究专项(2015G01)
王水良,Email: shuiliang.wang@xmu.edu.cn
(2016-05-23)

