人脐带间充质干细胞来源的微囊泡提取和鉴定
姚嘉唐晖郑俊张琪杨扬张英才
人脐带间充质干细胞来源的微囊泡提取和鉴定
姚嘉1唐晖1郑俊1张琪2杨扬1张英才1
目的 研究分离和提纯人脐带间充质干细胞来源的微囊泡(hUC-MSCs-MVs)并分析其理化性质。方法 (1)运用Ⅰ型胶原酶联合透明质酸酶消化Wharton's Jelly组织的方法,分离和扩增人脐带间充质干细胞(hUC-MSCs);(2)实验组:用“饥饿法”处理hUC-MSCs,分离和提纯hUC-MSCs-MVs;对照组:用未经“饥饿法”处理的hUC-MSCs来尝试提取hUCMSCs-MVs;(3)验证hUC-MSCs-MVs的理化性质和生物学特性。结果 (1)分离出的hUCMSCs状态良好,扩增后的子代hUC-MSCs数量及状态满足后续实验的要求。流式细胞术结果显示hUC-MSCs-MVs高表达CD44、CD29和CD73,而低表达α-6 integrin(CD49f)和HLA-classⅡ(HLA-DR)。(2)实验组成功分离和提纯了hUC-MSCs-MVs,而对照组未见确切hUCMSCs-MVs产生;扫描电镜观察到hUC-MSCs-MVs的囊泡样结构,直径几十到几百nm不等,均在1 μm以下;透射电镜观察到hUC-MSCs-MVs的产生和胞吐作用;蛋白定量结果为1337.1 μg/ml;流式细胞术结果显示其大小绝大部分在1 μm以下,并能高表达CD44和CD29,而低表达CD73、α-6 integrin(CD49f)和HLA-classⅡ(HLA-DR)等表面分子。结论 用“饥饿法”处理hUC-MSCs可成功获得hUC-MSCs-MVs。
脐带; 间质干细胞; 微囊泡
迄今为止,多项研究表明间充质干细胞(mesenchymal stem cells,MSCs)在多种条件刺激下可释放大量的微囊泡(microvesciles,MVs),这些MVs含有与母细胞相似的脂类、蛋白质、mRNA、miRNA以及胞质中部分细胞器等内容物[1]。近期研究发现,MSCs来源的MVs(mesenchymal stem cells derived MVs,MSCs-MVs)与MSCs具有相似的功能,不仅能促进缺血处组织血管的新生[2]、减轻肾脏和心脏的缺血再灌注损伤(ischemia-reperfusion injury,IRI),还能促进相关脏器IRI后功能和组织形态的恢复[3-5]。由于MVs没有类似MSCs的细胞自生能力,更具安全性和更易于产业化生产,因此MVs有望成为一种比MSCs更安全、更方便的减轻脏器IRI、修复组织损伤、促进组织再生的方法。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)因无创、更广泛的来源等优点越来越受科研工作者们的青睐[6],相信从hUC-MSCs中可以提取出足够多的人脐带间充质干细胞来源的微囊泡(human umbilical cord mesenchymal stem cells-derived microvesicles,hUCMSCs-MVs)来用于相关研究。本实验拟用“饥饿法”提取hUC-MSCs-MVs,以期分离和提纯出大量hUC-MSCs-MVs,并分析其理化性质,将结果与已发表的相关文献研究结果相比较,总结出异同点,以满足后续相关动物实验的需求。
材料与方法
一、材料
1.主要设备仪器:环境扫描电子显微镜(Fei quanta 200,美国FEI公司),透射电子显微镜(Tecnai g2 spirit twin,美国FEI公司),超速离心机(Optima L-90K,美国Beckman公司),钛合金定角钻子(TYPE 70.1 Ti,美国Beckman公司),指封管(16× 60 mm 8.9 ml,美国Beckman公司),流式细胞仪(Calibar,美国BD公司)等。
2.主要的试剂和材料:磷酸缓冲液(pH7.4)(particle-free)(美国Invitrogen公司),DMEM Basic培养基(美国Invitrogen公司),胎牛血清(FBS)(美国Invitrogen公司),RPMI 1640 Basic培养基(美国Invitrogen公司),牛血清白蛋白(BSA)(美国Invitrogen公司),Medium-199(含HEPES 25 mmol/L)(美国Invitrogen公司),胰蛋白酶(美国Invitrogen公司),L-谷氨酰胺(美国Invitrogen公司),二甲基亚砜(美国Sigma公司),Ⅰ型胶原酶(美国Invitrogen公司),透明质酸酶(美国Sigma公司),CD44-PE(美国BD PharmingenTM公司),CD29-PE(美国BD PharmingenTM公司),CD73-PE(美国BD PharmingenTM公司),HLA-classⅡ(HLA-DR DP DQ)-PE(美国BD PharmingenTM公司),6-integrin(CD49f)-PE(美国BD PharmingenTM公司),FACS Beads(美国BD PharmingenTM公司)等。
3.实验用脐带:脐带来自在中山大学附属第三医院行剖宫产术的足月妊娠产妇,签署内容包含“自愿将脐带等分娩废弃物交由医院处理或供科研所用”的知情同意书,术前予艾滋病病毒抗体、乙肝两对半、丙型肝炎病毒抗体、梅毒螺旋体抗体、支原体等检测筛查,筛选出可供实验用的脐带。
二、方法
(一)hUC-MSCs的培养和鉴定
1.原代hUC-MSCs的分离和培养:预处理一段长约30 cm的新鲜脐带,PBS洗涤2 ~ 3次后并浸泡30 min后剪碎成大小均匀的小块,在室温、300×g条件下离心5 min,弃去上清液后往装有沉淀的离心管中加入少量Ⅰ型胶原酶(10×)和透明质酸酶(10×)(工作浓度为0.1%),并加入CaCl2(100×,工作浓度为3 mmol/L),充分混匀后置于恒温振荡器在37℃、200 r/min条件下消化4 ~ 5 h,将消化好的悬液用PBS稀释后用100目滤网负压抽滤,收集的滤液置入离心管于室温、300×g条件下离心5 min,重悬细胞及组织碎屑于含10%FBS的DMEM Basic培养基,均匀接种于T25培养瓶,置于培养箱(37℃、5%CO2、饱和湿度)培养;培养3 d后观察细胞形态并更换培养基,并移除未贴壁细胞。此后,用含10%FBS的DMEM Basic培养基每4 d换液1次。
2.原代hUC-MSCs的扩增:原代hUC-MSCs持续培养12 ~ 16 d后,用0.25%Trypsin-EDTA消化下原代细胞,重悬后,根据培养瓶底的细胞覆盖情况,以1:3到1:5分瓶传代,每瓶加入含10%FBS的DMEM Basic培养基12 ~ 15 ml;根据观察到的细胞生长状态,每2 ~ 3 d全量换液1次。
3. hUC-MSCs的冻存和复苏:为保证hUCMSCs的细胞量足够多,可以考虑将部分细胞冻存。用10%DMSO + 90%FBS的冻存液对hUC-MSCs按约(1 ~ 2)×106/ml的细胞密度分装入冻存管,每管1 ml,分装好的冻存管放入4℃预冷的程序冻存盒,置-80℃冰箱过夜,次日转入液氮罐长期保存;取出时可在37℃恒温水浴锅中复温后离心、重悬细胞继续培养。
4. hUC-MSCs的细胞表型流式细胞术鉴定:取细胞数量达(1 ~ 2)×106个细胞/瓶的P3 ~ 5代hUC-MSCs数瓶按前述方法消化、离心后用适量PBS重悬;用PBS调整细胞数量至适当浓度,分取单细胞悬液至FACS专用管,每管约1×106个细胞,所得细胞用PBS 100 μl重悬,加入1 μl(0.5 mg/ml)PE标记的CD44、CD29、CD73、6-integrin(CD49f)和HLA-class Ⅱ(HLA-DR)等抗体,设空白对照,4℃条件下避光孵育30 min,孵育后用PBS 2 ml洗去多余抗体,再次离心后弃去上清液;用PBS 400 μl重悬沉淀后用流式细胞仪检测,所得结果用Cell Quest软件分析。
(二)hUC-MSCs-MVs的提取和特性分析
1. hUC-MSCs-MVs的分离和提纯:实验组:以经原代扩增后稳定传代的P3 ~ 5代状态良好贴壁培养的hUC-MSCs,细胞计数约为(1 ~ 2)×106个细胞/瓶,用“饥饿法”即使用仅含有0.5%BSA的RMPI 1640 Basic培养基12 ~ 15 ml培养24 h,后在2 000×g、4℃的条件下高速离心20 min,收集的上清液经100 000×g、4℃的条件下离心1 h,弃去上清液,再用含有HEPES 25 mmol/L的Medium-199培养基重悬沉淀,再次在100 000×g、4℃的条件下离心1 h后用PBS(particle-free,pH7.4)100 μl重悬沉淀,保存于-80℃冰箱内备用。对照组:将未经“饥饿法”处理的同代数、同细胞数的hUC-MSCs上清液按上述步骤处理,观察有无沉淀。
2. hUC-MSCs-MVs的特性分析:扫描电镜下观察hUC-MSCs-MVs形态,透射电镜下观察hUCMSCs内的hUC-MSCs-MVs,hUC-MSCs对hUCMSCs-MVs的胞吐作用及其亚结构;并用BCA蛋白浓度测定试剂盒的酶标板法(BCA protein assay kit test)测定hUC-MSCs-MVs的蛋白含量;提纯后的hUC-MSCs-MVs用PBS重悬,加样至FACS专用管,每管100 μl样本,加入适量的1,2,4,6 μm微珠作为大小标记,加入1 μl(0.5mg/ml)PE标记的CD44、CD29、CD73、6-integrin(CD49f)和HLA-class Ⅱ(HLA-DR)等抗体,设空白对照,在4℃避光孵育30 min,无需洗去多余抗体,流式细胞仪背景用去离子水冲洗15 min后开始检测样本,所得结果用Cell Quest软件分析。
结 果
一、hUC-MSCs的培养和鉴定
1.原代hUC-MSCs接种于T25培养瓶内24 h后即可在倒置相差显微镜下观察到已有少量纺锤形和多角形细胞贴壁,细胞核清晰可见;定期换液、培养至第7天显微镜下观察可见细胞数量开始增多,绝大多数细胞形态转变为长而扁平的梭形,表现为成纤维细胞的典型形态。继续培养至第12天显微镜下观察可见细胞间汇合已达90%左右,细胞极性排列,细胞集落呈典型的漩涡状(图1a)。细胞培养传代至第3代(P3)以后,从P3开始,其细胞形态逐渐转变为形态相对均一的长梭形(图1b)。
2.第3代hUC-MSCs表面分子流式细胞术检测结果发现:其能高表达CD44、CD29和CD73,而低表达6-integrin(CD49f)和HLA-class Ⅱ(HLADR)(图2)。
二、hUC-MSCs-MVs的提取和特性分析
(一)hUC-MSCs-MVs的分离和提纯
1.经过含0.5%BSA的RMPI 1640 Basic培养基培养24 h后的细胞做台盼蓝拒染实验,发现细胞存活率超过99%,符合进一步实验要求[3]。
2.实验组经超速离心后可在位于固定角度转子内最低点的指封管壁上见到明显沉淀贴壁,“饥饿法”同样适用于hUC-MSCs-MVs的提取,纯化后的hUC-MSCs-MVs用PBS(particle-free,pH7.4)重悬移入EP管中保存于-80℃冰箱中[7],贮存足量的hUC-MSCs-MVs为后续实验做准备,而对照组未见任何沉淀贴壁。

图1 光学显微镜下观察 huc-MSCs形态 (×200)

图2 流式细胞仪检测第3代huc-MSCs细胞表型
(二)hUC-MSCs-MVs的特性分析
1.在扫描电镜下的hUC-MSCs-MVs呈现为单个或聚集成团的膜性囊泡样结构(图3a、b),直径大小从几十纳米到几百纳米不等,单个囊泡直径均小于1 μm。
2.在透射电镜下可见hUC-MSCs的亚结构和标本中hUC-MSCs-MVs的形成、释放和胞吐作用(图3c)。
3. BCA蛋白浓度测定试剂盒酶标板法结果提示所测hUC-MSCs-MVs样本蛋白含量平均值高达1337.1 μg/ml。
4. 流式细胞术检测发现hUC-MSCs-MVs的直径大小多聚集在1 μm微珠基准线下(图4);hUCMSCs-MVs能高表达CD44和CD29,而低表达CD73、α-6 integrin(CD49f)和HLA-class Ⅱ(HLADR)(图5),与hUC-MSCs相似。
讨 论
MSCs-MVs在组织损伤的修复和再生中的促进作用主要通过传递其含有的来源自MSCs的蛋白质、脂质、mRNA、miRNA等物质并介导旁分泌通路,使损伤组织中尚存活的细胞重新进入细胞周期,同时能通过与受损细胞释放的MVs的遗传物质的双向性交换获得组织特异性,进一步修复受损组织。多项研究结果表明,MSCs-MVs在用药物毒性诱导[8-13]、基因敲除[14]、感染[15]、抗体性肾小球肾炎[16]、单侧肾脏切除[3,17]、IRI[18-24]等方法建立的急、慢性肾损伤动物模型中,能有效地促进肾脏及相关受损组织修复和再生,从而缓解急、慢性肾损伤。同样地,在另一些研究的运用药物毒性诱导[25-27]、部分肝切除[24,28]、小肝移植[29]等方法建立的急、慢性肝损伤动物模型中,MSCs-MVs对受损的肝组织的修复和再生作用也得到了证实,为近年来研究热点之一。而基于各种MSCs来源的MVs在基础和临床上的治疗应用研究也逐渐走进更广阔的领域,包含越来越多的内容,如针对真菌所致过敏性气道反应[30]、重症肺炎[31]、其他肺部疾病[32]以及多种MSCs-MVs在临床上的应用展望[33]等。

图3 扫描电镜下的huc-MSCs-MVs以及透射电镜下观察到的huc-MSCs和huc-MSCs-MVs 环境
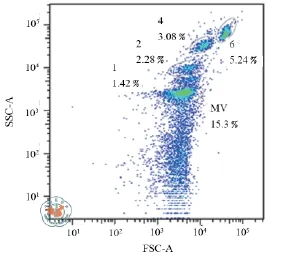
图4 流式细胞术检测发现huc-MSCs-MVs的直径大小
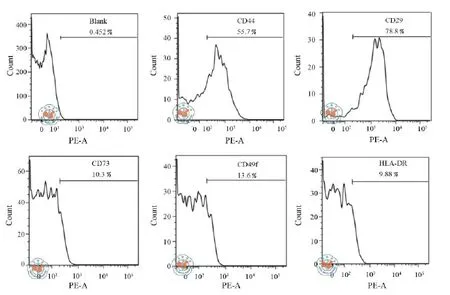
图5 流式细胞仪分析huc-MSCs-MVs
MSCs-MVs的产量直接受其来源的MSCs的产量影响,因此,想获得足够的MSCs-MVs,首先应考虑的是MSCs的来源问题。尽管骨髓来源的MSCs最早被人们发现,但就MSCs在人体的临床应用的现状来看,因为法规、伦理、道德等方面的多重限制,现阶段只能将从人体组织分离后增殖的MSCs应用于临床,即从人到人。而人骨髓来源的MSCs因其取材的有创性、配型困难、数量较少和子代增殖活性衰减快等缺点显然不能满足大规模应用于临床的需要。所以近年来人们一直试图寻找其他来源的MSCs代替之。迄今为止,越来越多的研究结果表明,hUC-MSCs是人骨髓来源的MSCs的最理想替代物[6]。
hUC-MSCs不但具有类似于人骨髓来源MSCs的趋化迁移、组织修复、免疫调节等诸多生物特性,还兼具免疫原性低和能特异性表达多种胚胎干细胞的分子标志的特点,而且来源更丰富,增殖能力更强,多次传代后子代生物性状仍较稳定,尤其是它的来源不受法律、伦理和道德等方面的限制[6]。hUC-MSCs在体外培养皿中培养时更可迅速贴壁、大量而有效地增殖[6],为实验和临床上的应用提供了充足而稳定的来源,同样地,也有利于稳定地获得大量的hUC-MSCs-MVs。
迄今为止,围绕MVs特别是MSCs-MVs的研究越来越多,但均趋向于应用在一定数量的较小动物模型(正常小鼠、基因敲除小鼠、裸鼠等)中[3],主要是因为在保证足够浓度的情况下,MVs难以大量提纯。每次提纯的MVs的数量直接受MSCs的数量影响。因此,为了贮存足够的hUC-MSCs-MVs应用于后续实验,如何建立稳定的、能大量提供细胞的hUC-MSCs培养链是其先决条件。
本实验成功地从人脐带中分离出了原代hUCMSCs,分离时操作更简单、容易,且不易污染,MSCs的纯度也明显优于易混杂淋巴细胞等其他细胞的骨髓来源的MSCs;并加以扩增,在无需加入人碱性成纤维细胞生长因子(bFGF)的条件下即可保证传代至第7代的细胞仍具有良好的形态和增殖能力,不会随着传代次数的增加过早地出现细胞形态的改变、有效增殖能力的衰退等现象;hUCMSCs丰富的来源和旺盛的增殖能力也使得在不影响供应临床和科研使用的前提下批量冻存不同代的细胞成为可能,保证了hUC-MVs的产量,同时丰富了hUC-MSCs传代的阶梯性,以便应用于各代细胞间的异同性研究;同时,验证了“饥饿法”提取MVs的方法同样适用于hUC-MSCs,可以大量产生和提纯hUC-MSCs-MVs,而未经处理的hUCMSCs则难以获得hUC-MSCs-MVs。用流式细胞术分析了hUC-MSCs的表面分子特性,证实了其能高表达某些间质细胞标志、干细胞标志和黏附分子受体标志,而低表达某些内皮细胞标志、造血系标志和人白细胞抗原标志物,但又与相关文献骨髓来源的间充质干细胞有些许差异[6],比如间质细胞标记CD73的较低表达,可能原因将在本研究后续实验以及对相关机制的研究中逐渐阐明。成功而又成熟的hUC-MSCs-MVs的培养扩增技术为hUCMSCs-MVs的大量提取提供了坚实基础,分离和纯化hUC-MSCs-MVs所用的方法已被多项研究证明是成功可行的;除了直接观察,充分利用扫描电镜、透射电镜、流式细胞术等方法,分析提取出的hUCMSCs-MVs所具大小、结构、生物特性,所得到的结果与多项研究的结果相似[3,7,34]。
综上所述,本实验成功建立了稳定的hUCMSCs和hUC-MSCs-MVs供应链,并初步分析并验证了一些他们所具特性,保证了相关动物实验研究的可行性。
1 Schorey JS, Bhatnagar S. Exosome function:from tumor immunology to pathogen biology[J]. Traffi c, 2008, 9(6):871-881.
2 Sahoo S, Klychko E, Thorne T, et al. Exosomes from human CD34(+)stem cells mediate their proangiogenic paracrine activity[J]. Circ Res,2011, 109(7):U35-724.
3 Bruno S, Grange C, Deregibus MC, et al. Mesenchymal stem Cell-Derived microvesicles protect against acute tubular injury[J]. J Am Soc Nephrol, 2009, 20(5):1053-1067.
4 Lai RC, Arslan F, Lee MM, et al. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury[J]. Stem Cell Res, 2010,4(3):214-222.
5 Gatti S, Bruno S, Deregibus MC, et al. Microvesicles derived from human adult mesenchymal stem cells protect against ischaemiareperfusion-induced acute and chronic kidney injury[J]. Nephrol Dial Transplant, 2011, 26(5):1474-1483.
6 Mundra V, Gerling IC, Mahato RI. Mesenchymal stem cell-based therapy[J]. Mol Pharm, 2013, 10(1):77-89.
7 Collino F, Deregibus MC, Bruno S, et al. Microvesicles derived from adult human bone marrow and tissue specifi c mesenchymal stem cells shuttle selected pattern of miRNAs[J]. PLoS One, 2010, 5(7):e11803.
8 Morigi M, Imberti B, Zoja C, et al. Mesenchymal stem cells are renotropic, helping to repair the kidney and improve function in acute renal failure[J]. J Am Soc Nephrol, 2004, 15(7):1794-1804.
9 Herrera MB, Bussolati B, Bruno S, et al. Mesenchymal stem cells contribute to the renal repair of acute tubular epithelial injury[J]. Int J Mol Med, 2004, 14(6):1035-1041.
10 Imberti B, Morigi M, Tomasoni S, et al. Insulin-like growth factor-1 sustains stem cell-mediated renal repair[J]. J Am Soc Nephrol, 2007,18(11):2921-2928.
11 Bi BY, Schmitt R, Israilova M, et al. Stromal cells protect against acute tubular injury via an endocrine effect[J]. J Am Soc Nephrol, 2007,18(9):2486-2496.
12 Semedo P, Wang PM, Andreucci TH, et al. Mesenchymal stem cells ameliorate tissue damages triggered by renal ischemia and reperfusion injury[J]. Transplant Proc, 2007, 39(2):421-423.
13 Choi S, Park M, Kim J, et al. The role of mesenchymal stem cells in the functional improvement of chronic renal failure[J]. Stem Cells Dev,2009, 18(3):521-529.
14 Ninichuk V, Gross O, Segerer S, et al. Multipotent mesenchymal stem cells reduce interstitial fi brosis but do not delay progression of chronic kidney disease in collagen4A3-deficient mice[J]. Kidney Int, 2006,70(1):121-129.
15 Morigi M, Introna M, Imberti B, et al. Human bone marrow mesenchymal stem cells accelerate recovery of acute renal injury and prolong survival in mice[J]. Stem Cells, 2008, 26(8):2075-2082.
16 Kunter U, Rong S, Boor P, et al. Mesenchymal stem cells prevent progressive experimental renal failure but maldifferentiate into glomerular adipocytes[J]. J Am Soc Nephrol, 2007, 18(6):1754-1764.
17 Toegel F, Cohen A, Zhang P, et al. Autologous and allogeneic marrow stromal cells are safe and effective for the treatment of acute kidney injury[J]. Stem Cells Dev, 2009, 18(3):475-485.
18 Herrera MB, Bussolati B, Bruno S, et al. Exogenous mesenchymal stem cells localize to the kidney by means of CD44 following acute tubular injury[J]. Kidney Int, 2007, 72(4):430-441.
19 Duffi eld JS, Park KM, Hsiao LL, et al. Restoration of tubular epithelial cells during repair of the postischemic kidney occurs independently of bone marrow-derived stem cells[J]. J Clin Invest, 2005,115(7):1743-1755.
20 Togel F, Weiss K, Yang Y, et al. Vasculotropic, paracrine actions of infused mesenchymal stem cells are important to the recovery from acute kidney injury[J]. Am J Physiol Renal Physiol, 2007, 292(5):F1626-F1635.
21 Lange C, Togel F, Ittrich H, et al. Administered mesenchymal stem cells enhance recovery from ischemia/reperfusion-induced acute renal failure in rats[J]. Kidney Int, 2005, 68(4):1613-1617.
22 Tögel F, Hu Z, Weiss K, et al. Administered mesenchymal stem cells protect against ischemic acute renal failure through differentiationindependent mechanisms[J]. Am J Physiol Renal Physiol, 2005, 289(1):F31-F42.
23 Németh K, Leelahavanichkul A, Yuen PS, et al. Bone marrow stromal cells attenuate sepsis via prostaglandin E(2)-dependent reprogramming of host macrophages to increase their interleukin-10 production[J]. Nat Med, 2009, 15(1):42-49.
24 Semedo P, Correa-Costa M, Cenedeze MA, et al. Mesenchymal stem cells attenuate renal fibrosis through immune modulation and remodeling properties in a rat remnant kidney model[J]. Stem Cells,2009, 27(12):3063-3073.
25 Zhang D, Jiang M, Miao D. Transplanted human amniotic membranederived mesenchymal stem cells ameliorate Carbon tetrachlorideinduced liver cirrhosis in mouse[J]. PLoS One, 2011, 6(2):e16789.
26 Mark AL, Sun Z, Warren DS, et al. Stem cell mobilization is Life saving in an animal model of acute liver failure[J]. Ann Surg, 2010,252(4):591-596.
27 Wang JB, Zhou XM, Cui LA, et al. The significance of CD14(+)monocytes in peripheral blood stem cells for the treatment of rat liver cirrhosis[J]. Cytotherapy, 2010, 12(8):1022-1034.
28 Herrera MB, Fonsato V, Gatti S, et al. Human liver stem cell-derived microvesicles accelerate hepatic regeneration in hepatectomized rats[J]. J Cell Mol Med, 2010, 14(6B):1605-1618.
29 Yu YE, Lu L, Qian XF, et al. Antifi brotic effect of hepatocyte growth Factor-Expressing mesenchymal stem cells in Small-for-Size liver transplant rats[J]. Stem Cells Dev, 2010, 19(6):903-914.
30 Cruz FF, Borg ZD, Goodwin MA, et al. Systemic administration of human bone Marrow-Derived mesenchymal stromal cell extracellular vesicles ameliorates aspergillus hyphal Extract-Induced allergic airway inflammation in immunocompetent mice[J]. Stem Cells Transl Med,2015, 4(11):1302-1316.
31 Monsel A, Zhu YG, Gennai S, et al. Therapeutic effects of human mesenchymal stem cell-derived microvesicles in severe pneumonia in mice[J]. Am J Respir Crit Care Med, 2015, 192(3):324-336.
32 Chen J, Li CH, Chen LA. The role of microvesicles derived from mesenchymal stem cells in lung diseases[J]. Biomed Res Int,2015:985814.
33 Rani S, Ryan AE, Griffi n MD, et al. Mesenchymal stem cell-derived extracellular vesicles:toward cell-free therapeutic applications[J]. Mol Ther, 2015, 23(5):812-823.
34 Deregibus MC, Cantaluppi V, Calogero R, et al. Endothelial progenitor cell derived microvesicles activate an angiogenic program in endothelial cells by a horizontal transfer of mRNA[J]. Blood, 2007,110(7):2440-2448.
(本文编辑:蔡晓珍)
姚嘉,唐晖,郑俊,等. 人脐带间充质干细胞来源的微囊泡提取和鉴定[J/CD].中华细胞与干细胞杂志:电子版, 2016,6(4):221-227.
Isolation and identification of human umbilical cord mesenchymal stem cells-derived
microvesic le s Yao Jia1, Tang Hui1, Zheng Jun1, Zhang Qi2, Yang Yang1, Zhang Yingcai1.1
Liver Transplant Center of the Third Affiliated Hospital of Sun Yat-sen University, Organ Transplantation Research Center of Guangdong Province, Guangzhou 510630, China;2Biotherapy Centre of the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Zhang Yingcai, Email: 76207884@qq.com
Objective The purpose of this present study was to isolate, purify human umbilical cord mesenchymal stem cells (hUC-MSCs) derived microvesicles (hUC-MSCs-MVs), and to analyze the physicochemical properties and biological characteristics of them. Methods (1)HUC-MSCs were isolated by the Wharton's Jelly by typeⅠcollagenase combined with hyaluronidase digestion, and then they were further cultured in DMEM medium containing 10% FBS. (2)Experimental group: hUC-MSCs-MVs were isolated and purified from hUC-MSCs that were processed with“starvation method”. Control group: normal supernatant of hUC-MSCs were processed to isolate and purify hUC-MSCs-MVs. (3)The physicochemical properties and biological characteristics of hUC-MSCs-MVs were verified by flow cytometry (FCM) and electron microscope. Results (1)FCM showed hUC-MSCs expressed CD44, CD29 and CD73. Expression of α-6 integrin(CD49f) and HLA-classⅡ(HLA-DR) was low. (2)The isolation and purification of hUC-MSCs-MVs were successful in the experimental group, while no hUC-MSCs-MVs were isolated in thecontrol group. The sizes of hUC-MSCs-MVs measured by SEM were generally below 1 μm, and the formation and exocytosis of hUC-MSCs-MVs were observed in hUC-MSCs by TEM. The protein concentration of hUC-MSCs-MVs was about 1337.1 μg/ml. The results of the FCM showed that the diameter of hUC-MSCs-MVs were generally below 1 μm, with high expression of CD44 and CD29 but low expression of CD73, α-6 integrin (CD49f) and HLA-class II(HLA-DR). Conclusions The hUC-MSC-MVs can be successfully isolated and purified from hUC-MSCs by the“starvation method”.
作者单位:510630广州,中山大学附属第三医院肝脏移植中心 中山大学器官移植研究所1;细胞生物治疗中心2
Umbilical cord; Mesenchymal stems cells; Microvesicles
10.3877/cma.j.issn.2095-1221.2016.04.005
国家自然科学基金(81300365、81370555、81370575、81570593);广东省自然科学基金研究团队项目(2015A030312013);广东省科技计划项目(2015B020226004);广州市科技计划项目-健康医疗协同创新重大专项(158100076)
张英才,Email:76207884@qq.com
(2016-05-23)

