间充质干细胞对肿瘤血管生成的影响
韩昌敏 张雷 吴启龙 李宝平
间充质干细胞对肿瘤血管生成的影响
韩昌敏 张雷 吴启龙 李宝平
间充质干细胞(MSC)是一类具有自我更新、多向分化潜能和损伤趋化的多能干细胞。在一定诱导条件下MSC可以分化为骨、软骨、肌肉和血管内皮等组织,常将其应用于组织修复和心肌缺血等其他缺血性疾病的实验研究及临床应用中。由于MSC具有向肿瘤间质的“损伤趋化性”,在过去的十几年,将其作为携带治疗基因的合适载体用于肿瘤治疗研究。而进一步研究发现趋化至肿瘤间质的MSC与肿瘤微环境相互作用可分化为血管内皮、血管周细胞等,或者通过旁分泌等各种机制对肿瘤血管生成产生影响。但是在不同的肿瘤模型中,MSC对肿瘤血管生成的影响存在争议,这篇综述旨在探讨影响实验结果的相关因素,综合分析认为:MSC可以促进肿瘤血管结构和功能的完整性,修复肿瘤血管,这在针对肿瘤血管生成治疗尤其是联合其他治疗方法来治疗肿瘤显示出很大潜力。
间质干细胞; 肿瘤; 血管生成
肿瘤内持续异常血管生成是肿瘤的十大特征之一,1972年Folkman[1]提出“抗血管生成治疗”的观点,抗血管生成治疗在肿瘤治疗中发挥着举足轻重的作用,从恩度、沙利度胺、贝伐单抗到甲磺酸阿帕替尼等抗血管生成治疗,研究者们试图通过阻断肿瘤血管“饿死”肿瘤,然而血管生成拟态[2]、马赛克血管[3]等缺氧状态下的异常血管出现,说明“抗血管生成治疗”并不如理论中效果那样好。2014年Jain[4]提出治疗肿瘤的一个新的策略:使肿瘤血管正常化,改善肿瘤内部缺氧,增加肿瘤血流灌注,有利于抗肿瘤药物进入到肿瘤组织内,发挥杀肿瘤作用。人们不断探索新的方法使肿瘤血管“正常化”,使肿瘤微环境达到稳态。研究发现间充质干细胞(mesenchymal stem cells,MSC)可以趋化至缺血受损组织内,向血管内皮细胞方向分化,促进缺血部位的血管生成,而MSC同样可以归巢至不可愈合的创伤组织-肿瘤中,分化为周细胞[5]、血管内皮细胞,或通过其他机制对肿瘤的生长及血管生成产生影响,这为肿瘤的治疗提供了新方向,目前对于这方面的研究内容繁杂丰富,本文旨在探讨间MSC对肿瘤血管的影响,从而为以后的研究以及临床肿瘤的治疗提供理论指导。
一、MSC的性质
(一)MSC血管分化特性
MSC是存在于骨髓、脐带、胎盘和脂肪等组织中一类干细胞,有自我更新和多向分化潜能。其在不同条件下可以分化为不同组织,目前研究发现MSC可以分化为骨、软骨和肌肉等组织,同时在体内外实验中发现其可以分化为血管内皮细胞。Oswald等[6]在体外实验中,用2%胎牛血清和50 ng/ml的血管内皮生长因子培养骨髓MSC,发现其可以向血管内皮细胞分化。而其向血管内皮细胞分化的能力被用于心肌缺血等缺血性疾病的模型研究中以及临床试验中。鼠心肌缺血疾病动物模型中,MSC分化为内皮细胞,促进缺血部位新生血管形成,改善左室结构和功能,局部区域的血流灌注和收缩增加[7]。MSC在临床应用中也获得同样的结果。一项随机双盲多中心临床试验中,204例急性心肌缺血患者在冠脉再灌注治疗后冠脉内给予自体骨髓MSC,实验组累计死亡终点、心衰进展、心肌缺血再发生等较安慰剂组明显降低[8]。Kim等[9]在血栓闭塞性脉管炎患者体内移植入HLA相合脐带来源的MSC,患者缺血性溃疡在4周内治愈,为进一步研究MSC作用的机理,研究者在缺血模型小鼠的肢体缺血部位局部输入MSC后,在缺血肢体的动脉管壁内发现标记的MSC及新生血管,这说明趋化至损伤缺血部位的MSC参与到新生血管的组成中,促进血管修复。李宝平等[10]研究MSC移植对实验性肺气肿大鼠动脉血气和组织病理的影响中发现“肺毛细血管的减少,导致通气血流比失调,可能是肺气肿主要的发病机制之一”,而“骨髓MSC可以使肺气肿病变组织血管正常化”,从而逆转肺气肿的病理改变。因而提出设想:MSC可以修复肿瘤血管,使肿瘤血管“正常化”,增加肿瘤血流灌注,改善缺血缺氧高间质压的肿瘤微环境,可以促使治疗药物到达肿瘤内发挥治疗作用。
作者单位:030001 太原,山西医科大学第二医院肿瘤生物治疗科
(二)MSC的肿瘤趋向性
MSC可以趋化迁移至缺血损伤部位,在缺血缺氧部位促进新生血管形成,实体肿瘤微环境与器官损伤处的微环境有许多相似之处,肿瘤被认为是“不可愈合的创伤”[11],在肿瘤组织释放的趋化因子、细胞因子以及黏附分子等炎症因子的作用下,MSC同样可以归巢至肿瘤间质这一缺血缺氧部位产生作用。Kidd等[12]将鼠的皮肤穿刺伤模型和MDAMB-231肺转移瘤、HEY腹腔卵巢癌、皮下4T1乳腺癌模型与正常鼠比较,发现荧光信号标记的MSC不仅趋化迁移至损伤部位,在肿瘤组织中同样聚集,而且分别在MSC输入后第29、14、12天均可检测到。Bexell等[13]发现在胶质瘤模型中,绿色荧光标记的鼠MSC迁移至移植瘤的血管壁,表达周细胞的表面标记如α-SMA、NG-2、PDGFR-β等。迁移至肿瘤组织内的MSC对肿瘤生长及血管生成的影响尚无定论。或通过分化为周细胞或血管内皮细胞,或通过分泌多种细胞因子影响血管生成的各个环节。以下将从两个方面探讨MSC对肿瘤血管生成的影响。
二、MSC对肿瘤生长及血管生成的影响
(一)MSC促进肿瘤血管生成
目前MSC对肿瘤生长及血管生成影响的认识只是冰山一角。目前大多数实验认为MSC促进肿瘤血管生成,进而影响肿瘤增殖和转移。表1列出了支持MSC促进肿瘤血管生成这一观点的部分研究。MSC以尾静脉注射、或与肿瘤细胞共同移植等方式,可以在如肝癌[14]、前列腺癌[15]、食管癌[16]和卵巢癌[17]等多种实体瘤动物模型体内促进血管生成。但是从表1中可以看出当MSC在肿瘤生长的初始阶段与肿瘤细胞共同种植似乎更支持肿瘤血管生成,而且在此情况下肿瘤生长速度更快。在肿瘤形成初始阶段,MSC的输入方式可能并不影响其对肿瘤血管的影响。但是在部分研究中成瘤后再输入MSC仍然支持肿瘤血管生成[18],Spaeth等[19]将Skov-3卵巢癌与MSC共同种植皮下或是卵巢癌腹腔种植、MDA-MB-231乳腺癌、Panc-1胰腺癌皮下种植成瘤后静脉输入人脐带来源的MSC,均可以观察到促进血管生成和肿瘤生长。Li和Sun等[14,18]的实验中成瘤后多次静脉注射MSC也发现其可以促进肿瘤血管生成,但对肿瘤生长的影响却不明确。
肿瘤细胞与MSC共同种植于裸鼠皮下时,MSC对肿瘤血管促进作用可能与二者的比例无明显相关性。Wang等[26]把MSC与不同病理类型的人结肠癌细胞系SW480、LS174T、HT29按1:1的比例共同种植皮下,均表现出促血管生成。林琳等[21]在研究MSC对Hela宫颈癌细胞体内生长影响中,把Hela细胞与人脐带MSC按10:1共同接种,发现共同移植组瘤内微血管密度明显增加,促进肿瘤生长。Suzuki等[29]把鼠的黑色素瘤细胞系B16-LacZ与MSC按照不同的比例依次为1:0.2,1:1,1:5,共同种于C57BL/6老鼠腹腔,肿瘤血管生成增加,他认为MSC不是通过促进肿瘤细胞的增殖,也不是通过增加自身的数目,而是通过分泌促血管生成因子促进肿瘤内血管生成,从而促进肿瘤的生长。
MSC来源广,骨髓、脂肪组织、胎盘和脐带等都可以获取,且这些组织来源的MSC有着共同的表面抗原特征和多向分化能力,但是不同部位的MSC可能对肿瘤血管生长及肿瘤生长影响不同。O'neill等[30]同样认为MSC对乳腺癌的作用不仅取决于于肿瘤类型,同样取决于MSC来源,人脂肪组织来源的MSC对乳腺癌BT-20、MCF-7、MDA-MB231的作用比骨髓来源的MSC更强。在同为HT-29结肠癌的皮下移植瘤模型中,肿瘤细胞与MSC以1:1的比例共同种植皮下,Huang和Wang等[25-26]的实验中肿瘤血管明显增加且MSC促进肿瘤生长,但Nakagaki等[24]却得到了不同的实验结果,实验中HT-29肿瘤组织中血管比同为结肠癌的COLO-320组织血管明显减少,且生长受到抑制,这三组实验中唯一不同的是Nakagaki使用的是鼠骨髓来源的MSC,而其他两位研究者使用的人骨髓来源的MSC,不同种属的骨髓MSC增殖分化能力不同与此可能有关。
(二)MSC促进血管生成的相关机制
MSC促进血管生成机制目前尚不明确,部分观点认为趋化至肿瘤组织中的MSC分化为血管内皮细胞、周细胞或者肿瘤相关成纤维细胞,促进肿瘤血管生成,为肿瘤提供营养支持。体外实验中MSC在一定条件下可以诱导分化为内皮细胞[6],Beckerman等[31]发现在体外不到0.01%的MSC可以分化为内皮细胞,在体内胰腺癌移植瘤模型中,GFP标记的MSC可以黏附至肿瘤血管壁上,参与血管形成,但是否分化为内皮细胞仍不明确。Sun等[18]则在黑色素瘤模型中发现了人胎儿骨髓来源的MSC分化为肿瘤血管内皮细胞,促进肿瘤血管生成。更多观点认为MSC分化为血管周细胞[5],N32和N29胶质瘤组织中[13]输入的鼠来源的BMSC表达周细胞的表面标记α-SMA、NG-2等,并不表达血管内皮细胞标记。而在Chowdhury等[32]的前列腺癌模型中,Du154前列腺癌细胞分泌的囊泡经过纯化后作用于MSC,可诱导其分化为肌成纤维细胞,促进前列腺癌血管生成。
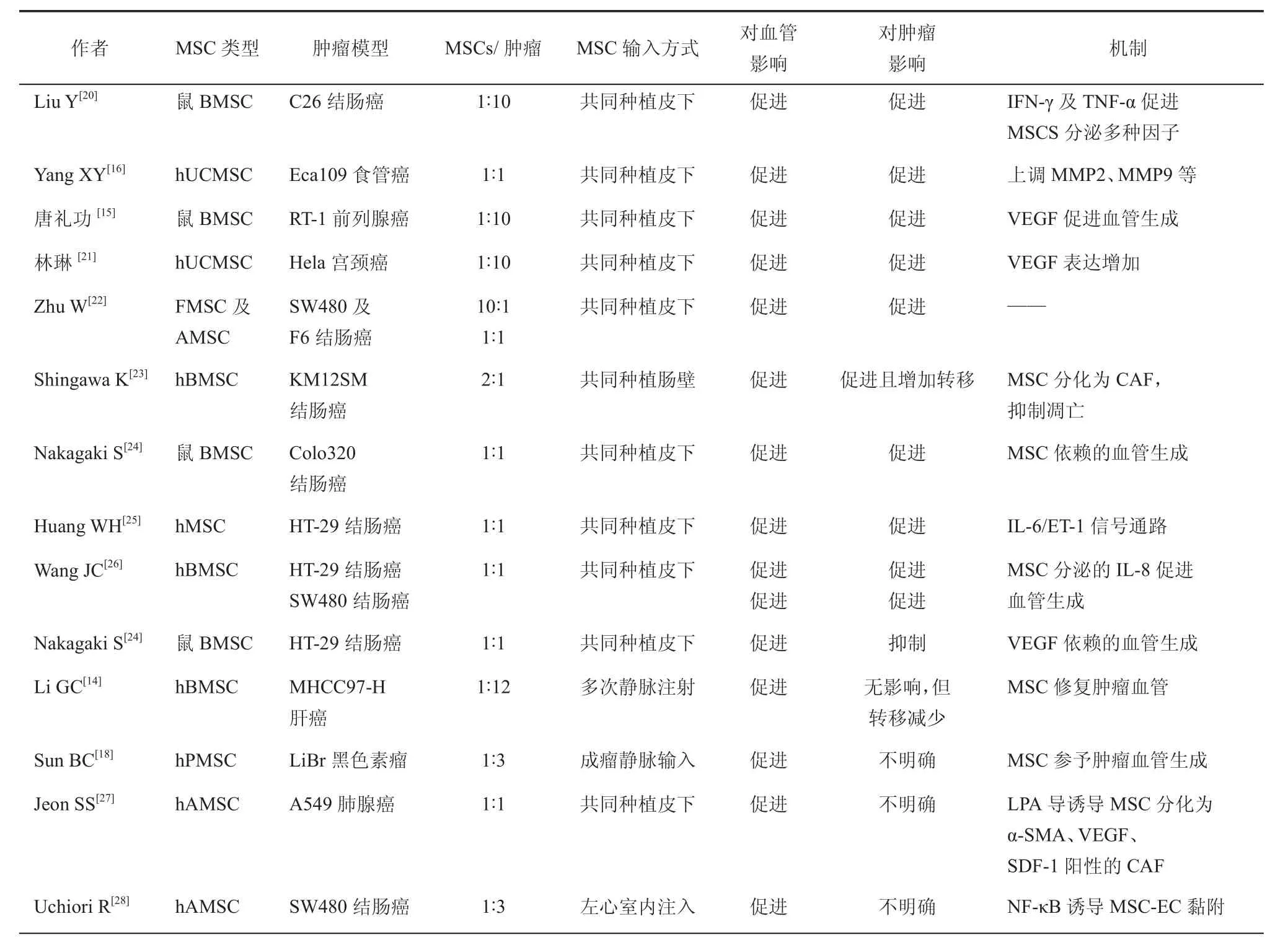
表1 MSC促进肿瘤血管生成
有部分观点认为肿瘤细胞可以分泌细胞因子,旁分泌作用于迁移至间质内的MSC,促进血管生成。人A549肺腺癌中[27],肿瘤细胞通过LPA-LPA1介导的旁分泌机制,诱导人脂肪组织来源的干细胞向CAF分化,促进肿瘤血管形成及肿瘤生长。可见肿瘤细胞分泌至间质内的可溶性细胞因子[23]可能在MSC的分化中发挥作用。
在肿瘤微环境的MSC中,MSC与肿瘤微环境相互作用,自身也可以分泌多种促血管生成因子,促进血管生成。TNF-α激活的MSCs分泌IL-6、IL-8等细胞因子促进内皮祖细胞的迁移和血管生成[33]。MSC分泌的IL-6增加肿瘤细胞内皮素1的产生[25],从而诱导内皮细胞上AKT和ERK的激活,促进内皮细胞聚集和肿瘤血管生成。在结肠癌移植瘤内[26],MSC分泌的IL-8通过促进脐静脉内皮细胞增殖、迁移并形成血管腔样结构,促进肿瘤血管生成。而MSC分泌的VEGF在介导肿瘤血管生成中发挥着关键作用[31],IFN-γ、TNF-α等细胞因子通过HIF-1α信号通路[20],影响MSC分泌VEGF,增加微血管密度,促进肿瘤生长和转移。MSC分泌的PDGF、FGF、SDF-1、Cyr61多肽[34]等在肿瘤血管生成中同样发挥作用。
(三)MSC抑制肿瘤血管生成
与支持MSC促进肿瘤血管生成的观点相反,部分研究认为MSC抑制血管生成(表2)。在成瘤后的MDA-MB-231人乳腺癌的[35]瘤组织内分次注射等数量的MSC,利用分子成像技术检测到CD31的表达在MSC治疗组中表达减少,且肿瘤的凋亡指数在该组明显增加,MSC可能通过抑制血管生成及促进肿瘤细胞凋亡从而抑制肿瘤生长。成瘤后再输入MSC多表现出抑制肿瘤血管生成,MSC输入的时机可能影响其对肿瘤血管生成的影响。
Ho等[36]在研究MSC对于胶质瘤影响的体外实验中发现,人骨髓来源的MSC不仅可以抑制传代培养的人胶质瘤细胞系ΔGli36的生长,同样可以抑制来源于患者的原代胶质瘤细胞的生长,进一步体内实验研究中,MSC与胶质瘤细胞以同等比例共同种植于裸鼠皮下,肿瘤体积和重量在联合组明显减少,用CD31检测微血管密度,肿瘤血管明显减少,但血管的结构更加完整,并在联合组中发现周细胞α-SMA的表达。而这与大多数研究中MSC和肿瘤细胞共同种植皮下促进血管生成不同,肿瘤的病理类型、恶性行为等都可能影响MSC对肿瘤血管的作用。同时血管结构的完整性增加可能更有利于抑制肿瘤生长。

表2 MSC抑制肿瘤血管生成
MSC浓度的增加可能促进内皮细胞凋亡,抑制血管生成。在Otsu等[37]的B16F10黑色素瘤模型中,成瘤后瘤内注射鼠来源的BMSC抑制肿瘤血管生成,为探讨其中机制,在培养基质中将内皮细胞与MSC分别以1:1、1:3比例共同培养,内皮细胞凋亡增加,而以10:1剂量比混合时,MSC对内皮细胞则无明显影响。
MSC在部分研究中表现为抑制血管生成,但同时可以修复肿瘤血管。Kéramidas等[40]在鼠的TSA-pGL3乳腺癌皮下移植瘤和肺转移瘤模型中,把人骨髓MSC输入成瘤裸鼠的瘤周或尾静脉,与单纯肿瘤组相比,联合组肿瘤生长速率减慢,肿瘤进展延缓,输入人骨髓MSC后血管数目减少,肿瘤内血管中血红蛋白的含量无明显改变,但肿瘤组织中α-SMA表达增加,而且联合组中血管结构和形态发生了改变,血管长度较对照组明显延长。他认为MSC可以修复血管,促进血管成熟和功能的改善。肿瘤血管越成熟则血管越趋近正常化。这与MSC在缺血损伤性疾病修复损伤血管使血管正常化相似,但这种使肿瘤血管结构及功能趋近正常化的相关分子机制尚未阐明。MSC可能通过分化为周细胞利于肿瘤血管结构和功能的完整性,促进肿瘤组织中纤维血管网络的有序化。
(四)MSC抑制血管生成的机制
多信号分子、多信号通路可能参与肿瘤血管生成的调节。对AKT信号通路的抑制是MSC抑制卡波氏肉瘤的血管生成和肿瘤生长的关键[41]。Menge等[42]在人血管内皮细胞和MSC共培养的体外实验中,发现MSC与血管内皮细胞直接接触,通过调节VE-Cadherin/β-catenin信号通路,抑制内皮细胞增殖和血管生成,在体内实验中,静脉输入MSC可得到同样的结果。Pati等[43]将MSC与人脐血管内皮细胞共培养同样发现其可以增加VE-Cadherin水平,并且增加VE-Cadherin和β-catenin在细胞膜及浆内的聚集,在脑损伤模型中,其可以调节血管内皮细胞的通透性,MSC可能通过其与内皮细胞之间的相互作用释放细胞因子保护血管内皮内皮祖细胞聚集,下调PDGF-BB、IL-1β等的表达,释放可溶性细胞因子抑制内皮细胞形成,从而抑制胶质瘤血管生成。Tian等[39]在肺癌细胞系SK-MES1和A549的体内外实验中发现MSC的培养基质能抑制肿瘤生长及血管生成,提示可能是MSC分泌的一些可溶性细胞因子下调VEGF的表达。不同肿瘤类型中MSC作用的信号通路及信号分子可能不同仍需要进一步研究明确。
三、讨论
很多研究认为:肿瘤的血管生成与肿瘤的转移有着必然的联系[44],血管生成被作为评估肿瘤预后的标志[45-46]。但是在MSC治疗的皮下或原位移植瘤组织中血管生成与肿瘤生长、侵袭和转移是否存在正相关性目前并不明确。Li等[14]在MHCC97-H肝癌中,静脉多次输入hBMSC,CD31代表的肿瘤微血管密度明显增加,但肿瘤的转移却明显减少。在部分肿瘤中MSC促进肿瘤血管生成并且肿瘤体积增加,但肿瘤增加具体成分还未确定,Studeny等[47]认为增加的肿瘤部分可能包括:肿瘤细胞的增加;MSC的增殖;二者都有。同时间质中这些新生的肿瘤血管其结构和功能并不明确。Kloop和Bexell等[13,48]的研究中MSC所在实验组中肿瘤组织血管周细胞覆盖明显增加,而周细胞是影响血管通透性的重要因素,并提供肿瘤转移的屏障[36]。MSC促进肿瘤血管生成可能同时修复血管结构和功能,更有利于肿瘤的治疗。
2015年,Wong等[49]用低剂量西仑吉肽联合维拉帕米、吉西他滨治疗肺癌和胰腺癌,三药联合组的肿瘤血管密度、直径、数量较其他组明显增加,缺氧也得到改善,而且促进了肿瘤血管的生长,但是瘤内吉西他滨浓度增加,肿瘤的生长受到了明显抑制。2015年[50]提出了类似的观点,促进血管生成、增加血流灌注和促进药物输送,肿瘤生长受到抑制。在部分肿瘤及一定的实验条件下MSC可以促进血管生成,有促进肿瘤生长的可能,但趋化至肿瘤间质内的MSC可能修复肿瘤血管,增加血管周细胞的覆盖,肿瘤血管结构和功能更加完善,改善肿瘤缺血、缺氧所致肿瘤生长及转移,微环境的改变肿瘤细胞的表型及恶性行为可能发生转化;同时在肿瘤血管生成的情况下,联合抗肿瘤药物,可能更利于抗肿瘤药物的进入杀灭肿瘤细胞,治疗肿瘤可能具有良好的效果。可进一步明确联合时间、作用方式、剂量,以及研究MSC归巢的相关机制;模拟MSC进入肿瘤间质内的方式,使抗肿瘤药物更多进入肿瘤间质内,使抗肿瘤治疗锦上添花。
MSC对肿瘤血管生成具有双向作用,具体机制尚有待进一步研究,但其对肿瘤血管的结构正常化及功能的恢复具有肯定的作用,这对肿瘤的治疗有重要意义,进一步研究使MSC更有效归巢至肿瘤,明确其对肿瘤血管结构和功能影响,为更好的利用MSC改善肿瘤微环境提供理论依据。肿瘤的治疗必须是总体综合治疗,即针对肿瘤的微环境又针对肿瘤细胞,双管齐下才能达到更好的效果。
1 Folkman J. Anti-angiogenesis: new concept for therapy of solid tumors[J]. Ann Surg, 1972, 175(3):409-416.
2 Mcdonald DM, Choyke PL. Imaging of angiogenesis: from microscope to clinic[J]. Nat Med, 2003, 9(6):713-725.
3 Chang YS, Di Tomaso E, Mcdonald DM, et al. Mosaic blood vessels in tumors: frequency of cancer cells in contact with fl owing blood[J]. Proc Natl Acad Sci U S A, 2000, 97(26):14608-14613.
4 Jain RK. Antiangiogenesis strategies revisited: from starving tumors to alleviating hypoxia[J]. Cancer Cell, 2014, 26(5):605-622.
5 Rajantie I, Ilmonen M, Alminaite A, et al. Adult bone marrowderived cells recruited during angiogenesis comprise precursors for periendothelial vascular mural cells[J]. Blood, 2004, 104(7):2084-2086.
6 Oswald J, Boxberger S, Jørgensen B, et al. Mesenchymal stem cells can be differentiated into endothelial cells in vitro[J]. Stem Cells, 2004,22(3):377-384.
7 Leblanc AJ, Nguyen QT, Touroo JS, et al. Adipose-derived cell construct stabilizes heart function and increases microvascular perfusion in an established infarct[J]. Stem Cells Transl Med, 2013,2(11):896-905.
8 Assmus B, Rolf A, Erbs S, et al. Clinical outcome 2 years after intracoronary administration of bone marrow-derived progenitor cells in acute myocardial infarction[J]. Circ Heart Fail, 2010, 3(1):89-96.
9 Kim SW, Han H, Chae GT, et al. Successful stem cell therapy using umbilical cord blood-derived multipotent stem cells for Buerger's disease and ischemic limb disease animal model[J]. Stem Cells, 2006,24(6):1620-1626.
10 李宝平,赵晓建,宋永明,等.骨髓间充质干细胞移植对实验性肺气肿大鼠动脉血气及肺组织病理学变化的影响(英文)[J]. 中国组织工程研究与临床康复, 2007 (50):10176-10180.
11 Dvorak HF. Tumors:wounds that do not heal.Similarities between tumor stroma Generation and wound healing[J]. N Engl J Med, 1986,315(26):1650-1659.
12 Kidd S, Spaeth E, Dembinski JL, et al. Direct evidence of mesenchymal stem cell tropism for tumor and wounding microenvironments using in vivo bioluminescent imaging[J]. Stem Cells, 2009, 27(10):2614-2623.
13 Bexell D, Gunnarsson S, Tormin A, et al. Bone marrow multipotent mesenchymal stroma cells act as pericyte-like migratory vehicles in experimental gliomas[J]. Mol Ther, 2009, 17(1):183-190.
14 Li GC, Zhang HW, Zhao QC, et al. Mesenchymal stem cells promote tumor angiogenesis via the action of transforming growth factor β1[J]. Oncol Lett, 2016, 11(2):1089-1094.
15 唐礼功,谢森,潘铁军,等.间充质干细胞对小鼠前列腺癌生长和血管生成促进作用的研究[J]. 临床泌尿外科杂志, 2012,(9):703-706.
16 Yang X, Li Z, Ma Y, et al. Human umbilical cord mesenchymal stem cells promote carcinoma growth and lymph node metastasis when coinjected with esophageal carcinoma cells in nude mice[J]. Cancer Cell Int, 2014, 14(1):93.
17 Coffelt SB, Marini FC, Watson K, et al. The pro-infl ammatory peptide LL-37 promotes ovarian tumor progression through recruitment of multipotent mesenchymal stromal cells[J]. Proc Natl Acad Sci U S A,2009, 106(10):3806-3811.
18 Sun B, Zhang S, Ni C, et al. Correlation between melanoma angiogenesis and the mesenchymal stem cells and endothelial progenitor cells derived from bone marrow[J]. Stem Cells Dev, 2005,14(3):292-298.
19 Spaeth EL, Dembinski JL, Sasser AK, et al. Mesenchymal stem cell transition to tumor-associated fi broblasts contributes to fi brovascular network expansion and tumor progression[J]. PLoS One, 2009, 4(4):e4992.
20 Liu Y, Han ZP, Zhang SS, et al. Effects of inflammatory factors on mesenchymal stem cells and their role in the promotion of tumor angiogenesis in colon cancer[J]. J Biol Chem, 2011,286(28):25007-25015.
21 林琳,孙雯,王丽双.间充质干细胞对人HeLa宫颈癌细胞生长的影响[J].中华医学杂志, 2015, 95(15):1175-1178.
22 Zhu W, Xu W, Jiang R, et al. Mesenchymal stem cells derived from bone marrow favor tumor cell growth in vivo[J]. Exp Mol Pathol, 2006,80(3):267-274.
23 Shinagawa K, Kitadai Y, Tanaka M, et al. Mesenchymal stem cells enhance growth and metastasis of colon cancer[J]. International Journal of Cancer, 2010, 127(10):2323-2333.
24 Nakagaki S, Arimura Y, Nagaishi K, et al. Contextual niche signals towards colorectal tumor progression by mesenchymal stem cell in the mouse xenograft model[J]. J Gastroenterol, 2015, 50(9):962-974.
25 Huang WH, Chang MC, Tsai KS, et al. Mesenchymal stem cells promote growth and angiogenesis of tumors in mice[J]. Oncogene,2013, 32(37):4343-4354.
26 Wang J, Wang Y, Wang S, et al. Bone marrow-derived mesenchymal stem cell-secreted IL-8 promotes the angiogenesis and growth ofcolorectal cancer[J]. Oncotarget, 2015, 6(40):42825-42837.
27 Jeon ES, Lee IH, Heo SC, et al. Mesenchymal stem cells stimulate angiogenesis in a murine xenograft model of A549 human adenocarcinoma through an LPA1 receptor-dependent mechanism[J]. Biochim Biophys Acta, 2010, 1801(11):1205-1213.
28 Uchibori R, Tsukahara T, Mizuguchi H, et al. NF-κB activity regulates mesenchymal stem cell accumulation at tumor sites[J]. Cancer Res,2013, 73(1):364-372.
29 Suzuki K, Sun R, Origuchi M, et al. Mesenchymal stromal cells promote tumor growth through the enhancement of neovascularization[J]. Mol Med, 2011, 17(7/8):579-587.
30 O'neill AC, Aggarwal P, Keating A, et al. Mesenchymal stem cell stimulation of breast cancer proliferation is dependent on both stem cell source and tumor type[J]. Plast Reconstr Surg, 2015, 136(4 Suppl):116. 31 Beckermann BM, Kallifatidis G, Groth A, et al. VEGF expression by mesenchymal stem cells contributes to angiogenesis in pancreatic carcinoma[J]. Br J Cancer, 2008, 99(4):622-631.
32 Chowdhury R, Webber JP, Gurney M, et al. Cancer exosomes trigger mesenchymal stem cell differentiation into pro-angiogenic and proinvasive myofi broblasts[J]. Oncotarget, 2015, 6(2):715-731.
33 Kwon YW, Heo SC, Jeong GO, et al. Tumor necrosis factor-αactivated mesenchymal stem cells promote endothelial progenitor cell homing and angiogenesis[J]. Biochim Biophys Acta, 2013,1832(12):2136-2144.
34 Estrada R, Li N, Sarojini H, et al. Secretome from mesenchymal stem cells induces angiogenesis via Cyr61[J]. J Cell Physiol, 2009,219(3):563-571.
35 Leng L, Wang Y, He N, et al. Molecular imaging for assessment of mesenchymal stem cells mediated breast cancer therapy[J]. Biomaterials, 2014, 35(19):5162-5170.
36 Ho IA, Toh HC, Ng WH, et al. Human bone marrow-derived mesenchymal stem cells suppress human glioma growth through inhibition of angiogenesis[J]. Stem Cells, 2013, 31(1):146-155.
37 Otsu K, Das S, Houser SD, et al. Concentration-dependent inhibition of angiogenesis by mesenchymal stem cells[J]. Blood, 2009,113(18):4197-4205.
38 Zheng L, Zhang D, Chen X, et al. Antitumor activities of human placenta-derived mesenchymal stem cells expressing endostatin on ovarian cancer[J]. PLoS One, 2012, 7(7):e39119.
39 Li L, Tian H, Chen Z, et al. Inhibition of lung cancer cell proliferation mediated by human mesenchymal stem cells[J]. Acta Biochim Biophys Sin (Shanghai), 2011, 43(2):143-148.
40 Kéramidas M, De Fraipont F, Karageorgis A, et al. The dual effect of mesenchymal stem cells on tumour growth and tumour angiogenesis[J]. Stem Cell Res Ther, 2013, 4(2):41.
41 Khakoo AY, Pati S, Anderson SA, et al. Human mesenchymal stem cells exert potent antitumorigenic effects in a model of Kaposi's sarcoma[J]. J Exp Med, 2006, 203(5):1235-1247.
42 Menge T, Gerber M, Wataha K, et al. Human mesenchymal stem cells inhibit endothelial proliferation and angiogenesis via cell-cell contact through modulation of the VE-Cadherin/β-catenin signaling pathway[J]. Stem Cells Dev, 2013, 22(1):148-157.
43 Pati S, Khakoo AY, Zhao J, et al. Human mesenchymal stem cells inhibit vascular permeability by modulating vascular endothelial cadherin/β-catenin signaling[J]. Stem Cells Dev, 2011, 20(1):89-101.
44 Tanigawa N, Amaya H, Matsumura M, et al. Tumor angiogenesis and mode of metastasis in patients with colorectal cancer[J]. Cancer Res,1997, 57(6):1043-1046.
45 Kaya A, Ciledag A, Gulbay BE, et al. The prognostic signifi cance of vascular endothelial growth factor levels in sera of non-small cell lung cancer patients[J]. Respir Med, 2004, 98(7):632-636.
46 Hanahan D, Weinberg RA. The hallmarks of cancer[J]. Cell, 2000,100(1):57-70.
47 Studeny M, Marini FC, Champlin RE, et al. Bone marrow-derived mesenchymal stem cells as vehicles for interferon-beta delivery into tumors[J]. Cancer Res, 2002, 62(13):3603-3608.
48 Klopp AH, Zhang Y, Solley T, et al. Omental adipose tissue-derived stromal cells promote vascularization and growth of endometrial tumors[J]. Clin Cancer Res, 2012, 18(3):771-782.
49 Wong PP, Demircioglu F, Ghazaly E, et al. Dual-action combination therapy enhances angiogenesis while reducing tumor growth and spread[J]. Cancer Cell, 2015, 27(1):123-137.
50 Rivera LB, Bergers G. CANCER. tumor angiogenesis, from foe to friend[J]. Science, 2015, 349(6249):694-695.
(本文编辑:李少婷)
韩昌敏, 张雷, 吴启龙. 间充质干细胞对肿瘤血管生成的影响[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(4):252-257.
Effects of mesenchymal stem cells on angiogenesis of tumor
Han Changmin, Zhang Lei, Wu Qilong, Li Baoping.
Department of Tumor Biotherapy, the Second Hospital of Shan Xi Medical University, Taiyuan 030001, China.
Coressponding author:Li Baoping, Email:164660904@qq.com
Mesenchymal stem cell(MSC)are multipotent stem cells that are capable of self-renewal, multilineage differentiation and chemotactic. In addition to bone, cartilage, muscle,it has been demonstrated that MSC are capable of differentiating into vascular endothelial cells under certain conditions. So they are currently being explored for tissue repair, myocardial ischemia and other ischemic diseases. MSC can be recruited into tumor and they have been considered as the potential vehicles for cell-based gene therapy. MSC interact with tumor micro-environment by differentiating into endothelial cells, perithelial cells or paracrine mechanism. But in different tumor models, the influence of MSC on tumor angiogenesis is controversial. This review aimed to explore the factors that may affect the experiments results.
Mesenchymal stem cell; Tumor; Angiogenesis
10.3877/cma.j.issn.2095-1221.2016.04.011
李宝平,Email:164660904@qq.com
(2016-03-02)

