利用靶向表皮生长因子受体的磁性纳米载体进行肝癌细胞基因治疗的效果观察
鲍洁 张娟 王晶
利用靶向表皮生长因子受体的磁性纳米载体进行肝癌细胞基因治疗的效果观察
鲍洁 张娟 王晶
目的 本研究采用靶向表皮生长因子受体(EGFR)的单克隆抗体对磁性纳米基因载体颗粒进行靶向修饰后进行针对肝癌的基因治疗,观察其对肝癌细胞HepG2的基因治疗效果。方法 制备靶向EGFR的SPIO磁性纳米基因载体。对肝癌细胞HepG2进行EGFR免疫荧光染色证明其在细胞膜上的表达。以LipofectamineTM2000推荐质粒用量的1/20进行分组转染,EGFR-Ab-PolyMAG100基因载体组作为(EP)组;LipofectamineTM2000基因载体组作为(LF)组;未转染空白对照细胞作为(NC)组。荧光显微镜观察纳米造影剂的细胞内吞效果。荧光实时定量PCR检测目的基因mRNA表达。western blot法进行蛋白表达鉴定。四甲基偶氮唑盐法检测基因治疗效果。HCCR-2 mRNA、HCCR-2蛋白和Ki67蛋白表达水平数据、A值的比较采用单因素方差分析和t检验。结果 免疫荧光法染色观察发现,肝癌HepG2细胞膜高表达EGFR蛋白。磁性纳米基因载体有效链接EGFR抗体。EP组细胞中质粒大量进入HepG2细胞,质粒内吞量大于LF组和NC组。EP组HCCR2 mRNA的相对表达量为(11.25±0.23)%,相对表达量明显低于NC组,差异具有统计学意义(t = 23.57,P = 0.00)。EP组HCCR2蛋白的相对表达量为(0.13±0.02),明显低于NC组的0.62±0.05,差异具有统计学意义(t =29.31,P =0.00)。EP组Ki67蛋白的相对表达量为(0.22±0.04),明显低于NC组的(0.83±0.07),差异具有统计学意义(t =18.88,P =0.00)。转染24 h、48 h后,EP组的A值明显低于NC组,差异具有统计学意义(t = -22.02,-34.73,P = 0.00,0.00)。结论 采用EGFR单克隆抗体修饰后的磁性纳米基因载体颗粒,可以实现对肝癌细胞的高效基因治疗,进而实现对肝癌细胞的增殖抑制。
纳米结构; 基因疗法; 受体,表皮生长因子; 肝肿瘤
磁性纳米载体(magnetic nanoparticles,MNPs)是由带有磁性的金属及金属氧化物等原料制备而成的纳米载体,在其表面修饰阳离子型材料,如PEI或者寡(多)聚精氨酸等带正电荷的材料后便于与带负电荷的核酸结合,形成载体/核酸复合物[1]。这一类磁性纳米载体可以在磁场或靶向基团引导下,在目的细胞表面进行富集,增加载体/核酸复合物与靶细胞的接触时间和接触量,促进细胞对核酸的内吞,提高基因转染效率[2-3]。研究发现,磁性纳米粒子能通过静电作用与DNA结合,形成紧密的复合物,产生空间位阻效应,有效地阻止DNA酶及Mg2+与DNA的接触,同时,载体的纳米级尺寸效应使得DNA嵌入纳米颗粒后,构象发生变异,发挥酶切保护效果[4]。表皮生长因子受体(epidermal growth factor receptor,EGFR)在正常细胞表面低表达,但高表达于包括多种恶性肿瘤细胞表面,有望作为包括肝癌在内的恶性肿瘤纳米载体基因治疗的良好靶向识别位点[5-7]。本研究采用靶向EGFR的单克隆抗体对磁性纳米基因载体颗粒进行靶向修饰后进行针对肝癌人宫颈癌基因-2(human cervical cancer oncogene 2,HCCR-2)的基因治疗,观察其对肝癌细胞HepG2的基因治疗效果。
材料与方法
一、材料
人肝癌细胞株HepG2、免疫荧光染色试剂盒购自广州安邦生物科技有限公司,由华南师范大学分子生物学实验室保存。重组质粒Pcmv6-ACGFP/ HCCR-2-siRNA购自广州爱科生物科技有限公司[8]。聚乙烯亚胺(polyethylenimine,PEI)包被的磁性纳米基因载体颗粒PolyMAG100购自德国Chemicell公司。兔抗人EGFR单克隆抗体(EGFR-Ab)、LipofectamineTM2000转染试剂购自美国Invitrogen公司。FITC标记的兔抗人-IgG抗体、羊抗兔-IgG抗体,荧光染料Hoechst33258购自北京中杉金桥公司。绿色核酸荧光染料GelGreen购自美国Biotium公司。[1-乙基-(3-二甲基氨基丙基)]碳化二亚胺盐酸盐(EDC·HCl)购自美国Sigma有限公司。
二、方法
1.靶向EGFR的SPIO磁性纳米基因载体的制备及抗体连接的检测:取Fe浓度为10 mg/ml的PolyMAG100磁性纳米基因载体100 μl,重悬于300 μl三蒸水中。取5 mg/ml的EGFR-Ab 400 μl,加入前述磁性纳米基因载体重悬液中混匀。同型对照抗体同前处理得对照组基因载体。于混合液中置入16 mg EDC·HCl。室温震荡下复合12 h后置于磁性分离器中,沉积纳米颗粒。洗涤、重悬磁性纳米基因载体于去离子水中,制成可靶向EGFR蛋白的EGFR-Ab-PolyMAG100磁性纳米基因载体。为鉴定EGFR-Ab是否已经与PolyMAG100磁性纳米基因载体基团连接,本研究采用足量FITC标记的羊抗兔-IgG抗体溶液与制成的EGFR-Ab-PolyMAG100磁性纳米基因载体悬液在20℃条件进行共孵育30 min后,于磁性分离器中沉积纳米颗粒,PBS反复洗涤3次后沉积,采用荧光显微镜观察染色结果。染色结果以未行抗体连接的PolyMAG100磁性纳米基因载体为对照,同样按照上述步骤荧光染色后进行观察。
2.肝癌细胞培养与EGFR免疫荧光染色:复苏培养人肝癌HepG2细胞株,以含有10%胎牛血清的DMEM高糖培养基培养于37℃、5%CO2的细胞培养箱中。待细胞融合度80%时,固定细胞,严格按照免疫荧光染色试剂盒说明书,使用EGFR单抗作为一抗,采用FITC标记的羊抗兔-IgG抗体进行EGFR蛋白免疫荧光染色。操作过程中,按照试剂盒说明书要求,在一抗和二抗作用后,分别采用PBS液冲洗细胞3次,去除非特异性染色。染色后采用荧光染料Hoechst 33258避光孵育0.5 h进行细胞核染色,荧光显微镜下观察染色结果。
3. 细胞培养和分组转染:HepG2肝癌细胞传代于6孔板,待细胞融合度80%时,分为如下三组,分别应用EGFR-Ab-PolyMAG100基因载体,并采用LipofectamineTM2000作为对照基因载体,分别按照说明书复合治疗质粒。按照PolyMAG100说明书要求,每μg质粒使用1 μl PolyMAG100原液制成的EGFR-Ab-PolyMAG100基因载体。以LipofectamineTM2000推荐质粒用量的1/20,每6孔板孔采用0.2 μg质粒量与细胞共孵育3 h进行转染:(1)EGFR-Ab-PolyMAG100基因载体组作为(EP)组;(2)LipofectamineTM2000基因载体组作为(LF)组;(3)未转染空白对照细胞作为(NC)组。
3.荧光显微镜观察纳米造影剂的细胞内吞效果:按照绿色核酸荧光染料GelGreen说明书,将转染试剂中的质粒进行染色后转染2 h,将共孵育后的3组细胞分别在避光条件下用冰甲醇固定15 min,PBS冲洗后荧光染料Hoechst 33258避光孵育0.5 h进行细胞核染色,荧光显微镜下观察。所有实验重复3次。
4. 荧光实时定量PCR检测mRNA表达:Trizol法提取各组总细胞RNA,逆转录合成cDNA。HCCR-2上游引物为:5'-ATGGCCTTAGTGTTCA TGGTCAT-3',下游引物为:5'-GGCAGAGGACA TTCTTCCTC-3';内参照为β-actin,上游引物为:5'-ACGTGGACATTCATGAAGTGTG-3',下游引物为:5'-ATGATCTTGCTCAGGAGGAGCA -3'。PCR反应条件为93℃,28 s;93℃,4 s;56℃,28 s;53个循环,循环延伸末端收集荧光信号。Real-time PCR数值分析采用2-ΔΔCt分析法。所有实验重复3次。
5.蛋白表达鉴定:细胞分组转染后培养3 d提取总蛋白。蛋白定量后进行聚丙烯酰胺凝胶电泳。电转移至聚偏二氟乙烯膜,封闭1 h,HCCR-2、Ki67和β-actin抗体4℃孵育过夜,辣根过氧化物酶标记的二抗处理,增强化学发光法显色,胶片曝光检查蛋白表达水平,经自动电泳凝胶成像分析仪检测两组细胞的蛋白表达量,以β-actin作为内参照计算蛋白的平均相对表达量。所有实验重复3次。
6.四甲基偶氮唑盐(MTT)法:各组转染后细胞重悬,以1×105个细胞/孔重悬于200 μl完全培养基中接种于96孔板。接种后分别培养24 h、48 h后,每孔加入20 μl 0.5%的MTT液。继续培养2 h后弃去培养液,PBS洗涤3次。每孔加入200 μl二甲亚砜,20℃缓慢震荡0.5 h。酶标仪测490 mn处吸光度(A)值。
三、统计学分析方法
采用SPSS 13.0 统计学软件进行数据分析。HCCR-2 mRNA和蛋白表达水平数据、A值采用± s表示,组间比较采用单因素方差分析和t检验。以P < 0.05为差异有统计学意义。
结 果
一、人肝癌HepG2细胞EGFR表达及磁性纳米基因载体抗体连接效果的免疫荧光观察
如图1所示,免疫荧光法染色观察发现,HepG2细胞膜上出现绿色荧光染色。说明人肝癌HepG2细胞细胞膜高表达EGFR蛋白,可以通过在纳米基因载体上连接EGFR抗体,对HepG2细胞进行识别。

图1 荧光显微镜下观察HepG2细胞的EGFR免疫荧光染色结果 (×1000)
如图2所示,免疫荧光法染色观察发现,经本研究靶向化后的EGFR-Ab-PolyMAG100载体沉积物中,出现荧光二抗携带的FITC绿色荧光,而同为磁性纳米载体的PolyMAG100上却没有产生荧光抗体染色。说明有EGFR-Ab抗体连接于EGFRAb-PolyMAG100载体上。

图2 荧光显微镜下观察纳米载体连接抗体的免疫荧光染色结果 (×1000)
二、纳米基因载体的细胞内吞效果
如图3所示,免疫荧光实验观察发现,EP组细胞中,在蓝色细胞核周围可以观察到大量被绿色核酸荧光染料GelGreen染色的质粒颗粒,而LF组中仅可见少量绿色荧光颗粒,而NC组仅可见蓝染的细胞核。说明EP组细胞中质粒大量进入HepG2细胞,质粒内吞量大于LF组。
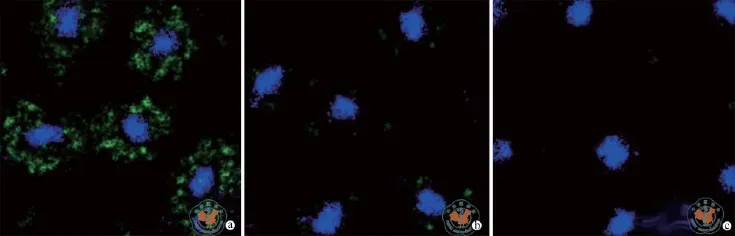
图3 荧光显微镜下观察HepG2细胞的纳米基因载体的细胞内吞效果 (×1000)
三、三组细胞HCCR2 mRNA的表达
以NC组的表达量为100%,EP组HCCR2 mRNA的相对表达量为(11.25±0.23)%,EP组的HCCR2 mRNA的相对表达量明显低于NC组,差异具有统计学意义(t = 23.57,P = 0.00)。LF组的相对表达量为(98.62±3.51)%,与NC组的差异没有统计学意义(t = 2.08,P = 0.09)。
四、三组细胞HCCR2蛋白和Ki67蛋白的表达
由图4可见,EP组HCCR2蛋白的相对表达量为0.13±0.02,明显低于NC组的0.62±0.05,差异具有统计学意义(t = 29.31,P = 0.00)。而LF组的相对表达量为0.60±0.12,差异无统计学意义(t =1.35,P = 0.08)。EP组Ki67蛋白的相对表达量为0.22±0.04,明显低于NC组的0.83±0.07,差异具有统计学意义(t =18.88,P = 0.00)。而LF组的相对表达量为0.87±0.08,差异无统计学意义(t =1.92,P = 0.07)。
五、三组细胞增殖能力的检测
转染24 h、48 h后,EP组、LF组和NC组的A值如表1所示。EP组的A值明显低于NC组,差异具有统计学意义(t = -22.02,-34.73,P = 0.00,0.00)。LF组的A值与NC组相比,差异无统计学意义(t =-1.13,2.69,P = 0.06,0.07)。

图4 3组细胞中蛋白表达水平的western blot检测
表1 三组细胞MTT实验测得的(A)值的比较(n=3,± s)

表1 三组细胞MTT实验测得的(A)值的比较(n=3,± s)
组别24 h48 h EP组0.17±0.040.23±0.06 LF组0.41±0.030.66±0.08 NC组0.43±0.050.64±0.10 F值14.1122.73 P值 0.01 0.00
讨 论
非病毒纳米基因载体能够携载大片段质粒DNA。目前众多低毒性、低免疫原性、且容易进行表面靶向修饰的纳米基因载体不多出现,逐渐成为最具潜力基因治疗手段之一。本研究采用的PolyMAG100就是一种基于超顺磁性纳米微粒结构制成的新型商品化纳米载体[9-10]。该载体能够将基因治疗质粒进行结合,运输到病灶部位发挥作用,可以通过其传输,有效提高质粒对目的细胞的转染效果。本研究进一步针对肝癌细胞表面特异性高表达的EGFR蛋白,对其进行靶向化修饰,使其具备可以智能识别肝癌细胞,促进肝癌细胞特异性内吞,并增加基因转染效率的功能[11-12]。EGFR在包括肝癌在内的肿瘤的发生、发展中发挥重要的作用,是原癌基因C-erb-1的表达产物,定位于细胞膜。其在多种恶性肿瘤细胞中特异性高表达,在部分恶性肿瘤细胞表面的表达水平超过100 000个,可以作为纳米载体识别恶性肿瘤细胞的良好靶点[13-14]。本研究利用免疫荧光染色技术,证实了人肝癌HepG2细胞表面高标的EGFP蛋白(图1),所以进一步利用EGFR蛋白的这一特性,对纳米基因载体进行EGFR抗体修饰,使其可以通过对EGFR蛋白的识别实现对肝癌细胞的治疗质粒靶向传输。在基因治疗手段的选取上,本研究采用了本团队前期采用的HCCR-2 siRNA真核表达质粒。人宫颈癌基因均定位于12号染色体,在肝癌、胃癌等恶性肿瘤中均呈高表达。本团队在前期研究中证实通过siRNA技术,对其在卵巢癌、胆管癌等恶性肿瘤细胞的表达进行沉默后,可以有效抑制恶性肿瘤细胞的发生、发展[8,15]。国际上的相关报道也证实针对人宫颈癌基因进行的基因治疗可以实现对肝癌细胞生长的抑制[16-18]。
在本研究中,为了证明EGFR靶向化的磁性纳米基因载体具有较高的基因转染效率,采用了常用的基因载体LipofectamineTM2000作为对照载体,但是将转染所用的质粒浓度控制在LipofectamineTM2000说明书规定的1/10,观察在较低的质粒浓度下,两种基因载体的质粒传输效率。通过对质粒进行GelGreen绿色荧光染色[19],发现在该浓度下,LipofectamineTM2000转染组细胞中的荧光强度极低,其质粒传输效率远远低于EGFR靶向化的磁性纳米基因载体(图3)。本研究进一步通过RT-PCR和western blot实验考察了不同转染手段传输治疗基因后,对目的基因mRNA和蛋白表达水平的影响,发现采用靶向化磁性纳米基因载体的EP组实现了良好的基因表达抑制功能,而对照的采用LipofectamineTM2000的LF组却没能在较低质粒浓度下实现有效的基因表达抑制功能(图4)。本研究进一步通过MTT实验证实,EP组在较低的质粒浓度下,实现了对肝癌HepG2细胞增殖的有效抑制,其24 h、48 h时测得的A值明显低于LF组和NC组(表1)。同时,本研究对采用的基因治疗手段抑制肝癌细胞增殖的机制进行了初步探讨,发现在HepG2细胞中,经典的细胞增殖相关蛋白Ki67的表达水平与HCCR-2蛋白的表达水平的变化趋势一致,说明Ki67蛋白可能参与了HCCR-2蛋白对肝癌细胞增殖的调控过程(图3)。
综上所述,采用EGFR单克隆抗体修饰后的磁性纳米基因载体颗粒,可以实现对肝癌细胞的高效基因治疗,进而实现对肝癌细胞的增殖抑制。
1 居会祥, 戴真煜, 孙明忠. 磁性纳米氧化铁颗粒在人肝癌Bel7402细胞裸鼠模型中的定向浓集及其生物学效应[J]. 中华肝脏病杂志,2011, 19(8):594-598.
2 吉金萍, 姜智, 陈宝安, 等. 磁性纳米四氧化三铁颗粒对卵巢癌细胞株SKOV3/DDP耐药的逆转作用[J/CD]. 中华临床医师杂志(电子版),2012, 6(10):2814-2816.
3 彭穗, 王晶, 彭振维, 等. 携带缺氧诱导因子-1α-siRNA的叶酸靶向化的磁性纳米复合物抑制肝癌干细胞增殖的实验研究[J/CD]. 中华细胞与干细胞杂志:电子版, 2016, 6(1):42-46.
4 王子真, 胡刚, 吴新淮. 磁性纳米复合物对人肝癌细胞增殖能力的影响[J]. 器官移植, 2015 (6):425-428, 437.
5 张晶晶, 吕喜英, 毛淑芳, 等. 非小细胞肺癌患者癌组织中的ERCC1、EGFR、K-ras表达与其预后的关系[J]. 山东医药, 2012,52(17):74-76.
6 王翠萍, 张静, 高洁, 等. 肾上腺皮质癌、腺瘤临床病理特征分析和表皮生长因子受体、血管内皮生长因子的表达及意义[J]. 中华病理学杂志, 2012, 41(10):686-690.
7 单宝珍, 李胜保, 王强, 等. 大肠癌及其癌前组织中EGFR蛋白的表达及意义[J]. 中国现代医学杂志, 2014, 24(11):63-66.
8 王晶, 梁建明, 刘安琪, 等. siRNA沉默HCCR-2基因抑制卵巢癌肝转移的实验研究[J/CD]. 中华肝脏外科手术学电子杂志, 2015(1):50-52.
9 Lo YL, Chou HL, Liao ZX, et al. Chondroitin sulfate-polyethylenimine copolymer-coated superparamagnetic Iron oxide nanoparticles as an effi cient magneto-gene carrier for microRNA-encoding plasmid DNA delivery[J]. Nanoscale, 2015, 7(18):8554-8565.
10 Namiki Y, Namiki T, Yoshida H, et al. A novel magnetic crystal-lipid nanostructure for magnetically guided in vivo gene delivery[J]. Nat Nanotechnol, 2009, 4(9):598-606.
11 孙丽娟, 付群, 李宏云, 等. EGFR、KRAS、BRAF、PI3K基因突变与非小细胞肺癌靶向药物治疗的关系[J]. 郑州大学学报(医学版),2013, 48(1):147-148.
12 张静, 高洁, 武莎斐, 等. 肾上腺嗜酸细胞型皮质癌的临床病理特征及表皮生长因子受体基因状态[J]. 协和医学杂志, 2015 (3):191-196.
13 姜忠于, 胡春秀, 刘学武, 等. 靶向药物治疗对表皮生长因子受体基因不同位点突变的非小细胞肺癌患者预后影响[J]. 中国临床药理学杂志, 2015 (23):2306-2308.
14 张荧荧, 何晓光, 丛林海, 等. mAb-EGFR功能化修饰的纳米金棒靶向光热作用对下咽癌FADU细胞株和293T细胞株的温度影响[J]. 听力学及言语疾病杂志, 2015 (2):170-175.
15 王晶, 鲍洁, 郭朋, 等. siRNA沉默人宫颈癌基因2抑制胆管癌细胞增殖的实验研究[J/CD]. 中华肝脏外科手术学电子杂志, 2015(4):242-245.
16 Qiao SS, Cui ZQ, Gong L, et al. Simultaneous measurements of serum AFP, GPC-3 and HCCR for diagnosing hepatocellular carcinoma[J]. Hepatogastroenterology, 2011, 58(110/111):1718-1724.
17 Jirun P, Zhang G, Kim HK, et al. Clinical utility of alpha fetoprotein and HCCR-1, alone or in combination, in patients with chronic hepatitis, liver cirrhosis and hepatocellular carcinoma[J]. Dis Markers,2011, 30(6):307-315.
18 Li JF, Dai XP, Zhang HF, et al. Up-regulation of human cervical cancer proto-oncogene contributes to hepatitis B virus-induced malignant transformation of hepatocyte by down-regulating E-cadherin[J]. Oncotarget, 2015, 6(30):29196-29208.
19 田田,朱钊奇,肖忠党. 新型核酸染料GelGreen在单分子荧光技术中的应用[c]. 第十一次中国生物物理学术大会暨第九届全国会员代表大会摘要集. 桂林, 2009, 302-303.
(本文编辑:蔡晓珍)
鲍洁, 张娟, 王晶. 利用靶向表皮生长因子受体的磁性纳米载体进行肝癌细胞基因治疗的效果观察[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(4):215-220.
Gene therapy of hepatocellular carcinoma cells using magnetic nanoparticles targeting
epidermal growth factor receptor Bao Jie, Zhang Juan, Wang Jing.
Department of Internal Medicine, South China Normal University Hospital, Guangzhou 510630, China
Bao Jie, Email: 12706446@qq.com
Objective This study used epidermal growth factor receptor (EGFR)monoclonal antibody to deliver magnetic nanoparticles as gene carrier to HepG2 cells. Methods SPIO magnetic nanoparticles with EGFR Ab were prepared. The expression of EGFR in hepatocellular carcinoma cell line HepG2 was demonstrated by immunofluorescence staining. LipofectamineTM2000 was used to transfect EGFR-Ab-PolyMAG100 gene vector (EP group),LipofectamineTM2000 gene vector (LF group) and blank vector (NC group). The endocytosis effect of contrast agent was observed with a fluorescence microscope. Fluorescent real time quantitative PCR was used to detect target gene mRNA expression. Protein expression was evaluated by western blot. Cell proliferation was detected by MTT method. MRNA HCCR-2, HCCR-2 and Ki67 protein expression levels were compared by ANOVA and t test. Results The expression of EGFR in the HepG2 cell membrane was observed by immunofluorescence staining. Magnetic nanoparticles were effectively linked to EGFR antibody. The relative expression of mRNA HCCR2 in the EP group was(11.25±0.23)%, significantly lower than that of the NC group (t = 23.57, P = 0.00). The relativeexpression amount of HCCR2 protein in the EP group was (0.13±0.02), which was significantly lower than that of the NC group (0.62±0.05) (t =29.31, P = 0.00). The relative expression of Ki67 protein in the EP group was (0.22±0.04), which was significantly lower than that of the NC group(0.83±0.07) (t =18.88, P =0.00). At 24 h and 48 hours after transfection, the A value of the EP group was significantly lower than that of the NC group (t = -22.02, -34.73, P = 0.00, 0.00). Conclusions In summary, using EGFR monoclonal antibody modified magnetic nanoparticle particles; gene therapy for hepatocellular carcinoma cells can be achieved.
作者单位:510630 广州,华南师范大学医院内科
Nanostructures; Gene therapy; Receptor, Epidermal Growth Factor; Liver Neoplasms
10.3877/cma.j.issn.2095-1221.2016.04.004
国家自然科学基金(81201918);广东省科技计划项目(2012B031800099)
鲍洁,Email:12706446@qq.com
(2016-05-23)

