中国部分地区肿瘤患者UGT1A1*28和UGT1A1*6位点基因多态性分布的差异研究
来向阳,衡雪源,车峰远,王守峰,石建华,蔡利娟,张金岭,黄 伟,李峥嵘
·论著·
中国部分地区肿瘤患者UGT1A1*28和UGT1A1*6位点基因多态性分布的差异研究
来向阳,衡雪源,车峰远,王守峰,石建华,蔡利娟,张金岭,黄 伟,李峥嵘
目的调查我国部分地区肿瘤患者UGT1A1*28和UGT1A1*6位点基因多态性分布情况,明确二者在肿瘤患者中分布的差异。方法收集2011年8月—2014年4月山东大学附属临沂市人民医院、临沂市肿瘤医院、兰州大学第一附属医院、西安交通大学第一附属医院、西京医院应用伊立替康治疗的住院肿瘤患者241例,均进行了UGT1A1*28位点基因多态性检测,其中177例同时进行了UGT1A1*6位点基因多态性检测,提取基因组DNA,PCR扩增UGT1A1基因片段,检测UGT1A1*28和UGT1A1*6位点基因型分布。结果241例检测UGT1A1*28位点基因多态性的患者中,UGT1A1*28位点基因启动子区TA序列呈6次重复的野生型(TA6/6)即野生型纯合子180例(74.7%),TA序列6次和7次重复的杂合突变型(TA6/7)即突变型杂合子56例(23.2%),TA序列7次重复的纯合突变型(TA7/7)即突变型纯合子5例(2.1%);177例检测UGT1A1*6位点基因多态性的患者中,UGT1A1*6位点基因型为野生型(G/G)即野生型纯合子106例(59.9%),杂合突变型(G/A)即突变型杂合子62例(35.0%),纯合突变型(A/A)即突变型纯合子9例(5.1%)。UGT1A1*28和UGT1A1*6位点基因型分布比较,差异有统计学意义(P<0.05)。不同性别、年龄、肿瘤部位、地区来源肿瘤患者UGT1A1*28位点基因型分布比较,差异均无统计学意义(P>0.05)。不同性别、年龄、地区来源肿瘤患者UGT1A1*6位点基因型分布比较,差异均无统计学意义(P>0.05);不同肿瘤部位患者UGT1A1*6位点基因型分布比较,差异有统计学意义(P<0.05)。男性、<40岁、肠道、山东地区、甘肃地区肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异有统计学意义(P<0.05);女性、40~60岁、>60岁、肺部、胃部、其他部位、陕西地区、其他地区肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异无统计学意义(P>0.05)。结论国内肿瘤患者中UGT1A1*28和UGT1A1*6位点基因野生型纯合子频率均较高,但两位点基因型分布有差异,所以研究UGT1A1基因与伊立替康毒副作用时应联合检测UGT1A1*28和UGT1A1*6两个突变位点,并且应同时注意患者的性别、年龄、肿瘤部位及地区来源。
肿瘤;基因;突变;UGT1A1*28;UGT1A1*6
来向阳,衡雪源,车峰远,等.中国部分地区肿瘤患者UGT1A1*28和UGT1A1*6位点基因多态性分布的差异研究[J].中国全科医学,2016,19(30):3705-3710.[www.chinagp.net]
LAI X Y,HENG X Y,CHE F Y,et al.Frequency of UGTlA1*28 and UGTlA1*6 gene polymorphisms in cancer patients in some areas of China[J].Chinese General Practice,2016,19(30):3705-3710.
UGT1A基因家族位于人类2号染色体2q37的3′末端,是尿苷二磷酸葡糖苷酸转移酶(UGT)超家族的一员,是人体内对很多内源性化合物(如胆红素、雌激素、胆汁酸和脂溶性维生素等)以及外源性化合物(如伊立替康)进行生物转化、解毒并加强排泄的重要酶类[1]。UGT1A通过不同的剪接方式形成了9种有功能的转录产物,其中临床最常见也是对化疗药物伊立替康疗效和毒副作用影响最大的是UGT1A1[2]。近年来大量的临床试验证明,UGT1A1基因多态性与伊立替康导致的化疗相关性腹泻及中性粒细胞分数减少密切相关[3-5]。有研究证实,UGT1A1*28位点基因多态性是造成伊立替康剂量依赖性毒性的主要原因[6]。另外研究发现,UGT1A1基因多态性的分布在不同种族间存在明显差异[7],而UGT1A1*6位点基因多态性目前仅在亚洲人群中被发现,并且目前其与伊立替康毒副作用有无确切关联尚存在争议[8]。近年有报道提出,可以联合检测UGT1A1*28和UGT1A1*6来研究预测药物毒副作用的价值,但二者在人群中伴发的概率可能较高,联合检测二者的必要性尚存在质疑[7-8]。为了进一步明确中国人UGT1A1*28和UGT1A1*6位点基因多态性在肿瘤患者中的分布特点、差异以及有无联合检测了解药物毒副作用的必要,本研究通过收集山东、甘肃和陕西等地区241例肿瘤患者UGT1A1基因测序的资料,回顾性分析UGT1A1*28和UGT1A1*6位点基因多态性的分布特点,为研究有无联合检测二者了解伊立替康毒副作用的必要性寻找依据。
1 资料与方法
1.1临床资料收集2011年8月—2014年4月山东大学附属临沂市人民医院、临沂市肿瘤医院、兰州大学第一附属医院、西安交通大学第一附属医院、西京医院应用伊立替康治疗的住院肿瘤患者241例,均进行了UGT1A1*28位点基因多态性检测,男163例,女78例;年龄23~87岁,平均年龄(56.7±10.4)岁;肿瘤部位:肺部肿瘤105例,胃部肿瘤79例,肠道肿瘤40例,其他部位17例;地区来源:山东174例,甘肃37例,陕西25例,其他5例。其中177例同时进行了UGT1A1*6位点基因多态性检测,男123例,女54例;年龄23~79岁,平均年龄(57.4±10.4)岁;肿瘤部位:肺部肿瘤79例,胃部肿瘤53例,肠道肿瘤33例,其他部位12例;地区来源:山东130例,甘肃21例,陕西24例,其他2例。
1.2资料收集收集肿瘤患者的性别、年龄、肿瘤部位、地区来源等。
1.3治疗方法根据不同肿瘤患者病情选择不同的化疗方案,均采用伊立替康(齐鲁制药有限公司生产)180 mg/m2,第1天;每2周重复1次。
1.4基因组DNA提取和UGT1A1基因多态性检测化疗前清晨采集患者外周静脉血液4 ml,乙二胺四乙酸(EDTA)抗凝,提取基因组DNA并测定浓度。UGT1A1*28和UGT1A1*6位点基因多态性通过PCR扩增外显子1和启动子部分片段后直接测序来分析。扩增引物序列:上游引物为5′-TCCCTGCTACCTTTGTGGAC-3′,下游引物为5′-ACGCTGCAGGAAAGAATCAT-3′;PCR反应体系包括DNA模板10 μl、上游引物和下游引物各1 μl、PCR mix预混液(上海基星生物科技有限公司)10 μl、双蒸水(ddH2O)6 μl。每次PCR反应均设置阴性对照、空白对照及阳性对照作为实验质控。PCR反应在ABI 9700 PCR仪上进行,反应条件为:94 ℃预变性3 min;94 ℃变性20 s,64 ℃复性20 s,72 ℃延伸40 s,共40个循环,最后72 ℃ 7 min。获得的PCR产物,以0.15 U碱性磷酸酶和0.75 U外切核酸酶Ⅰ于37 ℃作用45 min。产物送济南珍康生物技术有限公司(中国基因组研究中心北方运行平台)进行测序。测序结果采用DNAStar软件显示,人工校读分析UGT1A1*28和UGT1A1*6位点基因型。
1.5统计学方法采用SPSS 11.5统计学软件进行数据处理。计数资料比较采用χ2检验或Fisher′s确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1UGT1A1基因型分布241例检测UGT1A1*28位点基因多态性的患者中,UGT1A1*28位点基因启动子区TA序列呈6次重复的野生型(TA6/6)即野生型纯合子(WW基因型携带者)180例(74.7%),TA序列6次和7次重复的杂合突变型(TA6/7)即突变型杂合子(WM基因型携带者)56例(23.2%),TA序列7次重复的纯合突变型(TA7/7)即突变型纯合子(MM基因型携带者)5例(2.1%);177例检测UGT1A1*6位点基因多态性的患者中,UGT1A1*6位点基因型为野生型(G/G)即WW基因型携带者106例(59.9%),杂合突变型(G/A)即WM基因型携带者62例(35.0%),纯合突变型(A/A)即MM基因型携带者9例(5.1%)。UGT1A1*28和UGT1A1*6位点基因型分布比较,差异有统计学意义(χ2=11.055,P=0.004)。
2.2不同临床特征肿瘤患者UGT1A1*28位点基因型分布不同性别、年龄、肿瘤部位、地区来源肿瘤患者UGT1A1*28位点基因型分布比较,差异均无统计学意义(P>0.05,见表1)。
表1不同临床特征肿瘤患者UGT1A1*28位点基因型分布比较〔n(%)〕
Table 1Comparison of the distribution of UGT1A1*28 genotype among cancer patients with different clinical features

临床特征例数基因型分布野生型纯合子 突变型杂合子 突变型纯合子P值性别0.480 男163123(75.5)38(23.3)2(1.2) 女7857(73.1)18(23.1)3(3.8)年龄(岁)0.127 <401515(100.0)00 40~6012993(72.1)34(26.4)2(1.5) >609772(74.2)22(22.7)3(3.1)肿瘤部位0.266 肺部10580(76.2)24(22.9)1(0.9) 胃部7959(74.7)18(22.8)2(2.5) 肠道4031(77.5)9(22.5)0 其他1710(58.8)5(29.4)2(11.8)地区来源0.305 山东174130(74.7)42(24.1)2(1.2) 甘肃3725(67.6)10(27.0)2(5.4) 陕西2520(80.0)4(16.0)1(4.0) 其他55(5/5)00
注:均采用Fisher′s确切概率法
2.3不同临床特征肿瘤患者UGT1A1*6位点基因型分布不同性别、年龄、地区来源肿瘤患者UGT1A1*6位点基因型分布比较,差异均无统计学意义(P>0.05);不同肿瘤部位患者UGT1A1*6位点基因型分布比较,差异有统计学意义(P<0.05,见表2)。
2.4不同性别肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较男性肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异有统计学意义(P=0.022);女性肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异无统计学意义(P=0.132)。
2.5不同年龄肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较<40岁肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异有统计学意义(P=0.001);40~60岁、>60岁肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异均无统计学意义(P=0.195、0.149)。
2.6不同肿瘤部位患者UGT1A1*28与UGT1A1*6位点基因型分布比较肠道肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异有统计学意义(P=0.007);肺部、胃部、其他部位肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异均无统计学意义(P=0.084、0.113、0.378)。
表2不同临床特征肿瘤患者UGT1A1*6位点基因型分布比较〔n(%)〕
Table 2Comparison of the distribution of UGT1A1*6 genotype among cancer patients with different clinical features
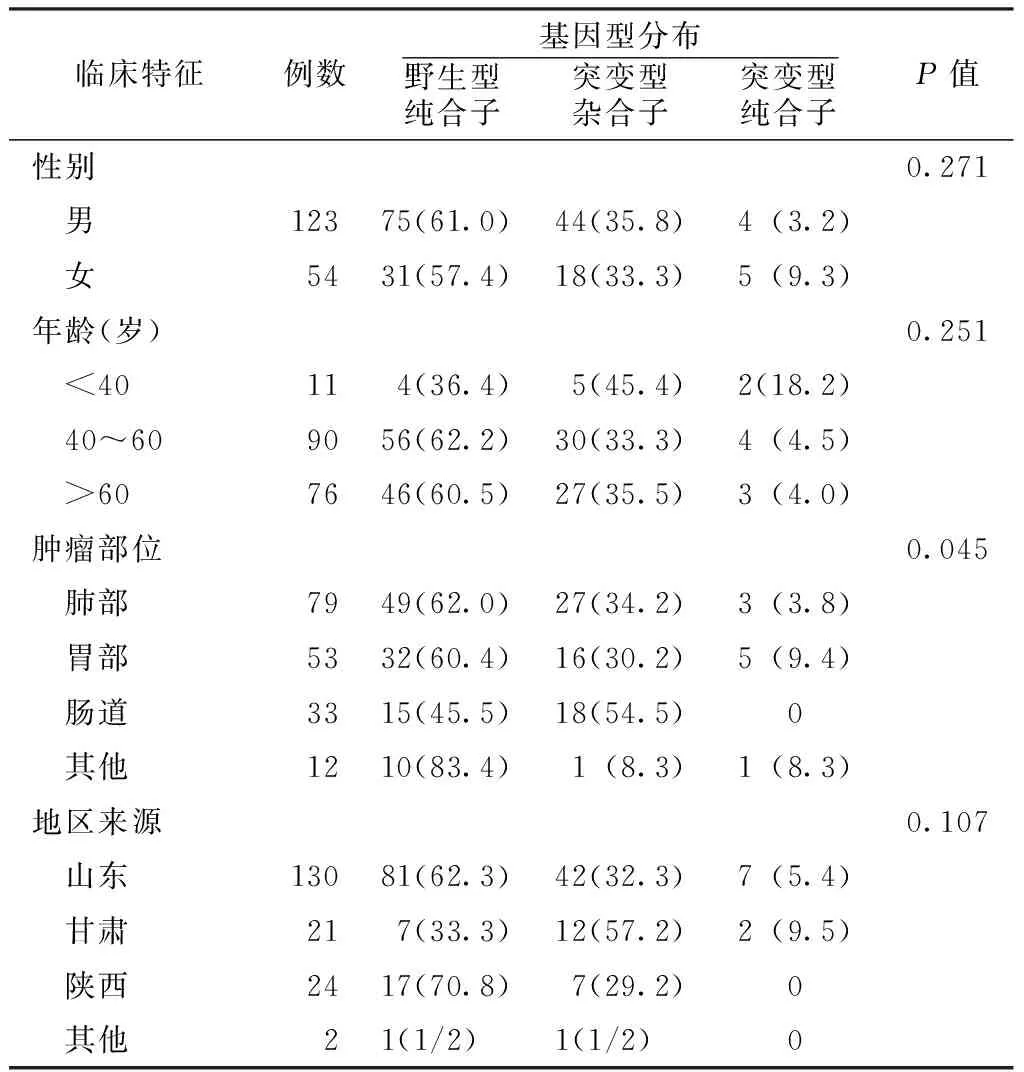
临床特征例数基因型分布野生型纯合子 突变型杂合子 突变型纯合子P值性别0.271 男12375(61.0)44(35.8)4(3.2) 女5431(57.4)18(33.3)5(9.3)年龄(岁)0.251 <40114(36.4)5(45.4)2(18.2) 40~609056(62.2)30(33.3)4(4.5) >607646(60.5)27(35.5)3(4.0)肿瘤部位0.045 肺部7949(62.0)27(34.2)3(3.8) 胃部5332(60.4)16(30.2)5(9.4) 肠道3315(45.5)18(54.5)0 其他1210(83.4)1(8.3)1(8.3)地区来源0.107 山东13081(62.3)42(32.3)7(5.4) 甘肃217(33.3)12(57.2)2(9.5) 陕西2417(70.8)7(29.2)0 其他21(1/2)1(1/2)0
注:均采用Fisher′s确切概率法
2.7不同地区来源肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较山东地区、甘肃地区肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异均有统计学意义(P=0.020、0.030);陕西地区和其他地区肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布比较,差异均无统计学意义(P=0.400、0.280)。
3 讨论
伊立替康是临床上治疗结直肠癌、胃癌、肺癌等实体肿瘤的常用化疗药物,临床试验证实,伊立替康可以明显延长患者的生存期[9-10],但部分患者应用伊立替康时会出现严重的毒副作用,包括迟发型腹泻和中性粒细胞分数减少等,严重者可以导致死亡,一项Ⅲ期随机对照研究发现,Ⅲ~Ⅳ度迟发型腹泻和中性粒细胞分数减少发生率分别可以达44.4%和28.8%[11]。近年来研究发现,伊立替康导致迟发型腹泻和/或中性粒细胞分数减少与UGT1A1基因多态性相关[3-5]。UGT1A1基因突变后可以引起UGT1A1酶的活性下降或缺失,使经过UGT1A1酶代谢的伊立替康的毒性增加,因此美国食品药品监督管理局(FDA)于2005年要求在伊立替康的药品标签上增加与药物遗传学相关的信息,并要求医生为使用伊立替康的患者进行UGT1A1基因多态性检测,并根据基因多态性检测的结果来指导临床用药剂量[12]。
UGT1A1基因有多个已知突变位点,目前研究最多的位点主要集中在UGT1A1基因启动子区TATA序列及第1外显子区突变[13]。UGT1A1基因启动子区存在大量TA碱基重复序列,最常见的为6个TA重复序列,即(TA6/6或*1/*1);UGT1A1*28为7个TA重复序列,包括纯合突变型(TA7/7或*28/*28)和杂合突变型(TA6/7或*1/*28),UGT1A1*6位点的多态性表现为211 G>A,形成3种基因型:G/G、A/G、A/A[8]。UGT1A1*28位点基因多态性更是国内外学者研究的热点,1篇纳入国内外23篇文献包括2 454例高加索、631例亚洲肿瘤患者的荟萃分析显示,UGT1A1*28位点MM基因型携带者或WM基因型携带者发生中性粒细胞分数减少和迟发型腹泻的风险均显著高于WW基因型携带者[14]。而有研究发现,亚洲人UGT1A1*6位点基因变异更为多见,其中MM突变可以使UGT1A1酶活性降低51%[15]。1项纳入10篇文献包含1 027例亚洲肿瘤患者的荟萃分析显示,UGT1A1*6位点MM基因型携带者发生严重迟发型腹泻的风险显著高于WW基因型携带者,UGT1A1*6位点WM基因型携带者或MM基因型携带者发生严重中性粒细胞分数减少的风险显著高于WW基因型携带者,而且与剂量无关[16]。这些数据表明,检测亚洲肿瘤患者UGT1A1*28和UGT1A1*6位点的突变情况对了解药物毒副作用均很重要。
近年多个研究提出,可以通过联合检测UGT1A1*28和UGT1A1*6位点基因多态性来研究预测药物毒副作用的价值[17-20],但人群中二者的分布差异特点尚未见报道。本研究241例检测UGT1A1*28位点基因多态性患者中,WW基因型携带者180例(74.7%),WM基因型携带者56例(23.2%),MM基因型携带者5例(2.1%);177例检测UGT1A1*6位点基因多态性患者中,WW基因型携带者106例(59.9%),WM基因型携带者62例(35.0%),MM基因型携带者9例(5.1%)。与国内其他学者研究结果相近[17-18,21-23]。说明在中国肿瘤患者中UGT1A1*28和UGT1A1*6位点基因突变率均较高。本研究同时发现,UGTlA1*28与UGT1A1*6位点基因型分布有差异,这也提示中国肿瘤患者需同时检测UGT1A1*28和UGT1A1*6位点基因多态性,才能更好地为临床治疗提供指导意见。
有研究报道,UGT1A1基因多态性存在明显的种族差异,亚洲人群UGT1A1*28位点WM、MM基因突变率显著低于白种人和非洲人,而UGT1A1*6位点WM、MM基因突变率显著高于白种人[21,24]。本研究中UGT1A1*28位点MM基因型携带者很少见(仅2.1%),显著低于国外白种人的8.9%[25];而UGT1A1*28位点WW基因型携带者达74.7%,显著高于国外白种人的58.4%[25],与王岩等[21]的研究结果一致。本研究中肠道肿瘤患者UGTlA1*6位点WM、MM基因型携带者显著高于日本肠道肿瘤患者(39.6%与21.3%)[26],提示国内肠道肿瘤患者UGTlA1*6位点基因多态性和日本肠道肿瘤患者间存在差异。
本研究中男性肿瘤患者UGT1A1*28和UGT1A1*6位点基因型分布有差异,与总体研究结果一致;而女性肿瘤患者UGT1A1*28和UGT1A1*6位点基因型分布无差异,与总体研究结果不一致。提示肿瘤患者UGT1A1*28和UGT1A1*6位点基因型分布可能存在性别差异。本研究中<40岁的肿瘤患者UGT1A1*28和UGT1A1*6位点基因型分布有差异,UGTlA1*28位点WM、MM基因型携带者均为0;而UGT1A1*6位点WM、MM基因型携带者达63.6%。提示年轻的肿瘤患者UGT1A1*6位点较UGT1A1*28位点更容易发生WM、MM基因突变,在临床实践中检测中国年轻的肿瘤患者基因多态性时,更应该关注UGTlA1*6位点。本研究中,肠道肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布有差异,而肺部、胃部、其他部位肿瘤患者UGT1A1*28与UGT1A1*6位点基因型分布无差异。提示对中国肠道肿瘤患者检测基因多态性时,更应该关注UGTlA1*6位点。本研究还发现山东和甘肃两地的肿瘤患者UGT1A1*28和UGT1A1*6位点基因型分布均有差异,与总体研究结果一致;而陕西地区肿瘤患者UGT1A1*28和UGT1A1*6位点基因型分布无差异。提示肿瘤患者UGT1A1*28和UGT1A1*6位点基因型分布可能存在地域差异。
根据以上研究结果,本文得出结论,我国肿瘤患者UGT1A1*28和UGT1A1*6位点基因突变率均较高,但UGT1A1*6位点基因型分布与UGT1A1*28位点有差异,有联合检测二者研究伊立替康毒副作用的必要。
综上所述,我国需接受伊立替康化疗的肿瘤患者在化疗前检测UGT1A1基因多态性时,应联合检测UGT1A1*28和UGT1A1*6位点,而且同时应注意患者性别、年龄、肿瘤部位和地区来源等特点,并进一步探索其与伊立替康延迟型腹泻的相关性特点,以期指导临床合理用药,规避相关用药风险,有必要进一步在中国人群中进行UGT1A1基因检测,完善中国人群UGT1A1基因突变库。但本研究仍存在较大的局限性:(1)所纳入临床患者资料为回顾性分析资料,因此数据采集上的选择性偏倚不可避免;(2)样本量较小,所涉及患者区域少,尚需要大样本量的临床资料进一步补充。
作者贡献:来向阳、衡雪源、李峥嵘进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;王守峰、石建华、蔡利娟进行试验实施、评估、资料收集;车峰远、张金岭、黄伟进行质量控制及审校。
本文无利益冲突。
[1]SUGATANI J.Function,genetic polymorphism,and transcriptional regulation of human UDP-glucuronosyltransferase (UGT) 1A1[J].Drug Metab Pharmacokinet,2013,28(2):83-92.
[2]WANG Y,SHEN L,XU N,et al.UGT1A1 predicts outcome in colorectal cancer treated with irinotecan and fluorouracil[J].World J Gastroenterol,2012,18(45):6635-6644.
[3]TAKANO M,KATO M,YOSHIKAWA T,et al.Clinical significance of UDP-glucuronosyltransferase 1A1*6 for toxicities of combination chemotherapy with irinotecan and cisplatin in gynecologic cancers:a prospective multi-institutional study[J].Oncology,2009,76(5):315-321.
[4]INNOCENTI F,UNDEVIA S D,IYER L,et al.Genetic variants in the UDP-glucuronosyltransferase 1A1 gene predict the risk of severe neutropenia of irinotecan[J].J Clin Oncol,2004,22(8):1382-1388.
[5]SCHULZ C,BOECK S,HEINEMANN V,et al.UGT1A1 genotyping:a predictor of irinotecan-associated side effects and drug efficacy[J].Anticancer Drugs,2009,20(10):867-879.
[6]FARHEEN S,SENGUPTA S,SANTRA A,et al.Gilbert′s syndrome:high frequency of the (TA)7 TAA allele in India and its interaction with a novel CAT insertion in promoter of the gene for bilirubin UDP-glucuronosyltransferase 1 gene[J].World J Gastroenterol,2006,12(14):2269-2275.
[7]OHNO S,NAKAJIN S.Determination of mRNA expression of human UDP-glucuronosyltransferases and application for localization in various human tissues by real-time reverse transcriptase-polymerase chain reaction[J].Drug Metab Dispos,2009,37(1):32-40.
[8]TEH L K,HASHIM H,ZAKARIA Z A,et al.Polymorphisms of UGT1A1*6,UGT1A1*27 & UGT1A1*28 in three major ethnic groups from Malaysia[J].Indian J Med Res,2012,136(2):249-259.
[9]周建红,李桂生,李高峰,等.伊立替康联合雷替曲塞在晚期结直肠癌二线化疗中的疗效及安全性研究[J].中国全科医学,2013,16(2):555-557.
ZHOU J H,LI G S,LI G F,et al.Efficacy and safety of irinotecan combined with raltitrexed as second-line chemotherapy for advanced colorectal cancer[J].Chinese General Practice,2013,16(2):555-557.
[10]SALTZ L B,COX J V,BLANKE C,et al.Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer.Irinotecan Study Group[J].N Engl J Med,2000,343(13):905-914.
[11]DOUILLARD J Y,CUNNINGHAM D,ROTH A D,et al.Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer:a multicentre randomised trial[J].Lancet,2000,355(9209):1041-1047.
[12]OˊDWYER P J,CATALANO R B.Uridine diphosphate glucuronosyhransferase(UGT)1A1 and ifinotecan:practical pharmacogenomics arrives in cancer therapy[J].J Clin Oncol,2006,24(28):4534-4538.
[13]田玉廷.UGT1A1基因多态性研究进展[J].实用癌症杂志,2013,28(3):324-326.
[14]原振龑,闫涵,李琴,等.UGT1A1*28 基因多态性与伊立替康相关不良反应的Meta分析[J].中华临床医师杂志(电子版),2013,7(19):8791-8798.
YUAN Z Y,YAN H,LI Q,et al.Association between the polymorphisms of UGT1A1*28 genotype and Irinotecan-related toxicity:a Meta-analysis[J].Chinese Journal of Clinicians(Electronic Edition),2013,7(19):8791-8798.
[15]SATOH T,URA T,YAMADA Y,et al.Genotype-direeted,dose-finding study of irinotecan in cancer patients with UGTl A1*28 and/or UGT1A1*6 polymorphisms[J].Cancer Sci,2011,102(10):1868-1873.
[16]CHENG L,LI M,HU J,et al.UGT1A1*6 polymorphisms are correlated with irinotecan-induced toxicity:a system review and meta-analysis in Asians[J].Cancer Chemother Pharmacol,2014,73(3):551-560.
[17]蔡贞,温淑娟,郑磊,等.UGT1A1*28和UGT1A1*6基因多态性在结直肠癌患者中的分布调查[J].实用检验医师杂志,2013,5(2):72-75.
CAI Z,WEN S J,ZHENG L,et al.Investigation the frequency of UGT1A1*28 and UGT1A1*6 gene polymorphisms in colorectal cancer patients[J].Chinese Jouranl of Clinical Pathologist,2013,5(2):72-75.
[18]徐静,朱海涛,邵茜雯,等.尿苷磷酸葡萄糖醛酸转移酶A1基因多态性与伊立替康为主化疗方案不良反应的关系[J].中华实验外科杂志,2014,31(2):431-434.
XU J,ZHU H T,SHAO Q W,et al.Relationship between UDP-glucuronosyltransferase 1A1 gene polymorphisms and toxicity in pafients with cancer treated with irinotecan-based chemotherapy[J].Chinese Journal of Experimental Surgery,2014,31(2):431-434.
[19]DI PAOLO A,BOCCI G,POLILLO M,et al.Pharmaeokinetie and pharmaeogenetic predictive markers of irinoteean activity and toxicity[J].Curr Drug Metab,2011,12(10):932-943.
[20]MARQUES S C,IKEDIOBI O N.The clinical application of UGT1A1 pharmaeogenetie testing:gene-environment interactions[J].Hum Genomies,2010,4(4):238-249.
[21]王岩,徐建明,沈琳,等.中国人尿苷二磷酸葡糖苷酸转移酶1A基因多态性与伊立替康毒性的相关性[J].中华肿瘤杂志,2007,29(12):913-916.
WANG Y,XU J M,SHEN L,et al.Polymorphisms of UGT1A gene and irinotecan toxicity in Chinese colorectal cancer patients[J].Chinese Journal of Oncology,2007,29(12):913-916.
[22]宋丽雪,王金萍,高昕,等.尿苷二磷酸葡糖醛酸基转移酶1家族肽A基因多态性与伊立替康所致不良反应的相关性研究[J].药物不良反应杂志,2013,15(3):136-140.
SONG L X,WANG J P,GAO X,et al.Correlation between UDP-glucuronosyltransferase 1 gene polymorphism and the adverse reactions due to irinotecan[J].Adverse Drug Reactions Journal,2013,15(3):136-140.
[23]LI M,WANG Z,GUO J,et al.Clinical significance of UGT1A1 gene polymorphisms on irinotecan-based regimens as the treatment in metastatic colorectal cancer[J].Onco Targets Ther,2014,7:1653-1661.
[24]HAN J Y,LIM H S,PARK Y H,et al.Integrated pharmacogenetic prediction of irinotecan pharmacokinetics and toxicity in patients with advanced non-small cell lung cancer[J].Lung Cancer,2009,63(1):115-120.
[25]LAMAS M J,DURAN G,BALBOA E,et al.The value of genetic polymorphisms to predict toxicity in metastatic colorectal patients with irinotecan-based regimens[J].Cancer Chemother Pharmacol,2012,69(6):1591-1599.
[26]HAZAMA S,MISHIMA H,TSUNEDOMI R,et al.UGT1A1*6,1A7*3,and 1A9*22 genotypes predict severe neutropenia in FOLFIRI-treated metastatic colorectal cancer in two prospective studies in Japan[J].Cancer Sci,2013,104(12):1662-1669.
(本文编辑:陈素芳)
Frequency of UGTlA1*28 and UGTlA1*6 Gene Polymorphisms in Cancer Patients in Some Areas of China
LAIXiang-yang,HENGXue-yuan,CHEFeng-yuan,WANGShou-feng,SHIJian-hua,CAILi-juan,ZHANGJin-ling,HUANGWei,LIZheng-rong.
DepartmentofPharmacy,LinyiPeople′sHospitalAffiliatedtoShandongUniversity,Linyi276000,China
Correspondingauthor:ZHANGJin-ling,DepartmentofOncology,LinyiPeople′sHospitalAffiliatedtoShandongUniversity,Linyi276000,China;E-mail:jinlingzhang_931@163.com
ObjectiveTo investigate the frequency of UGT1A1*28 and UGT1A1*6 gene polymorphisms in cancer patients in some areas of China,and explore the distribution difference of the frequency of UGT1A1*28 and UGT1A1*6 gene among cancer patients.Methods241 hospitalized cancer patients who were treated with irinotecan in Linyi People′s Hospital Affiliated to Shandong University,Linyi Cancer Hospital,the First Affiliated Hospital of Lanzhou University,the First Affiliated Hospital of Xi′an Jiaotong University and Xijing Hospital from August 2011 to April 2014,underwent UGT1A1*28 genetic polymorphism analysis,among whom 177 patients underwent UGT1A1*6 genetic polymorphism analysis.Genomic DNA was extracted,UGT1A1 gene was amplified by PCR,DNA sequencing was used to know the genotype distribution of UGT1A1*28 and UGT1A1*6 gene.Results241 patients underwent UGT1A1*28 genetic polymorphism analysis,TA sequences in UGT1A1*28 gene promoter region repeated for 6 times (TA6/6) among 180 cases (74.7%),that is,wild homozygous genotype,TA sequences repeated for 6 times or 7 times (TA6/7) among 56 cases (23.2%),that is,heterozygous mutant genotype,and TA sequences repeated for 7 times (TA7/7) among 5 cases (2.1%),that is,homozygous mutant genotype;177 cases underwent UGT1A1*6 genetic polymorphism analysis,106 cases (59.9%) were wild homozygous genotype,62 cases (35.0%) were heterozygous mutant genotype,and 9 cases(5.1%)were homozygous mutant genotype.There was significant difference in the distribution of gene polymorphisms between UGT1A1*28 and UGT1A1*6 gene (P<0.05).There was no significant difference in the distribution of UGT1A1*28 genotype among groups with different gender,age,tumor location and hometown (P>0.05).There was no significant difference in the distribution of UGT1A1*6 genotype among groups with different gender,age and hometown (P>0.05);there was significant difference in the distribution of UGT1A1*6 genotype among groups with different tumor location (P<0.05).There was significant difference in the distribution of gene polymorphisms between UGT1A1*28 and UGT1A1*6 gene among male group,<40 years old group,intestinal tumor group,Shandong region group and Gansu region group,respectively (P<0.05).There was no significant difference in the distribution of gene polymorphisms between UGT1A1*28 and UGT1A1*6 gene among female group,40-60 years old group,>60 years old group,lung tumor group,stomach tumor group,Shaanxi region group and other region group,respectively (P>0.05).ConclusionThe frequencies of wild homozygous genotype in UGT1A1*28 and UGT1A1*6 gene among cancer patients are relatively high.There was significant difference in the distribution of gene polymorphisms between UGT1A1*28 and UGT1A1*6 gene.In order to study UGT1A1 gene and side effects of irinotecan better,mutant sites of both UGT1A1*28 and UGT1A1*6 should be tested,and gender,age,tumor location,hometown of patients should be paid attention to.
Neoplasms;Genes;Mutation;UGT1A1*28;UGT1A1*6
国家自然科学基金资助项目(81402538);山东省自然科学基金资助项目(ZR2014HL062);山东省医药卫生科技发展计划项目(2013WS0082)
276000山东省临沂市,山东大学附属临沂市人民医院药学部(来向阳,李峥嵘),肿瘤科(衡雪源,车峰远,王守峰,张金岭);临沂市肿瘤医院(石建华);济南珍康生物技术有限公司(蔡利娟);山东省放射肿瘤学重点实验室 山东省肿瘤医院放疗六病区(黄伟)
张金岭,276000山东省临沂市,山东大学附属临沂市人民医院肿瘤科;E-mail:jinlingzhang_931@163.com
R 73
A
10.3969/j.issn.1007-9572.2016.30.013
2016-02-24;
2016-07-16)

