阿托伐他汀对ApoE基因敲除小鼠血管外膜成纤维细胞表型的影响*
徐 芳, 刘 颖, 齐 洁, 石 磊, 胡业佳, 王蔚琛, 蔡虹静, 刘 巍, 李钰伶
(1滨州医学院病理生理学教研室,山东 烟台 264003;2滨州医学院附属医院,山东 滨州 256603)
阿托伐他汀对ApoE基因敲除小鼠血管外膜成纤维细胞表型的影响*
徐 芳1△, 刘 颖2, 齐 洁2, 石 磊1, 胡业佳1, 王蔚琛1, 蔡虹静1, 刘 巍1, 李钰伶1
(1滨州医学院病理生理学教研室,山东 烟台 264003;2滨州医学院附属医院,山东 滨州 256603)
目的: 观察载脂蛋白E基因敲除(ApoE-/-)小鼠动脉粥样硬化斑块形成过程中血管外膜α-平滑肌肌动蛋白(α-SMA)和转化生长因子-β1(TGF-β1)的表达变化,同时探讨阿托伐他汀抗动脉粥样硬化的作用机制。方法: 选择40只6周龄雄性ApoE-/-小鼠随机分为模型组和阿托伐他汀干预组,给予高脂饲料喂养。阿托伐他汀干预组给予阿托伐他汀(20 mg·kg-1·d-1)灌胃,模型组给予等量生理盐水灌胃。20只同龄C57BL/6小鼠给予普通饲料喂养作为正常对照组。各组小鼠喂养至10、15周龄,在各个时点处死动物,取升主动脉制备连续切片,通过Movat染色进行形态学观察,测量并计算血管外膜厚度及斑块相对面积;天狼星红染色检测胶原的表达;免疫组织化学染色检测不同时点血管外膜α-SMA及TGF-β1的表达变化。用实时荧光定量PCR检测胸主动脉外膜中TGF-β1 mRNA的表达水平,通过Western blot 法检测主动脉外膜中TGF-β1蛋白的表达。结果: 与模型组相比,阿托伐他汀干预组的斑块相对面积明显减小,血管外膜厚度及胶原合成明显下降;免疫组化结果显示 15周龄模型组血管外膜α-SMA及TGF-β1的表达高于10周龄模型组;与模型组相比,阿托伐他汀干预组血管外膜α-SMA及TGF-β1的表达明显下降。各时点模型组的TGF-β1 mRNA和蛋白的表达明显高于对照组,给药干预后TGF-β1 mRNA和蛋白的表达明显降低。15周龄模型组血管外膜TGF-β1 mRNA和蛋白的表达高于10周龄模型组。结论: 阿托伐他汀可能通过下调TGF-β1的表达调控血管外膜成纤维细胞表型的改变,进而延缓ApoE-/-小鼠动脉粥样硬化的进程。
ApoE-/-小鼠; 动脉粥样硬化; 成纤维细胞; 表型; 阿托伐他汀
动脉粥样硬化(atherosclerosis,AS)是多种原因引起的由一系列复杂分子和细胞参与的病理过程,长期以来AS一直是心血管疾病发生的最主要的病理基础。但是血管外膜在AS中的作用被长期忽视,外膜曾一度被认为只是血管外周一层松散的结缔组织,是血管外层无功能的包裹物[1]。然而越来越多的实验证据提示血管外膜可以通过组织学、生物化学和功能特性的改变直接或间接地来调节血管对损伤和应激的反应能力,在维持整个血管系统的动态平衡中发挥着重要作用[2-4]。成纤维细胞作为外膜最主要的细胞成分,在应对炎症、环境应激(如缺氧、缺血)和损伤等的反应中往往是最先被激活[5-6]。
许多研究发现他汀类除调脂作用外,还具有改善血管内皮细胞功能、抗炎、抗氧化、抑制血管平滑肌细胞增生等其它作用[7]。但是关于他汀对血管外膜作用的报道甚少,本研究拟观察阿托伐他汀对ApoE-/-小鼠动脉粥样硬化斑块形成过程中血管外膜 α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和转化生长因子-β1(transforming growth factor-β1,TGF-β1)表达的影响,探讨阿托伐他汀抗动脉粥样硬化的作用机制。
材 料 和 方 法
1 动物和试剂
6周龄ApoE-/-雄性小鼠和C57BL/6小鼠均购自北京大学医学部实验动物中心,合格证编号为SCXK(京)2011-0012。
阿托伐他汀由美国辉瑞公司惠赠,用0.9%氯化钠溶解;抗小鼠vimentin抗体、抗小鼠α-SMA抗体均购于NeoMarkers;免疫组化试剂盒购自福州迈新试剂公司;兔多克隆抗TGF-β1抗体购自Santa Cruz;即用型SP免疫组化试剂盒购于北京中杉金桥生物技术公司;链霉亲和素-生物素-cy3(strept avidin-biotin complex-cy3,SABC-cy3) 试剂盒购于武汉博士德公司;TRIzol、反转录试剂盒、SYBR®Green荧光定量PCR试剂盒购于大连宝生物公司。
2 方法
2.1 动物分组 选取40只6周龄雄性ApoE-/-小鼠给予高脂饲料喂养(78.85%基础饲料+21%脂肪+0.15%胆固醇),随机分为模型组(生理盐水,0.1~0.2 mL,ig)和阿托伐他汀干预组(阿托伐他汀,20 mg·kg-1·d-1,ig),每组20只。同龄C57BL/6雄性小鼠作为正常对照组,给予普通饲料喂养。
2.2 标本处理 每组小鼠喂养至10周龄和15周龄,各取10只在各个时点处死动物,无菌条件下将心脏在升主动脉水平分离出来,将心脏从左右心耳底缘1~2 mm处水平分开,4%多聚甲醛固定后石蜡包埋制备连续切片,用于Movat染色、天狼星红染色及免疫组化染色。分离胸腹主动脉,解剖显微镜下剥离外膜,-80 ℃ 冻存。
2.3 Movat染色 步骤参照文献[8]进行。由图像分析系统Image Pro Plus 6.0测算斑块面积与血管管腔面积相对比值,测量血管外膜厚度。
2.4 天狼星红染色 部分切片经天狼星红染色后在偏振光显微镜下观察拍照,Image-Pro Plus 6.0测定胶原所占面积。
2.5 免疫组织化学染色 选取部分切片进行免疫组织化学染色检测α-SMA和vimentin的表达,按组织免疫组化试剂盒说明书进行操作。部分切片通过免疫荧光染色检测TGF-β1的表达,按SABC-cy3试剂盒说明书进行操作,显微镜下观察采集图像,由图像分析系统Image Pro Plus 6.0分析平均光密度值。
2.6 实时荧光定量PCR 采用TRIzol两步法抽提胸腹主动脉外膜的总RNA;反转录按照TaKaRa的反转录试剂盒进行。10 μL反应体系为RNA 2 μL、5×PrimeScript buffer 2 μL、PrimeScript RT Enzyme Mix I 0.5 μL、Oligo dT Prime 0.5 μL、Random 6 mers 0.5 μL,去RNA酶水 4.5 μL。反应条件为37 ℃ 15 min、85 ℃ 5 s,1个循环后得到的cDNA于-20℃保存备用。荧光定量PCR反应所用 GAPDH的上游引物序列为5′-AACTGCTTAGCACCCCTGGC-3′,下游引物序列为5′-ATGACCTTGCCCACACAGCCTT-3′;TGF-β1的上游引物序列为5′-CGTCAGACATTCGGGAAGC-3′,下游引物序列为5′-ACGTCAAAAGACAGCCACTC-3′。实时荧光定量PCR反应体系为SYBR®PrimeExTaq(Tli RNaseH Plus) 10 μL、PCR上游引物(10 μmol/L) 0.4 μL,PCR下游引物(10 μmol/L) 0.4 μL、ROX Reference Dye(50×)0.4 μL、DNA模板 2 μL、dH2O 6.8 μL;反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s, 共40个循环。反应结束,设定最佳阈值得到Ct值。用2-ΔΔCt法计算。实验重复3次。
2.7 Western blot 法检测蛋白表达水平 取各组小鼠胸腹主动脉外膜组织,提取蛋白后进行蛋白定量;进行SDS-聚丙烯酰胺凝胶电泳,湿转法将蛋白质转移至硝酸纤维素膜。 封闭液封闭2 h后,加入TGF-β1(1∶100)和β-actin(1∶1 000)I抗4 ℃过夜。洗膜液洗膜3次,洗膜后加入HRP标记的II抗(1∶2 500)37 ℃孵育1 h,然后洗膜液洗膜3次,ECL发光,曝光后扫描,以目的条带和内参照β-actin的光密度比值表示TGF-β1蛋白的表达水平。
3 统计学处理
检测结果以均数±标准差(mean±SD)表示,采用SPSS 13.0软件进行统计分析,组间均数比较采用单因素方差分析,2组间样本均数比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 不同周龄小鼠主动脉组织的形态学变化
C57BL/6小鼠主动脉壁厚薄均匀,内膜完整,无动脉粥样硬化斑块形成,血管外膜未见明显病理变化。10周龄ApoE-/-小鼠模型组局部内膜增厚,并有泡沫细胞聚集;干预组内膜局部稍有增厚,少量泡沫细胞。15周龄ApoE-/-小鼠模型组主动脉内膜明显增厚,局部可见腔内明显凸起的纤维斑块,干预组病变程度较模型组显著减轻,见图1。
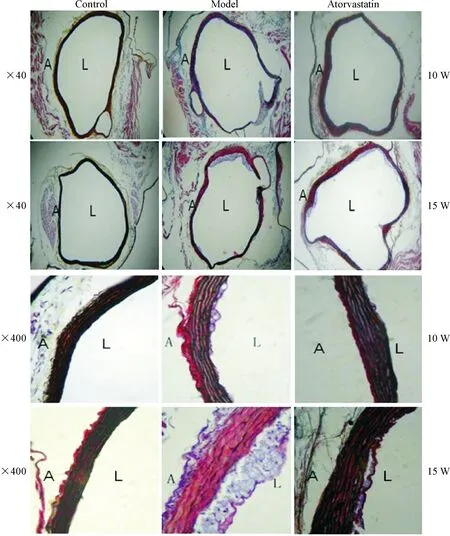
Figure 1. The pathological changes of arterial tissues in each group. A: adventitia; L: lumen; W: weeks.
图1 各组小鼠主动脉组织形态学观察
2 不同周龄小鼠主动脉粥样硬化斑块的面积及外膜厚度的定量分析
10周龄模型组、阿托伐他汀干预组和正常对照组AS斑块面积/管腔总面积分别为0.20±0.03、0.14±0.01和0,外膜厚度分别为(76.88±6.17) μm、(50.51±5.54) μm和(26.43±3.32) μm;15周龄模型组、阿托伐他汀干预组和正常对照组 AS 斑块面积/管腔总面积分别为0.44±0.03、0.23±0.02和0,外膜厚度分别为(114.93±4.32) μm、(78.64±5.72) μm和(25.51±2.89) μm;与10周龄模型组比较,15周龄模型组斑块面积/管腔总面积显著增大(P<0.05),外膜厚度增加(P<0.05);同一时点小鼠斑块面积/管腔总面积及外膜厚度相比较,阿托伐他汀干预组明显小于模型组(P<0.05),见图2、表1。

Figure 2.The changes of plaque area/lumen area in different groups. W: weeks. Mean±SD.n=10.*P<0.05vsmodel;#P<0.05vs10 W.
图2 各组小鼠不同周龄斑块面积/管腔面积比值的比较
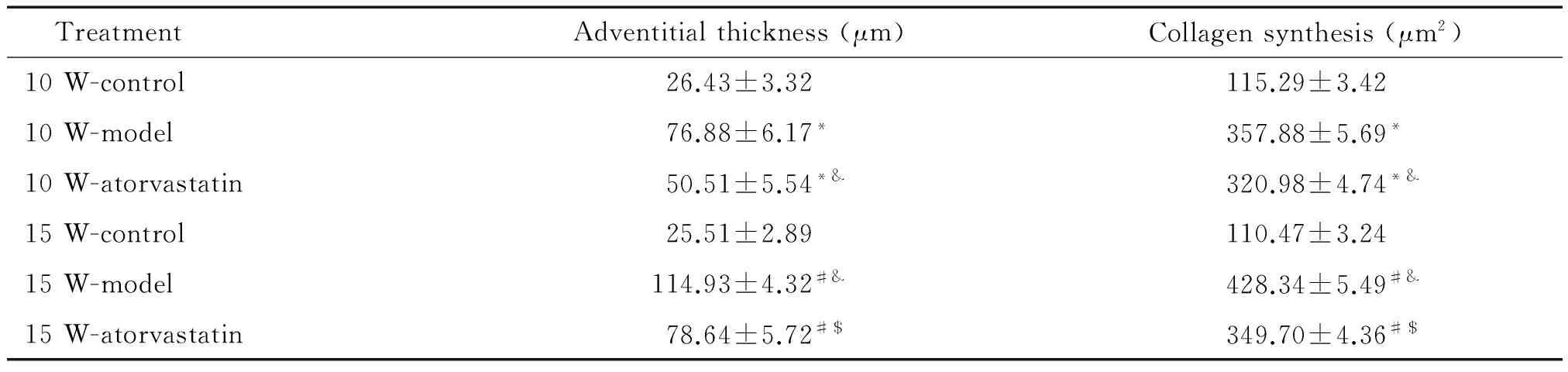
表1 各组小鼠血管外膜厚度及胶原合成的比较
W: weeks.*P<0.05vs10 W-control;#P<0.05vs15 W-control;&P<0.05vs10 W-model;$P<0.05vs15 W-model.
3 不同周龄小鼠主动脉的胶原合成比较
10周龄模型组、阿托伐他汀干预组与正常对照组血管外膜胶原所占面积分别为(357.88±5.69) μm2、(320.98±4.74) μm2、(115.29±3.42) μm2;15周龄模型组、阿托伐他汀干预组与正常对照组血管外膜胶原所占面积分别为(428.34±5.49) μm2,(349.70±4.36) μm2,(110.47±3.24) μm2,各模型组血管外膜胶原合成明显高于对照组。与10周龄模型组比较,15周龄模型组血管外膜胶原合成明显增加(P<0.05),同一时点相比较,阿托伐他汀干预组外膜胶原合成明显低于模型组(P<0.05),见图3、表1。
4 不同周龄小鼠主动脉外膜α-SMA、vimentin及TGF-β1的表达水平
10周、15周ApoE-/-小鼠血管外膜大部分细胞呈现vimentin阳性表达, 部分细胞呈现α-SMA的阳性表达,显示检测细胞为成纤维细胞,并表现出转化为肌成纤维细胞的特性。而C57BL/6小鼠血管外膜细胞只检测到vimentin的阳性表达,始终未检测到α-SMA的阳性表达。15周龄模型组血管外膜α-SMA及TGF-β1的表达高于10周龄模型组(P<0.05);与模型组相比,阿托伐他汀干预组血管外膜α-SMA及TGF-β1的表达明显下降(P<0.05),见图4~6。
5 不同周龄小鼠主动脉外膜TGF-β1 mRNA的表达水平
各时点模型组TGF-β1 mRNA的表达明显高于对照组(P<0.05),阿托伐他汀干预后TGF-β1 mRNA的表达明显降低(P<0.05)。15周龄模型组血管外膜TGF-β1 mRNA的表达高于10周龄模型组(P<0.05),见图7。
6 不同周龄小鼠主动脉外膜TGF-β1蛋白的表达水平
各时点模型组的TGF-β1蛋白的表达明显高于对照组(P<0.05),阿托伐他汀干预后TGF-β1蛋白的表达明显降低(P<0.05)。15周龄模型组血管外膜TGF-β1蛋白表达高于10周龄模型组(P<0.05),见图8。
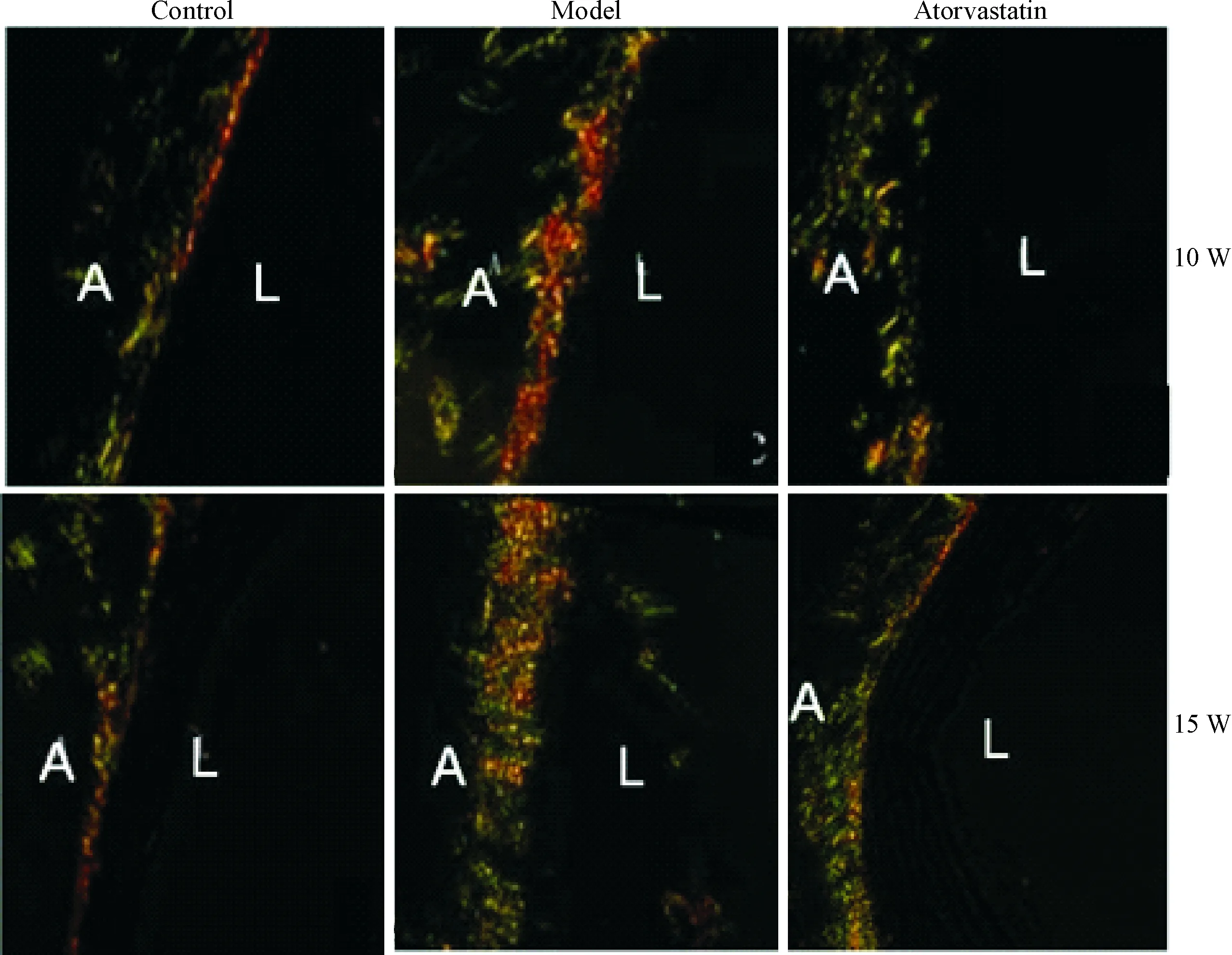
Figure 3.Sirius red staining for collagen fibers (×400). A: adventitia; L: lumen; W: weeks.
图3 胶原合成的天狼星红染色观察
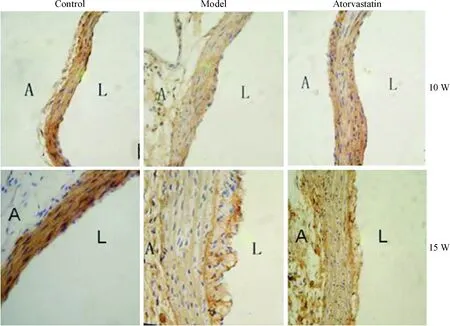
Figure 4. Immunohistochemical staining for vimentin (×400). A: adventitia; L: lumen; W: weeks.
图4 Vimentin的免疫组化染色
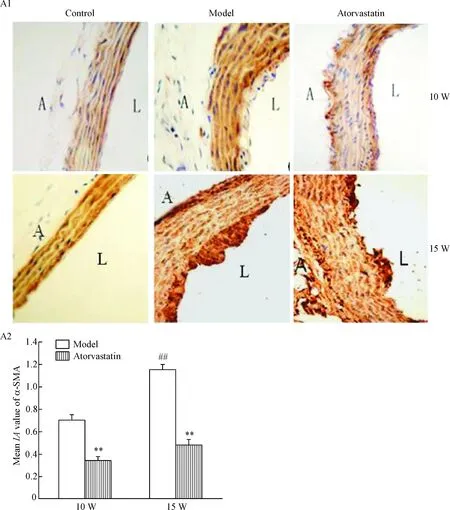
Figure 5.The changes of α-SMA in the adventitia of different groups. A1: immunohistochemical staining for α-SMA (×400). A: adventitia; L: lumen. A2: the changes of α-SMA (quantitatively expressed as meanIAvalue) in the adventitia of different groups. W: weeks. Mean±SD.n=10.##P<0.01vs10 W;**P<0.01vsmodel.
图5 比较各组小鼠主动脉外膜α-SMA的表达
讨 论
长期以来血管内皮细胞损伤、血管平滑肌细胞增殖被认为在AS发生发展中起着关键作用,其中内皮细胞损伤是AS病灶形成的始动环节。而血管外膜特别是成纤维细胞的作用长期被忽视。随着研究的进一步深入,越来越多的实验证据显示外膜可以通过由外而内的作用方式影响血管中膜及内膜,在AS病灶的形成和发展过程中,外膜不是无辜的旁观者,而是积极的参与者。他汀类药物是目前临床上应用最广泛的调血脂类药物,多项研究发现除调脂作用外,他汀类还具有改善血管内皮细胞功能、抗炎、抗氧化、抑制血管平滑肌细胞增生等其它作用[7,9],可以稳定AS斑块[10],降低心脑血管疾病的发生风险。但是关于他汀对AS病灶形成过程中血管外膜的作用尚少见报道。阿托伐他汀属于3-羟基-3-甲基戊二酰辅酶A还原酶抑制剂,本研究拟观察阿托伐他汀对ApoE-/-小鼠动脉粥样硬化斑块形成过程中血管外膜α-SMA和TGF-β1表达的影响,探讨阿托伐他汀抗动脉粥样硬化的作用机制。
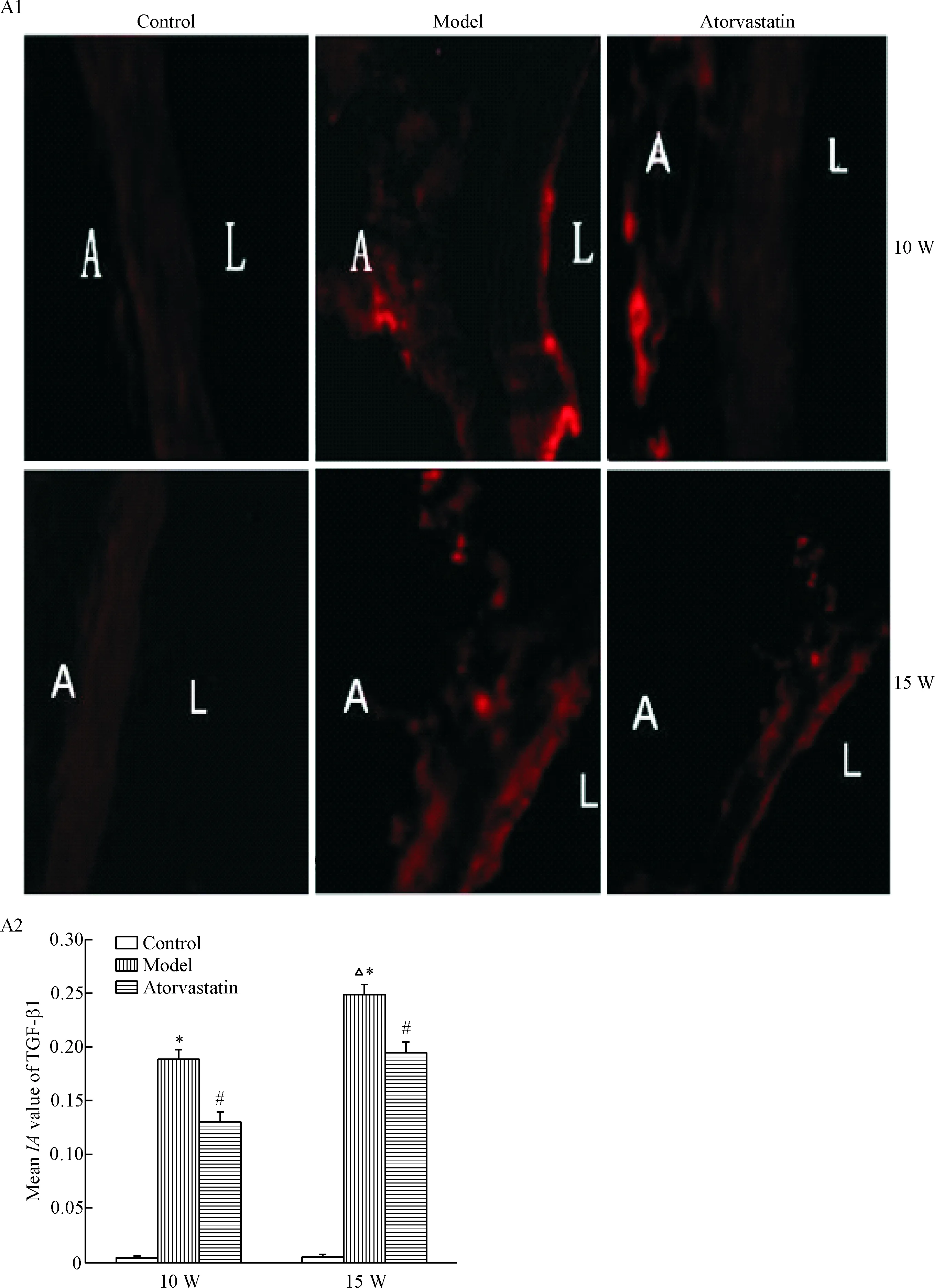
Figure 6.The changes of TGF-β1 in the adventitia of different groups. A1: immunofluorescence staining for TGF-β1 (×400). A: adventitia; L: lumen.A2: the changes of TGF-β1 (quantitatively expressed as meanIAvalue) in the adventitia of different groups. W: weeks. Mean±SD.n=10.*P<0.05vscontrol; #P<0.05vsmodel;△P<0.05vs10 W.
图6 比较各组小鼠主动脉外膜TGF-β1的表达
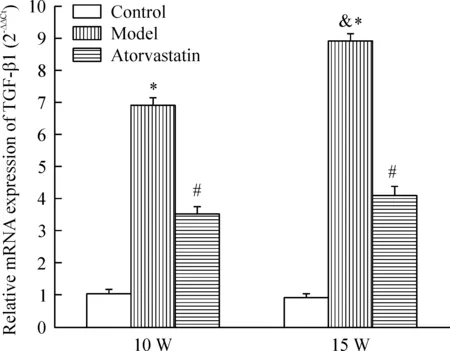
Figure 7.The mRNA expression of TGF-β1 in different groups. W: weeks. Mean±SD.n=10.*P<0.05vscontrol;#P<0.05vsmodel;&P<0.05vs10 W.
图7 各组小鼠主动脉外膜TGF-β1 mRNA的表达
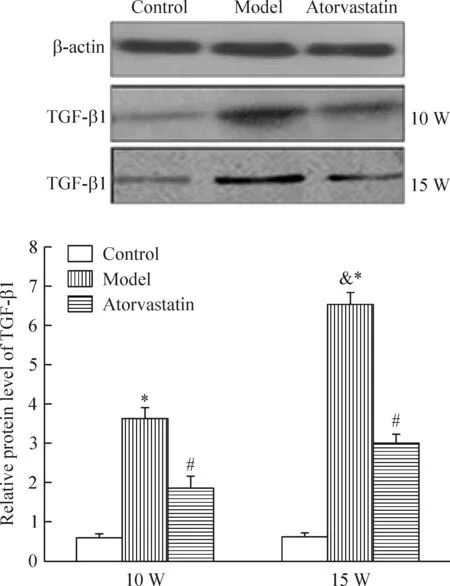
Figure 8.The protein expression of TGF-β1 in different groups. W: weeks. Mean±SD.n=10.*P<0.05vscontrol;#P<0.05vsmodel;&P<0.05vs10 W.
图8 各组小鼠主动脉外膜TGF-β1蛋白的表达
在面对各种损伤的反应过程中,外膜细胞可表现出不同的结构和功能行为的改变,表达多种血管活性因子,参与血管重塑。有研究证明在血管内皮损伤的动物模型中,血管外膜表现为明显增厚,出现血管外膜成纤维细胞表型转化成肌成纤维细胞聚集[11-12]。在移植性血管病动物模型中发现新生内膜增生之前外膜即出现大量α-SMA 阳性的肌成纤维细胞[13]。肌成纤维细胞非典型平滑肌细胞,是一类具有平滑肌细胞样特点的成纤维细胞。成纤维细胞表型转变为肌成纤维细胞后又可以通过合成胶原,分泌其它细胞外基质蛋白、趋化因子和生长因子[14],释放活性氧,进行大量增殖,并且能够迁移到新生内膜中,促进内皮细胞和平滑肌细胞的增殖[15],从而参与AS病灶的形成和发展。Zalewski等[16]报道冠状动脉球囊成形术后外膜成纤维细胞首先出现增殖,随后转化为肌成纤维细胞并迁移到新生内膜。我们前期研究也发现ApoE-/-小鼠血管外膜成纤维细胞表现出最早最显著的增殖活性, BrdU阳性标记细胞出现的次序提示外膜增殖的成纤维细胞向内膜迁移的可能性[17]。而且有研究发现辛伐他汀可以剂量依赖地抑制血管外膜成纤维细胞增殖、 迁移和胶原合成[18]。我们在本实验中观察了不同周龄ApoE-/-小鼠AS病灶形成过程中血管外膜成纤维细胞表型的变化。结果发现10周、15周的ApoE-/-小鼠血管外膜大部分细胞呈现vimentin阳性表达, 部分细胞呈现α-SMA的阳性表达,而且15周龄ApoE-/-小鼠血管外膜α-SMA的表达高于10周龄模型组,提示所检测的细胞为成纤维细胞,并表现出转化为肌成纤维细胞的特性。而C57BL/6小鼠血管外膜细胞只检测到vimentin的阳性表达,始终未检测到α-SMA的阳性表达。应用阿托伐他汀干预后发现,与模型组相比,干预组血管外膜α-SMA的表达明显下降。干预组AS斑块面积及外膜厚度较模型组减少,外膜胶原合成明显减少,结果提示阿托伐他汀可以干预AS病灶形成过程中血管外膜成纤维细胞向肌成纤维细胞的转化,减少胶原的合成,从而减轻病灶的形成和发展。
成纤维细胞转变为肌成纤维细胞是由一个非常复杂的微环境调节的,其中在血管外膜TGF-β1是一非常重要的血管外周生长因子,被公认为是影响外膜成纤维细胞生物功能最直接,也是最重要的细胞因子[19]。有研究发现在兔血管重塑的静脉移植模型中TGF-β1促进了肌成纤维细胞的激活和迁移[20]。Ren等[21]在研究中也发现TGF-β1可促进大鼠胸主动脉外膜成纤维细胞向肌成纤维细胞转变、增殖、合成胶原,其机制可能和Smad2/Smad3信号通路有关。我们在实验中观察到ApoE-/-小鼠随着高脂喂养时间延长,主动脉外膜TGF-β1的表达增加,从而促使成纤维细胞向肌成纤维细胞的转化。阿托伐他汀可以明显减少ApoE-/-小鼠血管外膜TGF-β1的表达,结果提示阿托伐他汀可能通过减少TGF-β1的表达来抑制外膜成纤维细胞向肌成纤维细胞的转化。
综上所述,本研究发现AS形成过程中血管外膜成纤维细胞表型转变为肌成纤维细胞,阿托伐他汀可以下调TGF-β1的表达,因此推测阿托伐他汀可能通过减少TGF-β1的表达来抑制外膜成纤维细胞向肌成纤维细胞的转化,从而减少胶原的合成,减轻AS病灶的形成和发展。我们将通过后续实验进一步研究阿托伐他汀抑制外膜成纤维细胞向肌成纤维细胞转化的作用机制,为阿托伐他汀抗AS的作用提供更充实的实验依据。
[1] Stedman TL. Stedman’s medical dictionary[M].Baltimore: Williams & Wilkins, 1995:154-160.
[2] Haurani MJ, Pagano PJ. Adventitial fibroblast reactive oxygen species as autacrine and paracrine mediators of remodeling: bellwether for vascular disease?[J]. Cardiovasc Res, 2007, 75(4):679-689.
[3] Coen M, Gabbiani G, Bochaton-Piallat ML. Myofibroblast-mediated adventitial remodeling: an under estimated player in arterial pathology[J]. Arterioscler Thromb Vasc Biol, 2011, 31(11):2391-2396.
[4] Hu Y, Xu Q. Adventitial biology: differentiation and function[J]. Arterioscler Thromb Vasc Biol, 2011, 31(7):1523-1529.
[5] Jin X, Fu GX, Li XD, et al. Expression and function of osteopontin in vascular adventitial fibroblasts and pathological vascular remodeling[J]. PLoS One, 2011, 6 (9):e23558.
[6] Siow RC, Churchman AT. Adventitial growth factor signalling and vascular remodelling: potential of perivascular gene transfer from the outside-in[J]. Cardiovasc Res, 2007, 75(4):659-668.
[7] Tesfamariam B, Frohlich BH, Gregg RE.Differential effects of pravastatin, simvastatin, and atorvastatin on Ca2+release and vascular reactivity[J]. J Cardiovasc Pharmacol, 1999, 34(1):95-101.
[8] 李 莉,翟同钧,陈 融,等. Movat五色套染法的改进及应用[J]. 临床与实验病理学杂志, 2002, 18(6):660-662.
[9] 葛金文,刘吉勇,朱惠斌,等. 阿托伐他汀对动脉粥样硬化兔氧化应激/炎症反应的影响[J]. 中国动脉硬化杂志, 2011, 19(12):979-983.
[10]林晓燕,林秋平,许昌声,等. 阿托伐他汀通过RXRα介导的抗氧化应激效应抑制高脂喂养糖尿病ApoE-/-小鼠动脉粥样硬化的形成[J]. 中国病理生理杂志, 2014, 30(9):1537-1545.
[11]Ruan CC, Zhu DL, Chen QZ, et al. Perivascular adipose tissue-derived complement 3 is required for adventitial fibroblast functions and adventitial remodeling in deoxycorticosterone acetate-salt hypertensive rats[J].Arterioscler Thromb Vasc Biol, 2010, 30(12):2568-2574.
[12]Li G, Chen SJ, Oparil S, et al. Directinvivoevidence demonstrating neointimal migration of adventitial fibroblasts after balloon injury of rat carotid artery[J]. Circulation, 2000, 101(12):1362-1365.
[13]Ji J, Xu F, Li L, et al. Activation of adventitial fibroblasts in the early stage of the aortic transplant vasculopathy in rat[J]. Transplantation, 2010, 89(8):945-953.
[14]Anwar A, Li M, Frid MG, et al. Osteopontin is an endogenous modulator of the constitutively activated phenotype of pulmonary adventitial fibroblasts in hypoxic pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 303(1):L1-L11.
[15]Coen M, Gabbiani G, Bochaton-Piallat ML. Myofibroblast-mediated adventitial remodeling: an underestimated player in arterial pathology[J]. Arterioscler Thromb Vasc Biol, 2011, 31(11):2391-2396.
[16]Zalewski A, Shi Y. Vascular myofibroblasts: lessons from coronary repair and remodeling[J]. Arterioscler Thromb Vasc Biol, 1997, 17(3):417-422.
[17]徐 芳,刘 颖,石 磊,等.载脂蛋白E基因敲除小鼠动脉粥样硬化早期血管外膜成纤维细胞增殖活性增强[J].中国病理生理杂志, 2010, 26(8):1503-1508.
[18]金培印,马业新,高 波,等. 辛伐他汀对大鼠血管外膜成纤维细胞增殖迁移和胶原合成的影响[J]. 中国动脉硬化杂志, 2004, 12(1):35-37.
[19]Leask A, Abraham DJ. The role of connective tissue growth factor, a multifunctional matricellular protein in fibroblast biology[J]. Biochem Cell Biol, 2003, 81 (6):355-363.
[20]Jiang Z, Yu P, Tao M, et al. TGF-β/CTGF mediated fibroblast recruitment influences early utward vein graft remodeling[J]. Am J Physiol Heart Circ Physiol, 2007, 293(1):H482-H488.
[21]Ren M, Wang B, Zhang J, et al. Smad2 and Smad3 as mediators of the response of adventitial fibroblasts induced by transforming growth factor β1[J]. Mol Med Rep,2011, 4(3):561-567.
(责任编辑: 陈妙玲, 余小慧)
Effect of atorvastatin on adventitial fibroblast phenotype differentiation in atherosclerosis of apolipoprotein E-knockout mice
XU Fang1, LIU Ying2, QI Jie2, SHI Lei1, HU Ye-jia1, WANG Wei-chen1, CAI Hong-jing1, LIU Wei1, LI Yu-ling1
(1DepartmentofPathophysiology,BinzhouMedicalUniversity,Yantai264003,China;2AffiliatedHospital,BinzhouMedicalUniversity,Binzhou256603,China.E-mail:xufang1979@163.com)
AIM: To explore the effect of atorvastatin on the expression of α-SMA and TGF-β1 in the adventitia ofApoE-/-mice with atherosclerosis, and to investigate the underlying mechanism of atorvastatin therapy. METHODS: MaleApoE-/-mice (n=40) at 6-weeks of age were used to establish the atherosclerosis model by feeding with high fat diet. The mice were randomly divided into model group and atorvastatin group. In atorvastatin group, the mice were lavaged with atorvastatin at dose of 20 mg·kg-1·d-1. The mice in model group were given normal saline. C57BL/6 mice of the same age served as control group, feeding with ordinary food. The mice were respectively sacrificed at the time points of 10 and 15 weeks after feeding with different diets. The ascending aorta was removed for serial sectioning. Some sections were performed with Movat staining in order to observe the morphological changes of the tissues, and to measure the relative atherosclerotic plaque area and the thickness of the adventitia. Some sections were stained with Sirius red to identify the collagen synthesis. Immunohistochemistry assay was prepared to observe the expression of α-SMA and TGF-β1 in the adventitia at different time points. The expression of TGF-β1 at mRNA and protein levels in the thoracoabdominal aorta was measured by RT-qPCR and Western blot.RESULTS: Compared with model group, the formation of plaque in atorvastatin group significantly descended. Meanwhile the adventitial thickness and collagen synthesis also decreased. The results of immunohistochemical staining showed that compared with 10 weeks-model group, α-SMA and TGF-β1 in 15 weeks-model group was increased. The expression of α-SMA and TGF-β1 in atorvastatin group decreased significantly compared with model group. The expression of TGF-β1 at mRNA and protein levels in model group were higher than those in control group. They decreased in atorvastatin group compared with model group. Compared with 10 weeks-model group, the mRNA and protein of TGF-β1 in 15 weeks-model group were increased.CONCLUSION: Atorvastatin modulates adventitial fibroblast phenotype differentiation by suppressing expression of TGF-β1 and intervenes atherosclerotic development inApoE-/-mice.
ApoE-/-mice; Atherosclerosis; Fibroblasts; Phenotype; Atorvastatin
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1599- 09
2016- 02- 22
2016- 05- 23
国家自然科学基金资助项目(No. 81401625)
△通讯作者 Tel: 0535-6913214; E-mail: xufang1979@163.com
R541.4; R972+.6
A
10.3969/j.issn.1000- 4718.2016.09.012

