AGEs对人主动脉内皮细胞线粒体融合蛋白表达的影响*
章顺荣, 高 越, 封 菲
(杭州市第一人民医院老年医学科,浙江 杭州 310006)
·短篇论著·
AGEs对人主动脉内皮细胞线粒体融合蛋白表达的影响*
章顺荣, 高 越△, 封 菲
(杭州市第一人民医院老年医学科,浙江 杭州 310006)
目的: 明确晚期糖基化终产物(AGEs)是否可引起内皮细胞线粒体融合蛋白Mfn1和Mfn2表达水平的变化。方法: AGEs用糖基化牛血清白蛋白(AGE-BSA)代替。将购买的原代人主动脉内皮细胞株进行体外扩增、传代、分组,进行AGEs干预,分为对照组,不同浓度梯度的AGEs干预组(50 mg/L、100 mg/L和200 mg/L)和干预不同时间组(分别是100 mg/L的AGEs干预人主动脉内皮细胞6 h、12 h、24 h和48 h)。采用实时荧光定量PCR方法对AGEs干预后的人主动脉内皮细胞Mfn1和Mfn2的mRNA表达水平进行检测;采用Western blot法对AGEs干预后的人主动脉内皮细胞Mfn1和Mfn2的蛋白表达水平进行检测。结果: 不同浓度AGEs干预人主动脉内皮细胞24 h可引起Mfn1和Mfn2的mRNA和蛋白表达水平显著降低;100 mg/L AGEs干预人主动脉内皮细胞6 h,Mfn1和Mfn2的mRNA和蛋白表达水平与对照组相比无显著变化,而干预12 h、24 h和48 h均引起人主动脉内皮细胞Mfn1和Mfn2的mRNA和蛋白表达水平显著降低。结论: AGEs干预体外培养的人主动脉内皮细胞12 h后其线粒体融合蛋白Mfn1和Mfn2的表达水平降低,提示AGEs可能引起内皮细胞线粒体动力学的改变,并可能通过这一途径引起内皮细胞线粒体功能异常,而导致内皮细胞的功能异常。
晚期糖基化终产物; 人主动脉内皮细胞; 线粒体动力学; 线粒体融合蛋白
晚期糖基化终产物(advanced glycation end products,AGEs)是蛋白慢性非酶糖基化的产物,糖尿病患者、慢性肾功能不全患者以及老年人体内AGEs的水平增高。AGEs与内皮功能异常和动脉粥样硬化的发病机制密切相关[1-2],AGEs可引起内皮细胞凋亡和活性氧簇(reactive oxygen species,ROS)的产生增加[3-4]。同时,最近研究表明线粒体动力学的改变与内皮功能异常密切相关[5]。线粒体不仅仅是能量工厂,尚能通过网架的动态重构、持续融合(fusion)和裂解(fission)来适应细胞能量需求的变化,这一动态改变过程被称为线粒体动力学。研究表明线粒体动力学的改变与内皮功能异常、糖尿病、动脉粥样硬化、衰老、退行性疾病,以及肿瘤的发病机制相关[6]。然而AGEs是否可影响内皮细胞线粒体动力学,从而通过这一途径导致内皮功能异常,目前国内外尚未见有研究报导,是一个值得研究的靶点。
线粒体动力学是线粒体融合和裂解动态平衡的过程,涉及多种融合和裂解的关键蛋白,其中Mfn1和Mfn2分别是线粒体融合的2种关键蛋白[7]。本研究通过AGEs体外干预人主动脉内皮细胞,来观察AGEs是否可引起人主动脉内皮细胞线粒体融合关键蛋白Mfn1和Mfn2表达水平的变化,从而可能导致人主动脉内皮细胞线粒体动力学的变化。
材 料 和 方 法
1 细胞株和主要试剂
原代人主动脉内皮细胞株购于武汉原生原代生物医药科技有限公司。
糖基化牛血清白蛋白(advanced glycation end product-bovine serum albumin,AGE-BSA)购于Millipore;人主动脉内皮细胞特殊培养基购于武汉原生原代生物医药科技有限公司;高纯总RNA快速提取试剂盒购自Generay;逆转录试剂盒RevertAid First Strand cDNA Synthesis Kit购自Fermentas;qPCR试剂SuperReal PreMix Plus (with SYBR Green I)购自TIANGEN;anti-GAPDH antibody购自Bioworld;anti-Mfn1 antibody和anti-Mfn2 antibody购自 CST。
2 方法
2.1 人主动脉内皮细胞的培养和AGEs的干预 人主动脉内皮细胞株接种于6孔板培养基,常规传代,待内皮细胞生长至约80%满后换液,对照组继续以含10%胎牛血清特殊培养液培养,而另外3组则在含10%胎牛血清的特殊培养液中分别加入不同浓度的AGEs,使AGEs的终浓度分别为50 mg/L、100 mg/L和200 mg/L。继续培养24 h后,去除培养液,PBS冲洗后,提取各组的总RNA和总蛋白,-20 ℃条件下保存,用于下一步研究。
另一批内皮细胞按2×107/L浓度接种于含有载玻片的6孔板培养基,分为对照组和100 mg/L AGEs干预6 h、12 h、24 h、48 h组,共5组。待内皮细胞生长至铺满80%玻片后换液,对照组继续以含10%胎牛血清的特殊培养液培养,干预组则在培养液中加入终浓度为100 mg/L的AGEs,继续分别培养6 h、12 h、24 h和48 h后去除培养液,PBS液冲洗后提取总蛋白和总RNA,-20 ℃条件下保存,用于进一步研究分析。
2.2 实时荧光定量PCR检测Mfn1和Mfn2 mRNA的表达水平 以相应溶剂为对照(blank组),取2 μL RNA溶液于Merinton SMA4000检测,观察A260/A280均>2.0且<2.3、观察A260/A230比值及连续波长吸收峰,并计算RNA溶液浓度。按反转录试剂盒说明书将RNA反转录成cDNA,再进行实时荧光定量PCR扩增检测。Premier 5.0软件设计PCR引物对,各引物序列见表1。PCR扩增反应体系为IQ SYBR Green Supermix 10 μL,10 μmol/L的forward primer 1 μL, 10 μmol/L的reverse primer 1 μL,cDNA(加水稀释成一致水平) 8 μL。Real-time PCR 条件为95 ℃ 15 min;95 ℃ 10 s、58 ℃ 20 s、72 ℃ 30 s,40个循环。实验重复3次,结果由荧光定量PCR分析软件Bio-Rad CFX Manager自动进行统计和计算。
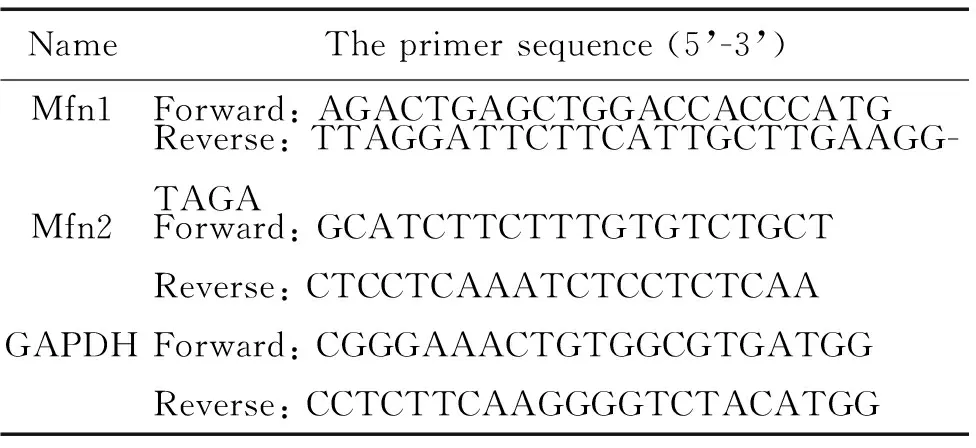
表1 Real-time PCR 引物序列
2.3 Western blot法检测Mfn1和Mfn2的蛋白表达水平 采用 RIPA裂解液(含1.2 mmol/L的PMSF)裂解内皮细胞,之后离心提取总蛋白,采用BCA法测定蛋白浓度。上样前样品加入5×上样缓冲液混匀,沸水中煮沸5 min,迅速冰浴中冷却,上样量为每泳道30 μg。50 mA恒流电泳至溴酚蓝跑完浓缩胶层,分离胶电泳电流为60 mA;200 mA恒流转膜;将PVDF膜浸入含5%脱脂奶粉的封闭液中,置摇床上缓慢摇动,室温封闭1 h。磷酸化抗体采用5% BSA 封闭,置摇床上缓慢摇动室温封闭1 h。取出已封闭的PVDF膜,加入Ⅰ抗4 ℃过夜后浸于TBST缓冲液中,于摇床上洗涤 15 min 3次;加入Ⅱ抗,于室温摇床上孵育1 h,洗膜同前,ECL化学发光显影,移入凝胶成像分析仪中,化学光敏模式曝光显影。照片以TIFF格式导出后在ImageJ软件下分析各条带光密度。
3 统计学处理
实时荧光定量PCR实验结果由荧光定量PCR分析软件Bio-Rad CFX Manager自动进行统计和计算,并生成相应的PDF文档和Excel原始数据文件。运用ImageJ 1.43图像分析软件对Western blot图片进行灰度扫描半定量分析。所有实验均重复3次,数据均用均数±标准差(mean±SD)表示,运用SPSS 16.0统计软件包进行数据统计分析,组间差异采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 AGEs引起人主动脉内皮细胞线粒体融合蛋白Mfn1和Mfn2 mRNA的表达水平降低
1.1 不同浓度的AGEs干预HAECs,引起Mfn1和Mfn2 mRNA表达水平降低 如图1所示,50 mg/L、100 mg/L和200 mg/L的AGEs干预人主动脉内皮细胞24 h后引起内皮细胞Mfn1和Mfn2的mRNA表达水平显著下降(P<0.05)。
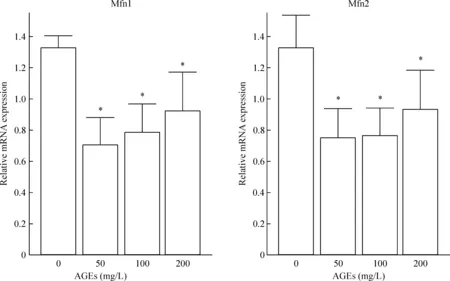
Figure 1.The relative mRNA expression levels of Mfn1 and Mfn2 in cultured HAECs stimulated with AGEs at different concentrations for 24 h. The relative mRNA expression levels were normalized to the GAPDH level. Mean±SD.n=3.*P<0.05vs0 mg/L group.
图1 不同浓度的AGEs干预HAECs 24 h引起Mfn1和Mfn2的mRNA表达水平降低
1.2 100 mg/L的AGEs干预HAECs 不同的时间,Mfn1和Mfn2 mRNA表达水平变化 如图2所示,100 mg/L的AGEs分别干预人主动脉内皮细胞6 h、12 h、24 h和48 h后,除了干预6 h组外,其余各不同干预时间组,内皮细胞Mfn1和Mfn2的mRNA表达水平均显著下降(P<0.05)。
2 AGEs引起人主动脉内皮细胞线粒体融合蛋白Mfn1和Mfn2的蛋白表达水平降低
2.1 不同浓度的AGEs干预人主动脉内皮细胞24 h引起Mfn1和Mfn2的蛋白表达水平降低 如图3所示,Western blot法检测结果显示50 mg/L、100 mg/L和200 mg/L的AGEs干预人主动脉内皮细胞24 h后引起其Mfn1和Mfn2的蛋白表达水平显著下降(P<0.05)。
2.2 100 mg/L的AGEs干预不同时间引起HAECs Mfn1和mfn2蛋白表达水平的降低 如图4所示,Western blot法检测结果显示 100 mg/L的AGEs分别干预人主动脉内皮细胞6 h、12 h、24 h和48 h后,除6 h干预组外,其余各不同时间干预组内皮细胞Mfn1和Mfn2的蛋白表达水平与对照组相比均显著下降(P<0.05)。
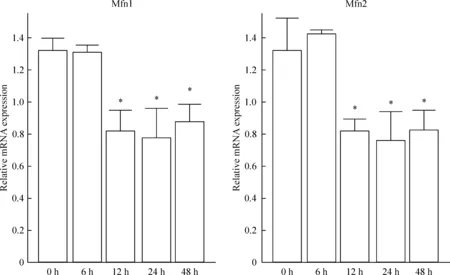
Figure 2.The relative mRNA expression levels of Mfn1 and Mfn2 in cultured HAECs stimulated with 100 mg/L AGEs for different time intervals. The relative mRNA expression levels were normalized to the GAPDH level. Mean±SD.n=3.*P<0.05vs0 h group.
图2 100 mg/L的AGEs干预HAECs 不同时间Mfn1和Mfn2 mRNA的相对表达水平
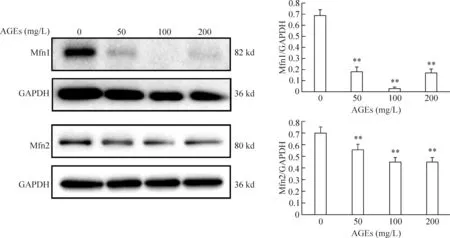
Figure 3.AGEs at different concentrations (50 mg/L, 100 mg/L and 200 mg/L) downregulated the protein expression levels of Mfn1 and Mfn2 in cultured HAECs. Mean±SD.n=3.*P<0.05,**P<0.01vs0 mg/L group.
图3 不同浓度的AGEs干预 HAECs 24 h引起Mfn1和Mfn2蛋白表达水平降低
讨 论
动脉粥样硬化的发病机制涉及多种因素,特别是糖尿病患者,内皮功能异常起着关键的作用。改善内皮功能可延缓动脉粥样硬化的进展,能改善相应疾病(如冠心病、脑动脉供血不足)症状和减少并发症,是动脉粥样硬化防治的重要靶点之一。而线粒体功能障碍与心血管疾病关系密切[8],线粒体动力学不仅在维持线粒体的正常功能中起着关键作用,其异常改变与内皮功能异常、糖尿病、动脉粥样硬化、衰老、退行性疾病,以及肿瘤的发病机制相关[6]。线粒体动力学异常导致内皮功能异常,从而引起动脉粥样硬化的发生发展[9-10]。
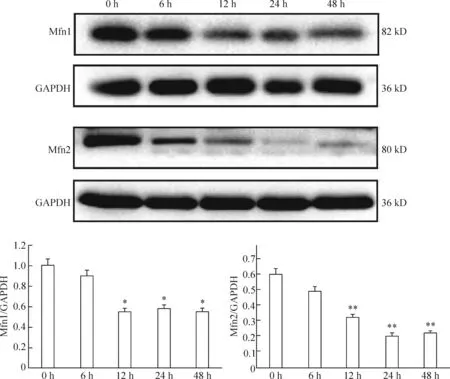
Figure 4.The protein expression levels of Mfn1 and Mfn2 in cultured HAECs stimulated with 100 mg/L AGEs for different time intervals. Except for 6 h intervention group, the protein expression levels of Mfn1 and Mfn2 in the HAECs for 12 h, 24 h, and 48 h were all downregulated. Mean±SD.n=3.*P<0.05,**P<0.01vs0 h group.
图4 100 mg/L AGEs干预HAECs不同时间Mfn1和Mfn2的蛋白表达水平
AGEs与动脉粥样硬化的发病机制密切相关,是糖尿病心血管并发症的关键致病因子,可以引起血管内皮功能异常。AGEs刺激血管内皮细胞能增加诱导型一氧化氮合酶的表达,诱导内皮细胞凋亡,促进细胞外基质、促凝血因子、组织因子、血小板与平滑肌细胞接触,引起单核/巨噬细胞迁移,吞噬脂质,启动动脉粥样硬化的病理过程,促进早期动脉粥样硬化斑块的形成[11]。最近研究表明,AGEs能促进心肌细胞和血管平滑肌细胞的自噬[12-13]。
但是AGEs是否通过影响线粒体动力学,引起线粒体动力学的异常,从而导致内皮功能异常,促进动脉粥样硬化的发生发展,目前国内外尚未见研究报道,是一个值得研究的靶点。线粒体动力学是融合和裂解动态平衡的过程,正常情况下融合和裂解保持平衡,线粒体形态保持在管状和颗粒状之间,如融合增加则线粒体表现为长管状形态,而裂解增加则表现为碎颗粒状形态。裂解和融合过程涉及多种关键的调节蛋白,Mfn1、Mfn2、OPA1参与融合过程,而Fis1、Drp1等参与裂解过程,此外,多种其它激酶参与了调节这一过程[14]。本研究采用AGEs干预体外培养的人主动脉内皮细胞,对线粒体膜2种关键融合蛋白Mfn1和Mfn2的mRNA和蛋白的表达水平进行了检测,结果发现AGEs干预能引起人主动脉内皮细胞Mfn1和Mfn2的mRNA和蛋白表达水平降低,AGEs的干预浓度从50 mg/L到200 mg/L,干预时间从12 h到48 h均能引起Mfn1和Mfn2的mRNA和蛋白表达水平下降。但AGEs干预人主动脉内皮细胞6 h,Mfn1和Mfn2的mRNA和蛋白表达水平未下降,这可能与干预时间过短、基因表达水平的改变尚未显现有关。
一般认为内皮细胞线粒体融合增加具有保护作用,具有维持正常线粒体功能和内皮功能的作用,而裂解增加则引起线粒体功能异常、ROS的产生增加,导致内皮功能异常。例如,线粒体裂解蛋白Drp-1抑制剂Mdivi-1抑制线粒体的裂解能减轻压力负荷诱导的心衰[15]和阿霉素诱导的心脏毒性[16],而过表达Mfn2则能抑制血管紧张素2引起的心肌肥厚[17],外源性Mfn2基因的转染能改善非酒精性脂肪肝细胞线粒体的功能、减少ROS的产生[18]。鉴于研究表明AGEs引起内皮细胞功能异常、损伤和凋亡,但是否通过影响线粒体动力学这一机制而导致内皮损伤和功能异常目前国内外未见有研究报导。本研究初步表明,AGEs体外干预培养的人主动脉内皮细胞引起线粒体融合蛋白Mfn1和Mfn2的表达水平降低,提示AGEs可能改变内皮细胞的线粒体动力学,即线粒体的融合减少而线粒体的裂解增加,从而通过这一途径引起内皮细胞功能异常。
本研究也存在一定的不足之处,由于未采用牛血清白蛋白(BSA)干预人主动脉内皮细胞作对照,因此不能完全排除高浓度的BSA可能会影响内皮细胞的基因表达水平。但理论上讲,血清白蛋白作为血清中的正常成分一般不会影响内皮细胞的正常基因表达水平,此外,内皮细胞的培养液中也有一定成分的胎牛血清。
总之,本研究表明AGEs可引起人主动脉内皮细胞线粒体融合蛋白Mfn1和Mfn2的表达水平降低,提示AGEs可能引起线粒体的融合减少,从而通过这一途径引起内皮细胞功能异常。本研究对进一步明确糖尿病动脉粥样硬化的发病机制具有重要意义,可以揭示AGEs引起血管内皮损伤的新机制,为糖尿病动脉粥样硬化的防治提供新的靶点和理论基础。
[1] Jandeleit-Dahm K, Watson A, Soro-Paavonen A. The AGE/RAGE axis in diabetes-accelerated atherosclerosis[J]. Clin Exp Pharmacol Physiol, 2008, 35(3):329-334.
[2] Chiers K, Vandenberge V, Ducatelle R. Accumulation of advanced glycation end products in canine atherosclerosis[J]. J Comp Pathol, 2010,143(1):65-69.
[3] Zhan Y, Sun HL, Chen H, et al. Glucagon-like peptide-1 (GLP-1) protects vascular endothelial cells against advanced glycation end products (AGEs)-induced apoptosis[J]. Med Sci Monit, 2012, 18(7):BR286-BR291.
[4] Li Z, Zhong Q, Yang T, et al. The role of profilin-1 in endothelial cell injury induced by advanced glycation end products (AGEs) [J]. Cardiovasc Diabetol, 2013, 12:141.
[5] 章顺荣,高 越. 细胞线粒体动力学与心血管疾病[J]. 中国慢性病预防与控制, 2014, 22(5):607-609.
[6] Archer SL. Mitochondrial dynamics: mitochondrial fission and fusion in human diseases[J]. N Engl J Med, 2013, 369(23):2236-2251.
[7] Hall AR, Burke N, Dongworth RK, et al. Mitochondrial fusion and fission proteins: novel therapeutic targets for combating cardiovascular disease[J]. Br J Pharmacol, 2014, 171(8):1890-1906.
[8] 熊 燕,张 梅,陈 菲,等. 线粒体功能障碍与心血管疾病[J]. 中国病理生理杂志, 2013, 29(2):364-370.
[9] Kluge MA, Fetterman JL, Vita JA. Mitochondria and endothelial function[J]. Circ Res, 2013,12(8):1171-1188.
[10]Shenouda SM, Widlansky ME, Chen K, et al. Altered mitochondrial dynamics contributes to endothelial dysfunction in diabetes mellitus[J]. Circulation, 2011, 124(4): 444-453.
[11]Hegab Z, Gibbons S, Neyses L, et al. Role of advanced glycation end products in cardiovascular disease[J]. World J Cardiol, 2012,4(4):90-102.
[12]Hou X, Hu Z, Xu H, et al. Advanced glycation endproducts trigger autophagy in cadiomyocyte via RAGE/PI3K/AKT/mTOR pathway[J]. Cardiovasc Diabetol, 2014, 13:78.
[13]Hu P, Lai D, Lu P, et al. ERK and Akt signaling pathways are involved in advanced glycation end product-induced autophagy in rat vascular smooth muscle cells[J]. Int J Mol Med, 2012, 29(4):613-618.
[14]Zhan M, Brooks C, Liu FU, et al. Mitochondrial dynamics: regulatory mechanisms and emerging role in renal pathophysiology[J]. Kidney Int, 2013, 83(4): 568-581.
[15]Givvimani S, Munjal C, Tyagi N, et al. Mitochondrial division/mitophagy inhibitor (Mdivi) ameliorates pressure overload induced heart failure[J]. PLoS One, 2012, 7(3):e32388.
[16]Gharanei M, Hussain A, Janneh O, et al. Attenuation of doxorubicin-induced cardiotoxicity by mdivi-1: a mitochondrial division/mitophagy inhibitor[J]. PLoS One, 2013,8(10):e77713.
[17]Yu H, Guo Y, Mi L, et al. Mitofusin 2 inhibits angiotensin II-induced myocardial hypertrophy[J]. J Cardiovasc Pharmacol Ther, 2011, 16(2):205-211.
[18]张 勇,胡文君,王 尧,等.mfn2基因转染对非酒精性脂肪肝细胞线粒体功能的影响[J]. 中国病理生理杂志,2010, 26(3):568-572.
(责任编辑: 卢 萍, 罗 森)
Effect of AGEs on expression of mitochondrial fusion proteins Mfn1 and Mfn2 in cultured human aortic endothelial cells
ZHANG Shun-rong, GAO Yue, FENG Fei
(GeriatricDepartment,HangzhouFirstPeople’sHospital,Hangzhou310006,China.E-mail:gy9821@sina.com.cn)
AIM: To clarify whether advanced glycation end products (AGEs) can influence the expression of mitochondrial fusion proteins Mfn1 and Mfn2 in cultured human aortic endothelial cells (HAECs)invitro. METHODS: AGE-BSA was used as AGEs. Purchased primary human aortic endothelial cell line was multiplied, and transferred to different passages for subsequent grouping. For dose-dependent experiment, HAECs were divided into 4 groups, and the concentrations of AGE-BSA in each group were 0 mg/L (control group), 50 mg/L, 100 mg/L and 200 mg/L, respectively. For time-dependent experiment, HAECs were divided into 5 groups with the same concentration (100 mg/L) of AGE-BSA, but the intervention time was 0 h (control group), 6 h, 12 h, 24 h and 48 h, respectively. The mRNA and protein expression levels of Mfn1 and Mfn2 in the HAECs were detected by real-time PCR and Western blot, respectively. RESULTS: Exposure of the HAECs to AGEs at different concentrations for 24 h all down-regulated the mRNA and protein expression levels of Mfn1 and Mfn2. Except for 6 h intervention group, 100 mg/L AGEs intervention for 12 h, 24 h and 48 h all down-regulated the mRNA and protein expression levels of Mfn1 and Mfn2 in cultured HAECs. CONCLUSION: AGEs down-regulates the expression of mitochondrial fusion proteins Mfn1 and Mfn2 in cultured HAECs, indicating that AGEs may influence mitochondrial dynamics of human aortic endothelial cells.
Advanced glycation end products; Human aortic endothelial cells; Mitochondrial dynamics; Mitochondrial fusion proteins
1000- 4718(2016)09- 1688- 06
2016- 01- 07
2016- 08- 03
杭州市科技计划项目(No.20120633B04)
△通讯作者 Tel: 0571-56006872; E-mail: gy9821@sina.com.cn
R543.1; R363
A
10.3969/j.issn.1000- 4718.2016.09.026
杂志网址: http://www.cjpp.net

