前梯度蛋白2干扰质粒的构建及其对鼻咽癌细胞生物学功能的影响*
李跃进, 王巍巍, 卢金平, 唐发清
(珠海市人民医院/暨南大学附属珠海医院检验科,广东 珠海 519000)
前梯度蛋白2干扰质粒的构建及其对鼻咽癌细胞生物学功能的影响*
李跃进, 王巍巍, 卢金平, 唐发清△
(珠海市人民医院/暨南大学附属珠海医院检验科,广东 珠海 519000)
目的: 构建前梯度蛋白2(AGR2)基因干扰重组质粒及建立AGR2基因沉默的鼻咽癌细胞及动物模型,检测AGR2对鼻咽癌细胞的生物学功能的影响。方法: 首先以real-time PCR和Western blot验证AGR2在鼻咽癌细胞系5-8F和6-10B中的表达,以高表达AGR2的5-8F细胞作为干扰转染的目标细胞;设计及构建shRNA表达载体pSR-GFP/Neo-AGR2-shRNA,将其转染至5-8F鼻咽癌细胞系中,通过Transwell小室迁移及侵袭实验来检测其迁移和侵袭功能的变化。结果: 与6-10B细胞比较,AGR2在5-8F中的表达显著上调(P<0.05);干扰鼻咽癌细胞5-8F中的AGR2可使细胞迁移和侵袭功能明显减弱(P<0.05),使其体外成瘤能力显著降低(P<0.05)。结论: AGR2在鼻咽癌细胞系5-8F中明显高表达;pSR-GFP/Neo-AGR2-shRNA可成功干扰5-8F中AGR2的表达;AGR2可抑制5-8F细胞的迁移、侵袭及体内成瘤能力。
鼻咽癌; 前梯度蛋白2; 肿瘤转移
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国南方地区常见的恶性肿瘤之一[1],严重威胁我国人民的生命和健康。鼻咽癌具有高转移、高复发和低分化的特征[2]。实验研究发现,生物因素EB病毒LMP1过表达与鼻咽癌转移呈正相关[3],此外环境因素二亚硝基哌嗪(dinitrosopiperazine,DNP)也被认为与鼻咽癌转移相关[4]。但是鼻咽癌高转移的确切分子机理仍不清楚。本项目组在前期的研究中发现DNP促进6-10B细胞高转移,且前梯度蛋白2(anterior gradient protein 2,AGR2)显著高表达[5]。通过文献复习发现,AGR2与前列腺癌[6]、乳腺癌[7]、胰腺癌[8]、食管腺癌[9]等多种肿瘤转移密切相关。在鼻咽癌的发生和转移的过程中,AGR2的相关报道比较少,本研究首先检测AGR2在具有不同转移侵袭能力鼻咽癌细胞系中的表达情况,再构建其基因的干扰重组质粒,验证AGR2对鼻咽癌细胞系生物学功能的影响,为进一步研究鼻咽癌转移机制奠定实验基础。
材 料 和 方 法
1 细胞系和质粒
人鼻咽癌高转移、高成瘤细胞株5-8F及低转移、低成瘤细胞株6-10B购自中南大学湘雅中心实验室细胞库;shRNA表达载体pSR-GFP/Neo购自Clontech。
2 主要试剂和仪器
BamH I与EcoR II购自NEB;T4 DNA连接酶购自大连宝生物公司;DNA凝胶回收试剂盒购自广州东盛生物公司;鼠抗人单克隆抗体购自Abcam;辣根过氧化物酶标记羊抗小鼠抗体购自武汉博士德公司;BCA蛋白浓度测定试剂盒购自Thermo;总RNA抽提试剂盒购自Sigma;Lipofectamine 2000购自Invitrogen;反转录试剂盒、定量PCR用SYBR Green PCR Master Mix购自Toyobo。定量PCR仪为ABI PRISM7500 Sequence Detection System。
3 主要方法
3.1 pSR-GFP/Neo-NC-shRNA和pSR-GFP/Neo-AGR2-shRNA重组质粒的构建 根据GenBank公布的AGR2基因序列(NM_006408),遵循 siRNA的设计原则,设计本实验中的AGR2干扰序列;AGR2-shRNA: 5’-CAUCUGGACUCAGACAUAUGAdTdT-3’;antisense-AGR2-shRNA: 5’-UCAUAUGUCUGAGUCCAGAUGdTdT-3’;以靶序列为基础设计并合成AGR2 shRNA的引物。将引物溶解置于沸水中,然后自然退火,反应体系为5.5 μL 10×NEB buffer,2.0 μLBamH I,2.0 μLEcoR II,15.5 μL pSR-GFP/Neo,加水至50 μL;将反应后产物置于37 ℃水浴4 h以上,经酶切、凝胶电泳后回收大片段;将回收的产物与经BamH I/EcoR II线性化的pSR-GFP/Neo进行连接,反应体系为1.5 μL T4 DNA ligase,1.5 μL 10× ligase buffer, 5 μL AGR2-shRNA,1 μL pSR-GFP/Neo, 加水至10 μL;将反应后产物置于4 ℃条件下过夜后即可用于制备细菌感受态并进行载体的转化;最后经挑取克隆进行鉴定确定成功后即可进行后续实验。
3.2 Real-time PCR实验 抽提细胞总RNA具体参照TRIzol试剂盒说明书,验证总RNA抽提完整后,加入反转录酶催化合成cDNA,以SYBR qPCR Mix 进行荧光定量PCR 验证实验组与对照组相关基因的差异性。AGR2的上游引物序列为5’-GTCACGTGGCCCAGATTTAT-3’,下游引物序列为5’-TCTCCTTCTTGGAAGCCTCA-3’;18S rRNA的上游引物序列为5’-CCTGGATACCGCAGCTAGGA-3’,下游引物序列为5’-GCGGCGCAATACGAATGCCCC-3’。Real-time PCR扩增条件为95 ℃ 15 s,63 ℃ 15 s,72 ℃ 32 s,35 个循环;取温度60~95 ℃进行融解曲线分析。每个样品重复5次。
3.3 Transwell小室迁移及侵袭实验 迁移实验首先收集各处理组细胞,计数1×105个细胞,用120 μL无血清培养液重悬,加入Transwell细胞培养板的小室上室,在下室加入500 μL完全培养液,在37 ℃、5% CO2孵育24 h后,取出Transwell板,以0.1%结晶紫染色后置倒置显微镜下计数细胞,计数3个高倍视野(×100)下从上室迁移穿过滤膜到达下室的细胞数。侵袭实验首先溶解Matrigel过夜,用预冷的无血清培养液以1∶3的体积比稀释Matrigel,取40 μL加入预冷的transwell小室中,37 ℃孵育2 h使Matrigel凝固。吸走小室中多余的液体,并在上、下室分别加入120 μL和500 μL无血清培养液,37 ℃平衡过夜。余下操作同上,计数并拍照。
3.4 动物模型的构建 4~5周龄、体重(20±2) g的雌性裸鼠,每组各18只。取对数生长期的pSR-GFP/Neo-Mock-shRNA-5-8F细胞和pSR-GFP/Neo- AGR2-shRNA-5-8F细胞制成浓度为2×1010/L的细胞悬液(活细胞比率>95.0%),用无血清基质10.0 mL,于1 500 r/min 离心3 min 3次, 最后用无血清基质混匀, 计数肿瘤细胞数量,取细胞悬液每只0.2 mL 注射于裸鼠尾静脉,30 s内注射完毕。4周后,小鼠腹腔注射2%戊巴比妥钠,每只0.4 mL,麻醉处死。剖腹取材,观察各器官肿瘤转移情况,实验结束取瘤称重后,4%多聚甲醛固定。肿瘤组织制成厚度3 μm石蜡切片。
3.5 HE染色和免疫组织化学检测AGR2的表达 取动物实验中获取的肿瘤标本,做HE染色和免疫组织化学检测。HE染色及免疫组织化学主要操作流程见参考文献[4]。
3.6 Western blot 检测相关蛋白的表达 细胞总蛋白应用蛋白裂解液进行提取,超声8 s,12 000 r/min 离心20 min,收集上清。应用BCA法进行蛋白定量,将待测样品上样后进行电泳。电转至PVDF膜后封闭,加入I 抗(1∶500,鼠抗人单克隆抗体AGR2)和II 抗(1∶4 000,辣根过氧化物酶标记兔抗小鼠抗体),ECL试剂盒进行曝光、显影、定影、压片。每种蛋白重复检测3次,以目的基因和GAPDH吸光度比值作为目的基因的相对表达量。
3.7 间接免疫荧光法检测AGR2蛋白的表达及定位 间接免疫荧光法具体操作流程见参考文献[4], I 抗兔抗人AGR2单克隆抗体1∶100稀释,II 抗FITC-羊抗兔IgG抗体1∶100稀释,DAPI染色细胞核,最后在荧光显微镜(×200)下观察AGR2蛋白表达,实验重复3次。
4 统计学处理
采用SPSS 17.0统计软件对所有实验数据进行统计分析,所有实验均重复3次,数据均采用均数±标准差(mean±SD)表示。两样本比较采用两样本t检验分析;多个样本比较采用单因素方差分析(one-way ANOVA),两两比较使用Bonferroni 法。以P<0.05 为差异有统计学意义。
结 果
1 Real-time PCR分析AGR2 mRNA在6-10B和5-8F细胞中的表达
Real-time PCR结果显示,AGR2在5-8F细胞中的表达量明显高于6-10B细胞(P<0.05)。选用5-8F细胞作为目的细胞进行RNA干扰后,5-8F细胞中AGR2的mRNA表达相对于未干扰的5-8F细胞显著降低(P<0.05),见图1。
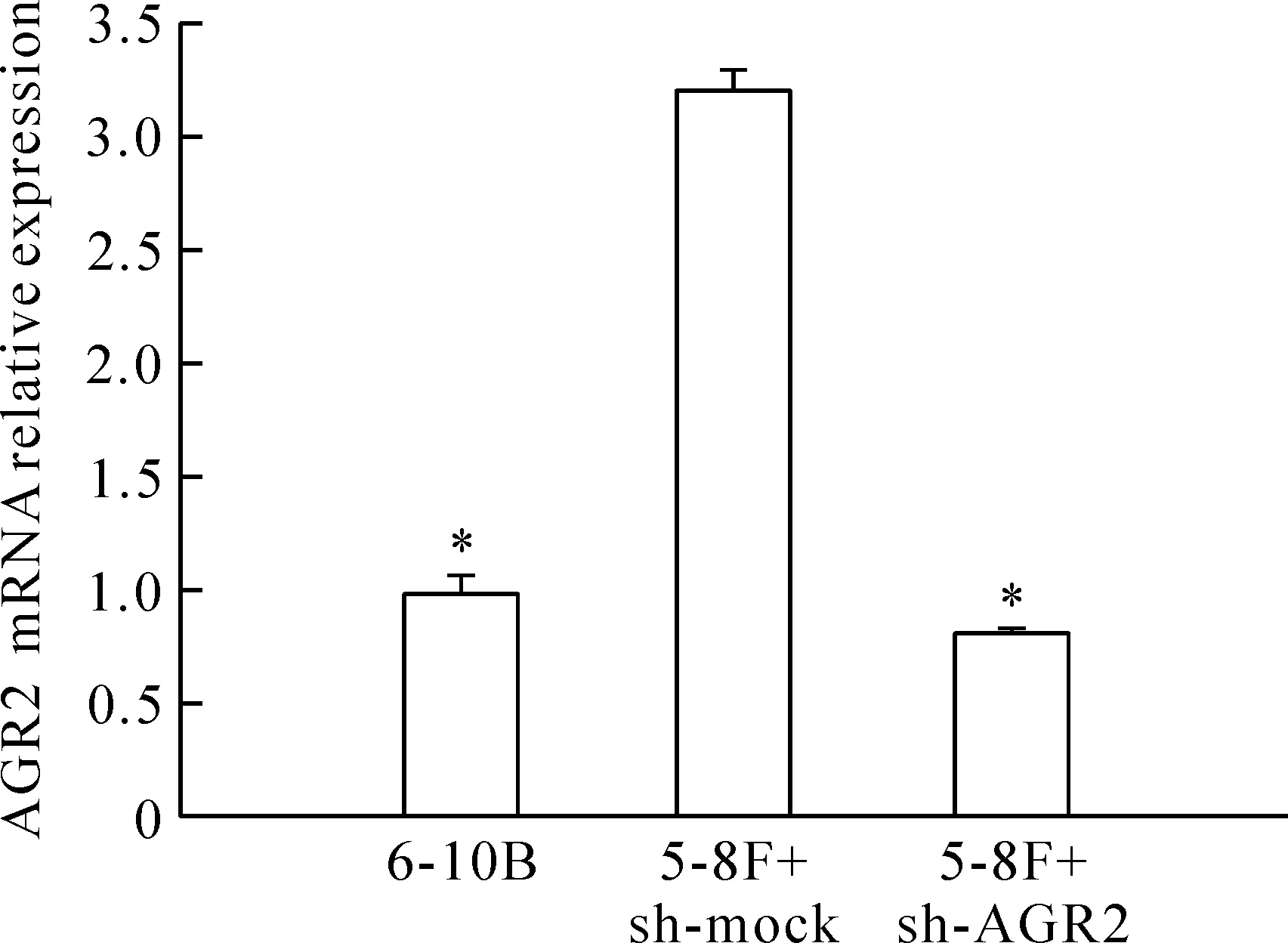
Figure 1.The mRNA expression of AGR2 in NPC cell lines 6-10B and 5-8F determined by real-time PCR. Mean±SD.n=5.*P<0.05vs5-8F+sh-mock.
图1 Real-time PCR分析AGR2 mRNA在6-10B细胞和5-8F细胞中的表达
2 Western blot 分析AGR2蛋白在6-10B和5-8F细胞系中的表达
Western blot结果显示AGR2在5-8F细胞中高表达,在6-10B细胞中低表达(P<0.05),见图2。故选择AGR2表达量高的5-8F细胞进行后续实验。
3 干扰质粒对鼻咽癌5-8F细胞的AGR2干扰验证
Western blot 法及间接免疫荧光法检测转染后不同组的蛋白表达水平。与未处理的对照组(5-8F细胞)及非特异序列组(sh-mock)相比,转染干扰质粒的5-8F细胞(sh-AGR2)的AGR2蛋白表达有不同程度的下调,差异有统计学显著性(P<0.05),见图3。
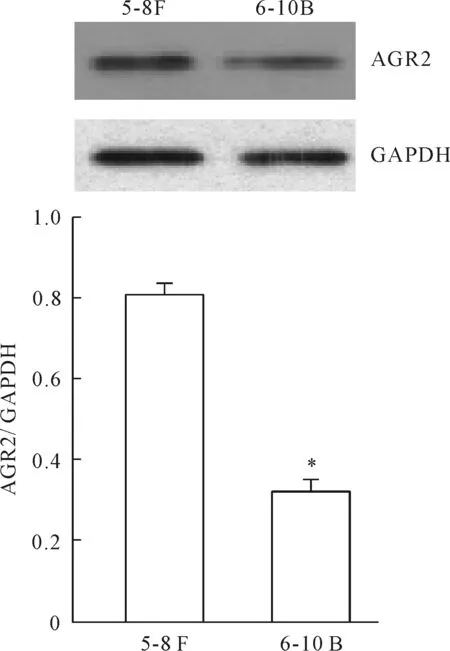
Figure 2.The protein expression of AGR2 in the NPC cell lines 6-10B and 5-8F detected by Western blot. Mean±SD.n=3.*P<0.05vs5-8F group.
图2 Western blot 检测不同鼻咽癌细胞系中AGR2蛋白的表达水平
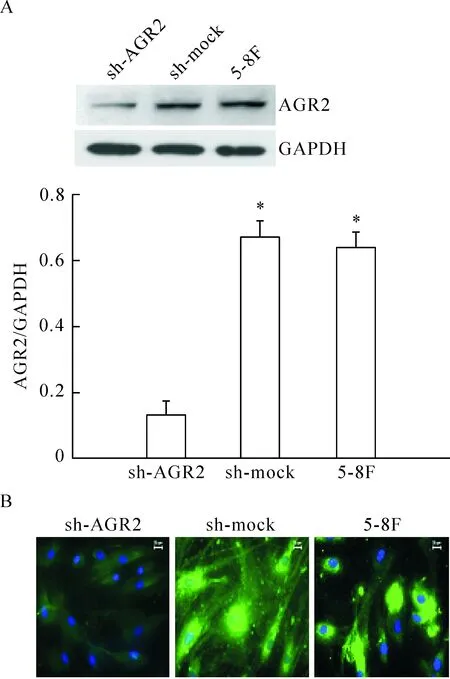
Figure 3.The protein expression of AGR2 in the NPC cell line 5-8F detected by Western blot (A) and indirect immunofluorescence (B) after interference. Mean±SD.n=3.*P<0.05vssh-AGR2 group.
图3 Western blot及间接免疫荧光法检测干扰转染后AGR2蛋白的表达
4 鼻咽癌5-8F细胞中AGR2基因的干扰对其迁移和侵袭功能的影响
实验分成未处理的对照组(5-8F细胞)、非特异序列组(sh-mock)和转染干扰质粒的5-8F细胞组(sh-AGR2)。培养24 h后,细胞侵袭和迁移检测结果显示,sh-AGR2组的侵袭及迁移能力较5-8F对照组和sh-mock组均显著降低(P<0.05),见图4。
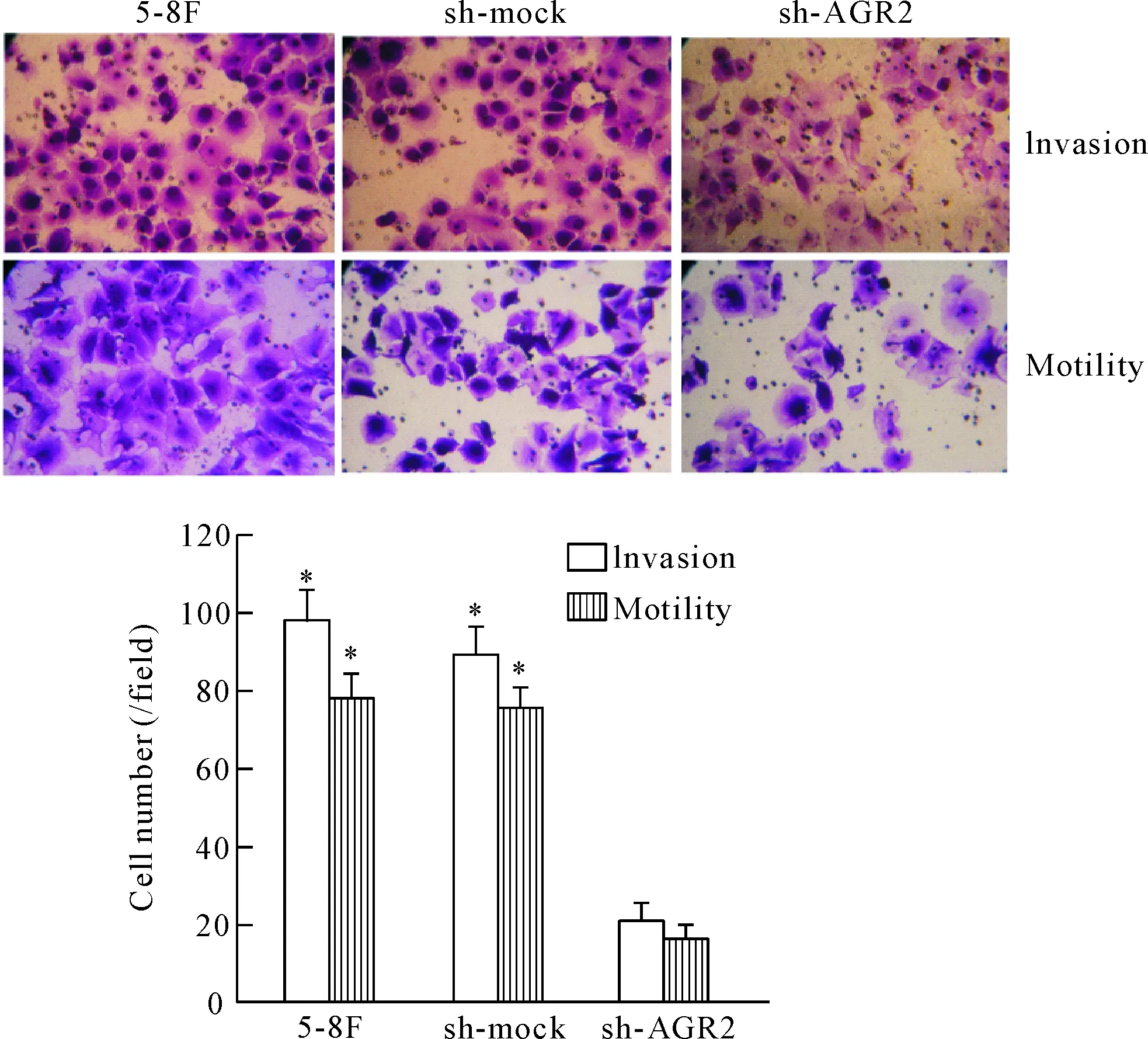
Figure 4.The effect of AGR2-shRNA on the invasion and migration abilities of 5-8F cells. Mean±SD.n=3.*P<0.05vssh-AGR2 group.
图4 AGR2-shRNA对5-8F细胞侵袭及迁移能力的影响
5 动物成瘤模型
5-8F+sh-mock 组与5-8F+sh-AGR2组相比,肺组织可见癌细胞广泛浸润,瘤体均为实体瘤,形状呈不规则形,其它组织器官变化不显著。瘤体称重结果显示,与5-8F+sh-mock组相比,5-8F+sh-AGR2组瘤体的重量显著降低(P<0.05)。免疫组织化学结果显示,5-8F+sh-mock组肺癌样品中AGR2表达显著高于5-8F+sh-AGR2组(P<0.05),见图5。
讨 论
AGR2又名HAG-2、AG2、GOB-4等,最早由Kuang等[10]在雌激素受体表达阳性的人乳腺癌细胞株中发现的,随后由Thompson等[11]得到全长cDNA克隆,并证实在多个肿瘤细胞株中AGR2的表达与雌激素呈正相关。AGR2的分布范围十分广泛,目前在细胞核、内质网等细胞器及细胞培养上清液中检测到了AGR2的存在[12-13]。AGR2具有多种生物学功能,在外界刺激因子的作用下高表达,促进细胞生长、促进细胞停泊非依赖性生长和细胞侵袭转移等。
AGR2与肿瘤生物学相关的证据来自一系列对激素依赖肿瘤如乳腺癌[14]、前列腺癌[6]、卵巢癌[15]和非激素依赖肿瘤如食道癌[9]、胃肠道癌[16]、肝癌[17]、肺癌[18-19]等的研究。AGR2被发现以来,大量证据表明AGR2在多种人类肿瘤中过量表达,并且与肿瘤的发生和转移密切相关[18, 20-23]。AGR2可能作为一个肿瘤转移的相关因子,与病人的差预后相关。另一方面利用细胞系的研究结果, 也支持AGR2可能参与肿瘤迁移等恶性行为。2005年,Liu等[24]在良性的非转移性乳腺癌细胞系中过量表达AGR2蛋白,注射入小鼠模型中后发现,小鼠的正常乳腺组织可转变为肿瘤组织,通过对小鼠其它组织如肺、肝、腋淋巴结等解剖,转移灶及早期肿瘤组织切片免疫组化检测都出现了AGR2的高表达,证实AGR2具有促进肿瘤细胞转移的作用。2008年,Ramachandran等[21]在研究胰腺癌的侵袭性及转移的分子机理时发现在转移性胰腺癌中AGR2明显高表达,而干扰AGR2后,肿瘤细胞的生长明显抑制,同时其侵袭行为明显降低,说明AGR2 可以增加肿瘤细胞的侵袭转移能力,从而促进肿瘤转移。Zhang等[25]发现过表达AGR2可以明显促进前列腺癌细胞的侵袭和迁移能力,而沉默了AGR2的蛋白表达后,其侵袭行为受到明显抑制。还有,沉默AGR2在SEG-1中的表达,可使食管癌细胞克隆减少,导致肿瘤异种移植物大小的减小[9]。这些研究再一次证实了AGR2在肿瘤转移中的重要作用。然而,国内外提及AGR2与鼻咽癌转移相关的研究未见报道。
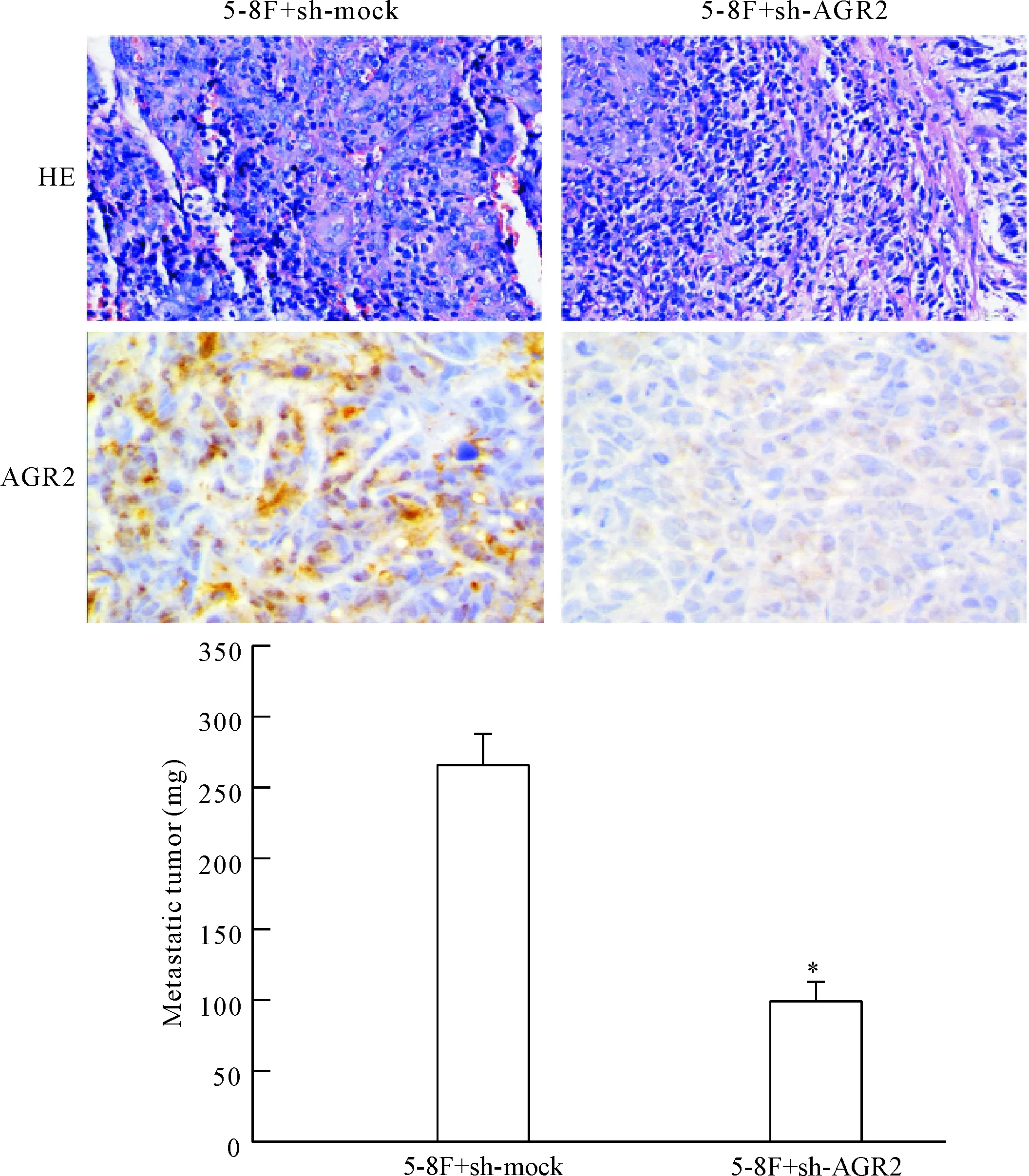
Figure 5.The effect of AGR2 on the abilities of metastasis and tumorigenicity in NPC cell line 5-8Finvivo. Mean±SD.n=3.*P<0.05vs5-8F+sh-mock group.
图5 AGR2对5-8F细胞动物体内成瘤及转移能力的影响
本研究首先利用real-time PCR和Western blot 法检测具有不同转移潜能的鼻咽癌细胞株5-8F(高转移、高成瘤)及6-10B(低转移、低成瘤)中AGR2的表达情况,初步发现AGR2从mRNA 水平和蛋白水平在5-8F细胞中的表达显著高于6-10B细胞,故推测AGR2极可能是鼻咽癌转移的重要分子靶点,AGR2的表达增强,进一步调控下游基因的转录、活化,这可能是鼻咽癌发生转移的机制之一。
本研究进一步利用RNA干扰技术抑制AGR2基因在鼻咽癌5-8F细胞中表达,以此来研究该基因在特定细胞中的功能。将干扰序列转入5-8F细胞,通过real-time PCR和Western blot验证干扰效果,结果提示干扰效果作用明显。至此,成功地构建了可有效干扰胃癌细胞中AGR2表达的干扰重组质粒。本研究以基因干扰技术为前提,通过Transwell小室侵袭及迁移实验显示AGR2干扰对5-8F细胞系侵袭及迁移功能有显著影响。
本研究以鼻咽癌细胞系mock-shRNA-5-8F(高表达AGR2)和AGR2-shRNA-5-8F为研究对象,通过3次尾静脉注射构建高转移模型,发现AGR2-shRNA-5-8F细胞的转移能力明显降低,细胞成瘤质量显著下降。应用免疫组织化学的方法,发现肿瘤细胞中,AGR2的表达有明显的差异,随着成瘤质量的下降,AGR2的表达明显减少,提示AGR2在鼻咽癌细胞的体内成瘤及转移作用同样存在,与其它研究结果一致。至此,在动物体内实验中证实AGR2在促进鼻咽癌的肿瘤转移、生长方面发挥了重要的作用。
综上所述,以上结果分别从细胞体外,动物体内证实了AGR2对5-8F细胞系侵袭及迁移功能的影响,为进一步研究鼻咽癌的临床组织及血清标本中AGR2表达侵袭及转移的分子机制打下了实验基础,其相关蛋白有可能成为抑制肿瘤转移的分子靶标及预测肿瘤复发或预后的重要标志。
[1] Wei WI, Sham JS. Nasopharyngeal carcinoma[J]. Lancet, 2005, 365(9476): 2041-2054.
[2] Wang X, Li L, Hu C, et al. Patterns of level II node metastasis in nasopharyngeal carcinoma[J]. Radiother Oncol, 2008, 89(1):28-32.
[3] Zhao Y, Wang Y, Zeng S, et al. LMP1 expression is positively associated with metastasis of nasopharyngeal carcinoma: evidence from a meta-analysis[J]. J Clin Pathol, 2012, 65(1):41-45.
[4] Li Y, Lu J, Peng Z, et al.N,N’-Dinitrosopiperazine-mediated AGR2 is involved in metastasis of nasopharyngeal carcinoma[J]. PLoS One, 2014, 9(4):e92081.
[5] Li Y, Liu N, Huang D, et al. Proteomic analysis onN,N’-dinitrosopiperazine-mediated metastasis of nasopharyngeal carcinoma 6-10H cells[J]. BMC Biochem, 2012, 13: 25.
[6] Kani K, Malihi PD, Jiang Y, et al. Anterior gradient 2 (AGR2): blood-based biomarker elevated in metastatic prostate cancer associated with the neuroendocrine phenotype[J]. Prostate, 2013, 73(3):306-315.
[7] Barraclough DL, Platt-Higgins A, de Silva Rudland S, et al. The metastasis-associated anterior gradient 2 protein is correlated with poor survival of breast cancer patients[J]. Am J Pathol, 2009, 175(5):1848-1857.
[8] Dumartin L, Whiteman HJ, Weeks ME, et al. AGR2 is a novel surface antigen that promotes the dissemination of pancreatic cancer cells through regulation of cathepsins B and D[J]. Cancer Res, 2011, 71(22):7091-7102.
[9] Wang Z, Hao Y, Lowe AW. The adenocarcinoma-associated antigen, AGR2, promotes tumor growth, cell migration, and cellular transformation[J]. Cancer Res, 2008, 68(2):492-497.
[10]Kuang WW, Thompson DA, Hoch RV, et al. Differential screening and suppression subtractive hybridization identified genes differentially expressed in an estrogen receptor-positive breast carcinoma cell line[J]. Nucleic Acids Res, 1998, 26(4):1116-1123.
[11]Thompson DA, Weigel RJ. hAG-2, the human homologue of theXenopuslaeviscement gland gene XAG-2, is coexpressed with estrogen receptor in breast cancer cell lines[J]. Biochem Biophys Res Commun, 1998, 251(1):111-116.
[12]Park SW, Zhen G, Verhaeghe C, et al. The protein disulfide isomerase AGR2 is essential for production of intestinal mucus[J]. Proc Natl Acad Sci U S A, 2009, 106(17):6950-6955.
[13]Vanderlaag KE, Hudak S, Bald L, et al. Anterior gra-dient-2 plays a critical role in breast cancer cell growth and survival by modulating cyclin D1, estrogen receptor-alpha and survivin[J]. Breast Cancer Res, 2010, 12(3):R32.
[14]Salmans ML, Zhao F, Andersen B. The estrogen-regulated anterior gradient 2 (AGR2) protein in breast cancer: a potential drug target and biomarker[J]. Breast Cancer Res, 2013, 15(2):204.
[15]Park K, Chung YJ, So H, et al. AGR2, a mucinous ovarian cancer marker, promotes cell proliferation and migration[J]. Exp Mol Med, 2011, 43(2): 91-100.
[16]Bai Z, Ye Y, Liang B, et al. Proteomics-based identification of a group of apoptosis-related proteins and biomarkers in gastric cancer[J]. Int J Oncol, 2011, 38(2):375-383.
[17]Yu H, Zhao J, Lin L, et al. Proteomic study explores AGR2 as pro-metastatic protein in HCC[J]. Mol Biosyst, 2012, 8(10): 2710-2718.
[18]Pizzi M, Fassan M, Balistreri M, et al. Anterior gradient 2 overexpression in lung adenocarcinoma[J]. Appl Immunohistochem Mol Morphol, 2012, 20(1): 31-36.
[19]Inoue M, Hiyama K, Nakabayashi K, et al. An accurate and rapid detection of lymph node metastasis in non-small cell lung cancer patients based on one-step nucleic acid amplification assay[J]. Lung Cancer, 2012, 78(3):212-218.
[20]Vivekanandan P, Micchelli ST, Torbenson M. Anterior gradient-2 is overexpressed by fibrolamellar carcinomas[J]. Hum Pathol, 2009, 40(3): 293-299.
[21]Ramachandran V, Arumugam T, Wang H, et al. Anterior gradient 2 is expressed and secreted during the development of pancreatic cancer and promotes cancer cell survival[J]. Cancer Res, 2008, 68(19):7811-7818.
[22]Innes HE, Liu D, Barraclough R, et al. Significance of the metastasis-inducing protein AGR2 for outcome in hormonally treated breast cancer patients[J]. Br J Cancer, 2006, 94(7):1057-1065.
[23]Fritzsche FR, Dahl E, Pahl S, et al. Prognostic relevance of AGR2 expression in breast cancer[J]. Clin Cancer Res, 2006, 12(6):1728-1734.
[24]Liu D, Rudland PS, Sibson DR, et al. Human homologue of cement gland protein, a novel metastasis inducer associated with breast carcinomas[J]. Cancer Res, 2005, 65(9):3796-3805.
[25]Zhang Y, Ali TZ, Zhou H, et al. Erbb3 binding protein 1 represses metastasis-promoting gene anterior gradient protein 2 in prostate cancer[J]. Cancer Res, 2010, 70(1): 240-248.
(责任编辑: 陈妙玲, 罗 森)
Construction of shRNA targeting AGR2 gene and effect of AGR2 on biological function of nasopharyngeal carcinoma cells
LI Yue-jin, WANG Wei-wei, LU Jin-ping, TANG Fa-qing
(DepartmentofClinicalLaboratory,ZhuhaiPeople’sHospital&ZhuhaiHospitalofJinanUniversity,Zhuhai519000,China.E-mail:tangfaqing33@hotmail.com)
AIM: To construct the shRNA targeting anterior gradient protein 2 (AGR2) gene for exploring the effect of AGR2 on the biological behavior of nasopharyngeal carcinoma (NPC) cells.METHODS: The expression of AGR2 at mRNA and protein levels in NPC cell lines 6-10B and 5-8F was detected by real-time PCR and Western blot. The pSR-GFP/Neo-AGR2-shRNA expression vector targetingAGR2 was constructed. Based on the interference targetingAGR2, the cell migration and motility were determined by Transwell migration and motility assays.RESULTS: The expression of AGR2 was increased in NPC cell line 5-8F compared with NPC cell line 6-10B (P<0.05). When theAGR2 expression in 5-8F cells was interfered, the cell migration, invasion and tumorigenicity were weakened. CONCLUSION: The expression of AGR2 is up-regulated in NPC cell line 5-8F. pSR-GFP/Neo-CLU-shRNA successfully inhibits the expression ofAGR2 in NPC cell line 5-8F. AGR2 inhibits the migration, invasion and tumorigenicity of 5-8F cellsinvivo.
Nasopharyngeal carcinoma; Anterior gradient protein 2; Neoplasm metastasis
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1545- 06
2016- 03- 10
2016- 05- 13
国家自然科学基金资助项目(No.81402265); 中国博士后科学基金资助项目(No.2016M592580); 广东省医学科研基金资助项目(No.A2016102)
△ 通讯作者 Tel: 0756-2157640; E-mail: tangfaqing33@hotmail.com
R730.23
A
10.3969/j.issn.1000- 4718.2016.09.002

