Fas过表达逆转胃癌细胞顺铂耐药*
陈 刚, 申屠杨萍
(1武警浙江总队嘉兴医院肿瘤科, 浙江 嘉兴 314000; 2温州医科大学机能实验教学中心, 浙江 温州 325000)
Fas过表达逆转胃癌细胞顺铂耐药*
陈 刚1△, 申屠杨萍2
(1武警浙江总队嘉兴医院肿瘤科, 浙江 嘉兴 314000;2温州医科大学机能实验教学中心, 浙江 温州 325000)
目的: 探究Fas在胃癌细胞顺铂耐药中的作用及可能的作用机制。方法: Western blot及RT-qPCR检测胃癌细胞株SGC-7901及胃癌耐药细胞株SGC-7901/DDP中Fas的表达情况。构建Fas过表达腺病毒载体,上调胃癌耐药细胞株SGC-7901/DDP中Fas的表达,CCK-8检测细胞活力,流式细胞术检测细胞周期及细胞凋亡,Western blot法检测Fas、P38/p-P38、JNK/p-JNK、cleaved caspase-8/caspase-8和cleaved caspase-3/caspase-3蛋白水平。结果: 耐药细胞株SGC7901/DDP中Fas的mRNA及蛋白表达水平均明显低于亲本细胞株;并且在亲本细胞株SGC7901中,Fas的蛋白表达水平随着顺铂的浓度增加不断降低。过表达Fas可抑制胃癌耐药细胞SGC7901/DDP的细胞活力,并诱导其凋亡;同时上调p-P38、p-JNK、cleaved caspase-8和cleaved caspase-3的蛋白水平。结论: 胃癌顺铂耐药细胞中过表达Fas可恢复细胞对顺铂的敏感性,促进细胞凋亡并抑制细胞生长,其机制可能与JNK和P38 MAPK信号通路的激活有关。
Fas; 胃癌; 顺铂耐药; 细胞凋亡
胃癌是消化系统常见肿瘤之一,目前放、化疗仍然是胃癌的主要治疗方法。顺铂是第一个被发现的铂类抗肿瘤药物,可直接作用于DNA,引发肿瘤细胞凋亡,被广泛应用于胃癌的治疗[1]。但是,随着化疗药物的大量应用,肿瘤细胞出现的耐药性成为影响化疗疗效的主要因素。因此,有关逆转肿瘤化疗耐药的研究具有重要的临床意义。
研究表明肿瘤化疗耐药产生的机制可能有以下几个方面[2-7]:(1) 包括P-糖蛋白(P-glycoprotein, P-gp)在内的ABC型膜载体介导的抗肿瘤药物主动外排作用增强;(2) 多药耐药基因表达异常;(3) DNA损伤修复系统失调;(4) 细胞凋亡通路被阻碍。Fas是属于肿瘤坏死因子受体超家族成员的一种跨膜蛋白,它与FasL结合可以启动凋亡信号的转导引起细胞凋亡,在肿瘤监视过程中发挥重要作用。大量研究发现,在包括胃癌[8]、直肠癌[9]、乳腺癌[10]、肺癌[11]等多种实体肿瘤中都出现Fas的低表达或表达缺失,表明Fas在肿瘤的发生发展过程中起着重要的作用;同时有研究表明,TNF-α可通过NF-κB通路上调Fas的表达,进而提高顺铂对成神经细胞瘤的治疗效果[12],提示Fas在肿瘤化疗耐药中可能也发挥一定的作用。但是Fas在胃癌化疗耐药中的作用并没有明确的阐释。本文通过构建Fas过表达载体,系统研究了Fas在胃癌细胞顺铂耐药中的作用及其相关机制。
材 料 和 方 法
1 材料
胃癌细胞株SGC-7901和胃癌耐药细胞株SGC-7901/DDP均购买于中科院上海细胞库;Ad-Fas腺病毒及病毒载体购买于上海和元生物有限公司;RPMI-1640培养基、胰蛋白酶购买于上海士锋生物科技有限公司;CCK-8细胞计数试剂盒购买于广州赖德生物技术有限公司;FBS胎牛血清购买于Gibco;乳酸脱氢酶细胞毒性检测试剂盒购买于江苏碧云天生物技术研究所;Annexin V-FITC/PI双染法细胞凋亡检测试剂盒购买于江苏凯基生物技术股份有限公司;TRIzol和引物购买于Invitrogen;抗p-JNK/JNK、p-P38/P38抗体购买于Santa Cruz;抗cleaved caspase-3/caspase-3、cleaved caspase-8/caspase-8、β-actin抗体和HRP标记抗兔II抗购买于江苏碧云天生物技术研究所。
2 实验方法
2.1 细胞培养 将胃癌细胞株SGC-7901和胃癌耐药细胞株SGC-7901/DDP培养于RPMI-1640培养基(含1.5 mmol/L L-谷氨酰胺、100 mL/L胎牛血清、1×105U/L青霉素和100 mg/L链霉素),并将细胞置于37 ℃、5% CO2、饱和湿度的培养箱中进行培养。每隔1 d 换液1次,细胞生长达90%融合后可用0.25%胰酶消化后按1∶3的比例传代。
2.2 实时荧光定量PCR检测mRNA的表达 细胞总RNA的抽提采用TRIzol一步法(参照操作手册)。取2 μg总RNA逆转录至终体积为20 μL,采用SYBR Green实时荧光定量PCR方法检测mRNA的表达。用于定量多聚酶链反应的Fas正向引物为5’-GGACATGGCTTAGAAGTG-3’,反向引物为5’-GGTTGGAGATTCATGAGAACC-3’;β-actin的正向引物为5’-AGCGGGAAATCGTGCGTG-3’,反向引物为5’-CAGGGTACATGGTGGTGCC-3’。qPCR反应体系包括为1 μL逆转录产物,10 μL SYBR Green PCR Master Mix和500 nmol/L正、反向引物。采用MyiQ单色实时PCR检测系统(Bio-Rad),95 ℃ 30 min; 95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,循环40次。β-actin作为内参照,采用2-ΔΔCt法分析基因的相对表达量。
2.3 细胞对顺铂的敏感性检测 首先,采用CCK-8的方法检测胃癌细胞的半数抑制浓度。将处于对数生长期的细胞以1×108/L密度接种于96孔板中,待细胞长至90%融合进行同步化处理并加入终浓度分别为0、0.25、0.5、1、2、4、8和16 mg/L的顺铂,继续培养48 h时,加入CCK-8 100 μL孵育2 h,测定450 nm波长处的吸光度值,计算细胞的生存率。其次,采用台盼蓝染色后血球计数板计数活细胞数量。取上述顺铂处理的细胞,胰酶消化后,冷PBS重悬2次,制备单个细胞悬液,适当稀释后,向细胞悬液中加入0.4%台盼蓝溶液,使台盼蓝终浓度为0.04%,倒置显微镜下用血球计数板计数无染色的活细胞数量(死细胞被染成淡蓝色)。
2.4 乳酸脱氢酶(lactate dehydrogenase,LDH)活性的测定 采用乳酸脱氢酶(LDH)相对活性变化检测细胞毒性。将处于对数生长期的细胞以1×108/L密度接种于96孔板中,待细胞长至90%融合进行同步化处理并加入终浓度分别为0、0.25、0.5、1、2、4、8和16 mg/L的顺铂,继续培养48 h。按照CytoTox 96®分析试剂盒实验说明书定量地测量LDH在细胞裂解后的释放量。记录酶标仪下测定490 nm波长处的吸光度(A)值。LDH活性(%)=(处理组A值-空白对照A值)/(对照组A值-空白对照A值)× 100%。
2.5 Ad-Fas腺病毒载体的构建和转染 腺病毒载体的构建参照文献报道的方法[13]。Ad-Fas的制备按照 AdMax (Microbix)和pSilencerTMadeno 1.0-CMV System (Ambion)的说明书进行。线性化重组腺病毒质粒用HEK293A细胞进行包装及扩增,经CsCl纯化后,用含10%甘油的Tris缓冲液(20 mmol/L)进行透析,于-80 ℃保存。Ad-LacZ作为对照,用Western blot法检测胃癌细胞转染Ad-Fas腺病毒48 h后Fas的表达。
2.6 细胞凋亡的检测 流式细胞术(Annexin V/PI双染色法)检测细胞凋亡,将各组细胞消化后1 000×g离心5 min,加入binding buffer重悬细胞。先加入Annexin V-FITC混匀后,室温避光静置10 min,后加PI染液,室温下避光染色10 min,上机检测,激发波长Ex=488 nm;发射波长Em=530 nm。
2.7 Western blot实验 收集各实验组蛋白样品并用BCA试剂盒进行蛋白定量,调整各组上样量后加入上样缓冲液,98 ℃水浴变性5 min。8% SDS-PAGE电泳后电转至PVDF膜(约90 min),依照试剂盒说明用5%脱脂牛奶室温封闭1 h,加入P38/p-P38、JNK/p-JNK、caspase-8/cleaved caspase-8、caspase-3/cleaved caspase-3及β-actin单克隆抗体,4 ℃孵育过夜,TBST洗涤5 min 3次,分别加入抗HRP标记的II抗,室温孵育1.5 h,TBST洗涤10 min 3次。于暗室中将PVDF膜的蛋白面浸入HRP-ECL发光液中激发荧光,压X片、显影并定影。
3 统计学处理
将数据录入SPSS 13.0标准版统计软件包行数据分析,所有实验数据以均数±标准差(mean±SD)表示,计量资料两组之间的比较采用t检验,多组间比较采用单因素方差分析,各组均数间的两两比较用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 Fas的表达与胃癌细胞顺铂耐药之间的关系
我们首先检测了胃癌顺铂耐药细胞株SGC7901/DDP及其对照亲本细胞株SGC7901的IC50[SGC7901/DDP:(5.51±0.23) mg/L;SGC7901:(0.62±0.02) mg/L],结果证明SGC7901/DDP对顺铂的耐药性明显增强。同时我们同时检测了这2株细胞Fas的mRNA及蛋白表达情况,耐药细胞株SGC7901/DDP中Fas的mRNA及蛋白表达水平均明显低于亲本细胞株;在亲本细胞株SGC7901中,Fas的蛋白表达水平随着顺铂的浓度增加不断降低。该结果提示Fas的表达可能与胃癌顺铂耐药之间存在相关关系。并且,在亲本细胞株SGC7901中,不同浓度顺铂处理细胞后,LDH活性没有明显变化,见图1。
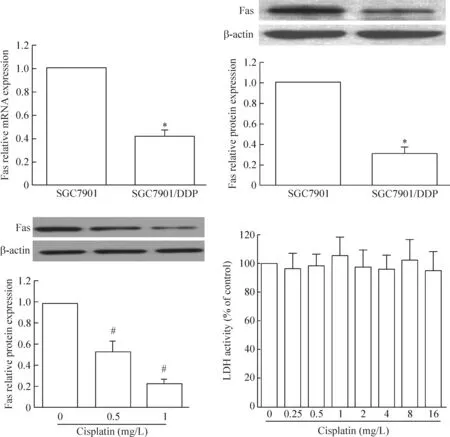
Figure 1.The relationship between Fas expression and cisplatin resistance in the stomach cells. Mean±SD.n=6.*P<0.05vsSGC7901;#P<0.05vs0 mg/L group.
图1 Fas的表达与胃癌细胞顺铂耐药之间的关系
2 Fas过表达对耐药细胞株SGC7901/DDP顺铂敏感性的影响
为进一步证明Fas的表达与胃癌顺铂耐药之间的相互关系,我们在耐药细胞株SGC7901/DDP中过表达Fas,并检测其对顺铂耐药性的变化,CCK-8实验的结果显示,SGC7901/DDP细胞过表达Fas后对顺铂的敏感性明显增加,差异有统计学显著性(P<0.05),见图2。
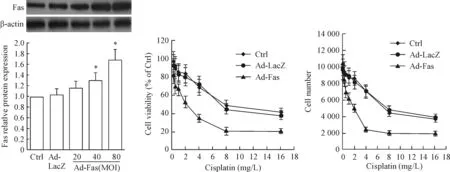
Figure 2.Overexpression of Fas increased the sensitivity of the SGC-7901/DDP cells to cisplatin. Ctrl: control. Mean±SD.n=6.*P<0.05vsCtrl.
图2 过表达Fas可提高耐药细胞SGC7901/DDP对顺铂的敏感性
3 Fas过表达对细胞生物学行为的影响
接着我们观察了Fas过表达对细胞活力的影响,结果显示,在SGC7901/DDP中过表达Fas之后,细胞活力明显降低(P<0.05)。细胞的凋亡情况检测则发现,Fas过表达之后,耐药细胞的凋亡明显增加(P<0.05),见图3。
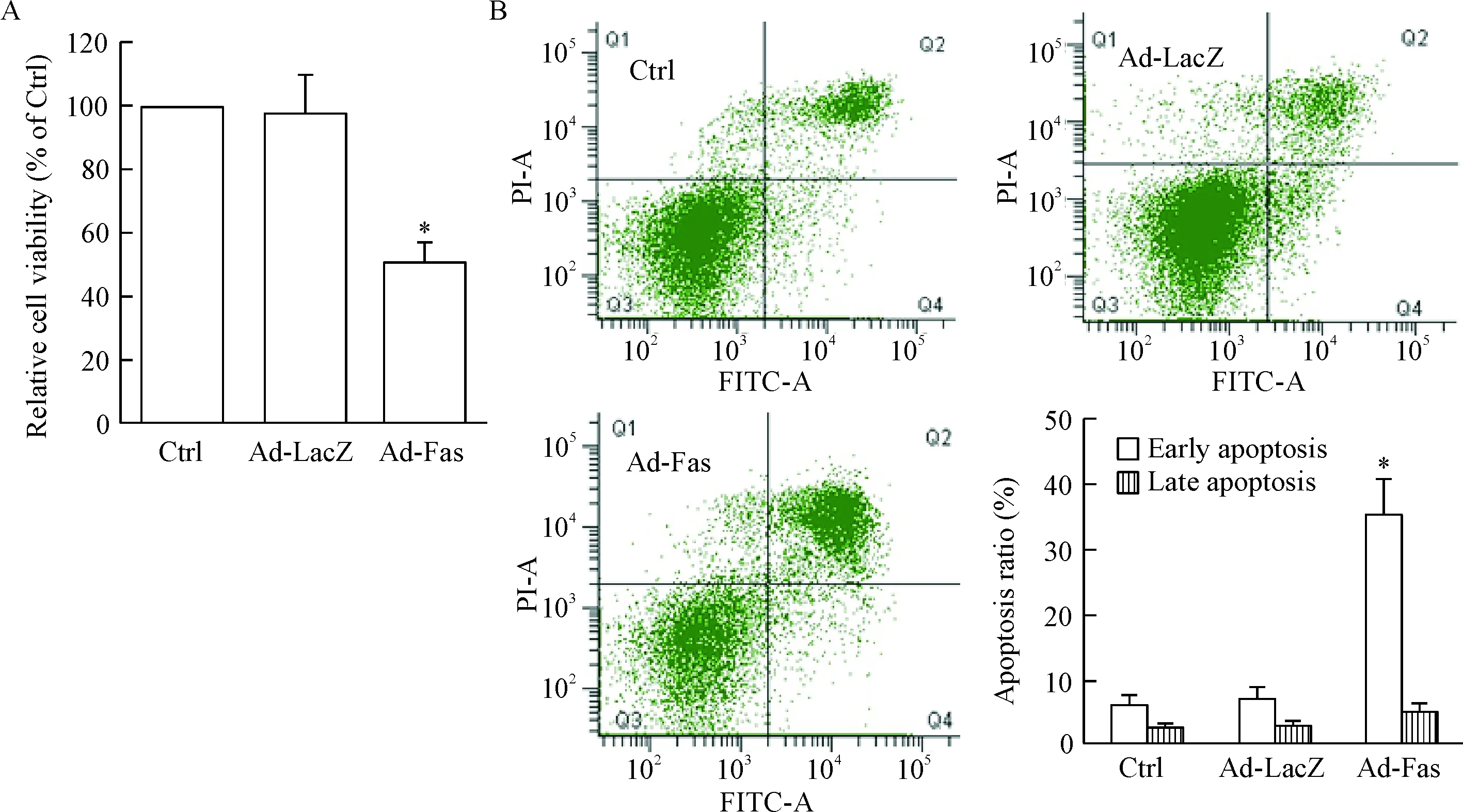
Figure 3.The effects of Fas overexpression on the viability (A) and apoptosis (B) of the SGC7901/DDP cells. Ctrl: control. Mean±SD.n=6.*P<0.05vsCtrl.
图3 SGC7901/DDP细胞过表达Fas后的细胞活力和凋亡情况
4 Fas过表达对凋亡信号通路的影响
Western blot法检测结果显示SGC7901/DDP细胞过表达Fas之后,p-P38和p-JNK蛋白水平明显增加(P<0.05),而P38和JNK的表达无明显变化,提示P38/JNK凋亡信号通路被激活。
除此之外,我们还检测了caspase家族凋亡相关蛋白的表达情况。结果显示,在SGC7901/DDP中过表达Fas之后激活型caspase-8和激活型caspase-3的蛋白水平增加,提示过表达Fas可诱导耐药细胞中caspase家族凋亡相关蛋白的活化(P<0.05),见图4。
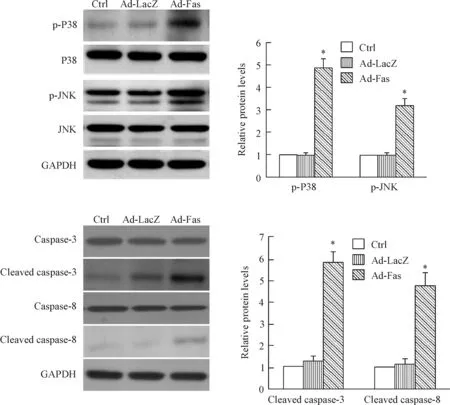
Figure 4.The effect of Fas on apoptosis-related pathway in the SGC7901/DDP cells. Ctrl: control. Mean±SD.n=6.*P<0.05vsctrl.
图4 Fas过表达对凋亡信号通路的影响
讨 论
细胞增殖与凋亡的失平衡被认为是肿瘤化疗耐药发生的一个重要原因。在参与调控细胞凋亡的众多信号转导通路中,Fas/FasL通路是重要凋亡信号通路之一,参与肿瘤发生和发展[14]。我们的研究发现,在胃癌顺铂耐药细胞株中Fas mRNA和蛋白的表达水平均显著增加,提示Fas可能参与调控胃癌顺铂耐药现象的发生。通过构建Fas过表达载体,我们发现在胃癌顺铂耐药细胞SGC7901/DDP中过表达Fas可提高细胞对顺铂的敏感性。因此我们认为,Fas可逆转胃癌顺铂耐药。
为进一步了解Fas逆转顺铂耐药的作用机制,我们检测了耐药细胞SGC7901/DDP过表达Fas后,细胞的活力及凋亡水平。结果发现过表达Fas可促进SGC7901/DDP的凋亡,同时抑制细胞生长。由此我们认为Fas逆转胃癌顺铂耐药可能是通过抑制耐药细胞生长和周期转换,同时促进耐药细胞凋亡来实现的。细胞凋亡是一个涉及多条信号通路、调控精细复杂的过程。Fas作为公认的凋亡受体蛋白,不仅可通过与FasL结合,激活死亡受体通路,诱导细胞凋亡;还可以激活JNK和P38 MAPK等促凋亡信号通路,使细胞对caspase介导的凋亡敏感性增加[15-17]。实验中我们发现,Fas过表达可促进耐药细胞中JNK及P38的磷酸化,激活JNK和P38信号通路;同时死亡蛋白酶caspase家族中2个关键的蛋白分子caspase-8和caspase-3被激活。Fas逆转胃癌顺铂耐药可能与凋亡信号通路的激活有关,但是除JNK和P38MAPK信号通路之外,是否还有其它通路的参与及其具体的调控机制还有待进一步的研究。
综上所述,胃癌顺铂耐药细胞中过表达Fas可恢复细胞对顺铂的敏感性,促进细胞凋亡并抑制细胞生长,其机制可能与JNK和P38 MAPK信号通路的激活有关。
[1] Ashraf N, Hoffe S, Kim R. Adjuvant treatment for gastric cancer: chemotherapy versus radiation[J]. Oncologist, 2013, 18(9):1013-1021.
[2] Galluzzi L, Senovilla L, Vitale I, et al. Molecular mechanisms of cisplatin resistance[J]. Oncogene, 2012, 31(15):1869-1883.
[3] Wen X, Buckley B, McCandlish E, et al. Transgenic expression of the human MRP2 transporter reduces cisplatin accumulation and nephrotoxicity inMrp2-Null mice[J]. Am J Pathol, 2014, 184(5):1299-1308.
[4] Juliachs M, Munoz C, Moutinho CA, et al. The PDGFRβ-AKT pathway contributes to CDDP-acquired resistance in testicular germ cell tumors[J]. Clin Cancer Res, 2014, 20(3):658-667.
[5] Marshall EA, Ng KW, Anderson C, et al. Gene expression analysis of microtubule affinity-regulating kinase 2 in non-small cell lung cancer[J]. Genom Data, 2015, 6:145-148.
[6] Ali AY, Kim JY, Pelletier JF, et al. Akt confers cisplatin chemoresistance in human gynecological carcinoma cells by modulating PPM1D stability[J]. Mol Carcinog, 2015, 54(11):1301-1314.
[7] Afonso J, Santos LL, Miranda-Gonçalves V, et al. CD147 and MCT1-potential partners in bladder cancer aggressiveness and cisplatin resistance[J]. Mol Carcinog, 2015, 54(11):1451-1466.
[8] Gryko M, Guzińska-Ustymowicz K, Pryczynicz A, et al. Correlation between Fas and FasL protein expression in normal gastric mucosa and gastric cancer[J]. Folia Histochem Cytobiol, 2011, 49(1):142-147.
[9] Mo JS, Alam KJ, Kang IH, et al. MicroRNA 196B regulates FAS-mediated apoptosis in colorectal cancer cells[J]. Oncotarget, 2015, 6(5):2843-2855.
[10]Horton JK, Siamakpour-Reihani S, Lee CT, et al. FAS death receptor: a breast cancer subtype-specific radiation response biomarker and potential therapeutic target[J]. Radiat Res, 2015, 184(5):456-469.
[11]Siena L, Pace E, Ferraro M, et al. Gemcitabine sensitizes lung cancer cells to Fas/FasL system-mediated killing[J]. Immunology, 2014, 141(2):242-255.
[12]Galenkamp KM, Carriba P, Urresti J, et al. TNFα sensitizes neuroblastoma cells to FasL-, cisplatin- and etoposide-induced cell death by NF-κB-mediated expression of Fas[J]. Mol Cancer, 2015, 14:62.
[13]Wu W, Wang HD, Guo W, et al. Up-regulation of Fas reverses cisplatin resistance of human small cell lung cancer cells[J]. J Exp Clin Can-cer Res, 2010, 29:49.
[14]Jin Y, Yan EZ, Fan Y, et al. Sodium ferulate prevents amyloid-beta-induced neurotoxicity through suppression of p38 MAPK and upregulation of ERK-1/2 and Akt/protein kinase B in rat hippocampus[J]. Acta Pharmacol Sin, 2005, 26(8):943-951.
[15]Qi S, Fu W, Wang C, et al. BPA-induced apoptosis of rat Sertoli cells through Fas/FasL and JNKs/p38 MAPK pathways[J]. Reprod Toxicol, 2014, 50:108-116.
[16]Chen KC, Chang LS. Notexin upregulates Fas and FasL protein expression of human neuroblastoma SK-N-SH cells through p38 MAPK/ATF-2 and JNK/c-Jun pathways[J]. Toxicon, 2010, 55(4):754-761.
[17]Kober AM, Legewie S, Pforr C, et al. Caspase-8 activity has an essential role in CD95/Fas-mediated MAPK activation[J]. Cell Death Dis, 2011, 2:e212.
(责任编辑: 林白霜, 罗 森)
△ 通讯作者 Tel: 020-38274637; E-mail: zslyjohn@163.com
Role of Fas overexperssion in reversing cisplatin resistance in stomach cancer cells
CHEN Gang1, SHEN-TU Yang-ping2
(1DepartmentofOncology,ArmedPoliceCorpsofZhejiangJiaxingHospital,Jiaxing314000,China;2FunctionLaboratoryCentre,WenzhouMedicalUniversity,Wenzhou325000,China.E-mail:hg15868181011@163.com)
AIM: To study the effect of Fas on cisplatin resistance in stomach cancer cells and its possible mechanisms.METHODS: The expression of Fas at mRMA and protein levels in SGC-7901 cells and SGC-7901/DDP cells was determined by RT-qPCR and Western blot. Fas-containing adenovirus vector was transfected into the SGC-7901/DDP cells to upregulate Fas expression. The cell viability was detected by CCK-8 assay. The cell cycle and cell apoptosis were analyzed by flow cytometry. The protein levels of Fas, P38/p-P38, JNK/p-JNK, cleaved caspase-8/caspase-8 and cleaved caspase-3/caspase-3 were detected by Western blot.RESULTS: The expression of Fas at both mRNA and protein levels was significantly downregulated in the SGC-7901/DDP cells. Fas expression was decreased by cisplatin in a dose-dependent manner in the SGC-7901 cells. Overexpression of Fas suppressed the viability and induced apoptosis in the SGC-7901/DDP cells, and upregulated the protein levels of p-P38, p-JNK, cleaved caspase-8 and cleaved caspase-3.CONCLUSION: Overexpression of Fas increases the sensitivity of the SGC-7901/DDP cells to cisplatin, and inhibits the cell growth and promotes cell apoptosis. The mechanism may be related to the activation of JNK and P38 pathway.
Fas; Stomach cancer; Cisplatin resistance; Cell apoptosis
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1568- 06
2015- 11- 18
2016- 06- 07
温州市科技计划项目(No.2012S0441; No.Y20130046; No.Y20140296)
△通讯作者 Tel: 0573-82824033; E-mail: hg15868181011@163.com
R735.2
A
10.3969/j.issn.1000- 4718.2016.09.006

