CD147单抗介导的基因治疗纳米颗粒的肺癌细胞靶向性研究*
吴飞龙, 孔庆磊, 蔡松旺, 叶志强△
(中山大学附属第三医院 1急诊科, 2心胸外科, 广东 广州 510630)
CD147单抗介导的基因治疗纳米颗粒的肺癌细胞靶向性研究*
吴飞龙1, 孔庆磊1, 蔡松旺2, 叶志强1△
(中山大学附属第三医院1急诊科,2心胸外科, 广东 广州 510630)
目的: 本研究采用靶向CD147的单克隆抗体对纳米基因载体颗粒进行靶向修饰后,进行针对肺癌细胞的蛋白激酶Cε(protein kinase Cε,PKCε)小干扰RNA基因治疗,观察其对肺癌细胞增殖和迁移能力的抑制效果。方法: 制作可靶向CD147蛋白的磁性纳米基因载体。激光扫描共聚焦显微镜观察肺癌细胞CD147表达量。分别设立CP组、CN组和LP组复合物,按每6孔板孔质粒总量250 ng进行细胞转染。另设CD147靶向载体对照CA组和未转染细胞的对照(control)组。激光扫描共聚焦显微镜观察纳米造影剂的细胞内吞效果。实时荧光定量PCR检测PKCε的mRNA表达。Western blot法检测PKCε、Ki67、MMP3、Wnt1和GAPDH的蛋白表达。平板克隆形成实验检测细胞的增殖能力。Transwell法检测细胞的迁移能力。结果: 免疫荧光法染色观察证实,人肺癌A549细胞的胞膜高表达CD147蛋白。CP组细胞中siRNA高效进入A549细胞,质粒内吞效率大于CN组和LP组。CP组、CN组、LP组和CA组的A549细胞中PKCε的mRNA相对表达量分别为control组的(9.76±0.18)%、(98.51±0.32)%、(99.17±0.16)%和(99.68±0.11)%,CP组与control组间的差异有统计学显著性(P<0.05),CN组、LP组与control组间的差异无统计学显著性。CP组PKCε、Ki-67、MMP3及Wnt1蛋白的表达量明显降低,CN组和LP组与对照组之间的蛋白表达量的差异无统计学显著性。CP组的克隆形成数量明显少于control组,差异具有统计学显著性(P<0.05)。CN组、LP组和CA组的有效克隆数量与control组相比差异没有统计学显著性。CP组的过膜细胞数量明显少于control组,差异具有统计学显著性(P<0.05)。CN组、LP组和CA组的数量与control组相比差异没有统计学显著性。结论: 靶向CD147修饰的纳米基因载体,可以对肺癌细胞进行高效的PKCε-siRNA基因治疗,实现对肺癌细胞增殖和迁移能力的高效抑制。
CD147; 纳米载体; 基因治疗; 蛋白激酶Cε
纳米基因载体是可以结合目的基因、组成1~1 000 nm大小的纳米级基因递送系统。纳米基因载体在递送治疗基因的过程中,可以避免基因损耗,增加病灶位置基因浓度,并促进细胞内吞,提高治疗基因的生物利用率,经过配体、抗体等表面修饰的纳米载体可与目的器官和目的细胞表面的特异性受体或特异性抗原结合,实现在特定部位的浓集及高效释放,进一步提高基因传递的效率[1-2]。CD147是一种在肺癌、泌尿系肿瘤、乳腺癌等多种恶性肿瘤中高表达的跨膜糖蛋白,适合作为纳米载体识别肿瘤细胞的靶向位点[3-5]。本研究采用CD147单抗,对纳米载体颗粒进行靶向化修饰,使其具备肺癌细胞特异性识别功能,进而采用该纳米载体负载本课题组前期报道的蛋白激酶Cε(protein kinase Cε,PKCε)小干扰RNA(small interfering RNA,siRNA)对肺癌细胞进行基因治疗,并研究其起效机制[6]。同时,对该纳米载体与通用的新型脂质体载体LipofectamineTM3000[7-8]的基因治疗效果进行了比较。本研究采用靶向CD147的单克隆抗体对纳米基因载体颗粒进行靶向修饰后,进行针对肺癌细胞的蛋白激酶PKCε-siRNA基因治疗,观察其对肺癌细胞增殖和迁移能力的抑制效果,并初步探讨其起效的分子生物学机制。
材 料 和 方 法
1 材料与试剂
人肺癌细胞株A549购自ATCC,由华南师范大学分子生物学实验室保存;红色荧光染料四乙基罗丹明(rhodamine)标记的羊抗兔-IgG抗体、兔抗人CD147单克隆抗体(CD147-Ab)及其同型对照抗体购自武汉博士德生物工程有限公司;免疫荧光染色试剂盒购自广州安邦生物科技有限公司;PKCε-siRNA和阴性对照siRNA (negative control siRNA, NC-siRNA)购自Santa Cruz。红色核酸荧光染料GelRed购自Biotium[9];TANBead®USPIO-101纳米级颗粒购自Advanced Nanotech;LipofectamineTM3000转染试剂购自Invitrogen;荧光染料Hoechst 33342购自成都麦卡希化工有限公司。
2 方法
2.1 纳米颗粒靶向CD147蛋白识别功能的添加 按照产品说明书要求,将CD147单克隆抗体配制为1 g/L溶液,与浓度为15 g/L的TANBead®USPIO-101纳米颗粒混悬液等体积混悬重悬于含有5 g/L[1-乙基-(3-二甲基氨基丙基)]碳化二亚胺盐酸盐(EDC·HCl)的三蒸水中。4 ℃条件下振荡8 h。于磁性分离器中收集含有磁性成分USPIO的纳米颗粒,制成可靶向CD147蛋白的CD147-Ab-TANBead®USPIO-101磁性纳米基因载体[10]。
2.2 肺癌细胞CD147表达量的鉴定 复苏人肺癌A549细胞株,常规条件培养于37 ℃、5% CO2、饱和湿度的细胞培养箱中。PBS冲洗细胞3次后,4%中性甲醛固定液固定细胞。使用免疫荧光染色试剂盒,以CD147单抗或其同型抗体为 I 抗,RIB200标记的羊抗兔-IgG抗体,进行免疫荧光染色。免疫荧光染色后,蓝色荧光染料Hoechst 33342避光孵育0.5 h染色细胞核。Olympus FV1200激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)观察染色结果。
2.3 基因载体与质粒的复合 分别按照载体说明书,采用靶向修饰的CD147-Ab-TANBead®USPIO-101、未靶向修饰的TANBead®USPIO-101 和脂质体载体LipofectamineTM3000复合PKCε-siRNA,作为CP(CD147 targeted-PKCε-siRNA)组、CN(CD147-non-targeted-PKCε-siRNA)组和LP(LipofectamineTM3000-PKCε-siRNA)组复合物用于细胞转染。另设不复合质粒的靶向修饰的空载体CD147-Ab-TANBead®USPIO-101对照CA(CD147-Ab-TANBead®USPIO-101)组和未转染细胞对照(control)组。
2.4 细胞培养和分组转染 A549细胞培养于6孔板上,待细胞融合度达70%时,分为如上CP组、CN组、LP组、CA组或control组分别按照说明操作步骤进行转染。转染条件为LipofectamineTM3000说明书推荐质粒用量的1/30,每6孔板孔采用含250 ng质粒的载体-siRNA复合物与细胞共孵育转染。
2.5 激光扫描共聚焦显微镜观察纳米造影剂的细胞内吞效果 采用红色核酸荧光染料GelRed对载体-siRNA复合物进行染色后转染3 h,4%中性甲醛固定液固定细胞,Hoechst 33342避光孵育0.5 h染色细胞核。激光扫描共聚焦显微镜观察。所有实验重复3次。
2.6 实时荧光定量PCR检测PKCε的mRNA表达 TRIzol法提取各组总细胞RNA,逆转录合成cDNA。PKCε的上游引物为5’-ATGGTAGTGTTCAATGGCCTTCT-3’,下游引物为5’-TCAGGGCATCAGGTCTTCAC-3’;内参照GAPDH的上游引物为5’-TTGCATGCGACATAAGGTGTGA-3’,下游引物为5’-CTGGGAGATCTAGCAATGCATG-3’。PCR反应条件为95 ℃ 35 s;95 ℃ 7 s、55 ℃ 32 s,62个循环,循环延伸末端收集荧光信号[6]。Real-time PCR数值分析采用2-ΔΔCt分析法。所有实验重复3次。
2.7 细胞功能蛋白表达鉴定 siRNA转染肺癌细胞48 h。收集细胞后提取蛋白,按照常规方法进行Western blot实验,检测 PKCε、Ki67、MMP3、Wnt1和GAPDH的蛋白水平。
2.8 平板克隆形成实验检测增殖能力 分别取5组转染后细胞制备单细胞悬液,测定细胞密度后,分别取500个细胞,分别接种于6孔板中,每组细胞设3个复孔。于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养14 d,PBS冲洗3次后,4%中性甲醛固定液固定细胞,结晶紫染色。光镜下观察每孔形成的细胞克隆数。设定每克隆的细胞数大于50个计作1个有效克隆。每组实验重复3次。
2.9 Transwell法检测细胞的迁移能力 取Transwell小室,每室中加入50 μL预稀释的Matrigel胶,37 ℃静置2 h凝固后用于实验。分别取5组转染后细胞制备单细胞悬液并测定细胞密度,分别取等量转染后细胞接种入Transwell上室。下室中加入含胎牛血清培养基500 μL。37 ℃、5% CO2、饱和湿度的细胞培养箱中培养24 h。取出小室,去除小室底膜上面的细胞后,4%中性甲醛固定液固定小室底膜下面细胞。结晶紫染色,光镜下计数穿过小室底膜的细胞数量。每组实验重复3次。
3 统计学处理
采用SPSS 13.0 统计学软件分析数据。实验数据以均数±标准差(mean±SD)表示,多组数据比较采用单因素方差分析,各组均数间的两两比较采用SNK法。以P<0.05为差异有统计学意义。
结 果
1 人肺癌A549细胞CD147表达的免疫荧光观察
免疫荧光法染色观察发现,采用CD147单抗作为 I 抗的A549细胞膜上出现RIB200免疫荧光标记的红色荧光染色,而使用同型对照抗体作为 I 抗的细胞膜上没有出现红色荧光染色,说明人肺癌A549细胞的胞膜高表达CD147蛋白。所以可以尝试在纳米基因载体上连接CD147抗体后,实现对A549细胞进行识别,见图1。
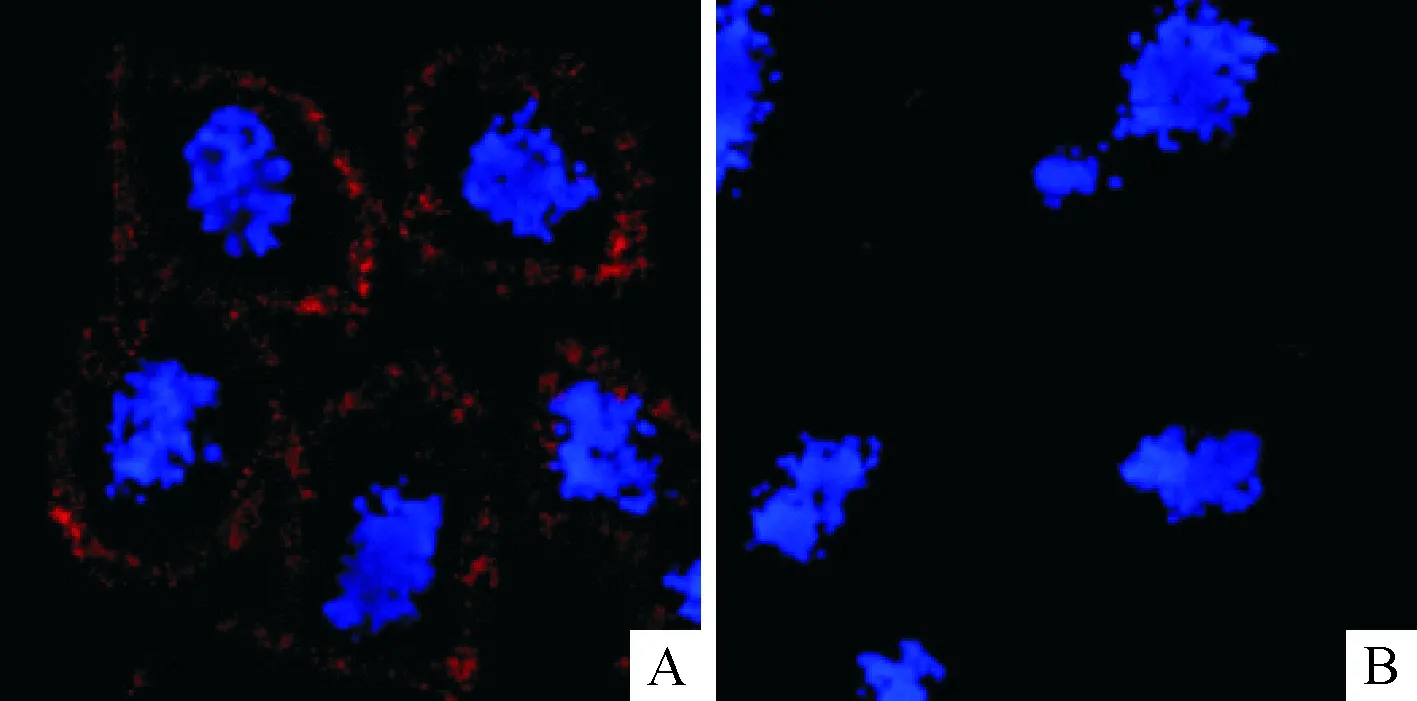
Figure 1.The images of A549 cells with-CD147 immunofluorescence staining (laser confocal microscope, ×1 000). A: stained with an anti-CD147 antibody; B: using the same type of control antibody.
图1 A549细胞的CD147免疫荧光染色结果
2 纳米基因载体的细胞内吞效果
如图2所示,免疫荧光实验观察发现,在经过设定较低的载体-siRNA复合物用量转染后,CP组肿瘤细胞中可以观察明显的大量红色核酸荧光染料GelRed发出的红色荧光,CN组和LP组仅可见极少的微弱红色荧光,CA组和control组未见红色荧光,说明CP组细胞中siRNA通过载体的介导,高效进入A549细胞,质粒内吞效率大于CN组和LP组。
3 5组细胞PKCε的mRNA表达
CP组、CN组、LP组和CA组的A549细胞中PKCε的mRNA相对表达量分别为control组的(9.76±0.18)%、(98.51±0.32)%、(99.17±0.16)%和(99.68±0.11)%,CP组与control组的差异有统计学显著性(P<0.05),CN组、LP组、CA组与control组的差异无统计学显著性。这说明在LipofectamineTM3000说明书推荐质粒用量的1/30进行转染时,仅有CD147靶向化的纳米载体可以实现siRNA对PKCε基因的明显沉默效果。
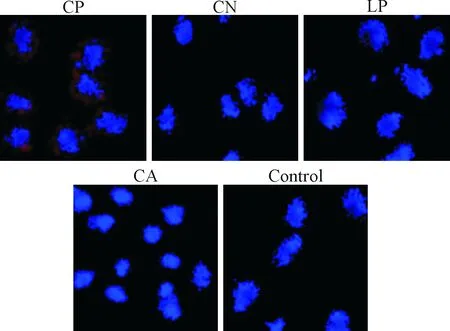
Figure 2.The effects of the gene vectors in 4 groups on the endocytosis of A549 cells (laser confocal microscope, ×1 000).
图2 4组基因载体对A549细胞内吞效果的观察
4 5组细胞PKCε、Ki67、MMP3和Wnt1的蛋白表达
由图3可见,在LipofectamineTM3000说明书推荐质粒用量的1/30进行转染时,仅有CP组PKCε、Ki-67、MMP3及Wnt1蛋白的表达量明显降低,CN组、LP组和CA组与对照组之间的蛋白表达量差异无统计学显著性。Western blot实验检测的结果与前述RT-qPCR实验结果一致,说明CD147靶向化的纳米载体可以实现较高的siRNA抑制PKCε蛋白表达的效果,且同时对Ki-67、MMP9、Wnt1等功能蛋白的表达产生抑制。
5 5组细胞增殖能力的检测
培养14 d后,分别计数5组细胞的有效克隆数量。发现CP组的克隆数量明显少于control组,差异具有统计学显著性(P<0.05)。而CN组、LP组和CA组的有效克隆数量与control组相比差异没有统计学显著性,见图4。
6 5组细胞细胞迁移能力的比较
Transwell小室培养24 h后,计数5组过膜细胞的数量,发现CP组的数量明显少于control组,差异具有统计学显著性(P<0.05)。而CN组、LP组和CA组的数量与control组相比差异没有统计学显著性,见图5。
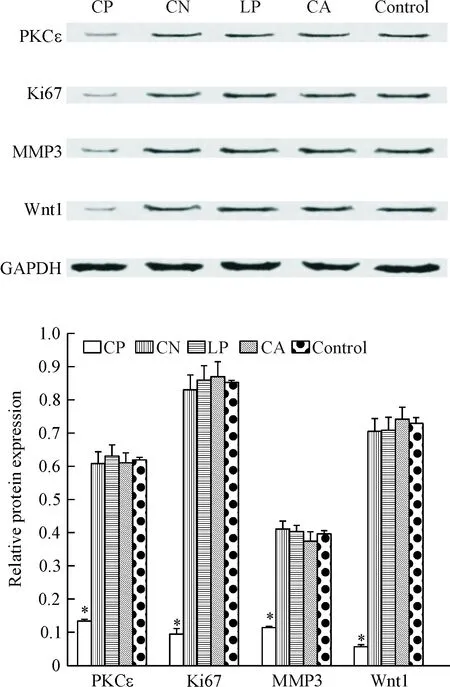
Figure 3.The protein expression levels in the A549 cells of 4 groups detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图3 4组A549细胞中蛋白表达水平的Western blot实验检测
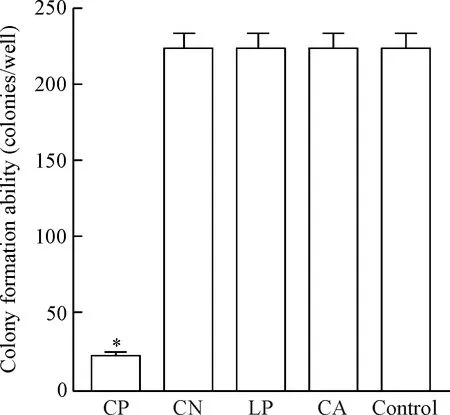
Figure 4.Comparison of the colony formation abilities of A549 cells in 5 groups. Mean±SD.n=3.*P<0.05vscontrol group.
图4 5组细胞克隆形成能力的比较
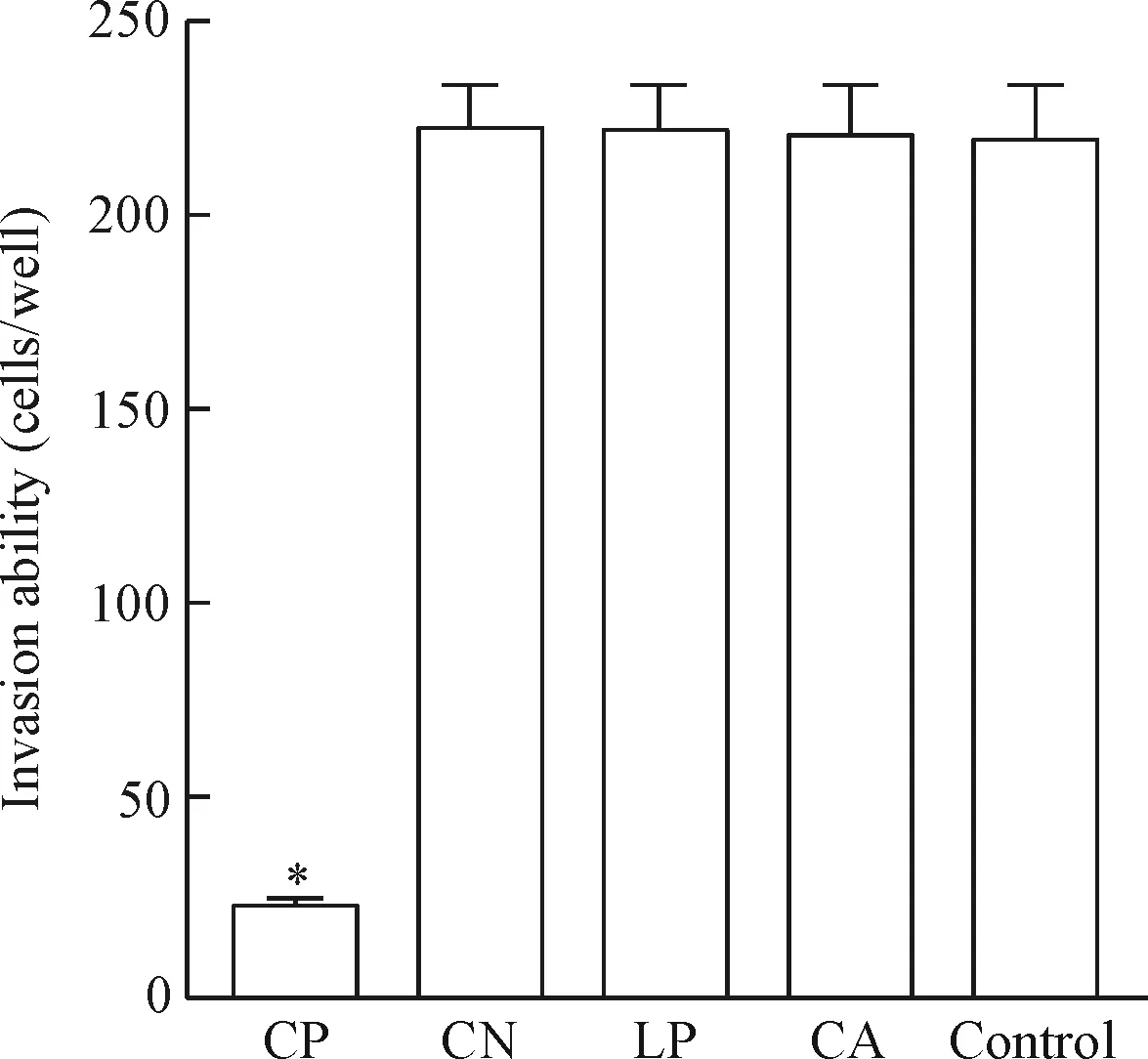
Figure 5.Comparison of the invasion abilities of A549 cells in 5 groups. Mean±SD.n=3.*P<0.05vscontrol group.
图5 5组细胞迁移能力的比较
讨 论
本研究首先合成了一种CD147靶向的磁性纳米基因载体CD147-Ab-TANBead®USPIO-101,并包裹PKCε-siRNA,实现对肺癌细胞A549的基因治疗。磁性纳米载体是一类粒径在纳米尺度的,由磁性金属及金属氧化物等原料组成的纳米载体,可用于包裹核酸进行基因治疗。在本研究中,我们采用了被证明具有确切基因负载传输效果的TANBead®USPIO-101纳米级颗粒进行治疗质粒负载[11-12]。在治疗基因方面,采用了研究团队前期研究中采用的可抑制细胞蛋白激酶Cε表达的商品化PKCε-siRNA。蛋白激酶Cε是蛋白激酶C的重要亚型之一,与肿瘤的增殖转移关系密切。在我们的前期研究中已证实,利用该手段对蛋白激酶Cε表达进行抑制可以通过NF-κB、AKT等信号通路对肿瘤细胞进行基因治疗[6]。磁性纳米载体复合核酸后,可以通过静电作用结合形成紧密的纳米颗粒,可以有效地阻止核酸酶与核酸的接触,并通过构象变异,发挥酶切保护效果。在纳米载体表面进行适当的配体或抗体靶向化修饰,可以有效提高特定部位纳米复合物聚集的能力,进而实现提高负载的治疗基因的生物利用率的目的。在纳米载体传递系统的设计中,靶向修饰位点的选择非常重要。CD147是一种定位于19p13.3的跨膜糖蛋白,为免疫球蛋白超家族成员,其蛋白结构包括细胞外2个免疫球蛋白区、跨膜区和胞内区,其胞外区具有诱导临近的成纤维细胞分泌MMP等功能[13]。目前已经证实,在肺癌、乳腺癌、结直肠癌、胶质瘤等肿瘤细胞中,CD147在细胞膜上的表达量均明显升高,适合作为纳米载体靶向识别上述肿瘤细胞的位点[14-15]。在本研究中,我们选用了在肺癌等肿瘤细胞表面特异性高表达的CD147作为靶点,对磁性纳米载体进行CD147抗体靶向修饰,期望使其具备肺癌细胞主动靶向功能[16]。
本研究进而通过免疫荧光法对肺癌A549细胞表面CD147的表达进行了进一步证明。通过免疫荧光染色发现,采用CD147单抗作为Ⅰ抗进行染色后A549细胞膜上出现免疫荧光标记的红色荧光染色,而相对的同型对照抗体不能实现荧光染色,证明与国际上的报道相似,本研究采用的A549细胞膜上确实高表达CD147,且可以通过CD147单抗进行A549细胞靶向。同时,我们以常用的脂质体载体,和未经靶向化修饰的磁性纳米载体,对经过靶向化修饰的纳米载体的siRNA传输效率进行了研究。为对不同载体转染效率的差异进行比较,本研究采用了通用脂质体载体LipofectamineTM3000推荐质粒量的1/30进行转染后,通过共聚焦显微镜直观观察发现,仅有CD147靶向化的纳米载体转染的A549细胞中可以观察到明显的核酸荧光染料聚集,而其它载体组仅可见极少的微弱红色荧光,说明本研究采用的CD147-Ab-TANBead®USPIO-101纳米载体可以在极低的质粒浓度下,实现明显优于LipofectamineTM3000的体外转染效果。
经过如上研究证明了CD147-Ab-TANBead®USPIO-101纳米载体转运质粒进入细胞的效率后,我们对纳米复合物进行基因治疗的效果进行了研究。在RT-qPCR实验和Western blot实验中发现,靶向化的纳米复合物可以有效降低PKCε的表达水平,并抑制肺癌A549细胞的增殖和迁移。对其分子生物学机制进行考察后发现,Ki-67、MMP3及Wnt1蛋白的表达量与PKCε的表达量变化呈正相关。Ki67和MMP3分别是Wnt信号通路中与细胞增殖和迁移转移密切相关的功能蛋白[17-19],Wnt1蛋白是Wnt信号通路的关键蛋白[20-21]。国际上有类似研究表明,PKCε在肿瘤中的活化和功能与Wnt信号通路密切相关[22-23]。在研究中,我们同时采用了等量不复合质粒的,单纯CD147靶向化的纳米载体对细胞进行干预,发现没有对细胞功能蛋白表达及迁移转移能力产生影响,说明本研究采用的纳米载体在实现有效转染和基因治疗的剂量下,本身并不能产生对细胞生物学功能的影响。前述研究结果说明,Ki-67、MMP3可能参与了CD147-Ab-TANBead®USPIO-101纳米载体负载的PKCε-siRNA对肺癌A549细胞的增殖和迁移的抑制,这种抑制功能可能是通过wnt信号通路实现的。
综上所述,靶向CD147修饰的纳米基因复合物负载PKCε-siRNA后,可以对肺癌细胞进行高效的基因治疗,实现对肺癌细胞增殖和迁移能力的高效抑制。
[1] Guo Y, Wang J, Zhang L, et al. Theranostical nanosystem-mediated identification of an oncogene and highly effective therapy in hepatocellular carcinoma[J]. Hepatology, 2016, 63(4):1240-1255.
[2] Guo Y, Chen W, Wang W, et al. Simultaneous diagnosis and gene therapy of immuno-rejection in rat allogeneic heart transplantation model using a T-cell-targeted theranostic nanosystem[J]. ACS Nano, 2012, 6(12):10646-10657.
[3] Huang W, Luo WJ, Zhu P, et al. Modulation of CD147-induced matrix metalloproteinase activity: Role of CD147 N-glycosylation[J]. Biochem J, 2013, 449(2):437-448.
[4] Wang H, Zhuo Y, Hu X, et al. CD147 deficiency blocks IL-8 secretion and inhibits lung cancer-induced osteoclastogenesis[J]. Biochem Biophys Res Commun, 2015, 458(2):268-273.
[5] Grass GD, Toole BP. How, with whom and when: An overview of CD147-mediated regulatory networks influencing matrix metalloproteinase activity[J]. Biosci Rep, 2016, 36(1):e283.
[6] 叶志强,范 瑾,杨跃武,等. 蛋白激酶 Cε对肝癌 SK-H ep-1细胞生物学行为的影响[J]. 中国病理生理杂志, 2014,30(6):994-998.
[7] Rust A, Hassan HH, Sedelnikova S, et al. Two complementary approaches for intracellular delivery of exogenous enzymes[J]. Sci Rep, 2015, 5:12444.
[8] Miryala B, Feng Y, Omer A, et al. Quaternization enhances the transgene expression efficacy of aminoglycoside-derived polymers[J]. Int J Pharm, 2015, 489(1-2):18-29.
[9] Sonmezoglu OA, Ozkay K. A new organic dye-based staining for the detection of plant DNA in agarose gels[J]. Nucleosides Nucleotides Nucleic Acids, 2015, 34(7):515-522.
[10]Tong M, Xiong F, Shi Y, et al.Invitrostudy of SPIO-labeled human pancreatic cancer cell line BxPC-3[J]. Contrast Media Mol Imaging, 2013, 8(2):101-107.
[11]Lo YL, Chou HL, Liao ZX, et al. Chondroitin sulfate-polyethylenimine copolymer-coated superparamagnetic iron oxide nanoparticles as an efficient magneto-gene carrier for microRNA-encoding plasmid DNA delivery[J]. Nanoscale, 2015, 7(18):8554-8565.
[12]Namiki Y, Namiki T, Yoshida H, et al. A novel magnetic crystal-lipid nanostructure for magnetically guidedinvivogene delivery[J]. Nat Nanotechnol, 2009, 4(9):598-606.
[13]Cui HY, Wang SJ, Miao JY, et al. CD147 regulates cancer migration via direct interaction with Annexin A2 and DOCK3-beta-catenin-WAVE2 signaling[J]. Oncotarget, 2016, 7(5):5613-5629.
[14]Messeha SS, Zarmouh NO, Taka E, et al. The role of monocarboxylate transporters and their chaperone CD147 in lactate efflux inhibition and the anticancer effects of in neuroblastoma cell line N2-A[J]. Eur J Med Plants, 2016, 12(4): EJMP.23992.
[15]Kong X, Wang Y, Dai C, et al. Is CD147 a new biomarker reflecting histological malignancy of gliomas?[J]. Mol Neurobiol, 2016 May 20.[Epub ahead of print]
[16]Muramatsu T. Basigin (CD147), a multifunctional transmembrane glycoprotein with various binding partners[J]. J Biochem, 2016, 159(5):481-490.
[17]Focke CM, Decker T, van Diest PJ. Intratumoral heterogeneity of Ki67 expression in early breast cancers exceeds variability between individual tumours[J]. Histopathology, 2016 Jun 6. [Epub ahead of print]
[18]Kim HJ, Kang GJ, Kim EJ, et al. Novel effects of sphingosylphosphorylcholine on invasion of breast cancer: involvement of matrix metalloproteinase-3 secretion leading to WNT activation[J]. Biochim Biophys Acta, 2016, 1862(9):1533-1543.
[19]Bleckmann A, Conradi LC, Menck K, et al. Beta-catenin-independent WNT signaling and Ki67 in contrast to the estrogen receptor status are prognostic and associated with poor prognosis in breast cancer liver metastases[J]. Clin Exp Metastasis, 2016, 33(4):309-323.
[20]Lindvall C, Evans NC, Zylstra CR, et al. The Wnt signaling receptor Lrp5 is required for mammary ductal stem cell activity and Wnt1-induced tumorigenesis[J]. J Biol Chem, 2006, 281(46):35081-35087.
[21]Rota LM, Albanito L, Shin ME, et al. IGF1R inhibition in mammary epithelia promotes canonical Wnt signaling and Wnt1-driven tumors[J]. Cancer Res, 2014, 74(19):5668-5679.
[22]Dissanayake SK, Weeraratna AT. Detecting PKC phosphorylation as part of the Wnt/calcium pathway in cutaneous melanoma[J]. Methods Mol Biol, 2008, 468:157-172.
[23]Kim S, Chun SY, Kwon YS, et al. Crosstalk between Wnt signaling and Phorbol ester-mediated PKC signaling in MCF-7 human breast cancer cells[J]. Biomed Pharmacother, 2016, 77:114-119.
(责任编辑: 林白霜, 罗 森)
CD147 monoclonal antibody-mediated nanoparticles for gene therapy to target lung cancer cells
WU Fei-long1, KONG Qing-lei1, CAI Song-wang2, YE Zhi-qiang1
(1DepartmentofEmergency,2DepartmentofCardiothoracicSurgery,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China.E-mail:zqye@163.com)
AIM: In this study, CD147 antibody was used to carry out targeted modification of nanoparticles for protein kinase Cε (PKCε)-siRNA gene therapy to target lung cancer cells. The inhibitory effects of the nanoparticles on the proliferation and invasion of the lung cancer cells were observed. METHODS: The magnetic nanoparticles targeting CD147 protein were assembled as gene vector. The expression of CD147 in the lung cancer cells was observed under laser scanning confocal microscope. The cells were divided into CP group, CN group and LP group as the experimental groups. Targeted nanoparticles were used as CA group. Non-transfected cells were used as control group. The cell transfection was carried out with 250 ng plasmids/well in 6-well plate. The effect of nanocontrast agent on the cell endocytosis was observed under laser scanning confocal microscope. The mRNA expression of PKCε was detected by RT-qPCR. The protein expression of Ki67, MMP3, PKCε, Wnt1 and GAPDH was determined by Western blot. The cell proliferation ability was detected with colony formation assay. The cell invasion ability was detected by Transwell method. RESULTS: The expression of CD147 protein in the human lung cancer A549 cells was confirmed by immunofluorescence staining. The endocytosis of siRNA into the A549 cells in CP group was observed with the highest efficiency as compared with CN group and LP group. The relative mRNA expression of PKCε in the A549 cells of CP group, CN group, LP group and CA group were (9.76±0.18)%, (98.51±0.32)%, (99.17±0.16)% and (99.68±0.11)%, respectively. The difference between CP group and control group was statistically significant (P<0.05). No significant difference among CN group, LP group and control group was observed. The protein expression of PKCε, Ki-67, MMP3 and Wnt1 in CP group was significantly reduced, and the protein expression levels among CN group, LP group and control group had no significant difference. The colony number in CP group was significantly smaller than that in control group (P<0.05). The effective colony numbers in CN group, LP group and CA group had no significant difference as compared with control group. The number of the invading cells in CP group was significantly less than that in control group (P<0.05). The numbers of the invading cells in CN group, LP group and CA group had no significant difference as compared with control group. CONCLUSION: Nanogene vector targeting CD147 can carry PKCε-siRNA to conduct gene therapy efficiently on the lung cancer cells to achieve effective inhibitory effects on the proliferation and invasion of the lung cancer cells.
CD147; Nanocarriers; Gene therapy; Protein kinase Cε
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1562- 06
2016- 06- 21
2016- 08- 16
广东省科技计划 (No.2014A020212533)
△通讯作者 Tel: 020-85253333; E-mail: zqye@163.com
R730.23
A
10.3969/j.issn.1000- 4718.2016.09.005

