雷公藤甲素通过ERK通路诱导肺癌A549细胞自噬*
王 伟, 王 坤
(杭州市下沙医院 1药学部, 2神经外科,浙江 杭州 310018)
雷公藤甲素通过ERK通路诱导肺癌A549细胞自噬*
王 伟1, 王 坤2△
(杭州市下沙医院1药学部,2神经外科,浙江 杭州 310018)
目的: 研究雷公藤甲素(tripchlorolide,TP)对肺癌A549细胞活力及自噬的影响,并初步探讨其作用机制。方法: 应用TP作用于肺癌A549细胞后,MTT法检测细胞活力;吖啶橙染色(AO)法在荧光显微镜下观察细胞自噬状态;GFP-LC3质粒转染实验观察细胞胞质中绿色点状聚集的自噬小体; Western blot法检测自噬相关蛋白LC3-Ⅱ的表达情况及有关的信号通路ERK蛋白水平的变化。结果: TP可以显著抑制肺癌A549细胞的增殖(P<0.05),并呈一定的剂量-时间依赖关系。TP作用于肺癌A549细胞48 h后,细胞内酸性滤泡染成亮红色荧光比例增多。GFP-LC3转染实验结果显示在100 nmol/L TP处理后,细胞胞质中出现绿色点状聚集的自噬小体,而正常培养组极少细胞有自噬小体形成;同时转染GFP-control质粒的细胞在100 nmol/L TP处理及正常培养条件下均未观察到点状聚集的自噬小体产生。TP作用于肺癌A549细胞48 h后,与对照组相比,100 nmol/L TP组LC3-Ⅱ蛋白表达水平显著升高(P<0.01),同时p-ERK/ERK蛋白水平也显著升高(P<0.01);与100 nmol/L TP组相比,TP+3-MA组LC3-Ⅱ蛋白表达水平显著下降(P<0.01),同时p-ERK/ERK蛋白水平也显著下降(P<0.01)。结论: TP可显著抑制肺癌A549细胞活力并诱导细胞发生自噬,这种作用可能与影响ERK的磷酸化有关。
肺癌; 雷公藤甲素; 细胞增殖; 自噬
雷公藤甲素(tripchlorolide,TP)是从雷公藤中提取到的主要活性物质,众多研究表明其是一种广谱肿瘤抑制剂,对乳腺癌、T细胞淋巴瘤、肝细胞癌、肺癌、胰腺癌、前列腺癌等多种肿瘤具有抑制作用[1-2]。肺癌已经成为我国发病率最高的癌症之一,手术及放、化疗是目前主要的治疗手段,但是肺癌手术切除后易复发,严重影响远期疗效,此外肺癌对目前常用的化疗药物不敏感,化疗效果不能令人满意。自噬在肿瘤进展中的角色随疾病病程而不断发生动态变化,随着研究的不断深入,越来越多的资料显示自噬性细胞死亡在许多肿瘤包括肺癌的发生发展中占有重要地位[3]。本研究根据已有研究结论,结合当前抗肿瘤研究的热点,观察雷公藤甲素对肺腺癌细胞A549活力的影响,并进一步研究雷公藤甲素诱导肺癌细胞的自噬现象,及其可能的作用机制。
材 料 和 方 法
1 材料
TP、二甲基亚砜(dimethyl sulphoxide,DMSO)、3-甲基腺嘌呤(3-methyladenine,3-MA)、雷帕霉素(rapamycin,Rapa)和吖啶橙(acridine orange,AO)购自Sigma;非小细胞肺癌A549细胞购自中国科学院上海细胞所;四甲基偶氮唑盐(MTT)购于碧云天生物公司;β-actin、LC3、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)及p-ERK抗体购自美国CST。iMARK型全自动酶标仪、垂直电泳仪、水平电泳仪购自Bio-Rad;倒置荧光显微镜(Leica)。
2 主要方法
2.1 细胞培养 A549细胞于含10%小牛血清的RPMI-1640培养液中培养,置于37 ℃、5% CO2、饱和湿度培养箱中。细胞贴壁生长良好,每3 d传代1次。取对数生长期的细胞进行实验。
2.2 MTT检测细胞活力 取对数生长期细胞以5.0×107/L的浓度接种于96孔细胞培养板中,每孔100 μL,置于37 ℃、5% CO2、饱和湿度培养箱中培养24 h,待细胞贴壁后,加入不同浓度TP(25、50、100、150、200 nmol/L),以不加TP处理组为对照组,加入不同浓度药物的为实验组。分别于培养箱中培养24 h、48 h和72 h后,每孔加入20 μL MTT(2 g/L),继续孵育4 h后,终止培养。吸去培养液,每孔加DMSO 150 μL,在酶标仪490 nm波长处测定各孔吸光度(A)值。每个浓度设6个复孔,重复实验3次。
2.3 吖啶橙染色 收集对数期细胞,调整细胞悬液浓度,将细胞接种于24孔板,37 ℃、5% CO2孵育培养24 h后,分别加入不同浓度的TP及Rapa,各组药物作用于肺癌A549细胞48 h后,吸尽旧培养液,用PBS缓冲液清洗3遍,加入终浓度为1 mg/L的吖啶橙溶液,避光染色15 min,弃去吖啶橙溶液,用PBS缓冲液清洗3遍,在倒置荧光显微镜下观察细胞形态,实验重复3次。
2.4 GFP-LC3转染实验 将肺癌A549细胞按每孔5×105个细胞接种于6孔板中,待细胞融合至80%左右时使用Lipofectamine 2000转染重组质粒GFP-LC3及对照质粒GFP-control。在离心管中加入100 μL Opti-MEM和4 μg质粒GFP-LC3混匀制成DNA稀释液。在另一个离心管中加入100 μL Opti-MEM和4 μL Lipofectamine 2000混匀制成Lipo稀释液,室温静置5 min。将DNA稀释液和Lipo稀释液混匀,室温静置20 min,将其加入到细胞中,使之均匀分散。37 ℃、5% CO2培养箱中培养4~6 h后更换培养基,继续培养48 h。
2.5 Western blot法检测相关蛋白表达 细胞经RIPA裂解液裂解30 min,冰上进行操作。收集到EP管,BCA蛋白定量法测定蛋白浓度定量,95~100 ℃煮沸5 min,即为样本蛋白。每个泳道加入蛋白样品10 μg,经10%聚丙烯酰胺凝胶电泳后,利用湿法将蛋白转移至PVDF膜上,用含5%脱脂奶粉封闭1 h,分别加入对应 I 抗4 ℃孵育过夜,TBST洗膜3次后,加入对应 II 抗室温摇床孵育2 h,TBST洗膜3次,ECL发光试剂盒发光显影,定影后进行分析。
3 统计学处理
所有实验均重复3次,实验数据用均数±标准差(mean±SD)表示,应用SPSS 17.0统计软件进行数据分析。多组间比较采用单因素方差分析,组间两两比较应用Bonferroni检验,以P<0.05为差异有统计学意义。
结 果
1 雷公藤甲素对肺癌A549细胞活力的影响
MTT实验结果显示,随着给药剂量和时间的增加,TP对肺癌细胞的生长抑制率显著上升,且呈一定的剂量-时间依赖关系,在给药24 h后,TP的IC50为190.81 nmol/L;在给药48 h后,TP的IC50为150.32 nmol/L;在给药72 h后,TP的IC50为73.86 nmol/L。结果表明,TP作用肺癌A549细胞后其细胞活力被显著抑制,见图1。
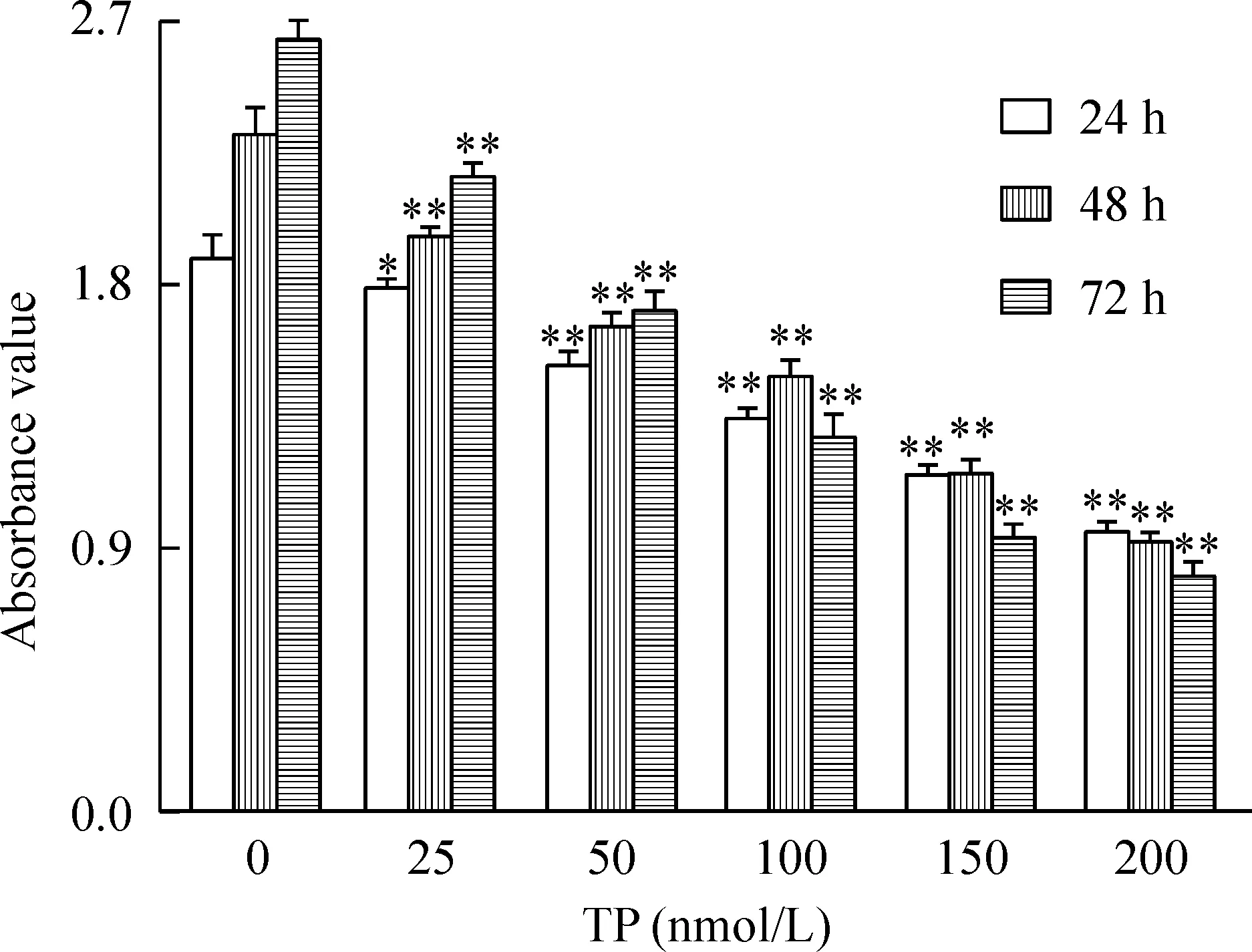
Figure 1.The effect of TP on the cell viability in different groups after 24 h, 48 h and 72 h. Mean±SD.n=3.*P<0.05,**P<0.01vs0 nmol/L.
图1 不同浓度的雷公藤甲素对肺癌 A549 细胞活力的影响
2 吖啶橙染色观察雷公藤甲素作用肺癌A549细胞后自噬泡的变化
吖啶橙可将胞质内酸性自噬泡染成红色,与对照组相比, Rapa阳性对照组胞质内酸性自噬泡染成红色明显,提示自噬水平增加。与对照组相比,TP作用于肺癌A549细胞48 h后细胞内酸性滤泡染成亮红色荧光比例增多,其中以100 nmol/L TP最为明显,见图2。因此,后续实验选择100 nmol/L作为实验浓度。
3 转染GFP-LC3观察雷公藤甲素作用肺癌A549细胞后绿色荧光斑点的变化
由上述吖啶橙染色和Western blot法检测结果可知,100 nmol/L TP诱导肺癌A549细胞自噬现象较为明显。为进一步验证TP确实能诱导肺癌A549细胞自噬现象,我们选择GFP-LC3转染实验于肺癌A549细胞中进行验证。 GFP-LC3转染实验结果显示,转染GFP-LC3质粒的细胞在100 nmol/L TP处理后,细胞胞质中出现绿色点状聚集的自噬小体,而正常培养组极少细胞有自噬小体形成。转染GFP-control对照质粒的细胞在100 nmol/L TP处理及正常培养条件下均未观察到点状聚集的自噬小体产生。这说明100 nmol/L TP能诱导肺癌A549细胞发生自噬,见图3。
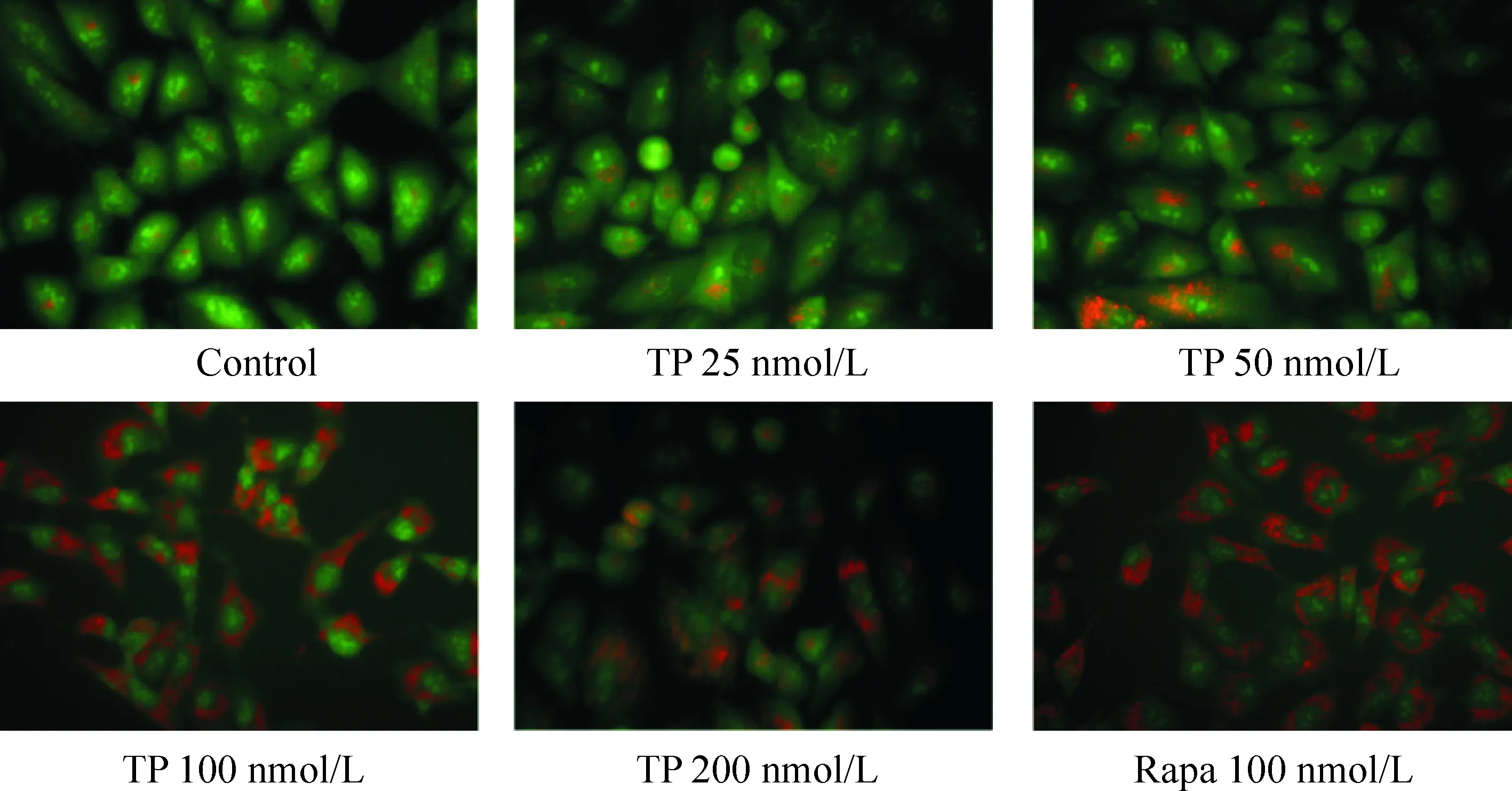
Figure 2.The change of autophagy vesicles in A549 cells after treated with TP (×400).
图2 不同浓度的雷公藤甲素对肺癌 A549 细胞自噬的影响
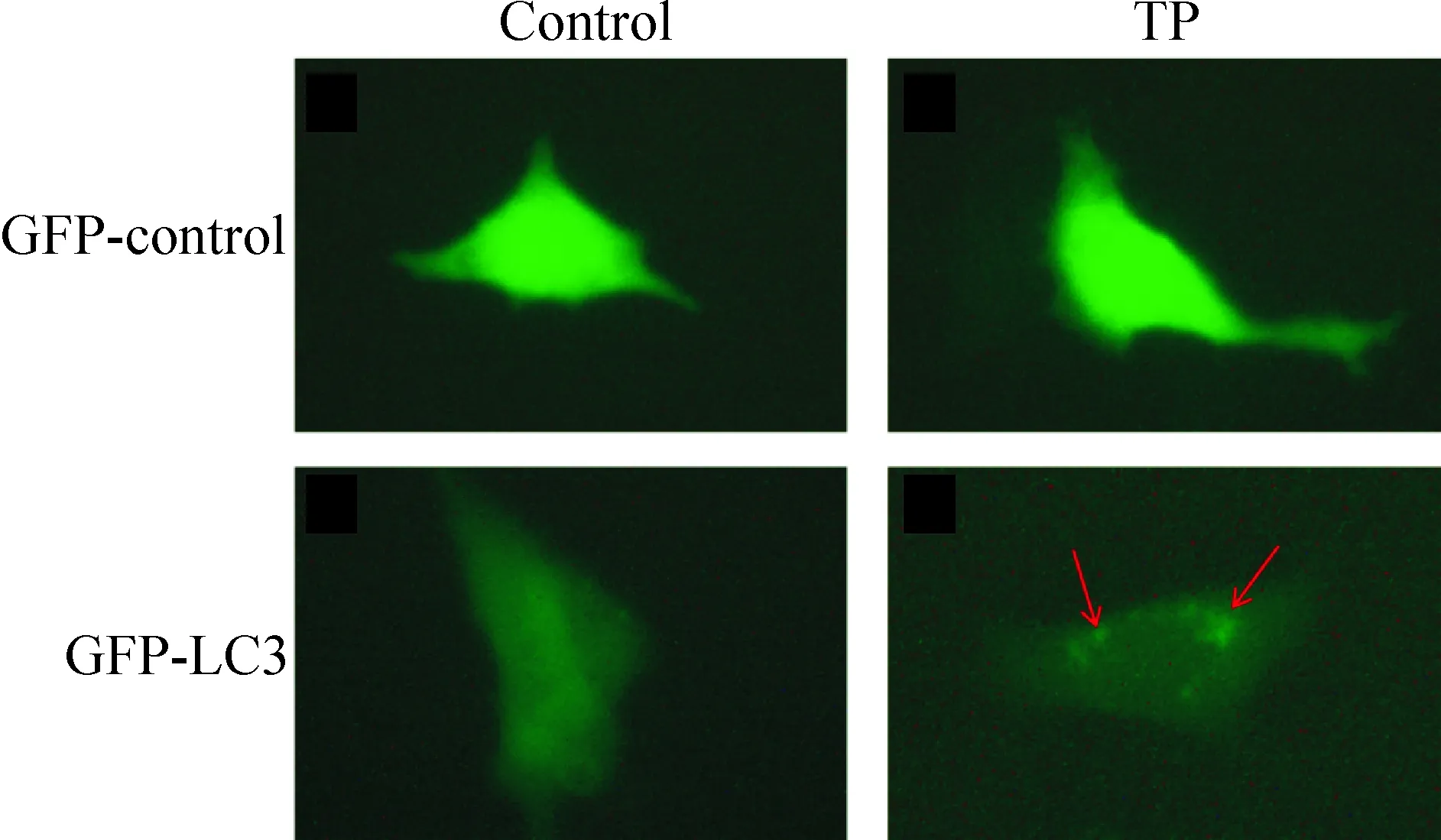
Figure 3.The change of autophagosome in A549 cells after treated with TP(×400).
图3 荧光显微镜观察转染GFP-LC3质粒肺癌A549细胞中自噬小体的形成
4 雷公藤甲素对肺癌A549细胞LC3蛋白表达的变化
Western blot法检测结果如图4所示,药物作用于肺癌A549细胞48 h后,与空白对照组相比,100 nmol/L TP组的LC3-Ⅱ蛋白表达水平显著升高(P<0.01);与TP组相比,TP+3-MA组的LC3-Ⅱ蛋白表达水平显著下降(P<0.01),说明3-MA减弱了TP诱导肺癌A549细胞的自噬水平。
5 雷公藤甲素对肺癌A549细胞ERK磷酸化的影响
Western blot法检测结果显示,药物作用肺癌A549细胞48 h后,与对照组相比,TP组p-ERK/ERK的蛋白水平显著升高(P<0.01),但低于自噬诱导剂Rapa组;与TP组相比,TP+3-MA组的p-ERK/ERK蛋白水平显著下降(P<0.01),见图5。
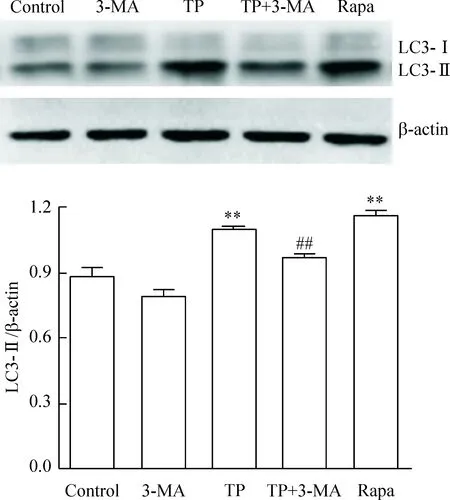
Figure 4.The protein levels of LC3-I and LC3-Ⅱin the lung cancer A549 cells treated with TP. Mean±SD.n=3.**P<0.01vscontrol;##P<0.01vsTP.
图4 雷公藤甲素对肺癌A549细胞LC3蛋白表达的变化
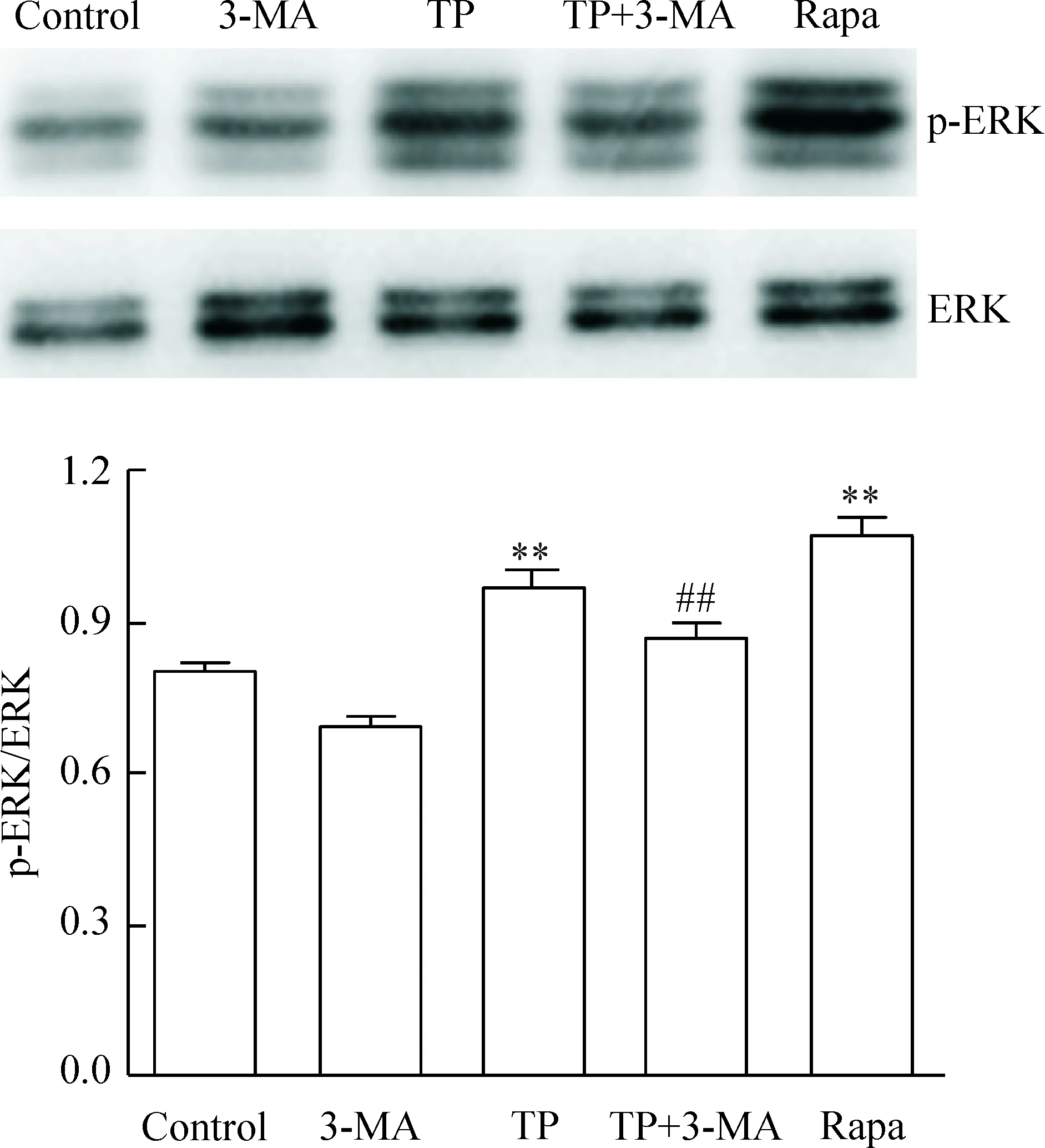
Figure 5.The protein levels of ERK and p-ERK in the lung cancer A549 cells treated with TP. Mean±SD.n=3.**P<0.01vscontrol;##P<0.01vsTP.
图5 雷公藤甲素对肺癌A549细胞p-ERK/ERK蛋白水平的影响
讨 论
肺癌是当今全球危害性最大的恶性肿瘤之一,其发病率和病死率在世界范围内呈持续上升趋势。我国的肺癌居恶性肿瘤死亡的第一位。化疗目前是肺癌最有效的治疗方法之一, 然而传统的肺癌化疗药物常因其各种严重的副作用使得其临床应用受到很大限制,因此寻找毒性更低、副作用更小的治疗肺癌化疗药物已成为医药界的一个重要课题。雷公藤甲素是从雷公藤中提取到的主要活性物质,系一种环氧二萜单体成分。近年来的研究发现,雷公藤甲素具有很好的抗排异、抗肿瘤及抗生育作用[4-5]。自噬作为Ⅱ型程序性死亡已经越来越受到人们的重视,在自噬发生的早期,自噬可作为一种保护机制,使肿瘤细胞避免受到低营养电离辐射和化疗等所致的损伤而持续生存;而当外部环境较差,肿瘤细胞过度自我吞噬时,就会引起自噬性死亡,从而抑制肿瘤的发生发展。研究还表明不同细胞自噬能力不同,但是在癌变之后其自噬能力有所减弱即在一些药物作用下自噬可以在肿瘤细胞中被激活,表明自噬在肿瘤的发生发展及治疗过程中有一定的作用。LC3是酵母自噬基因Apg8/Aut7p的哺乳动物同源物,目前认为细胞中LC3Ⅱ的含量和细胞内自噬泡的数量呈正相关,可以反映细胞的自噬现象和细胞内自噬泡的多少,是研究自噬现象的标志分子[6]。然而,在肿瘤中雷公藤甲素对自噬的研究又较少,如Mujumdar 等[7]研究认为雷公藤甲素能诱导胰腺癌细胞自噬,Krosch等[8]研究认为雷公藤甲素在神经母细胞瘤细胞中通过凋亡和自噬途径引起细胞死亡。本实验希望通过研究雷公藤甲素对人肺癌细胞自噬的影响及其可能的作用机制,为肺癌及其它肿瘤化疗提供一个新的选择。我们的实验结果显示,雷公藤甲素显著抑制肺癌细胞的生长,并呈一定的剂量-时间依赖性。雷公藤甲素作用肺癌A549细胞48 h后,细胞内酸性滤泡染成亮红色荧光明显增多,转染GFP-LC3质粒的细胞胞质中出现绿色点状聚集的自噬小体,LC3-Ⅱ蛋白表达水平也显著升高。表明雷公藤甲素能诱导肺癌A549细胞发生自噬性死亡,从而抑制细胞活力。
ERK是一类丝/苏氨酸蛋白激酶,是MAPK家族的一员,包括ERK1和ERK2。磷酸化激活的ERK1/2由胞质转位到核内,进而介导Elk-1、ATF、NF-κB、AP-1、c-Fos和c-Jun的转录活化,参与细胞的增殖与分化、细胞形态维持、细胞骨架的构建、细胞凋亡和细胞的癌变等多种生物学反应[9-10]。Yue等[11]研究发现抑制GRIM-19的表达可通过激活p-ERK诱导人宫颈癌细胞发生自噬。Huang 等[12]研究也发现在肝癌细胞中Apelin-13能通过激活ERK1/2诱导自噬。雷公藤甲素在肺癌细胞中通过激活p-ERK诱导自噬未见报道。本研究发现雷公藤甲素抑制A549的细胞活力并诱导其发生自噬的同时还能够明显增加p-ERK的蛋白水平。说明雷公藤甲素可能通过影响ERK蛋白磷酸化从而抑制细胞生长,促进自噬体的形成。
综上所述,本实验初步研究表明雷公藤甲素作为一种天然存在的化合物能够抑制肺癌A549细胞的活力并诱导其自噬,可为雷公藤甲素应用于肺癌的临床治疗提供实验依据。目前关于雷公藤甲素是如何通过ERK调节肺癌细胞自噬的研究文献较少,本研究推测MAPK信号通路可能参与雷公藤甲素诱导的自噬,具体的机制有待于进一步研究。
[1] Li J, Zhu W, Leng T, et al. Triptolide-induced cell cycle arrest and apoptosis in human renal cell carcinoma cells[J]. Oncol Rep, 2011, 25(4):979 -987.
[2] 张 纯,崔国惠,刘 芳,等. 雷公藤内酯醇抑制Raji细胞增殖和迁移的体外实验研究[J]. 中国病理生理杂志, 2007, 23(2):222-225.
[3] Gozuacik D, Kimchi A. Autophagy as a cell death and tumor suppressor mechanism[J]. Oncogene, 2004, 23(16):2891-2906.
[4] Meng HT, Zhu L, Ni WM, et al. Triptolide inhibits the proliferation of cells from lymphocytic leukemic cell lines in association with downregulation of NF-κB activity and miR-16-1*[J]. Acta Pharmacol Sin, 2011, 32(4): 503-511.
[5] Reno TA, Kim JY, Raz DJ. Triptolide inhibits lung can-cer cell migration, invasion, and metastasis[J]. Ann Thorac Surg, 2015, 100(5):1817-1825.
[6] Huang AC, Lien JC, Lin MW, et al. Tetrandrine induces cell death in SAS human oral cancer cells through caspase activation-dependent apoptosis and LC3-Ⅰand LC3-Ⅱactivation-dependent autophagy[J]. Int J Oncol, 2013, 43(2): 485-494.
[7] Mujumdar N, Mackenzie TN, Dudeja V, et al. Triptolide induces cell death in pancreatic cancer cells by apoptotic and autophagic pathways[J]. Gastroenterology, 2010, 139 (2):598-608.
[8] Krosch TC, Sangwan V, Banerjee S, et al. Triptolide-mediated cell death in neuroblastoma occurs by both apoptosis and autophagy pathways and results in inhibition of nuclear factor-kappa B activity[J]. Am J Surg, 2013, 205(4): 387-396.
[9] Sui X, Kong N, Ye L, et al. p38 and JNK MAPK pathways control the balance of apoptosis and autophagy in response to chemotherapeutic agents[J]. Cancer Lett, 2014, 344(2):174-179.
[10]倪晓辰,赵志红,马永良,等. 粉防己碱对膀胱癌T24细胞的凋亡诱导和自噬抑制作用[J]. 肿瘤, 2014, 34(12):1109-1114.
[11]Yue X, Zhao P, Wu K, et al. GRIM-19 inhibition induced autophagy through activation of ERK and HIF-1α not STAT3 in HeLa cells[J]. Tumour Biol, 2016 Jan 25. [Epub ahead of print].
[12]Huang Q, Liu X, Cao C, et al. Apelin-13 induces autophagy in hepatoma HepG2 cells through ERK1/2 signaling pathway-dependent upregulation of Beclin1[J]. Oncol Lett, 2016, 11(2):1051-1056.
(责任编辑: 陈妙玲, 罗 森)
Tripchlorolide activates p-ERK and induces autophagy in lung cancer A549 cells
WANG Wei1, WANG Kun2
(1DepartmentofPharmacy,2DepartmentofNeurosurgery,HangzhouXiashaHospital,Hangzhou310018,China.E-mail:simonkunwang@hotmail.com)
AIM: To investigate the effects of tripchlorolide (TP) on proliferation and autophagy of human lung cancer A549 cells, and explore its mechanism. METHODS: MTT assay was performed to analyze the effect of TP on the viability of human lung cancer A549 cells. The A549 cells were treated with TP, and their autophagy was observed under the fluorescence microscope through acridine orange staining. Green fluorescence spots were observed by fluorescence microscopy through GFP-LC3 plasmid transfection experiment. The levels of LC3 and p-ERK in the A549 cells after TP treatment were determined by Western blot. RESULTS: The viability of human lung cancer A549 cells was significantly inhibited by TP in a dose-time dependent manner (P<0.05). The number of the intracellular acidic follicles dyed with bright red fluorescence was significantly increased after TP treatment in A549 cells. The number of green dot-like congregate autophagosomes in cell cytoplasm was significantly increased after TP treatment in the A549 cells transfected with GFP-LC3 plasmid, while the normal treatment only induced a few cells with autophagosome formation. At the same time, we did not observe the dot-like congregate autophagosomes after TP treatment in the A549 cells transfected with GFP-control plasmid. Compared with control group, the expression of LC3-II protein was up-regulated in A549 cells after TP treatment (P<0.01). Furthermore, treatment with TP in A549 cells for 48 h also led to a significant upregulation of phosphorylated form of ERK (P<0.01). In contrast, no significant change in the levels of total ERK protein was observed. Compared with 100 nmol/L TP group, TP+3-MA group down-regulated the protein levels of LC3-II (P<0.01) and p-ERK (P<0.01) in the A549 cells. CONCLUSION: TP significantly inhibits the growth of A549 lung cancer cells and induces the autophagy, which may be correlated with upregulation of p-ERK protein.
Lung cancer; Tripchlorolide; Cell proliferation; Autophagy
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1551- 05
2016- 04- 05
2016- 05- 23
国家自然科学基金资助项目(No. 81402044); 浙江省自然科学基金资助项目(No. LY14H160017)
△ 通讯作者 Tel: 0571-86006166; E-mail: simonkunwang@hotmail.com
R730.23
A
10.3969/j.issn.1000- 4718.2016.09.003

