雷公藤多苷通过NOXs-ROS-NLRP3炎症小体信号通路抑制结肠炎症*
郑健豪, 钟继红, 曹海军, 朱 灵, 刘 军, 胡华军, 李善高△
(浙江中医药大学 1附属第一医院消化科, 2附属第二医院消化科, 3中国计量学院生命科学学院,浙江 杭州 310006)
雷公藤多苷通过NOXs-ROS-NLRP3炎症小体信号通路抑制结肠炎症*
郑健豪1, 钟继红2, 曹海军1, 朱 灵1, 刘 军3, 胡华军3, 李善高1△
(浙江中医药大学1附属第一医院消化科,2附属第二医院消化科,3中国计量学院生命科学学院,浙江 杭州 310006)
目的: 观察雷公藤多苷对右旋葡聚糖硫酸钠(dextran sulphate sodium,DSS)诱导的小鼠溃疡性结肠炎(ulcerative colitis,UC)的防治作用及对黏膜组织NADPH氧化酶(NADPH oxidases,NOXs)-活性氧簇(reactive oxygen species,ROS)-NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体信号通路表达的影响,探讨其治疗溃疡性结肠炎的作用及机制。方法: BALB/c小鼠随机分为5组:模型组;低、中及高剂量雷公藤多苷灌胃组;正常组。采用DSS诱发UC动物模型,雷公藤多苷灌胃21 d 后,取结肠组织,运用实时荧光定量PCR法检测结肠黏膜组织NLRP3、ASC及caspase-1 的mRNA表达,免疫组化法检测结肠黏膜组织caspase-1的表达,ELISA法检测结肠组织匀浆上清IL-1α、TNF-α及IL-13的含量,鲁米诺化学发光法检测结肠黏膜组织ROS的生成和经DPI(NOXs抑制剂)抑制后的NADPH消耗率来分析NOXs活性;体外分离结肠组织中性粒细胞,检测分离的中性粒细胞中ROS的生成、NOXs活性以及NLRP3、ASC、caspase-1的mRNA表达。结果: 雷公藤多苷灌胃各组小鼠结肠黏膜组织病理均存在不同程度异常,但组织病理学评分均低于模型组;雷公藤多苷灌胃各组结肠黏膜组织和分离的中性粒细胞中,除高剂量组结肠黏膜组织caspase-1的mRNA表达与正常组相比差异无统计学显著性外,其余各组ROS生成、NOXs活性及NLRP3、ASC、caspase-1的mRNA表达水平低于模型组(P<0.05),高于正常组(P<0.05);雷公藤多苷灌胃各组间两两比较发现,除中、高剂量组结肠黏膜组织及分离的中性粒细胞caspase-1的mRNA表达差异无统计学显著性外,其它指标相比均有统计学显著性(P<0.05);雷公藤多苷灌胃各组小鼠结肠组织匀浆上清中促炎因子(IL1α和TNF-α)含量低于模型组(P<0.05),高于正常组(P<0.05),抑炎因子(IL-13)含量各组间比较差异无统计学显著性。结论: 雷公藤多苷可能通过抑制NOXs-ROS-NLRP3炎症小体信号通路来降低IL-1α、TNF-α等促炎因子的表达从而对DSS诱导的UC小鼠起保护作用,中性粒细胞可能是参与其保护作用的主要炎性细胞。
雷公藤多苷; 右旋葡聚糖硫酸钠; 溃疡性结肠炎; 活性氧簇; NADPH氧化酶; NLRP3炎症小体
溃疡性结肠炎(ulcerative colitis,UC)的确切病因和发病机制尚不清楚,多数学者认为UC的发生与免疫反应异常有关[1]。雷公藤多苷(Tripterygiumglycosides,TG)是从卫矛科植物雷公藤根提取精制而成[2],具有很强的抗炎和免疫调节作用,本研究旨在探讨雷公藤多苷对右旋葡聚糖硫酸钠(dextran sulphate sodium,DSS)诱导小鼠UC的防治作用,并从NADPH氧化酶(NADPH oxidases,NOXs)、活性氧簇(reactive oxygen species,ROS)和NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体信号通路的角度探讨其作用机制。
材 料 和 方 法
1 动物和试剂
健康雄性BALB/c小鼠50只,8周龄,体重(20±2) g,由浙江中医药大学动物实验中心提供,动物生产许可证号为SCXK(沪)2013-0016。DSS购自Sigma,临用前配成5% 的溶液(5 g DSS溶于100 mL 蒸馏水)。雷公藤多苷片购于浙江得恩德制药有限公司,临用前按人-小鼠体表面积换算,分别溶于蒸馏水配制成低、中、高剂量的雷公藤多苷混悬液,即:9.02 mg·kg-1·d-1、27.02 mg·kg-1·d-1和81.08 mg·kg-1·d-1。检测IL-1α、TNF-α和IL-13的ELISA检测试剂盒均购于R&D。
2 方法
2.1 实验动物的分组及处理 参考文献[3-4]制作UC模型,小鼠随机分为5组,每组10只,即模型组,低、中及高剂量雷公藤多苷灌胃组和正常组。自第1周开始模型组和雷公藤多苷灌胃各组小鼠自由饮用5% DSS溶液,正常组小鼠自由饮用纯净水,同时,模型组小鼠每天用蒸馏水按0.02 mL/g进行灌胃,每天1次,而低、中及高剂量雷公藤多苷灌胃组每天分别用低、中、高剂量雷公藤多苷混悬液按0.02 mL/g进行灌胃,每天1次。造模开始后第8天各组随机处死1只小鼠,剖腹,观察结肠组织大体形态,然后取直乙交界处结肠组织病检(HE 染色),以明确是否造模成功。第2周开始,各组小鼠均自由饮用纯净水,其中模型组小鼠继续每天蒸馏水灌胃1次,低、中及高剂量雷公藤多苷灌胃组每天分别用低、中、高剂量雷公藤多苷混悬液灌胃,每天1次,至21 d后取直乙交界处结肠组织,分别进行如下处理:(1)PCR 样品保存液保存,用于实时荧光定量PCR、ROS和NOXs检测;(2)10%福尔马林固定,用于HE染色及免疫组化检测相关指标;(3)PBS 液保存,用于ELISA检测和分离中性粒细胞。
2.2 结肠组织形态学检测 取上述置10%福尔马林固定的结肠组织,石蜡包埋,3~4 μm厚连续切片,HE染色,光镜观察组织形态学变化。
2.3 小鼠结肠黏膜组织病理学损伤评分标准 (1) 黏膜损伤:无黏膜损伤为0分;接近基膜1/3的隐窝丢失为1分;接近基膜2/3的隐窝丢失为2分;隐窝全部消失,上皮细胞完整覆盖为3分;隐窝、上皮都消失为4分;(2)病变范围:无病变为0分;局灶性病变为1分;病变大约累及1/3黏膜为2分;病变大约累及2/3黏膜为3分;病变累及到全部黏膜组织为4分。组织病理学评分总分(histological score,HS)为黏膜损伤评分与病变范围评分的乘积[3]。
2.4 分离结肠组织中的中性粒细胞 采用组织中性粒细胞分离试剂盒(购于上海易佰聚生物)分离结肠组织中的中性粒细胞,操作步骤按说明书进行。
2.5 ROS测定 应用ROS检测试剂盒(南京建成生物工程研究所)检测小鼠结肠黏膜组织和分离的中性粒细胞中的ROS水平,操作步骤按说明书进行。
2.6 NOXs 活性测定 结肠黏膜组织和分离的中性粒细胞经胰酶(Gibco)消化后,4 ℃、2 500×g离心5 min,然后以PBS悬浮,接着加入250 μmol/L NADPH(北京博润莱特科技有限公司)孵育,5 min后测定340 nm波长的吸光度,通过吸光率的减少来测定NADPH的消耗量。为了分析NOXs特异活性,在测定之前30 min加入10 μmol/L DPI(NOXs抑制剂,Sigma),测定DPI抑制后的NADPH 的消耗率。为标准化,用等量的细胞加入SDS溶解,浓缩蛋白后用Lowry solution测定,计算NADPH消耗总量的吸收消光系数是6.22 L·mmol-1·cm-1,NOXs活性用pmol NADPH·min-1·mg-1表示。
2.7 实时荧光定量PCR检测结肠黏膜组织和分离的中性粒细胞中NLRP3、ASC及caspase-1的mRNA表达 用TRIzol裂解结肠黏膜组织及分离的中性粒细胞,氯仿抽提,异丙醇沉淀,75% 乙醇洗涤,DEPC水溶解,使用分光光度计测定总RNA含量和纯度。cDNA合成具体步骤按照TaKaRa试剂盒说明书进行。PCR扩增具体步骤参照TaKaRa试剂盒说明书进行,引物序列和反应条件见表1。
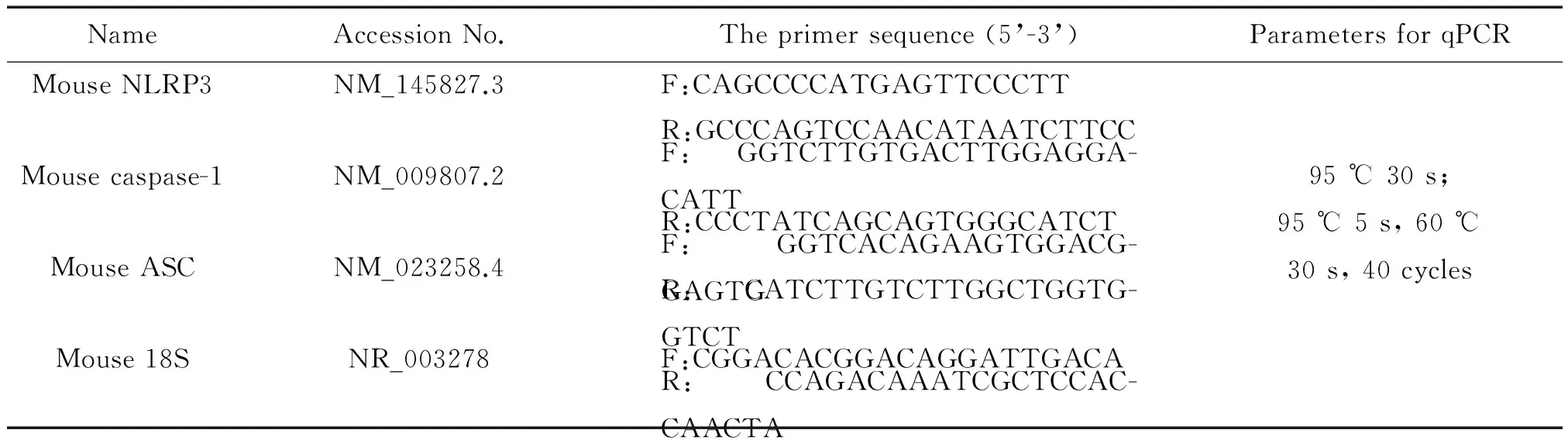
表1 RT-qPCR的有关参数
F:forward;R:reverse.
2.8 免疫组织化学法检测结肠黏膜组织中caspase-1的表达 采用二步法(EnVisionTM试剂盒),基本工作步骤为脱蜡、水化;预处理组织切片(据 I 抗具体说明而定),热修复;3% H2O2阻断内源性过氧化物酶,孵育10 min;滴加 I 抗孵育60 mim;滴加山羊抗兔IgG抗体孵育40 min;DAB显色液显色3 min,在显微镜下控制反应,纯净水冲洗终止反应;漂洗,复染,封片。在细胞浆和/或胞核内发现黄、棕色颗粒判定为阳性细胞。利用Image-Pro Plus 6.0测定吸光度(A)值。
2.9 组织匀浆上清中IL-1α、TNF-α及IL-13含量的测定 取结肠组织,切成(2~3) mm×1 mm×1 mm小块,放入组织匀浆器中,加入适量PBS,冰上研磨,研磨产物在4oC下12 000×g离心15 min,取上清液分装,-80oC保存,严格按照ELISA试剂盒说明书进行操作。
3 统计学处理
应用SPSS 17.0统计软件分析,数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 小鼠的一般状况
除正常组小鼠外,自造模开始后其余各组动物均出现少动,进食少,毛色失去光泽,精神倦怠,不同程度的腹泻,肉眼便血, 肛门血染,体重下降等症状,但雷公藤多苷灌胃各组小鼠较模型组上述症状较轻,各组均未出现死亡现象。
2 小鼠结肠组织病理学改变及评分
造模第8天,模型组及雷公藤多苷灌胃各组小鼠结肠黏膜可见不同程度的充血水肿及中性粒细胞浸润,表明造模成功。实验结束后,雷公藤多苷灌胃各组小鼠结肠黏膜组织病理学评分明显低于模型组(P<0.05);雷公藤多苷灌胃高剂量组的组织病理学评分与正常组相比差异无统计学显著性,但雷公藤多苷灌胃中、低剂量组小鼠结肠组织病理学评分显著高于正常组(P<0.05);雷公藤多苷灌胃各组间两两比较发现,除中、低剂量组间病理学评分差异无统计学显著性外,余均有统计学显著性(P<0.05),见图1、表2。
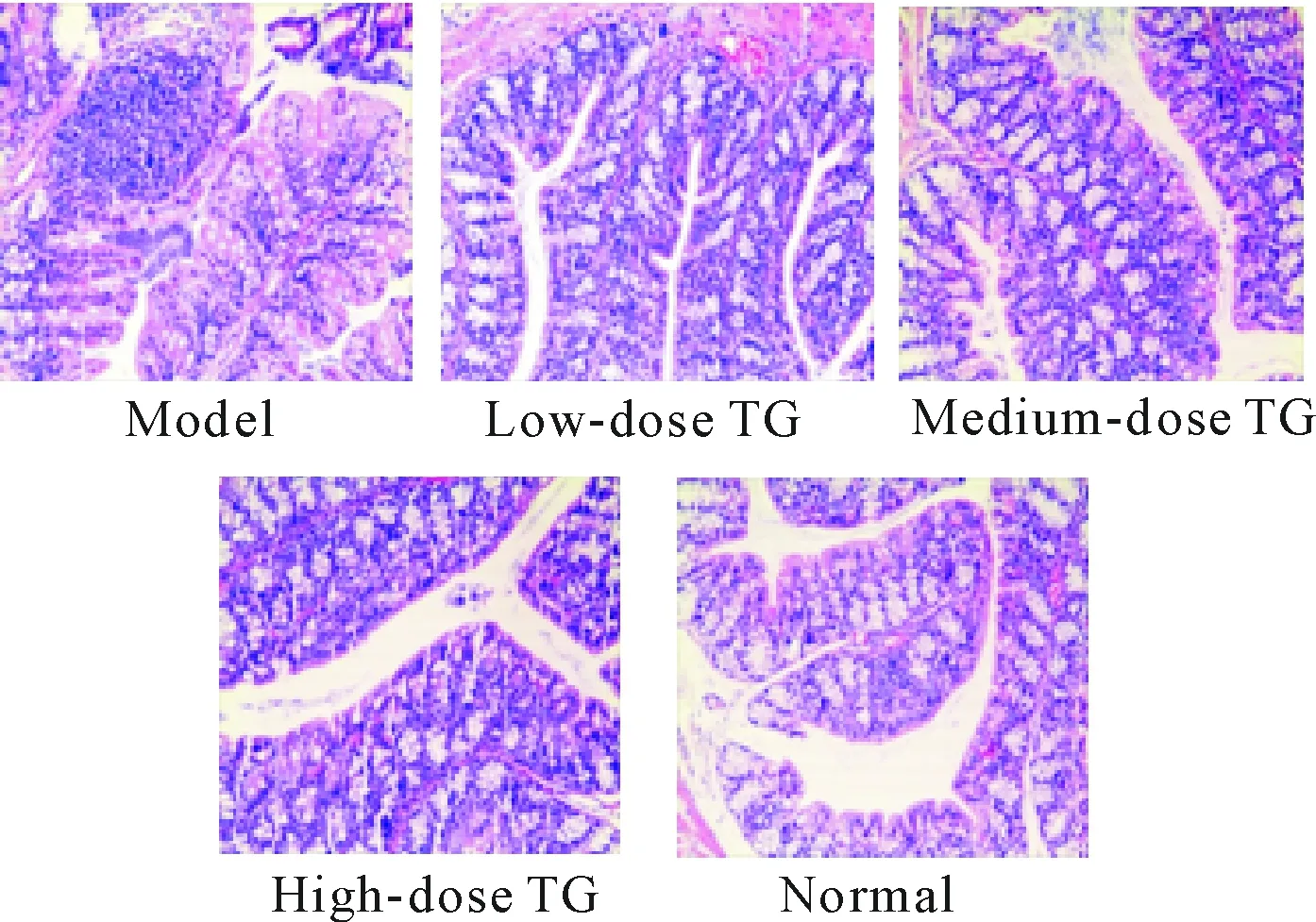
Figure 1.HE staining of mouse colon sections in different groups (×100).
图1 各组小鼠结肠组织HE染色
表2 各组小鼠结肠组织病理学评分和结肠组织中caspase-1的表达
Table 2.The histological score of mouse colon tissues and the expression of caspase-1 in different groups (Mean±SD.n=9)
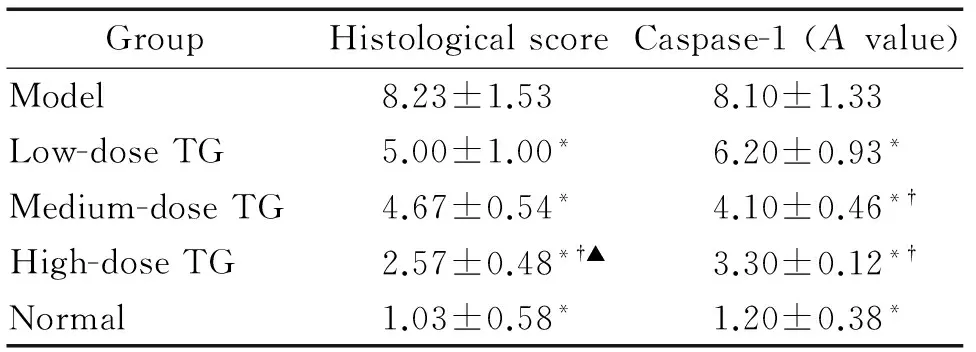
GroupHistologicalscoreCaspase-1(Avalue)Model8.23±1.538.10±1.33Low-doseTG5.00±1.00*6.20±0.93*Medium-doseTG4.67±0.54*4.10±0.46*†High-doseTG2.57±0.48*†▲3.30±0.12*†Normal1.03±0.58*1.20±0.38*
*P<0.05vsmodel;†P<0.05vslow dose TG;▲P<0.05vsmedium dose TG.
3 小鼠结肠黏膜组织及分离的中性粒细胞ROS生成水平和NOXs活性
雷公藤多苷灌胃各组小鼠结肠黏膜组织及分离的中性粒细胞中ROS生成水平和NOXs活性明显低于模型组,但高于正常组(P<0.05);雷公藤多苷灌胃各组间两两比较发现,以高剂量组最低,低剂量组最高,各组之间比较差异均有统计学显著性(P<0.05),见图2。
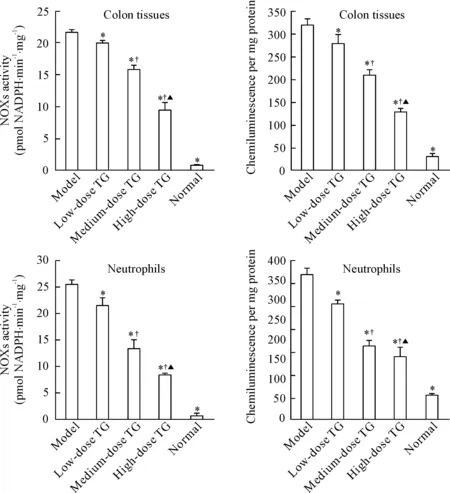
Figure 2.ROS generation and NOXs activity in the mouse colon tissues and neutrophils of different groups. Mean±SD.n=9.*P<0.05vsmodel;†P<0.05vslow-dose TG;▲P<0.05vsmedium-dose TG.
图2 各组小鼠结肠黏膜组织及分离的中性粒细胞ROS生成和NOXs活性的比较
4 小鼠结肠黏膜组织及分离的中性粒细胞中NLRP3、ASC和caspase-1的mRNA表达水平
雷公藤多苷灌胃各组结肠黏膜组织及分离的中性粒细胞中,除了结肠黏膜组织正常组与高剂量组caspase-1的mRNA差异无统计学显著性外,其余各组NLRP3、ASC及caspase-1的mRNA表达水平低于模型组(P<0.05);但高于正常组(P<0.05)。雷公藤多苷灌胃各组间两两比较发现,除结肠黏膜组织及分离的中性粒细胞中、高剂量组caspase-1的mRNA差异无统计学显著性外,其余各组之间NLRP3、ASC及caspase-1 的mRNA表达水平差异均有统计学显著性(P<0.05),见图3。
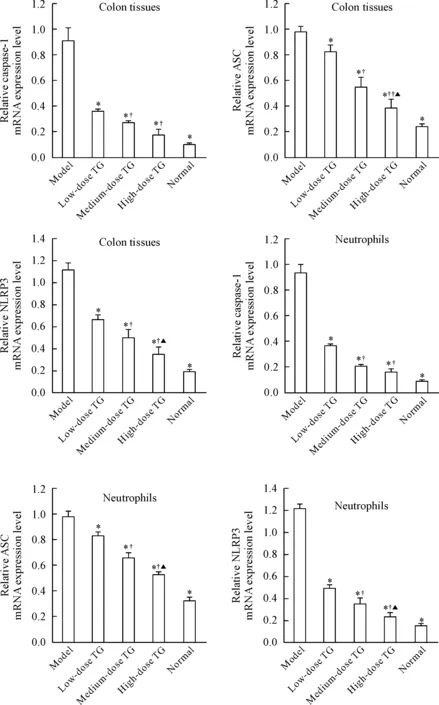
Figure 3.The mRNA expression levels of NLRP3, caspase-1 and ASC in the mouse colon tissues and neutrophils of different groups. Mean±SD.n=9.*P<0.05vsmodel;†P<0.05,††P<0.01vslow-dose TG;▲P<0.05vsmedium-dose TG.
图3 各组小鼠结肠组织及分离的中性粒细胞NLRP3、ASC 及caspase-1 mRNA表达水平的比较
5 小鼠结肠黏膜组织caspase-1免疫组化染色结果
模型组、雷公藤多苷灌胃各组caspase-1表达量均高于正常组,且结肠炎症黏膜区caspase-1表达远高于非炎症黏膜区,该表达现象在模型组尤为明显,差异有统计学显著性(P<0.05);与模型组相比,雷公藤多苷灌胃各组结肠黏膜组织caspase-1表达水平明显下降,差异有统计学显著性(P<0.05),雷公藤多苷灌胃各组间两两比较发现,除了中、高剂量组间caspase-1表达水平差异无统计学显著性外,其余均有统计学显著性(P<0.05),见图4、表2。
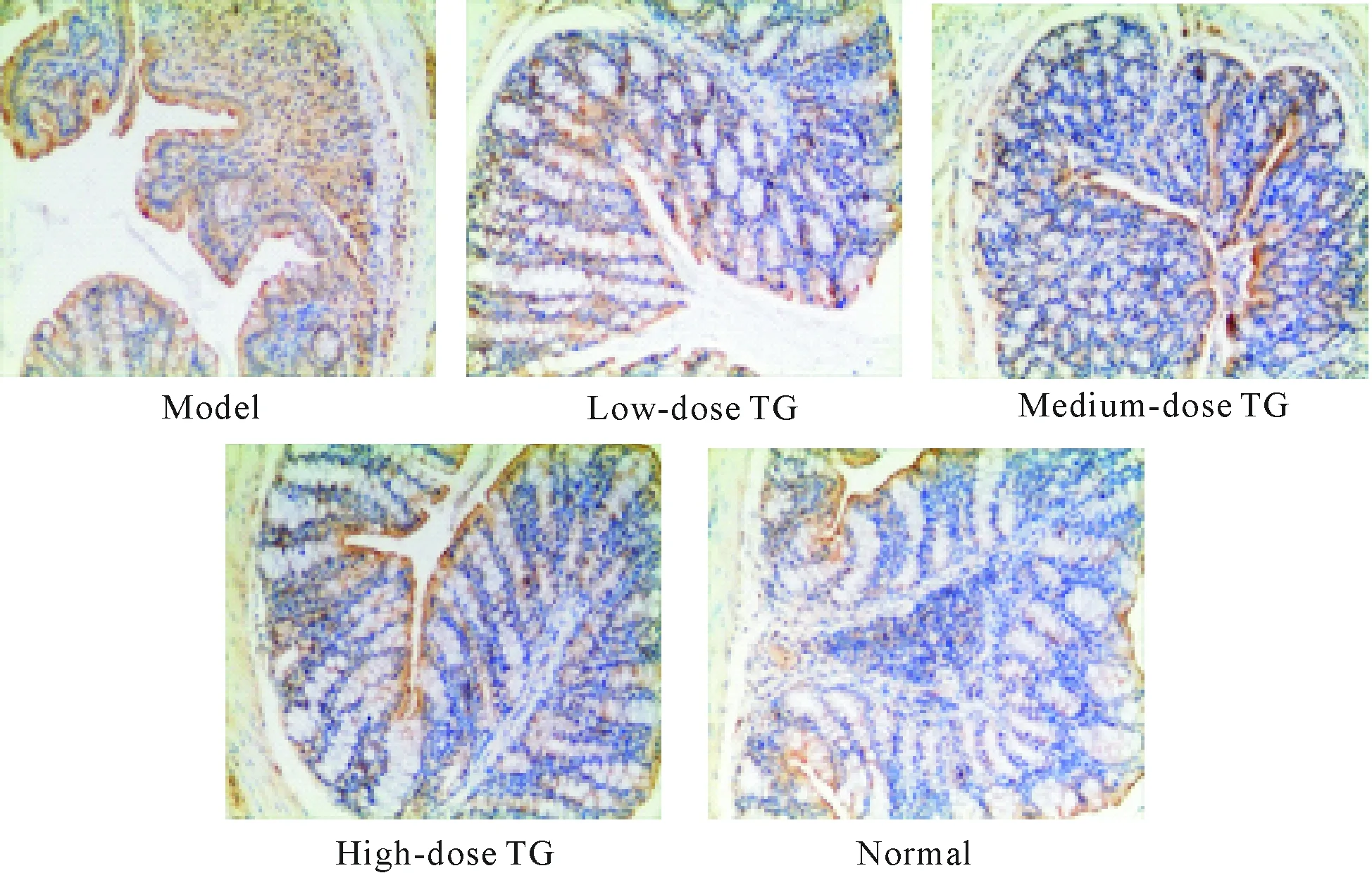
Figure 4.Detection of caspase-1 expression in the mouse colon sections in different groups (×200).
图4 各组小鼠结肠组织caspase-1的检测
6 小鼠结肠黏膜组织匀浆上清中IL-1α、TNF-α及IL-13含量
雷公藤多苷灌胃各组小鼠结肠黏膜组织匀浆上清中IL-1α和TNF-α的含量明显低于模型组(P<0.05),但高于正常组(P<0.05);雷公藤多苷灌胃各组间两两比较发现,除了高、中剂量组间IL-1α含量差异无统计学显著性外,其余均有统计学显著性(P<0.05);各组间IL-13含量差异均无统计学显著性,见表3。
表3 各组小鼠结肠组织匀浆上清IL-1α、TNF-α及IL-13含量
Table 3.The IL-1α, TNF-α and IL-13 levels in the supernatant of colon tissue homogenate in different groups (ng/L. Mean±SD.n=9)
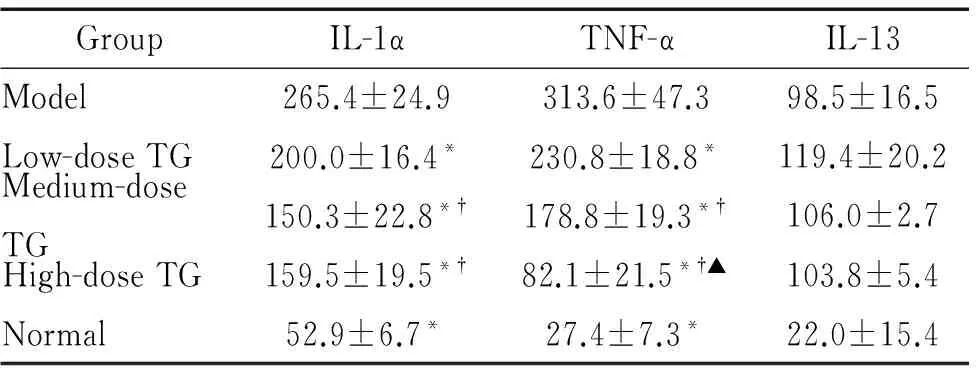
GroupIL-1αTNF-αIL-13Model265.4±24.9313.6±47.398.5±16.5Low-doseTG200.0±16.4*230.8±18.8*119.4±20.2Medium-doseTG150.3±22.8*†178.8±19.3*†106.0±2.7High-doseTG159.5±19.5*†82.1±21.5*†▲103.8±5.4Normal52.9±6.7*27.4±7.3*22.0±15.4
*P<0.05vsmodel;†P<0.05vslow-dose TG;▲P<0.05vsmedium-dose TG.
讨 论
UC发病机制仍不明,现认为UC是免疫、遗传、环境及肠道菌群等多因素共同作用的结果,其中免疫功能紊乱被认为是重要致病因素之一[5]。目前治疗炎症性肠病3大类药物(氨基水杨酸类药物、皮质类固醇、免疫抑制剂)虽然有一定效果,但均存在诸多副作用,不宜长期服用。因此,寻找一种高效,且毒副作用少、能长期用于UC患者维持缓解治疗的药物已迫在眉睫。
雷公藤多苷是从中药雷公藤中提取出来的有效成分,具有很强抗炎,免疫调节作用,能够抑制多种细胞因子表达,如IL-1、IL-12、TNF-α等[6]。有研究报道雷公藤多苷能够有效抑制小鼠结肠急性炎症反应[7],其具体作用机制仍不清楚。
Bauer等[8]研究发现,NLRP3-/-小鼠对DSS诱导的结肠炎耐受,其机制可能与结肠组织中促炎细胞因子的产生减少有关,NLRP3炎症性小体在炎症疾病中有着重要作用。NLRP3炎症性小体的激活机制目前认为与钾离子外流、溶酶体破坏和ROS生成有关,其中ROS生成是最主要的激活机制[9]。近年来研究发现氧化应激致机体免疫功能紊乱被认为可能在UC发病机制中起重要作用,而ROS是氧化应激的分子基础[10]。在胃肠道紊乱患者肠道定居的中性粒细胞、嗜酸细胞及巨噬细胞中NOXs能促进ROS的生成[11]。中性粒细胞是参与组织炎症损害的主要细胞之一[12],其在UC中的主要机制为迁移以及聚集在炎症部位[13-14],并释放出炎症因子以及大量ROS[15-16],故推测在UC炎症部位,NOXs能够促进ROS生成,而中性粒细胞是其中参与的主要炎性细胞。综上所述,UC发病机制可能通过NOXs活化产生大量ROS,激活NLRP3炎症性小体释放促炎因子,而雷公藤多苷抑制肠道炎症反应是否是通过抑制NOXs-ROS-NLRP3炎症性小体信号通路发挥作用,目前国内外未见文献报道。
本实验通过小鼠自由饮用5% DSS溶液成功复制了与人类UC类似的小鼠UC动物模型,运用雷公藤多苷干预,通过检测小鼠结肠黏膜组织ROS生成水平和NOXs活性、NLRP3炎症性小体各组成部分(NLRP3、caspase-1和ASC)在小鼠结肠黏膜组织表达水平,及受NLRP3炎症性小体调节下游蛋白(促炎因子如IL-1α、TNF-α和抑炎因子如IL-13)表达,探讨雷公藤多苷对DSS诱导小鼠UC的保护作用及可能作用机制。发现雷公藤多苷灌胃各组ROS生成水平和NOXs活性,NLRP3、ASC及caspase-1的mRNA表达水平,IL-1α及TNF-α含量虽高于正常组,但明显低于模型组,其组织病理学评分明显好于模型组,以上作用以高剂量组最明显,各组抑炎因子(IL-13)表达水平无明显变化。表明雷公藤多苷对DSS诱发UC起防治作用可能是经雷公藤多苷干预后致结肠黏膜组织ROS生成水平和NOXs的活性及NLRP3炎症性小体各组成部分表达下调,降低促炎因子(IL-1α和TNF-α)表达来实现的,与调控抑炎因子的表达无关。为明确中性粒细胞在雷公藤多苷对DSS诱发UC发生中的作用,我们还通过体外分离结肠组织中的中性粒细胞,并检测了以上指标,结果与体内结果一致,说明中性粒细胞是参与其保护作用的主要炎性细胞。
综上所述,据本实验研究结果推测雷公藤多苷对DSS诱导UC具有防治作用可能是雷公藤多苷通过抑制肠道NOXs活性及ROS生成,从而抑制NLRP3炎症性小体的激活,最后抑制促炎因子的表达,即抑制NOXs-ROS-NLRP3炎症性小体信号传导通路发挥作用。后续将在本实验的基础上应用ROS与NOXs的抑制剂及激动剂进一步研究雷公藤多苷对NOXs-ROS-NLRP3炎症性小体信号通路的具体作用机制,挖掘信号转导通路中的关键分子及防治UC作用的最适剂量,为临床运用雷公藤多苷治疗UC提供实验依据。
[1] Neuman MG. Immune dysfunction in inflammatory bowel disease[J]. Transl Res, 2007, 149 (4):173-186.
[2] 黄 真,毛庆秋. 雷公藤多苷的临床应用、不良反应及预防[J]. 药品评价, 2005, 2(2):125-127.
[3] 李旺林,曹 杰,肖焕擎,等. 大肠埃希氏菌在葡聚糖硫酸钠诱导的结肠炎恢复中的作用[J]. 中国病理生理杂志, 2012, 28(1):163-167.
[4] 祝 斌,张寒仙,曾今诚,等.美沙拉嗪对DSS诱导小鼠溃疡性结肠炎模型Th1、Th17及Treg细胞亚群的影响[J]. 中国病理生理杂志, 2014, 30(12):2219-2225.
[5] 赵 曼,高 峰. 溃疡性结肠炎发病机制研究进展[J]. 现代生物医学进展, 2010, 16(10):3160-3165.
[6] 周 泠,刘卓志. 雷公藤多甙栓对溃疡性结肠炎大鼠TNF-α和IL-8 的影响[J].遵义医学院报, 2006, 29 (1):31-33.
[7] 肖南平,欧阳钦. 雷公藤多苷对结肠炎小鼠结肠组织IL-23、IL-17和IL-12表达的影响[J]. 第二军医大学学报, 2008, 29(9):1069-1073.
[8] Bauer C, Duewell P, Mayer C. Colitis induced in mice with dextran sulfate sodium (DSS) is mediated by the NLRP3 inflammasome[J]. Gut, 2010, 59(9):1192-1199.
[9] Tschopp J, Schroder K. NLRP3 inflammasome activation: the convergence of multiple signalling pathways on ROS production?[J]. Nat Rev Immunol, 2010, 10(3):210-215.
[10]Zhu H, Li YR. Oxidative stress and redox signaling me-chanisms of inflammatory bowel disease: updated experimental and clinical evidence[J]. Exp Biol Med, 2012, 237(5):474-480.
[11]Pongnimitprasert N,EI-Benna J,Foglietti MJ,et al.Potential role of the “NADPH oxidases”(NOX/DUOX) family in cystic fibrosis[J]. Ann Biol Clin (Paris), 2008, 66(6):621-629.
[12]El-Benna J, Dang PM, Gougerot-Pocidalo MA. Priming of the neutrophil NADPH oxidase activation: role of p47phox phosphorylation and NOX2 mobilization to the plasma membrane[J]. Semin Immunopathol, 2008, 30(3): 279-289.
[13]Podolsky DK. Inflammatory bowel disease[J]. N Engl J Med, 2002, 347(6): 417-429.
[14]Kucharzik T, Walsh SV, Chen J, et al. Neutrophil transmigration in inflammatory bowel disease is associated with differential expression of epithelial intercellular junction proteins[J]. Am J Pathol, 2001, 159(6):2001-2009.
[15]Naito Y, Takagi T, Yoshikawa T. Molecular fingerprints of neutrophil dependent oxidative stress in inflammatory bowel disease[J]. J Gastroenterol, 2007, 42(10): 787-798.
[16]Naito Y, Takagi T, Yoshikawa T. Neutrophil-dependent oxidative stress in ulcerative colitis[J]. J Clin Biochem Nutr, 2007, 41(1):18-26.
(责任编辑: 林白霜, 罗 森)
Tripterygium glycosides suppress colitis via NOXs-ROS-NLRP3 inflammatory signaling pathways
ZHENG Jian-hao1, ZHONG Ji-hong2, CAO Hai-jun1, ZHU Ling1, LIU Jun3,HU Hua-jun3, LI Shan-gao1
(1DepartmentofGastroenterology,TheFirstAffiliatedHospitalofZhejiangChineseMedicalUniversity,2DepartmentofGastroenterology,TheSecondAffiliatedHospitalofZhejiangChineseMedicalUniversity,3AcademyofLifeSciencesofJiliangUniversityofChina,Hangzhou310006,China.E-mail:galisga@aliyun.com)
AIM: To observe the effect ofTripterygiumglycosides on NOXs-ROS-NLRP3 inflammatory signaling pathways in the colon tissue in dextran sulphate sodium (DSS)-induced ulcerative colitis (UC) mice, and to investigate the underlying mechanisms. METHODS: BALB/c mice were used and the mouse model of UC was established by DSS induction. The mice were randomly divided into 5 groups (model group, low-, medium- and high-doseTripterygiumglycosides groups, and normal group). The colon tissues were collected 21 d afterTripterygiumglycosides gavage. The mRNA expression of NLRP3, ASC and caspase-1 in the colon tissues was detected by real-time PCR. The caspase-1 expression in the colorectal mucosa was observed by immunohistochemical method. ELISA was used to detect the protein le-vels of IL-1α, TNF-α and IL-13. The production of reactive oxygen species (ROS) was measured by chemiluminescence technique, and the consumption rate of NADPH, which was inhibited by DPI, was analyzed to determine the activity of NADPH oxidases (NOXs). The neutrophils were isolated, and the ROS production, NOXs activity, and the mRNA expression of NLRP3, ASC and caspase-1 were also detected. RESULTS: The colon tissues were abnormal with different degrees inTripterygiumglycosides groups, and histopathological scores were lower than that in model group. InTripterygiumglycosides groups, in addition to the mRNA expression levels of caspase-1 in the colon tissues between normal group and high-dose group, ROS production, NOXs activity and the mRNA expression levels of NLRP3, ASC and caspase-1 in the colon tissues and colon-isolated neutrophils were lower than those in model group (P<0.05), and higher than those in normal group (P<0.05). The results of pairwise comparison for the efficacy ofTripterygiumglycosides administration showed that the above indexes were statistically significant except the mRNA expression levels of caspase-1 between middle-dose group and high-dose group.Tripterygiumglycosides administration significantly decreased the expression levels of proinflammatory cytokines IL-1α and TNF-α in the homogenates of colon tissues in the model mice (P<0.05). No difference of IL-13 expression among the groups was observed. CONCLUSION:Tripterygiumglycosides inhibits NOXs-ROS-NLRP3 inflammatory signaling pathways to reduce the expression of IL-1α, TNF-α and other proinflammatory cytokines, and attenuates DSS-induced ulcerative colitis in mice, by which the neutrophils might be involved in the process.
Tripterygiumglycosides; Dextran sulphate sodium; Ulcerative colitis; Reactive oxygen species; NADPH oxidases; NLRP3 inflammasome
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1653- 07
2016- 02- 24
2016- 07- 18
国家自然科学青年基金资助项目(No. 81403335)
△通讯作者 Tel: 0571-86919331; E-mail: galisga@aliyun.com
R363.2
A
10.3969/j.issn.1000- 4718.2016.09.020

