血管新生的分子机制与相关疾病*
张梦泽, 李国珅, 赵欣童, 铁 璐
(北京大学 1基础医学院药理学系, 2第三医院, 北京 100191; 3北京积水潭医院, 北京 100035)
血管新生的分子机制与相关疾病*
张梦泽1, 2, 李国珅1, 3, 赵欣童1, 2, 铁 璐1△
(北京大学1基础医学院药理学系,2第三医院, 北京 100191;3北京积水潭医院, 北京 100035)
血管新生指从已存在的血管上生长出新的毛细血管的过程[1]。该过程十分复杂,依赖血管内皮细胞、成纤维细胞、巨噬细胞和细胞外基质的相互作用,并受促血管新生分子和抗血管新生分子协同调控。生理条件下,促血管新生分子和抗血管新生分子保持动态平衡;一旦平衡被打破,机体就会出现多种疾病,如肿瘤、多种眼科疾病、帕金森病(Parkinson’s disease,PD)和阿尔茨海默症(Alzheimer’s di-sease,AD)等[2]。因此,深入研究血管新生的机制有助于为多种疾病提供新的治疗方案。
1 血管新生的过程
血管新生主要由缺氧和炎症诱导,由多种因子、多条信号通路进行精确的调节,各环节紧密相连且有序发生。血管新生涉及到以下几个过程[2-4]:(1)细胞连接破坏——原有血管损伤后,在血管生成素2(angiopoietin-2,ANG-2)刺激和基质金属蛋白酶(matrix metalloproteinases, MMPs)的作用下,血管上的周细胞脱离基底,随后在一氧化氮(nitric oxide,NO)的作用下,内皮细胞间细胞连接松开,而细胞外基质可提供临时支架;(2)内皮细胞出芽——多种因子引导内皮细胞迁移,柄细胞(与顶细胞相邻的内皮细胞称为柄细胞)不断分裂,进而实现内皮出芽,在内皮出芽的过程中,管腔雏形逐渐形成;(3)血管成熟——血管新生晚期,管腔雏形已形成,周细胞聚集并覆盖内皮细胞,在蛋白酶抑制因子的作用下,内皮细胞和周细胞共同分泌细胞外基质,最终可累积形成完整的细胞外基质,同时,细胞间连接也重新建立;(4)血管退化——若新建立的血管缺乏血液灌注,则血管逐渐退化。
2 血管新生的分子机制
现有研究发现可诱导血管新生的物质包括血管内皮生长因子(vascular endothelial growth factor,VEGF)家族、血小板源性生长因子(platelet-derived growth factor,PDGF)家族、转化生长因子(transforming growth factor,TGF)家族、纤维母细胞生长因子(fibroblast growth factor,FGF)家族、血管生成素(angiopoietin,ANG)家族、Notch家族、Wnt家族、整合素和蛋白酶等(表1)。不同生长因子家族通过不同的通路作用于血管细胞,相互影响、协同作用,共同促进血管新生。
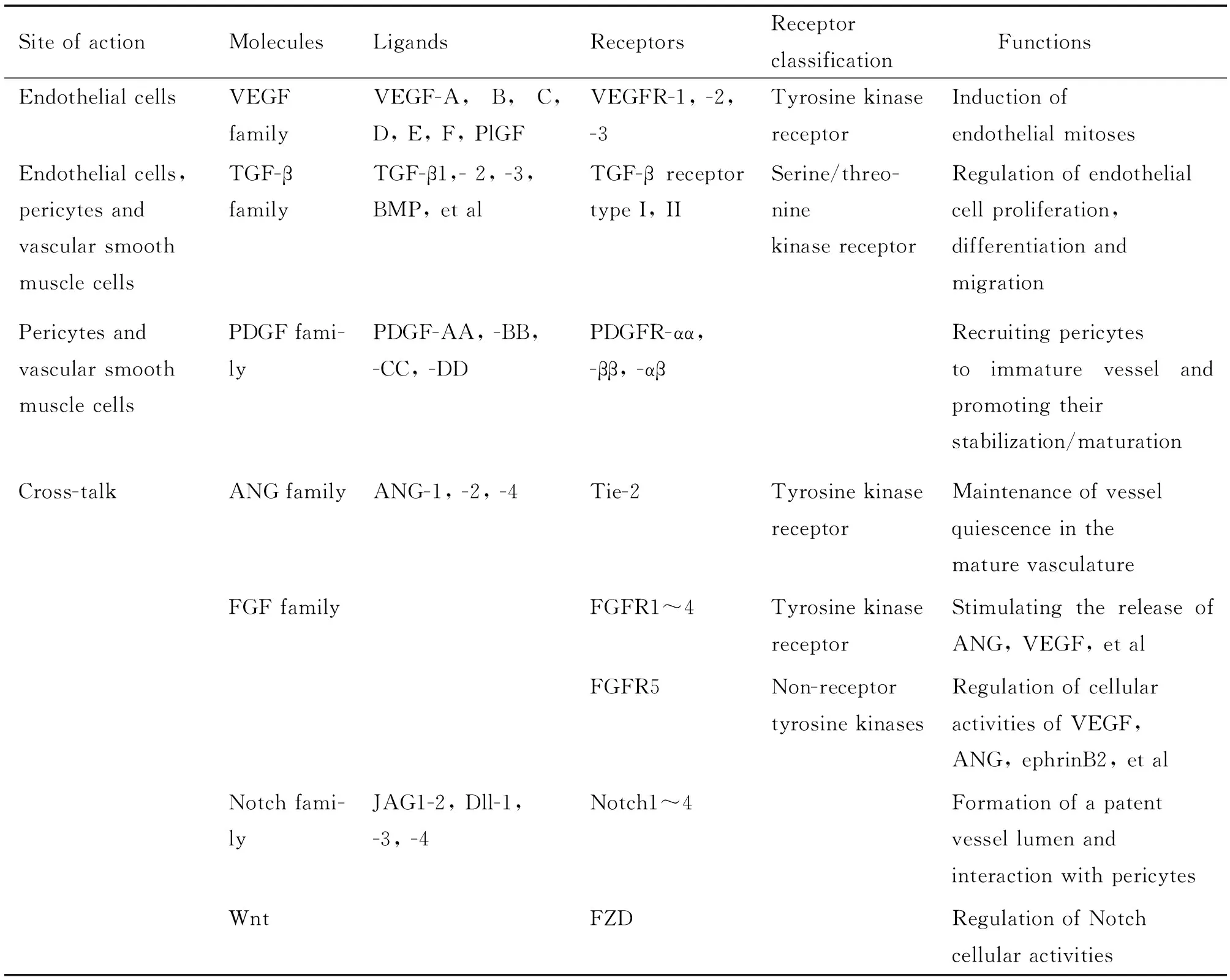
表1 调节血管新生的分子
JAG: Jagged; Dll: delta-like ligand; FZD: frizzled.
2.1 主要作用于血管内皮细胞的血管新生相关物质 VEGF家族及其受体是血管新生过程中的关键分子,并可作为许多分子的下游通路促进血管新生。VEGF家族主要有7个成员,分别为VEGF-A、B、C、D、E、F和胎盘生长因子(placental growth factor,PlGF)。其受体为血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR),是一种酪氨酸激酶受体。VEGFR有3种亚型:VEGFR-1、2、3,其中VEGF与VEGFR-2结合后诱导内皮细胞有丝分裂的能力最强。在成人血管中,VEGFR-2表达量较低;而当机体处于病理条件下如肿瘤、慢性炎症和创伤修复时,VEGFR-2的表达显著上升,促进血管新生。在肿瘤的血管新生中,VEGF起着促进作用,而肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)可以对其起到抑制作用。目前发现TRAIL可增加caspase-8的活性,caspase-8通过剪切黏着斑激酶而直接抑制VEGF的活性,从而减少血管新生[5]。另外,2型金属硫蛋白(metallothionein 2,MT2)也参与了VEGF的调节。Schuermann等[6]发现MT2具有重要的功能,其可通过调节VEGF的mRNA水平进而促进内皮细胞的迁移、增殖,影响血管新生;而MT2的功能不能被同家族的其它分子所代偿。此外,近年还发现了稳定VEGFR-2的关键调节蛋白phosducin-like 3 (PDCL3),它具有分子伴侣的活性。缺氧可促进PDCL3表达,继而通过增加VEGFR-2的表达而调节血管新生。因此,PDCL3也可能成为药物的新靶点[7]。
TGF家族成员数目众多,主要包括TGF-β和骨形态发生蛋白(bone morphogenetic proteins,BMP)。其中,TGF-β受体是丝氨酸/苏氨酸激酶受体,分为I型和II型,其中I型受体又被称为激活素受体样激酶(activin receptor-like kinase,ALK)。TGF-β家族成员对血管新生具有促进和抑制2种作用,微环境、配体、受体、调节因子的种类和浓度及各信号之间的相互作用对其具体的作用方式进行调控。
2.2 主要作用于壁细胞的血管新生相关物质 新生的毛细血管基底膜并不完整,内皮间隙较大,壁细胞(周细胞和血管平滑肌细胞)覆盖后可稳定新生血管。部分新生的毛细血管在这样不断的改建后可增厚发展为小动脉、小静脉。PDGF家族、TGF家族和ANG家族都在壁细胞促进新生血管成熟的过程中发挥重要作用。PDGF家族有4种单体:PDGF-A、PDGF-B、PDGF-C和PDGF-D,各单体通过二硫键形成同源二聚体,其中PDGF-BB作用最强。PDGF-BB可以趋化血小板源性生长因子受体(platelet-derived growth factor receptor β,PDGFR-β)阳性的周细胞。但PDGF功能过强或过弱均不利于血管新生[3]。TGF-β受体表达于血管平滑肌细胞,TGF-β与受体结合后可激活多种平滑肌细胞分化基因的表达。TGF-β还可调节血管平滑肌细胞的增殖和迁移。BMP也可以影响血管平滑肌细胞的分化和功能,但其作用效果依赖于微环境。ANG家族主要有ANG-1、ANG-2、ANG-4 3个成员,其受体主要是酪氨酸激酶受体Tie-2。ANG-Tie系统可调控血管的完整性,并且参与维持血管的静息状态[8]。ANG-1与Tie-2受体结合后可调节连接分子,加强内皮细胞与壁细胞间的联系。此外,ANG-1还可以促进壁细胞附着和基底膜沉积,稳定新生血管。ANG-2的作用受到微环境的影响,微环境中有VEGF时,ANG-2促进内皮细胞迁移和增殖,从而促进血管新生;微环境中缺乏VEGF时,ANG-2竞争性拮抗ANG-1的作用[8]。
2.3 主要通过信号交联作用发挥促血管新生作用的物质 FGF家族、Notch家族、Wnt家族、整合素、蛋白酶等主要与其它信号交联发挥调节血管新生的作用。其中,FGF家族主要与其它生长因子交联而间接促进血管新生。Notch家族则可以与VEGF、ANG、ephrinB2和Wnt等信号发生交联[9]。整合素可与基质蛋白结合从而双向传递信号,在血管新生中可调控血管内皮细胞和平滑肌细胞的动态平衡。除上述较为熟知的分子通路外,近年来又有了一些新的研究,如含I型血小板结合蛋白基序的解聚蛋白样金属蛋白酶(disintegrin and metalloproteinase with thrombospondin motifs,ADAMTS)、MDM2和RhoA等。
ADAMTS是一类分泌型金属蛋白酶,共有19类亚型,其中又以ADAMTS3的功能最受关注。ADAMTS3特异性表达于胚胎及成人的软骨中,可剪切II型胶原的N端前肽。Janssen等[10]构建ADAMTS3基因敲除小鼠,发现ADAMTS3敲除小鼠的胚胎血管功能紊乱,胚胎时期即死亡。有关ADAMTS3的作用机制目前还未探讨清楚,研究推测ADAMTS3可能由VEGF-C活化,通过促进蛋白质的剪切而激活多种生长因子,和胚胎期的血管新生有关[11]。
MDM2具有多种生物功能,和血管新生密切相关。缺氧可以促使MDM2从细胞核转移至细胞质,MDM2的羧基端和VEGF mRNA的一段非编码区紧密结合后,能增强胞质中VEGF mRNA的稳定性,进而促进VEGF基因的翻译[12]。此外,MDM2也可通过P53来调节血管新生。MDM2是一类P53的负性调控因子,它可和P53结合,通过蛋白酶体降解P53,解除P53对VEGF-A的转录抑制,促进血管新生[13]。另外,MDM2上调VEGF的机制可能也和STAT3、NF-κB通路相关[14]。
RhoA对血管新生有着重要意义,它可通过促进伪足的伸展和应力纤维的产生而调整细胞骨架的形态[15]。近年研究发现,RhoA和VEGF通路及PDGF通路之间有着密切的联系。RhoA的激活可增加VEGFR-2酪氨酸磷酸化,从而活化VEGFR-2,同时增加VEGF的分泌;而VEGFR-2的激活又可激活蛋白激酶C和Ras,增加RhoA的活性[16],两者共同作用形成正反馈通路促进血管新生。此外,缺氧条件下,P53的下降会伴有RhoA升高,二者可以通过VEGF通路共同促进血管新生。RhoA、VEGF也与血管相关的迁移细胞蛋白(angio-associated migratory cell protein,AAMP)密切相关。RhoA可增强AAMP的作用,VEGF可上调细胞膜上AAMP的表达,AAMP在两者的共同作用下促进内皮细胞的迁移和细胞骨架重构[17]。同时,高表达RhoA的细胞中多伴有高表达的PDGF-B,提示RhoA或可促进PDGF-B的表达从而在新生的血管周围招募更多的周细胞[18]。
综上所述,血管新生是一个复杂的过程,除上述分子外,还涉及到microRNA、连接分子、趋化因子等。
3 血管新生与疾病
在成年个体中,大部分的血管处于静息状态,但内皮细胞仍保有分裂潜能。当机体受到某些刺激时,血管新生会被激活。刺激过度时会导致血管新生相关因子的失衡,与恶性肿瘤、部分眼科疾病和炎症性疾病的进程密切相关[2]。血管新生激活不足时,则可能出现缺血性心肌病、糖尿病伤口愈合不良等疾病[2, 19]。
3.1 血管新生过度的相关疾病 缺氧是肿瘤组织血管新生的主要诱因,缺氧可促进缺氧诱导因子(hypoxia-inducible factor,HIF)的转录激活,从而上调各种促血管新生因子的表达,促进血管新生。与正常的新生血管相比,肿瘤组织中的新生血管过度迂曲、脆性增加、通透性增高且缺乏周细胞。目前研究显示,多种分子均可促进肿瘤组织中的血管新生,如肿瘤细胞及肿瘤基质细胞可通过自分泌和旁分泌产生大量的VEGF-A;肿瘤微环境中的调节性T细胞可以分泌细胞因子TGF-β、IL-10和IL-35促进血管新生[20];PlGF也能通过自分泌或旁分泌的方式促进表达VEGFR-1的肿瘤细胞的生长[21-22];肿瘤生长会分泌信号素4D(semaphorin 4D,SEMA4D)可诱导表达其受体(plexin-B1)的内皮细胞进入肿瘤组织中,促进肿瘤增长和血管新生[23]。肿瘤血管结构紊乱、通透性高,肿瘤组织细胞间液静水压高,导致抗肿瘤药物难以很好地作用于靶细胞。拮抗血管新生药物的应用可以暂时性促进肿瘤血管结构正常化,从而增加局部组织氧供和药物浓度。
眼内血管新生紊乱是多种眼科疾病的显著特征,它可导致多种眼科疾病的恶化。在糖尿病视网膜病变(diabetic retinopathy,DR)和老年黄斑变性(age-related macular degeneration,AMD)等眼科疾病中,视网膜色素上皮细胞(retinal pigment epithelium,RPE)及脉络组织可分泌并调节VEGF和PlGF;VEGF、PlGF及其相应受体的过量表达则导致血管通透性增加,促进血管新生[24]。生理条件下,TGF-β1和TGF-β2抑制脉络膜血管内皮细胞的增殖,调节成纤维细胞功能,从而维持血眼屏障的生理功能[25]。患者血清中TGF-β含量明显高于正常人。可能是由于高糖损伤血眼屏障,血小板和单核巨噬细胞侵入玻璃体及视网膜,释放TGF-β,而TGF-β上调胶原蛋白表达,促进内皮细胞增殖、黏附和细胞外基质沉积引起的[26]。
很多脑部退行性病变,如PD、多发性硬化症、脊髓损伤和中风等,都被发现和血管新生有密切关系。在PD中,患者的脑脊液中发现促血管新生分子显著增多,其原因可能和血脑屏障功能受损有关。PD患者机体的慢性炎症可促进血管紧张素II(angiotensin II,AngII)的产生,进而诱导NADPH氧化酶的活化和超氧化物的释放,上调多种炎症细胞因子的水平,炎性刺激可促进血管新生[27]。应用血管紧张素I型受体(angiotensin type 1 receptor,AT1)的拮抗剂抑制AT1的作用,可以显著改善PD患者的症状[27]。另外,炎症刺激会上调VEGF,下调ANG2;VEGF能够增强血脑屏障的通透性;而ANG2降低血脑屏障的通透性,PD中ANG2减少和VEGF增加二者协同作用,共同增高血脑屏障通透性,损伤多巴胺神经元,导致神经系统退行性病变[28]。
3.2 血管新生不足相关疾病 在某些情况下,正常个体血管新生通路未被充分激活,造成血管新生不足,从而引发一系列疾病。
创面愈合是由多种细胞和物质共同参与的复杂过程,大致可以分为局部炎症反应、细胞增殖分化和组织塑形重建3个阶段。其中,血管新生和炎症反应与细胞的增殖及分化密切相关。
糖尿病小鼠伤口愈合模型中,伤口处的血管新生明显减少,伤口处血液灌流明显下降[29-31]。血管新生减少主要是因为高糖环境诱导产生的氧化应激损伤血管内皮细胞;伤口组织中新生血管不足可导致局部营养供应不足,阻滞炎症细胞迁移至伤口处,这使伤口局部免疫细胞产生不同血管生成因子的能力受限,进一步抑制伤口的血管新生[30-31]。这种情况下,增强伤口局部的血管新生有利于伤口的愈合。
以往认为AD的发病和淀粉样蛋白β(amyloid-β,Aβ)的累积有关。而近年发现,AD的发病可能也与血管新生有关。其发病机制可能以β淀粉样前体蛋白(amyloid precursor protein,APP)和早老素(presenilin,PS)的改变为始动因素。Notch-1和APP均依赖PS剪接而激活,二者存在竞争关系。由于PS的突变,会导致Notch-1的剪切减少;或是随着年龄增加,PS剪接的Notch-1含量减少。随着Notch-1含量的减少,血管新生受损,影响脑部的营养供给,从而导致神经元退行性病变。同时由于Notch-1和APP之间的竞争关系,Notch-1剪接减少,APP的剪接相应增多,故产生更多的APP剪接产物Aβ。Aβ具有潜在的细胞毒性,同时血流量减少使其清除减少,故Aβ逐渐累积并导致神经元受损[32-33]。除Notch-1外,血清中VEGF和TGF-β水平也下降,提示血管新生不足引发AD,并可能级联放大作用于AD的进展过程中[34]。Herran等[35]将VEGF给予AD模型小鼠,发现模型小鼠的Aβ减少,神经元受损减轻;Religa等[36]人通过在AD小鼠脑组织中过表达VEGF,发现AD症状缓解,这两者也从侧面证实血管新生在AD的发生中起到了重要作用,这也为治疗AD提供了新的思路。
4 展望
血管新生的机制正在探究之中,其与多种疾病的关系也逐渐得到重视。随着研究的逐渐深入,对血管新生调节机制及信号分子的进一步认识都有可能为我们日后的治疗提供靶点。当然,要想把基础研究转入临床治疗当中,必须要克服抗血管新生药物的效果受机体中多个因素影响的障碍,为了解决这些问题,未来还需要做更多的研究。
[1] Wang Z, Dabrosin C, Yin X, et al. Broad targeting of angiogenesis for cancer prevention and therapy[J]. Semin Cancer Biol, 2015, 35 Suppl:S224-S243.
[2] 权 伟,张丽莙. 磷脂酰肌醇3-激酶在血管新生相关性疾病中的作用[J]. 中国病理生理杂志, 2011, 27(8):1643-1646.
[3] Carmeliet P, Jain RK. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature, 2011, 473(7347):298-307.
[4] Hillmeister P, Gatzke N, Dülsner A, et al. Arteriogenesis is modulated by bradykinin receptor signaling[J]. Circ Res, 2011, 109(5):524-533.
[5] Na HJ, Hwang JY, Lee KS, et al. TRAIL negatively regulates VEGF-induced angiogenesis via caspase-8-mediated enzymatic and non-enzymatic functions[J]. Angiogenesis, 2014, 17(1):179-194.
[6] Schuermann A, Helker CS, Herzog W. Metallothionein 2 regulates endothelial cell migration through transcriptional regulation of vegfc expression[J]. Angiogenesis, 2015, 18(4):463-475.
[7] Srinivasan S, Chitalia V, Meyer RD, et al. Hypoxia-induced expression of phosducin-like 3 regulates expression of VEGFR-2 and promotes angiogenesis[J]. Angiogenesis, 2015, 18(4):449-462.
[8] Girling JE, Rogers PA. Regulation of endometrial vascular remodelling: role of the vascular endothelial growth factor family and the angiopoietin-TIE signalling system[J]. Reproduction, 2009, 138(6):883-893.
[9] Zhou XL, Liu JC. Role of Notch signaling in the mammalian heart[J]. Braz J Med Biol Res, 2014, 47(1):1-10.
[10]Janssen L, Dupont L, Bekhouche M, et al. ADAMTS3 activity is mandatory for embryonic lymphangiogenesis and regulates placental angiogenesis[J]. Angiogenesis, 2016, 19(1):53-65.
[11]Jeltsch M, Jha SK, Tvorogov D, et al. CCBE1 enhances lymphangiogenesis via A disintegrin and metalloprotease with thrombospondin motifs-3-mediated vascular endothe-lial growth factor-C activation[J]. Circulation, 2014, 129(19):1962-1971.
[12]Patterson DM, Gao D, Trahan DN, et al. Effect of MDM2 and vascular endothelial growth factor inhibition on tumor angiogenesis and metastasis in neuroblastoma[J]. Angiogenesis, 2011, 14(3):255-266.
[13]Lv PC, Sun J, Zhu HL. Recent advances of p53-MDM2 small molecule inhibitors (2011-present)[J]. Curr Med Chem, 2015, 22(5):618-626.
[14]Muthumani P, Alagarsamy K, Dhandayuthapani S, et al. Pro-angiogenic effects of MDM2 through HIF-1α and NF-κB mediated mechanisms in LNCaP prostate cancer cells[J]. Mol Biol Rep, 2014, 41(8):5533-5541.
[15]Ma J, Xue Y, Cui W, et al. Ras homolog gene family, member A promotes p53 degradation and vascular endothelial growth factor-dependent angiogenesis through an interaction with murine double minute 2 under hypoxic conditions[J]. Cancer, 2012, 118(17):4105-4116.
[16]Kumar B, Chile SA, Ray KB, et al. VEGF-C differentially regulates VEGF-A expression in ocular and cancer cells; promotes angiogenesis via RhoA mediated pathway[J]. Angiogenesis, 2011, 14(3):371-380.
[17]Hu J, Qiu J, Zheng Y, et al. AAMP regulates endothelial cell migration and angiogenesis through RhoA/Rho kinase signaling[J]. Ann Biomed Eng, 2016, 44(5):1462-1474.
[18]Zhou H, Yang YH, Basile JR. The Semaphorin 4D-Plexin-B1-RhoA signaling axis recruits pericytes and regulates vascular permeability through endothelial production of PDGF-B and ANGPTL4[J]. Angiogenesis, 2014, 17(1):261-274.
[19]耿志敏,王 珏,范鸿洋,等. 骨髓间充质干细胞膜微粒促进大鼠心肌梗死后血管新生[J]. 中国病理生理杂志, 2015, 31(8):1371-1375.
[20]Panahi Y, Darvishi B, Ghanei M, et al. Molecular mechanisms of curcumins suppressing effects on tumorigenesis, angiogenesis and metastasis, focusing on NF-κB pathway[J]. Cytokine Growth Factor Rev, 2016, 28:21-29.
[21]Yao J, Wu X, Zhuang G,et al. Expression of a functional VEGFR-1 in tumor cells is a major determinant of anti-PlGF antibodies efficacy[J]. Proc Natl Acad Sci U S A, 2011, 108(28):11590-11595.
[22]Bais C, Wu X, Yao J, et al. PlGF blockade does not inhibit angiogenesis during primary tumor growth[J]. Cell, 2010, 141(1):166-177.
[23]Zhou H, Binmadi NO, Yang YH, et al. Semaphorin 4D cooperates with VEGF to promote angiogenesis and tumor progression[J]. Angiogenesis, 2012, 15(3):391-407.
[24]Klettner A, Kaya L, Flach J, et al. Basal and apical regulation of VEGF-A and placenta growth factor in the RPE/choroid and primary RPE[J]. Mol Vis, 2015, 21:736-748.[25]Liu L, Jiao J, Wang Y, et al. TGF-beta1 gene polymorphism in association with diabetic retinopathy susceptibility: a systematic review and meta-analysis[J]. PLoS One, 2014, 9(4):e94160.
[26]Zorena K, Malinowska E, Raczynska D, et al. Serum concentrations of transforming growth factor-Beta 1 in predicting the occurrence of diabetic retinopathy in juvenile patients with type 1 diabetes mellitus[J]. J Diabetes Res, 2013, 2013(11):310-319.
[27]Munoz A, Garrido-Gil P, Dominguez-Meijide A, et al. Angiotensin type 1 receptor blockage reduces l-dopa-induced dyskinesia in the 6-OHDA model of Parkinson’s disease. Involvement of vascular endothelial growth factor and interleukin-1β[J]. Exp Neurol, 2014, 261:720-732.
[28]Janelidze S, Lindqvist D, Francardo V, et al. Increased CSF biomarkers of angiogenesis in Parkinson disease[J]. Neurology, 2015, 85(21):1834-1842.
[29]Tie L, Chen LY, Chen DD, et al. GTP cyclohydrolase I prevents diabetic-impaired endothelial progenitor cells and wound healing by suppressing oxidative stress/thrombospondin-1[J]. Am J Physiol Endocrinol Metab, 2014, 306(10):E1120-E1131.
[30]Tie L, An Y, Han J, et al. Genistein accelerates refractory wound healing by suppressing superoxide and FoxO1/iNOS pathway in type 1 diabetes[J]. J Nutr Biochem, 2013, 24(1):88-96.
[31]Tie L, Yang HQ, An Y, et al. Ganoderma lucidum polysaccharide accelerates refractory wound healing by inhibition of mitochondrial oxidative stress in type 1 diabetes[J]. Cell Physiol Biochem, 2012, 29(3-4):583-594.
[32]Drachman DA. The amyloid hypothesis, time to move on: Amyloid is the downstream result, not cause, of Alzheimer’s disease[J]. Alzheimers Dement, 2014, 10(3):372-380.
[33]Tanveer R, Gowran A, Noonan J, et al. The endocannabinoid, anandamide, augments Notch-1 signaling in cultured cortical neurons exposed to amyloid-beta and in the cortex of aged rats[J]. J Biol Chem, 2012, 287(41):34709-34721.
[34]Huang L, Jia J, Liu R. Decreased serum levels of the angiogenic factors VEGF and TGF-beta1 in Alzheimer’s disease and amnestic mild cognitive impairment[J]. Neurosci Lett, 2013, 550:60-63.
[35]Herran E, Perez-Gonzalez R, Igartua M, et al. VEGF-releasing biodegradable nanospheres administered by craniotomy: a novel therapeutic approach in the APP/Ps1 mouse model of Alzheimer’s disease[J]. J Control Release, 2013, 170(1):111-119.
[36]Religa P, Cao R, Religa D, et al. VEGF significantly restores impaired memory behavior in Alzheimer’s mice by improvement of vascular survival[J]. Sci Rep, 2013, 3:2053.
(责任编辑: 卢 萍, 余小慧)
Angiogenesis: molecular mechanism and related diseases
ZHANG Meng-ze1, 2, LI Guo-shen1, 3, ZHAO Xin-tong1, 2, TIE Lu1
(1DepartmentofPharmacology,SchoolofBasicMedicalSciences,2ThirdHospital,PekingUniversity,Beijing100191,China;
3BeijingJishuitanHospital,Beijing100035,China.E-mail:tielu@bjmu.edu.cn)
Angiogenesis is the process of capillary formation from the existing blood vessels, which is regulated by many cytokines. Balance of these cytokines plays an important role in angiogenesis. Unbalance of these cytokines, leading to excessive or insufficient blood vessel, relates to a variety of diseases, such as tumor, ophthalmic diseases and wound healing. Recently, it has been observed that angiogenesis is also involved in Parkinson’s disease and Alzheimer’s disease. This review mainly discusses the molecular mechanism of angiogenesis and related diseases, and emphasizes the value of targeting angiogenesis as a strategy to develop drugs for those diseases.
血管新生; 血管内皮生长因子; 转化生长因子-β; 纤维母细胞生长因子; 肿瘤
Angiogenesis; Vascular endothelial growth factor; Transforming growth factor-β; Fibroblast growth factor; Tumor
R331.3; R363
A
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1718- 06
2016- 03- 01
2016- 06- 29
国家自然科学基金资助项目(No. 81373405; No. 30901803);北京市支持中央高校共建项目——青年英才计划(No. YETP0053);杨森科学研究委员会中国分会研究基金(No. JRCC2011药理01);国家基础科学人才培养基金(No. J1030831/J0108);北京市重点学科基础医学学科建设项目(No.BMU20110254)
△通讯作者 Tel: 010-82801890; E-mail: tielu@bjmu.edu.cn
10.3969/j.issn.1000- 4718.2016.09.032

