子痫前期患者血清内脂素、肿瘤坏死因子α水平与胰岛素抵抗的相关性*
王江玲, 陈思思, 唐 杰, 池胜英, 郭 祎, 陈香娟, 黄引平△
(温州医科大学 1附属第一医院产科, 2附属第二医院产科, 3附属第一医院检验科, 浙江 温州 325000)
子痫前期患者血清内脂素、肿瘤坏死因子α水平与胰岛素抵抗的相关性*
王江玲1, 陈思思2, 唐 杰1, 池胜英3, 郭 祎1, 陈香娟1, 黄引平1△
(温州医科大学1附属第一医院产科,2附属第二医院产科,3附属第一医院检验科, 浙江 温州 325000)
目的: 探讨子痫前期患者血清内脂素及肿瘤坏死因子-α(TNF-α)与胰岛素抵抗(IR)的关系。方法: 根据子痫前期分类标准选取重度子痫前期患者30例、轻度子痫前期患者30例及正常孕妇40例。采用酶联免疫吸附试验(ELISA)法检测孕妇血清内脂素和TNF-α浓度,血浆葡萄糖氧化酶法测定空腹血糖(FBG),放射免疫法测定空腹胰岛素(FIns),全自动生化分析仪测定血浆甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)水平。通过计算平均动脉压(MAP)、体质量指数(BMI)和胰岛素抵抗指数(HOMA-IR),分析子痫前期患者血清内脂素、TNF-α水平与IR的关系。结果: 重度、轻度子痫前期患者的血清内脂素和TNF-α浓度低于正常孕妇 (P<0.05),且重度子痫前期患者的血清内脂素和TNF-α浓度低于轻度子痫前期患者(P<0.05);血清内脂素与TNF-α、HDL-C呈正相关(P<0.05),与MAP、FIns呈负相关(P<0.05);血清TNF-α与HDL-C呈正相关(P<0.05),与BMI、TG、MAP、FIns呈负相关(P<0.05)。多元逐步线性回归分析显示,FBG、FIns和HOMA-IR是影响血清内脂素及TNF-α水平的相关因素。结论: 子痫前期患者血清内脂素、TNF-α水平与IR密切相关。
子痫前期; 内脂素; 肿瘤坏死因子-α; 胰岛素抵抗
子痫前期是妊娠中晚期特有的并发症之一,其发病率高,常危及母儿生命,是孕产妇和围生儿生存率下降的主要原因。近年来研究发现,脂肪组织不仅是能量的储存器官,还能分泌多种细胞因子,如内脂素、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)等。有学者提出,脂肪因子的异常表达可能是子痫前期和胰岛素抵抗(insulin resistance,IR)发生的重要分子机制[1-2]。本文旨在通过测定子痫前期患者血清内脂素、TNF-α水平来揭示两者与IR的相关性,探讨内脂素、TNF-α在IR和子痫前期发生发展中的作用,为子痫前期的临床治疗提供新方向。
材 料 和 方 法
1 对象
随机选择2011年8月至2013年12月在温州医科大学附属第一医院产科住院分娩的单胎妊娠产妇共计100名,其中正常孕妇40名、轻度子痫前期孕妇30例、重度子痫前期孕妇30例。诊断标准参照乐杰主编的第七版《妇产科学》[3]。轻度子痫前期:妊娠20周以后出现血压≥140/90 mmHg(1 mmHg=0.133 kPa);尿蛋白≥0.3 g/24 h或随机尿蛋白(+)。重度子痫前期:妊娠20周以后出现血压≥160/110 mmHg;尿蛋白 ≥ 2.0 g/24 h或随机尿蛋白≥(++);血清肌酐>106 μmol/L;血小板减少(<100×109/L);血乳酸脱氢酶(lactate dehydrogenase,LDH)升高;血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)或天冬氨酸氨基转移酶(aspartate transaminase,AST)升高;持续头痛或其它脑神经或视觉障碍;持续性上腹部不适,少尿,胎儿生长受限,羊水过少等。所有孕妇排除慢性高血压、妊娠期糖尿病、慢性肾炎、肾病综合征、多囊卵巢综合征及孕期使用皮质激素类药物。该实验获得温州医科大学附属第一医院伦理委员会批准及研究对象的知情同意。
2 方法
2.1 临床资料收集 根据研究对象的婚育史、末次月经及孕早期B超准确核实年龄、孕次、产次及孕周。于清晨测量每例患者的身高和体质量,根据公式计算体质量指数(body mass index,BMI):BMI=体质量(kg)/身高2(m2)。选择符合计量标准的水银血压计,让被测量者安静休息5 min后测量血压,具体操作参照《中国高血压防治指南2010》实施,收缩压读数取柯氏音第Ⅰ时相,舒张压读数取柯氏音第V时相,所有患者相隔1~2 min重复测量,取2次测量平均值作为该患者的血压。
2.2 标本采集 所有研究对象均在住院后孕晚期隔夜空腹12 h,晨取肘静脉血10 mL,其中5 mL迅速注入加有EDTA抗凝的试管中,另外5 mL迅速注入未加抗凝剂的试管中。轻轻摇匀后静置15 min,4 ℃ 3 000 r/min离心15 min分离血浆及血清,放置于-80 ℃冰箱保存。
2.3 糖脂代谢指标检测 葡萄糖氧化酶法测定血浆空腹血糖(fasting blood glucose,FBG),放射免疫法测定血浆空腹胰岛素(fasting insulin,FIns),全自动生化分析仪测定血浆甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和总胆固醇(total cholesterol,TC)浓度。用稳态模型胰岛素抵抗指数(homeostatic model assessment for insulin resistance index,HOMA-IR)作为评价IR的指标:HOMA-IR = 空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5。
2.4 血清内脂素、TNF-α浓度的测定 采用双抗体夹心酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法检测血清中内脂素及TNF-α浓度,ELISA试剂盒购自上海博古生物科技有限公司。分别用纯化的人内脂素、TNF-α抗体包被微孔板,制成固相抗体,依次加入血清样品及标准品,再加入辣根过氧化物酶标记的内脂素、TNF-α抗体,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物显色。用酶标仪在450 nm波长下测定吸光度(A)值,通过标准曲线计算样品中内脂素、TNF-α浓度。所有检测指标均在同次实验、用同批试剂完成,各项质控指标均符合要求,批内变异系数<10%,批间变异系数<12%。
3 统计学处理
采用SPSS 13.0 软件进行数据分析,计量资料以均数±标准差(mean±SD)表示,比较前先进行正态性检验及方差齐性检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,半定量资料采用秩和检验,参数间的相关性分析采用Pearson相关分析,多因素分析采用多元逐步回归。以P<0.05为差异有统计学意义。
结 果
1 基线特征
3组孕妇的年龄和孕早期BMI比较差异均无统计学显著性。重度子痫前期组患者收缩压和舒张压高于轻度子痫前期和正常孕妇组(P<0.05),分娩孕周和新生儿体质量低于轻度子痫前期和正常孕妇组(P<0.05);轻度子痫前期组收缩压高于正常孕妇组(P<0.05),舒张压、分娩孕周和新生儿体质量与正常孕妇组差异无统计学显著性,见表1。
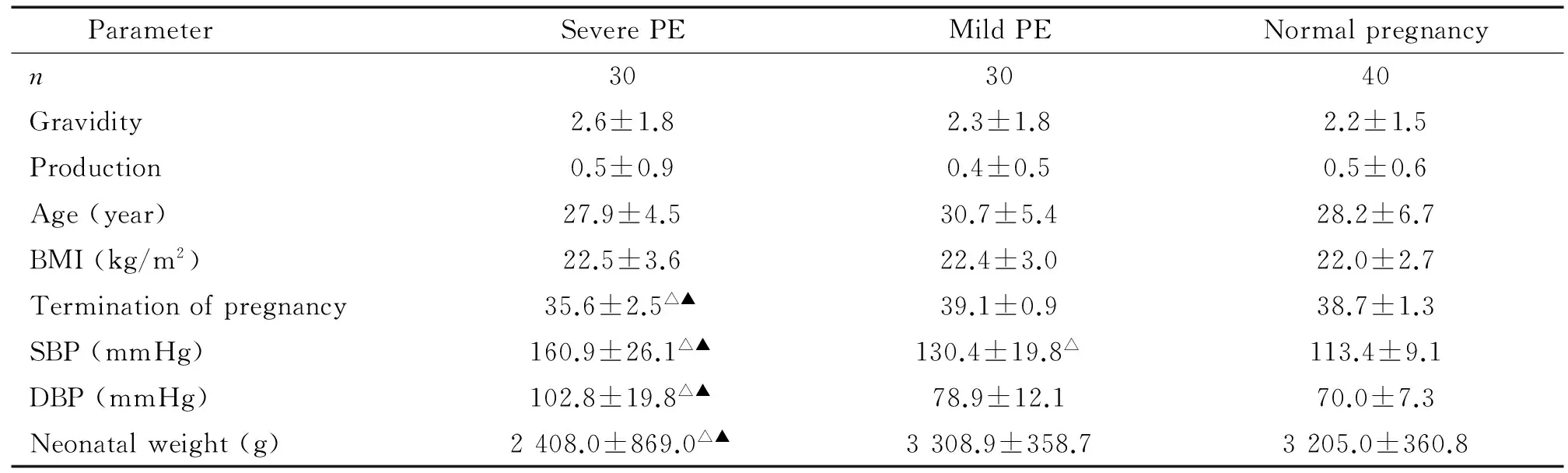
表1 3组临床资料的比较
△P<0.05vsnormal pregnancy group;▲P<0.05vsmild PE group.
2 血清内脂素、TNF-α及糖脂代谢指标的变化
血清内脂素和TNF-α浓度随着子痫前期程度的加重逐渐降低,3组间比较差异均有统计学显著性(P<0.05)。重度子痫前期组FIns和TC高于正常孕妇(P<0.05),HDL-C低于正常孕妇(P<0.05);轻度子痫前期组HDL-C低于正常孕妇(P<0.05),见表2。
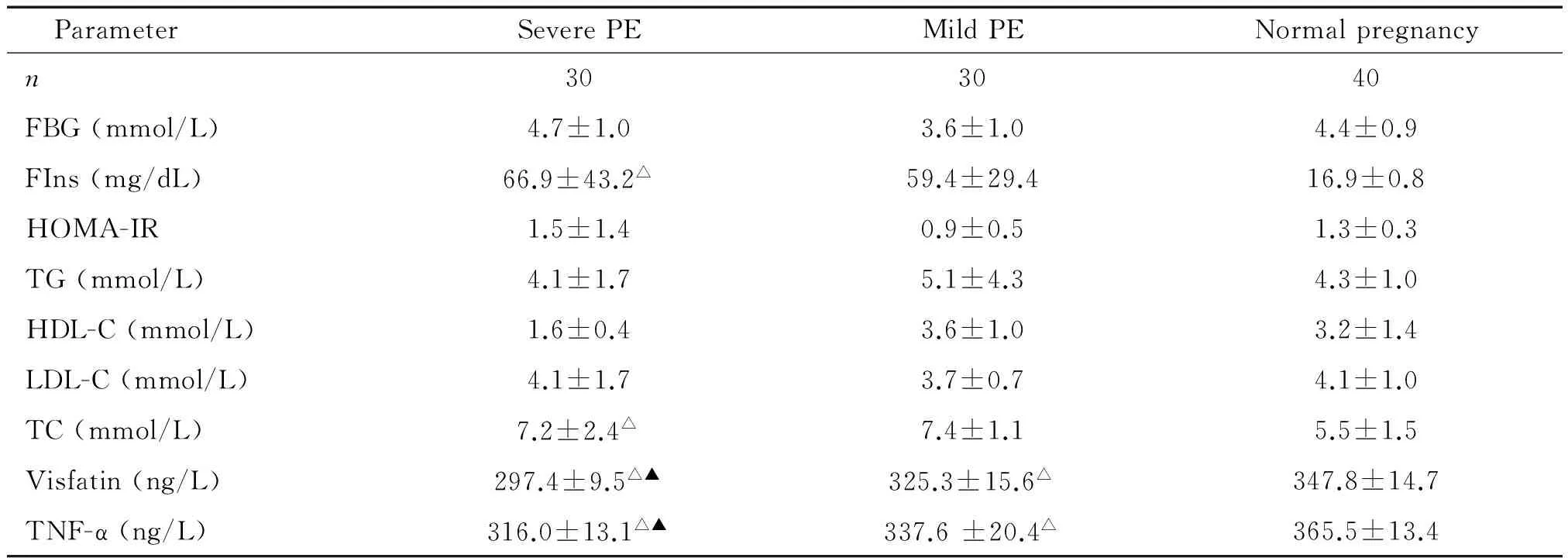
表2 血清内脂素、TNF-α及糖脂代谢指标的比较
△P<0.05vsnormal pregnant group;▲P<0.05vsmild PE group.
3 相关性分析
直线相关分析结果显示,血清内脂素与TNF-α、HDL-C呈正相关(P<0.05),与MAP、FIns呈负相关(P<0.05),与BMI、FBG、HOMA-IR、TC、LDL-C、TG的相关性无统计学显著性,见图1。血清TNF-α与HDL-C呈正相关(P<0.05),与BMI、TG、MAP、FIns呈负相关(P<0.05),与FBG、HOMA-IR、TC、LDL-C的相关性无统计学显著性,见图2。
4 多因素分析
分别以血清内脂素和TNF-α为因变量,以BMI、FBG、FIns、HOMA-IR、TC、HDL-C、LDL-C和TG为自变量进行多元逐步回归分析,结果显示,FBG、FIns和HOMA-IR是血清内脂素和TNF-α水平的相关因素。
讨 论
子痫前期是妊娠期特有的疾病,在我国,发病率为3%~5%,其发病机制尚未明确,目前普遍认为胎盘浅着床、血管内皮损伤和功能紊乱、炎症反应、氧化应激是子痫前期发生发展的重要原因[1]。内脂素是新发现的一种脂肪细胞因子,妊娠后血清内脂素逐渐升高并于妊娠中期达到巅峰,随后稍有下降,在妊娠晚期保持相对稳定[4]。有研究发现,肾透析患者血清内脂素与高敏C反应蛋白(hs-CRP)密切相关[5];血清内脂素是2型糖尿病患者血管内皮损伤和功能紊乱的标志[6]。以上研究提示,血清内脂素与炎症反应、血管内皮损伤和功能紊乱密切相关,因此,推测内脂素可能参与子痫前期的发病机制。TNF-α是一种具有调节免疫反应及炎症反应的细胞因子,血清TNF-α水平在妊娠期间保持相对稳定[7]。Visser 等[8]认为,TNF-α可以调节滋养细胞的生长和侵入从而影响胎盘着床,同时,TNF-α还可以造成血管内皮细胞损伤和功能紊乱,促进血管收缩因子的生成和释放并减少血管舒张因子生成和释放,最终导致血管调节因子失衡。由于TNF-α与胎盘浅着床、血管内皮损伤和功能紊乱、炎症反应等病理生理过程相关,所以推测TNF-α也极有可能参与子痫前期的发生。本研究通过测定子痫前期孕妇孕晚期血清内脂素、TNF-α浓度证实:子痫前期患者血清内脂素、TNF-α水平明显低于正常孕妇,其中,重度子痫前期患者血清内脂素、TNF-α水平明显低于轻度子痫前期患者。以上结果证明血清内脂素、TNF-α水平均与子痫前期密切相关,这和Hu等[9]的研究结果一致。
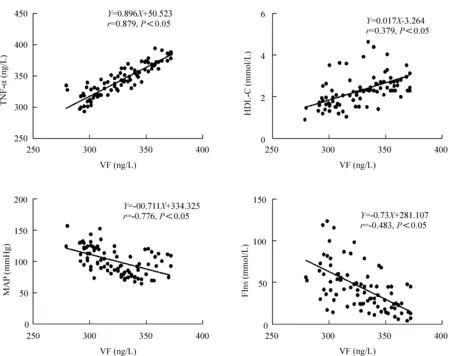
Figure 1.The correlation analysis between visfatin and glycolipid metabolism data.n=100.
图1 血清内脂素与糖脂代谢指标相关性分析
IR是指各种原因使胰岛素促进葡萄糖摄取和利用的效率下降,机体代偿性分泌过多胰岛素产生高胰岛素血症以维持血糖的稳定。妊娠期孕妇体质量逐渐增加,出现一定程度的IR,这对胎儿生长发育是有利的,但是,合并IR的患者发生子痫前期的风险明显高于正常孕妇[10-11]。有研究发现,内脂素是一种具有结合并激活胰岛素受体、模拟胰岛素作用的肽类激素,能提高胰岛素敏感性,从而改善糖尿病患者的空腹血糖和空腹胰岛素水平[12]。但是,Samal等[13]并不这么认为,他们通过测定糖尿病患者胰岛素敏感性及血清内脂素浓度发现,内脂素与IR并无关联。研究发现,TNF-α与2型糖尿病、肥胖等病理状态下的IR具有相关性,合并IR的患者血清TNF-α水平,脂肪细胞、巨噬细胞、肌肉细胞源性TNF-α表达水平均高于无IR者。近年来,学者们开始关注妊娠期IR与TNF-α的相关性,并且证实TNF-α是预测妊娠期IR最有价值的指标之一[14],但是子痫前期患者血清TNF-α与IR的关系目前还未明确。本研究结果显示,血清内脂素与HDL-C呈正相关,与空腹胰岛素呈负相关,血清TNF-α与HDL-C呈正相关,与BMI、TG、MAP、FIns呈负相关;FBG、FIns和HOMA-IR是影响血清内脂素和TNF-α水平的相关因素。由于FBG、FIns和HOMA-IR是反映IR较好的指标,BMI、TG和HDL-C也是与IR相关的指标,所以本研究证实子痫前期患者血清内脂素和TNF-α水平与IR密切相关,提示内脂素和TNF-α可以通过某种方式调节IR。内脂素能与胰岛素受体非胰岛素结位结合,抑制肝糖原的释放,促进葡萄糖向TG的转变;同时内脂素可维持循环中烟酰胺单核苷酸处于高水平,继而通过SIRT-1途径调节胰岛素释放来调节IR。一旦机体的IR状态得到缓解,机体的高血糖、高血脂状态也将有所改善。持续的高血糖、高血脂可损坏线粒体功能,使其产生大量活性氧簇,引起氧化应激反应,进而引起血管内皮细胞损伤及功能紊乱。内脂素和TNF-α通过调节IR抑制上述过程,所以在一定程度上阻止了子痫前期的发展。
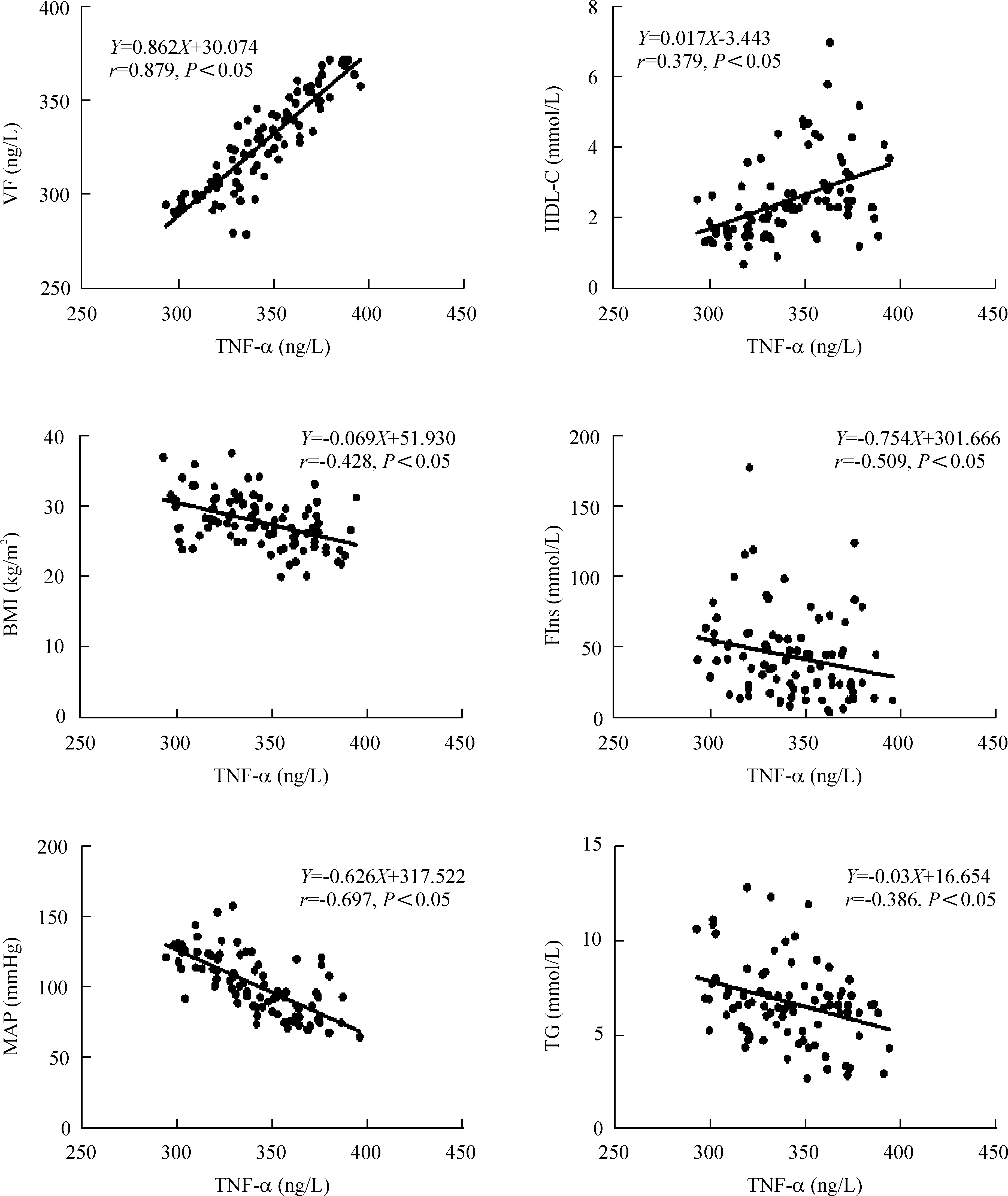
Figure 2.The correlation analysis between TNF-α and glycolipid metabolism data.n=100.
图2 血清TNF-α与糖脂代谢指标相关性分析
研究认为,内脂素与TNF-α之间存在相互联系。Moschen等[15]发现内脂素可以通过p38 MAPK、JNK、PI3K信号通路促进外周单核细胞合成和释放TNF-α等细胞因子,同时,TNF-α也可以提高肥胖小鼠脂肪组织表达内脂素[16]。本研究结果显示,血清内脂素与TNF-α水平呈正相关,重度子痫前期患者血清内脂素水平下降可能会引起其血清TNF-α水平下降,这可能是重度子痫前期患者炎症程度重而TNF-α水平反而低的原因之一。鉴于内脂素与TNF-α的关系,还不能断定内脂素和TNF-α是影响IR诱导子痫前期的独立因素。
目前子痫前期的诊治在临床上仍然存在诸多困难,本实验结果提示,内脂素、TNF-α可能通过改善IR减轻子痫前期,因此,改善IR、提升血清内脂素、TNF-α浓度可以成为未来子痫前期治疗的新方法。沈俊飞等[17]提出,非诺贝特等改善IR的药物可以提高血清内脂素浓度,但是,此类药物是否具有治疗子痫前期的作用还需进一步研究。
[1] Wang Q, Guo T, Tao Y, et al. Association between serum adipocyte factor level and insulin resistance in polycystic ovarian syndrome[J].Gynecol Endocrinol, 2011, 27(11): 931-934.
[2] Noureldeen AF, Qusti SY, Al-Seeni MN, et al. Maternal leptin, adiponectin, resistin, visfatin and tumor necrosis factor-alpha in normal and gestational diabetes[J]. Indian J Clin Biochem, 2014, 29(4):462-470.
[3] 乐 杰. 妇产科学[M]. 第7版. 北京: 人民卫生出版社, 2008:101-102.
[4] Mazaki-Tovi S, Romero R, Kusanovic JP, et al. Maternal visfatin concentration in normal pregnancy[J]. J Perinat Med, 2009, 37(3):206-217.
[5] Kato A, Odamaki M, Ishida J, et al. Relationship between serum Pre-B cell colony-enhancing factor/visfatin and atherosclerotic parameters in chronic hemodialysis patients[J]. Am J Nephrol, 2009, 29(1):31-35.
[6] Vanhoutte PM. Endothelial dysfunction: the first step toward coronary arteriosclerosis[J]. Circ J, 2009, 73(4):595-601.
[7] Palm M, Axelsson O, Wernroth L, et al. Involvement of inflammation in normal pregnancy[J]. Acta Obstet Gynecol Scand, 2013, 92(5):601-605.
[8] Visser N, van Rijn BB, Rijkers, et al. Inflammatory changes in preeclampsia: current understanding of the maternal innate and adaptive immune response[J]. Obstet Gynecol Surv, 2007, 62(3):191-201.
[9] Hu W, Wang Z, Wang H, et al. Serum visfatin levels in late pregnancy and pre-eclampsia[J]. Acta Obstet Gynecol Scand, 2008, 87(4):413-418.
[10]Hauth JC, Clifton RG, Roberts JM, et al. Maternal insulin resistance and preeclampsia[J]. Am J Obstet Gynecol, 2011, 204(4):327.e1-327.e6.
[11]Valdés E, Sepúlveda-Martínez A, Manukián B, et al. Assessment of pregestational insulin resistance as a risk factor of preeclampsia[J]. Gynecol Obstet Invest, 2014, 77(2):111-116.
[12]Trayhum P, Beattie JH. Physiological role of adipose tissue: white adipose tissue as an endocrine and secretory organ[J]. Proc Nutr Soc, 2001, 60(3):329-339.
[13]Samal B, Sun Y, Stearns G, et al. Cloning and characte-rization of the cDNA encoding a novel human pre-B-cell colony-enhancing factor[J]. Mol Cell Biol, 1994, 14(2):1431-1437.
[14]Kirwan JP, Haugue-DeMouzon S, Lepercq J, et al. TNF-alpha is a predictor of insulin resistance in human pregnancy[J]. Diabetes, 2002, 51(7):2207-2213.
[15]Moschen AR, Kaser A, Enrich B, et al. Visfatin, an adipocytokine with proinflammatory and immunomodulating properties[J]. J Immunol, 2007, 178(3):1748-1758.
[16]Ye SQ, Simon BA, Maloney JP, et al. Pre-B-cell colony-enhancing factor as a potential novel biomarker in acute lung injury[J]. Am J Respir Crit Care Med, 2005, 171(4):361-370.
[17]沈俊飞,代 芳,王长江,等. 非诺贝特和TNF-α对3T3-L1脂肪细胞内脂素表达的影响[J]. 山东医药,2008, 48(19):28-30.
(责任编辑: 林白霜, 罗 森)
Serum levels of visfatin and tumor necrosis factor-alpha in patients with pre-eclampsia and their relationship with insulin resistance
WANG Jiang-ling1, CHEN Si-si2, TANG Jie1, CHI Sheng-ying3, GUO Yi1, CHEN Xiang-juan1, HUANG Yin-ping1
(1DepartmentofObstetrics,TheFirstAffiliatedHospital,2DepartmentofObstetrics,TheSecondAffiliatedHospital,3DepartmentofLaboratoryMedicine,TheFirstAffiliatedHospital,WenzhouMedicalUniversity,Wenzhou325000,China.E-mail:yphuangy@126.com)
AIM: To explore the serum levels of visfatin (VF) and tumor necrosis factor-alpha (TNF-α) in the patients with pre-eclampsia (PE) and their correlation with insulin resistance (IR). METHODS: The severe PE patients (n=30), mild PE patients (n=30) and normal pregnant women (n=40) were selected according to the classification standard of PE. The serum levels of VF and TNF-α were measured by ELISA. Fasting plasma glucose (FPG) and fasting insulin (FIns) were detected by glucose oxidase method and radioimmunoassay, respectively. Triglyceride (TG), total cholesterol (TC), high-density lipoprotein cholesterol (HDL-C) and low-density lipoprotein cholesterol (LDL-C) were measured by an automatic biochemical analyzer. According to calculating the mean arterial pressure (MAP), body mass index (BMI) and homeostatic model assessment for insulin resistance index (HOMA-IR), the correlation between IR and the levels of serum VF as well as TNF-α were analyzed.RESULTS: The levels of VF and TNF-α in severe PE group and mild PE group were significantly lower than those in normal pregnancy group (P<0.05). In addition, the levels of VF and TNF-α in severe PE group were lower than those in mild PE group (P<0.05). Linear correlation analysis showed that serum VF was positively correlated with TNF-α and HDL-C (P<0.05), and negatively with MAP and FIns (P<0.05). The serum TNF-α was positively correlated with HDL-C (P<0.05), and negatively with BMI, TG, MAP and FIns (P<0.05). Multiple stepwise regression analysis showed that FBG, FIns and HOMA-IR were relative independent factors of serum VF and TNF-α (P<0.05).CONCLUSION: Serum levels of VF and TNF-α are closely related to IR.
Pre-eclampsia; Visfatin; Tumor necrosis factor-alpha; Insulin resistance
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1677- 06
2016- 03- 23
2016- 05- 20
温州市科技局资助项目(No. Y20110256)
△ 通讯作者 Tel: 0577-88069304; E-mail: yphuangy@126.com
R714.252
A
10.3969/j.issn.1000- 4718.2016.09.024

