JAK/STAT信号通路在机体免疫及相关疾病中的作用机制
潘志鹏 伦永志
(莆田学院药学与医学技术学院医学检验系,莆田351100)
JAK/STAT信号通路在机体免疫及相关疾病中的作用机制
潘志鹏①伦永志
(莆田学院药学与医学技术学院医学检验系,莆田351100)
JAK/STAT(Janus kinase/Signal transducer and activator of transcription)信号通路目前已成为研究细胞膜到细胞核信号传递中的经典信号途径,同时也解释了大量细胞因子和激素是如何发挥其相关功能的。解析JAK/STAT信号通路同样有助于细胞间通讯和细胞外基因表达控制的研究。目前针对JAK/STAT信号通路的特异性临床治疗已取得一定成就。在本综述中,简要探讨了JAK/STAT信号转导在细胞、分子以及基因水平上的现有理论和观点,尤其强调了JAK/STAT信号转导在人类疾病方面的研究进展,同时总结在该领域研究过程中获得的经验和教训,进而展望了JAK/STAT信号通路未来的研究方向以及面临的困难和挑战。
1 典型JAK/STAT信号通路
相关研究已经表明,从低等生物列脊椎动物的整个系统发育过程中,JAK/STAT信号通路都具有很强的保守性[1]。免疫系统信号网络是细胞内最复杂的网络系统,JAK/STAT信号通路的研究也为临床治疗提供了动力和基本理论。
具体来说,JAK/STAT信号转导是从细胞外相关细胞因子或生长因子与其相应的跨膜受体结合开始的。这种方式可以使JAKs在空间位置上彼此接近,同时促使JAKs在空间结构上发生改变,最终使JAKs的激酶结构域从无激酶活性的抑制形式转变为具有激酶活性的活化形式[2]。这种结合方式使JAKs与其受体的空间距离接近,进而导致JAKs自身和胞浆细胞质受体的尾部磷酸化,生成潜在的STAT单体停靠必要位点。酪氨酸磷酸化的STAT蛋白作为主要的触发事件,导致STAT二聚体化、核易位、结合DNA、诱导靶基因表达等一系列反应。然而,磷酸化的酪氨酸也可以通过非依赖的JAK/STAT通路进行信号传递,即并不是所有的细胞活动都需要JAK的活性(即非磷酸化状态的STATs),翻译后修饰(如磷酸化丝氨酸)也会影响STATs的活性和功能。虽然每个细胞因子/受体通常是与某一特定的STAT相关,但每个细胞因子/受体却常常与多个STAT家族成员(异构信号)相关,导致了同型二聚体、异聚体和高阶四聚体的形成。它们在细胞核内通过序列一致GAS(Gamma-interferon activation site)与DNA结合,同时,也通过非依赖GAS的方式导致基因表达的激活、抑制,或者与编码蛋白质的mRNAs或非编码RNA[包括微小RNA(miRNAs)和长链非编码RNA(lncRNAs)]的靶基因进行中性结合,作为多分子复合物的一部分。由于GAS基序具有相同的亲和力,多种形式的STATs可能共同结合到相同的靶位点(即重叠特异性)。它们还可以结合并促进增强子的重塑和调节靶基因的表观遗传状态。STATs在核外的功能,特别是在线粒体中的作用逐渐受到重视(图1)。
在哺乳动物中的4种JAKs激酶(JAK1、JAK2、JAK3、Tyk2)和7种STATs(STAT1、STAT2、 STAT3、STAT4、STAT5a、STAT5b、STAT6)可以与50多种细胞因子和生长因子结合,那么问题接踵而至,在保证其特异性的前提下,数量这么少的JAKs激酶和STATs是如何与它们相应的配体(即细胞因子和生长因子)结合的呢?一种解释是,具有相同激活属性的细胞因子可能在不同类型细胞(或不同状态细胞)中发挥作用,不同敏感性的STAT是由不同的STAT基因编码的。然而,这种解释并不能阐明为什么在“看起来”相似的STAT信号级联反应中的细胞因子,在相同的细胞类型或状态下具有不同生物学反应的现象。例如在髓系细胞中,IL-6和IL-10都可以有效地激活STAT3,IL-6主要发挥促炎作用,而IL-10主要是抗炎作用。STAT3信号产生的差异主要表现在STAT3信号的持续时间和强度方面,然而这可能仅仅是问题的一部分[3]。虽然通常每个细胞因子只与一个特定的STAT相关,但是,几乎每一个STAT都是多个细胞因子或生长因子的家族成员,只是在不同的家族中的作用程度不同而已(即异构的信号传递;图1)。例如,Ⅰ型干扰素(Interferon-Ⅰ,IFN-Ⅰ)是典型的STAT1激活剂,但是它同样可以激活STAT3和STAT4[4]。在某些情况下,细胞因子参与多个STATs的活动并具有同等作用,如IL-27可以强烈激活STAT1和STAT3[5]。而其他情况下,二者的相互作用具有清晰的层次性,如IFN-γ可以引起强烈的STAT1反应,而对STAT3引起的反应则相反[6]。
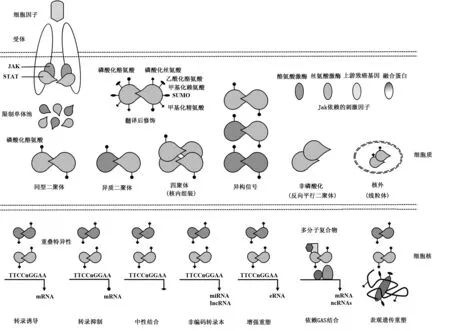
图1 典型JAK / STAT信号通路Fig.1 Typical JAK/STAT signaling pathway
STATs可以直接与DNA结合,作为经典的转录因子(Transcription factors,TFs)来发挥作用。高通量测序技术可以与染色质免疫沉淀技术相结合,从而产生全面无偏差的STAT-DNA结合的图谱,这些STAT-DNA相互作用的结果可以被整合到转录组学和功能基因组学的功能缺失研究当中[即基因敲除小鼠、小干扰RNA(small interfering RNA,siRNA)],从而对靶基因进行分类,还可以进一步将这些结果运用于STAT的结合占位和STAT依赖的转录调控上[7]。STATs分散在整个基因组中,可以调节编码蛋白质的基因和非编码基因的转录过程[8],见图1。
全基因组分析揭示了STAT结合特性的普遍性。在Th细胞中,成千上万的结合位点已经与每个家族成员建立了对应关系,有时结合位点在转录起始位点的近端,但更多的位于转录起始位点的远端,通常与增强子或其他的顺式作用元件相关[8]。
这些相互关联事件很多与序列一致DNA基序不相关。不同STATs具有高度的重叠性(即重叠特异性;图1)[9]。众所周知,所有STATs都识别的相同DNA序列,称为GAS基序。每个STAT家族成员在核心核苷酸上都具有一些选择性,如STAT6优先选择某些额外间隔的核苷酸[6]。这说明不同的STATs个体之间存在基因组的重叠性。特殊的序列一致基序认为,STATs之间可能相互拮抗竞争结合相同的基因组区域。上述观点在STAT3和STAT5上得到了验证:在T细胞、树突状细胞和肿瘤细胞株中,STAT3介导的IL-17的转录均被STAT5所阻断[10]。因而其他STATs是否也参与上述这种竞争,以及STAT介导的转录抑制是如何发挥作用的有必要进一步确定。
尽管STATs是细胞因子特异性和功能的关键性因素,然而,细胞因子受体接受刺激,也可以在一定程度上通过影响STAT来产生部分非依赖STAT的信号。ITAM轴受体是一个很好的例子(免疫受体酪氨酸激活基序,Immunoreceptor tyrosine-based activation motif,ITAM),它是通过调节STAT1信号转导,与肿瘤坏死因子受体相关因子作用激活受体来发挥作用的,最终调节STAT3信号途径[11,12]。
2 非经典JAK/STAT信号通路
JAK/STAT信号通路通常表现为经典途径,但其中充满复杂因素,如STATs也作为异聚体和高阶四聚体发挥作用(图1)。IFN-Ⅰ和IFN-Ⅱ一个关键的区别在于,前者诱导STAT1/STAT2异二聚体的形成(即ISGF3复合体),而后者则主要诱导产生STAT1二聚体(即GAF复合物)[13]。二聚体的组装在细胞质中,而四聚体化反应发生在细胞核内,随后与两个STAT二聚体一起结合到相邻的(或串联)的DNA元件上。在功能方面,人们研究认为STAT5是转录活性的关键。STAT1四聚体对IFN-Ⅱ很重要,但是对IFN-Ⅰ却是非必需的[14]。STAT蛋白的表达是受到严格调控的,胞质内STAT蛋白的浓度具有重要的生物学作用,比如在NK细胞中,STAT1和STAT4的相对水平决定着IFN-Ⅰ的反应水平(图1)[15]。
经典JAK/STAT信号通路认为STATs是通过JAK依赖的磷酸化的酪氨酸触发的,这显然是处于主导地位的细胞因子受体途径的下游,但是,在其他情况下,JAKs的作用却受到了新的挑战。在多种肿瘤中,JAK非依赖的磷酸化的酪氨酸与STAT的高活性是联系在一起的,并且认为STAT在正常的生理过程中发挥重要作用(图1)。如某些受体酪氨酸激酶[如flt3r(人FMS样酪氨酸激酶3受体)]可以引起STAT5的激活而不需要JAKs的参与[16]。干扰素基因刺激因子(Stimulator of interferon genes,STING)参与了JAK非依赖的STAT6酪氨酸蛋白的磷酸化,诱发宿主的保护性抗病毒免疫应答,丙酮酸激酶M2调用JAK非依赖的STAT6酪氨酸蛋白的磷酸化进而影响代谢反应[17,18]。磷酸化的酪氨酸蛋白的核心作用方面,无论是JAK依赖或不依赖,都受到严格的控制,越来越多的STAT6的功能已被归因于“非磷酸化”的STATs(图1)[13]。STATs形成了明显的反向平行的二聚体酪氨酸,因此不需要磷酸化的酪氨酸蛋白进行核易位和/或其基因的转录活性[13]。
除了磷酸化的酪氨酸蛋白,某些翻译后的修饰也可以影响STAT的功能(图1)。如磷酸化丝氨酸调节各种STAT的生命活动,包括DNA的结合功能,与其他辅助蛋白的相互作用等。所有的STATs都至少有一个丝氨酸残基被磷酸化,通常并没有发生酪氨酸蛋白的磷酸化,而众多的外部信号也可以诱导丝氨酸磷酸化。反过来,这些磷酸化的氨基酸又决定着上游激酶的特性,蛋白激酶MAPKs、细胞周期蛋白依赖的蛋白激酶和核因子-κB激酶抑制剂(IKK)都包括在其中[13,19]。体外研究证实,磷酸化丝氨酸对基因的转录至关重要,比如在T细胞中STAT4驱动IFN-γ[20],而体内实验显示,STAT4对免疫功能和造血系统产生影响[21]。
STATs的其他化学修饰主要包括乙酰化、甲基化和SUMO化(图1)[13],大致可分为促进STAT功能的修饰和限制STAT功能的修饰两类。赖氨酸的乙酰化和精氨酸的甲基化可以被归结在第一类中;前者通过影响二聚体化和转录活性促进STAT的功能,而后者可以抑制其与PIAS(Protein inhibitor of activated STAT)蛋白的相互作用,PIAS蛋白是STAT抑制剂类的分子。而这些研究结果所反映的生物学意义却是有争议的[22]。赖氨酸甲基化对STAT的功能是正调控或负调控目前还不清楚[23]。有证据表明,STAT1和STAT5的功能受SUMO化修饰的限制[24]。
另一个经典的观点认为STATs只有在细胞核内才具有活性。STAT3蛋白可以定位在线粒体上,促进氧化磷酸化和细胞膜的通透性(图1)。这种效果依赖于丝氨酸的磷酸化,与细胞内呼吸的改变有关,如细胞应激与肿瘤[25]。所有的其他STATs(STAT4除外)都已经在线粒体内检测到,但其在线粒体内的功能还没有明确[25]。
3 JAK/STAT信号通路在免疫和疾病中的作用
JAK/STAT信号通路从抵御感染到维持免疫耐受,加强屏障功能,抗肿瘤等方面都具有重要作用。错误的免疫反应可以对机体造成巨大的伤害,长期存在的JAK/STAT信号与各种类型的自身免疫性疾病密切相关。当机体需要免疫系统发挥作用或适当的缩减时,JAK/STAT通路必须高效诱导。
在鉴定出与JAK/STAT信号成分和相关的细胞因子/受体突变引起的单基因疾病后,JAK/STAT通路首先在体内作用表现明显,包括免疫缺陷、易感性、自身免疫性疾病等[26]。
单基因病的一个显著的例子是“泡沫男孩”综合征[X-连锁的重症联合免疫缺陷(Severe combined immunodeficiency disease,SCID)]。患者遭受极端的病原体易感性,这主要是由于患者的T细胞和NK细胞缺乏常见的γ-chain功能所致[27]。体外的研究结果显示,在普通的γ-chain信号转导的过程中,JAK3的作用具有选择性,部分SCID患者发生该激酶的突变并使其停靠下来,从而在体内水平上提供了任何JAK/STAT组件都没有冗余的现象[28,29]。在IL-7/IL-7R缺陷的人类和STAT5缺陷的小鼠体内已经证实了JAK3和STAT5轴参与类似的表型发生,但也需要注意到,STAT5b突变的人类不是免疫缺陷患者;相反,他们出现自身免疫性疾病在很大程度上是由于调节性T细胞的功能缺陷[26]。
自从JAK3-SCID发现以后,涉及到JAK/STAT元件的其他类型孟德尔疾病被大量发现。这些研究结果强调了JAK/STAT信号通路在抗感染和遗传易感性中的核心作用。事实上,遗传易感性是确定这些突变等位基因的关键。众所周知,STAT功能的丧失性突变与特定类型的病原体易感性相关。如STAT1突变的患者易发生分枝杆菌和病毒感染,STAT2突变的患者容易发生病毒感染,STAT3基因突变的患者容易发生真菌感染[30]。STAT1突变的患者也可以发生真菌感染;然而,在这种情况下,异常活跃的STAT1似乎限制了STAT3诱导的抗真菌感染的应答反应[26]。一般来说,STAT缺陷的表型反映在患者的上游/下游介导物质的突变;携带IL-10/IL-10R等位的功能基因突变的患者不易受真菌感染,但易发生炎症性肠病[26]。具有同型的STAT3突变的患者没有表现出临床症状,如高IgE综合征和发育畸形(即Job综合征),类似的现象在小鼠中很明显; IL-10和IL-10R缺乏易发生结肠炎,而携带有同型的STAT3等位基因的高IgE综合征患者却不发生结肠炎[31]。对STAT3基因功能获得性突变的患者的研究更加说明了这一信号通路在促进自身免疫性疾病中的重要作用。这类患者表现出一系列的临床症状,尤其是1型糖尿病,在小鼠中,STAT3能够诱导病理性炎症反应的发生[32]。
高通量测序技术促使全基因组水平的关联性研究(Genome-wide association study,GWASs)的大量出现,在受影响的人群中,疾病的表型与单核苷酸多态性(Single nucleotide polymorphism,SNPs)密切相关[33]。在多种常见的疾病中,GWASs与STAT基因的SNPs相关。例如STAT3基因的SNPs与克罗恩病、银屑病和强直性脊柱炎相关;STAT4基因的SNPs与类风湿关节炎、克罗恩病、系统性红斑狼疮和干燥综合征相关;STAT6基因的SNPs与哮喘相关[7,34]。研究发现,在JAKs上游的细胞因子/受体的SNPs数据支持其在这些疾病中的核心作用。
JAK/STAT信号转导与肿瘤发生之间的关系已成为肿瘤生物学的主线。众所周知,STAT的高活性可以驱动下游的经典致癌信号,如白血病融合基因(BCR-ABL)、Ras和肉瘤基因等的细胞转化现象[35,36]。这种高活性通常涉及STAT3和STAT5, STAT3和STAT5是大多数实体瘤和血液肿瘤的一个主要特征[35]。此外,JAK激酶本身的体细胞突变已被认为是主要的致癌病变因素。如JAK2功能的获得性突变是骨髓增生性肿瘤的基础[37]。在JAK激酶结构域发现了许多的突变。最近的研究证明,具有催化活性和限制JAKs 的“自激活”发生在受体的寡聚化之前[38]。研究发现,JAK2的融合蛋白也在血液系统的恶性肿瘤中发挥作用,血液系统的恶性肿瘤中也具有JAK3的突变[30,37]。尽管也有例外,某些STAT基因的突变体与肿瘤发生相关,这表明其致癌性主要是继发于上游事件。
4 结论
JAK/STAT信号通路研究为基础研究成功地转化为临床应用提供了依据,包括干细胞生物学及代谢方面的研究,加强了人们对疾病的了解,继而为靶向药物的开发提供信息。除此之外,JAK/STAT信号通路研究将继续提供关于细胞内通讯的自然特性和基因表达调控方面的线索,为进一步研究奠定了基础。
[1]Wang Y,Levy DE.Comparative evolutionary genomics of the STAT family of transcription factors[J].JAK-STAT,2012,1(1):23-33.
[2]Brooks AJ,Dai W,O′Mara ML,etal.Mechanism of activation of protein kinase JAK2 by the growth hormone receptor[J].Science,2014,344(6185):1249783.
[3]O′Shea JJ,Murray PJ.Cytokine signaling modules in inflammatory responses[J].Immunity,2008,28(4):477-487.
[4]Cho SS,Bacon CM,Sudarshan C,etal.Activation of STAT4 by IL-12 and IFN-alpha:evidence for the involvement of ligand-induced tyrosine and serine phosphorylation[J].J.Immunol,1996,157(11):4781-4789.
[5]Villarino A,Hibbert L,Lieberman L,etal.The IL-27R (WSX-1) is required to suppress T cell hyperactivity during infection[J].Immunity,2003,19(5):645-655.
[6]Seidel HM,Milocco LH,Lamb P,etal.Spacing of palindromic half sites as a determinant of selective STAT (signal transducers and activators of transcription) DNA binding and transcriptional activity[J].Proc Natl Acad Sci USA,1995,92(7):3041-3045.
[7]O′Shea JJ,Lahesmaa R,Vahedi G,etal.Genomic views of STAT function in CD4+T helper cell differentiation[J].Nat Rev Immunol,2011,11(4):239-250.
[8]Kanno Y,Vahedi G,Hirahara K,etal.Transcriptional and epigenetic control of T helper cell specification:molecular mechanisms underlying commitment and plasticity[J].Annu Rev Immunol,2012,30:707-731.
[9]Kang K,Robinson GW,Henniqhausen L.Comprehensive metaanalysis of Signal Transducers and Activators of Transcription (STAT) genomic binding patterns discerns cell-specific cis-regulatory modules[J].BMC Genomics,2013,14:4.
[10]Yang XP,Ghoreschi K,Steward-Tharp SM,etal.Opposing regulation of the locus encoding IL-17 through direct,reciprocal actions of STAT3 and STAT5[J].Nat Immunol,2011,12(3):247-254.
[11]Bezbradica JS,Rosenstein RK,DeMaeco RA,etal.A role for the ITAM signaling module in specifying cytokine-receptor functions[J].Nat Immunol,2014,15(4):333-342.
[12]Nagashima H,Okuyama Y,Asao A,etal.The adaptor TRAF5 limits the differentiation of inflammatory CD4(+) T cells by antagonizing signaling via the receptor for IL-6[J].Nat Immunol,2014,15(5):449-456.
[13]Stark GR,Darnell JE Jr.The JAK-STAT pathway at twenty[J].Immunity,2012,36(4):503-514.
[14]Begitt A,Droescher M,Meyer T,etal.STAT1-cooperative DNA binding distinguishes type 1 from type 2 interferon signaling[J].Nat Immunol,2014,15(2):168-176.
[15]Miyagi T,Gil MP,Wang X,etal.High basal STAT4 balanced by STAT1 induction to control type 1 interferon effects in natural killer cells[J].J Exp Med,2007,204(10):2383-2396.
[16]Zhang S,Fukuda S,Lee Y,etal.Essential role of signal transducer and activator of transcription (Stat)5a but not Stat5b for Flt3-dependent signaling[J].J Exp Med,2000,192(5):719-728.
[17]Gao X,Wang H,Yang JJ,etal.Pyruvate kinase M2 regulates gene transcription by acting as a protein kinase[J].Mol Cell,2012,45(5):598-609.
[18]Chen H,Sun H,You F,etal.Activation of STAT6 by STING is critical for antiviral innate immunity[J].Cell,2011,147(2):436-446.
[19]Bancerek J,Poss ZC,Steinparzer I,etal.CDK8 kinase phosphorylates transcription factor STAT1 to selectively regulate the interferon response[J].Immunity,2013,38(2):250-262.
[20]Morinobu A,Gadina M,Strober W,etal.STAT4 serine phosphorylation is critical for IL-12-induced IFN-gamma production but not for cell proliferation[J].Proc Natl Acad Sci USA,2002,99(19):12281-12286.
[21]Friedbichler K,Kerenyi MA,Kovacic B,etal.Stat5a serine 725 and 779 phosphorylation is a prerequisite for hematopoietic transformation[J].Blood,2010,116(9):1548-1558.
[22]O′Shea JJ,Kanno Y,Chen X,etal.Cell signaling.Stat acetylation-a key facet of cytokine signaling? [J].Science,2005,307(5707):217-218.
[23]Yang J,Huang J,Dasgupta M,etal.Reversible methylation of promoter-bound STAT3 by histone-modifying enzymes[J].Proc Natl Acad Sci USA,2010,107(50):21499- 21504.
[24]Van Nguyen T,Angkasekwinai P,Dou H,etal.SUMO-specific protease 1 is critical for early lymphoid development through regulation of STAT5 activation[J].Mol Cell,2012,45(2):210-221.
[25]Meier JA,Larner AC.Toward a new STATe:the role of STATs in mitochondrial function[J].Semin Immunol,2014,26(1):20-28.
[26]Casanova JL,Holland SM,Notarangelo LD.Inborn errors of human JAKS and STATs[J].Immunity,2012,36(4):515-528.
[27]Noguchi M,Yi H,Rosenblatt HM,etal.Interleukin-2 receptor gamma chain mutation results in X-linked severe combined immunodeficiency in humans[J].Cell,1993,73(1):147-157.
[28]Macchi P,Villa A,Giliani S,etal.Mutations of Jak-3 gene in patients with autosomal severe combined immune deficiency (SCID)[J].Nature,1995,377(6544):65-68.
[29]Russell SM,Tayebi N,Nakajima H,etal.Mutation of Jak3 in a patient with SCID:essential role of Jak3 in lymphoid development[J].Science,1995,270(5237):797-800.
[30]O′Shea JJ,Holland SM,Staudt LM.JAKS and STATs in immunity,immunodeficiency,and cancer[J].N Engl J Med,2013,368(2):161-170.
[31]Steward-Tharp SM,Laurence A,Kanno Y,etal.A mouse model of HIES reveals pro- and anti-inflammatory functions of STAT3[J].Blood,2014,123(19):2978-2987.
[32]Flanagan SE,Haapaniemi E,Russell MA,etal.Activating germline mutations in STAT3 cause early-onset multi-organ autoimmune disease[J].Nat Genet,2014,46(8):812-814.
[33]Manolio TA.Bringing genome-wide association findings into clinical use[J].Nat Rev Genet,2013,14(8):549-558.
[34]Vercelli D.Discovering susceptibility genes for asthma and allergy[J].Nat Rev Immunol,2008,8(3):169-182.
[35]Bromberg J.Stat proteins and oncogenesis[J].J Clin Invest,2002,109(9):1139-1142.
[36]Yu H,Pardoll D,Jove R.STATs in cancer inflammation and immunity:a leading role for STAT3[J].Nat Rev Cancer,2009,9(11):798-809.
[37]Levine RL,Pardanani A,Tefferi A,etal.Role of JAK2 in the pathogenesis and therapy of myeloproliferative disorders[J].Nat Rev Cancer,2007,7(9):673-683.
[38]Ungureanu D,Wu J,Pekkala T,etal.The pseudokinase domain of JAK2 is a dual-specificity protein kinase that negatively regulates cytokine signaling[J].Nat Struct Mol Biol,2011,18(9):971-976.
[收稿2015-11-04修回2015-11-30]
(编辑倪鹏)
10.3969/j.issn.1000-484X.2016.09.035
潘志鹏(1990年-),女,硕士,主要从事感染性疾病的分子生物学方面研究,E-mail:panzp0109@163.com。
及指导教师:伦永志(1973年-),男,博士,副教授,硕士生导师,主要从事感染性疾病的分子生物学方面研究,E-mail:lunyz@163.com。
R392.11
A
1000-484X(2016)09-1395-05
①大连大学医学院医学检验系,大连116622。

