Cyclopamine在佐剂性关节炎大鼠肾脏损伤中的保护作用及机制研究①
宋先兵 刘梅梅 安 梅 方安宁 陈晓宇 张俊强
(安徽医学高等专科学校人体解剖教研室,合肥230601)
Cyclopamine在佐剂性关节炎大鼠肾脏损伤中的保护作用及机制研究①
宋先兵刘梅梅安梅方安宁陈晓宇②张俊强②
(安徽医学高等专科学校人体解剖教研室,合肥230601)
目的:观察佐剂性关节炎(AA) 大鼠Hedgehog信号通路活化,并探讨Cyclopamine对大鼠关节炎症及肾脏损伤的影响。方法:将40只大鼠随机分为空白组、Cyclopamine组、AA+Cyclopamine组、AA模型组。采用弗氏完全佐剂建立AA大鼠模型,使用Cyclopamine腹腔注射,并通过测量足爪肿胀、全身炎症反应及关节炎症评分的方法进行半定量评价。HE染色检测各组大鼠肾脏病理改变,Western blot检测各组大鼠肾脏Gli1蛋白表达水平,免疫组织化学法染色检测各组大鼠肾脏TNF-α、IFN-γ、IL-6表达。结果:使用Cyclopamine后,能够明显降低AA大鼠足爪肿胀度和改善AA大鼠的关节炎指。与对照组相比,AA模型组大鼠Cr、BUN和脏器系数出现明显升高改变,差异有统计学意义,同时肾脏电镜病理检测发现AA模型组大鼠出现明显的病理改变,AA大鼠使用抑制剂Cyclopamine后能够明显降低肌酐(Cr)、尿素氮(BUN)和脏器系数改变。Western blot检测各组肾脏组织中Gli1的蛋白表达,发现对照组与Cyclopamine组相比Gli1蛋白表达无明显差异,AA模型组及AA+Cyclopamine组Gli1蛋白表达量明显高于对照组,差异有统计学意义,AA+Cyclopamine组与AA模型组相比,Gli1蛋白表达水平明显有下降趋势,差异有统计学意义;免疫组化法检测肾脏组织中促炎因子TNF-α、IFN-γ、IL-6表达改变情况并进行半定量评分,与空白组相比,AA模型组及AA+Cyclopamine组肾脏TNF-α、IFN-γ表达明显升高,且使用Cyclopamine后,AA大鼠肾脏TNF-α、IFN-γ表达显著降低,AA模型组肾脏IL-6表达较对照组明显升高。结论:Cyclopamine能够明显改善AA大鼠的关节炎症和肾脏损伤程度,在此过程中Hh通路处于活化状态,并诱导炎性因子表达改变。
佐剂性关节炎; Hedgehog;肾脏损伤
类风湿关节炎(Rheumatic arthritis,RA)是一种慢性、系统性炎症性自身免疫病。其特征性的症状为对称性、多个周围性关节的慢性炎症病变,临床表现主要为受累关节疼痛、肿胀、功能下降,病变呈持续、反复发作的过程。其病理改变主要为慢性滑膜炎,侵及下层的软骨和骨,造成关节破坏[1,2]。RA在我国人群发病率约0.5%,是导致人群丧失劳动力和致残的重要原因之一[3]。目前大多数研究以RA的骨质破坏机制为主,尽管骨和关节的破坏是RA的主要病理特点和临床表现,但对于患病期较长RA患者,多系统器官的损害是一个不容忽视的问题。因此对于RA伴其他脏器受累的机制研究具有十分重要的临床意义。
Hedgehog (Hh)信号通路是一条进化保守的信号通路,在从低等动物(果蝇)到高等动物(人类)中普遍存在。既往的Hh通路研究主要集中在胚胎期调节组织分化、肿瘤形成机制[4,5],近年来有研究发现骨关节炎患者和模型小鼠均存在关节软骨细胞Hh信号通路的明显激活,会促进炎症细胞的损伤作用,加重骨关节炎的软骨破坏程度;当用基因沉默或特异性阻断剂抑制Hh通路后,能明显缓解骨关节炎病情的严重程度[6],该研究工作为骨关节疾病的防治提供了新的思路。Gli1作为经典的Hh信号通路中最重要的转录因子之一,在人类胚胎发育过程中处于高度活化状态而精确调控细胞增殖和组织分化、器官形成、维持组织极性,机体发育成熟后Gli1在成年组织和细胞中一般很少表达,但当Gli1发生异常激活时,常会导致肾脏慢性纤维化疾病的发生[7]。环巴明(Cyclopamine)是Hh通路的抑制剂[8],通过与Hh信号通路中的Smo蛋白结合,影响Smo蛋白下游信号的传导,减少α-SMA和Col11的表达,从而减弱甚至阻止HSC的这种变化。因此本研究拟使用佐剂性关节炎(Adjuvant arthritis,AA)大鼠模型,通过使用Hh信号通路阻断剂Cyclopamine,初步探讨AA大鼠Hh通路活化情况,并研究Hh信号通路在AA大鼠肾脏损伤中的作用,为RA的发病机制提供新的科学依据。
1 材料与方法
1.1材料
1.1.1实验动物40只雄性Sprague-Dawley(SD)大鼠,体质量140~160 g,安徽省实验动物中心提供,动物饲养于安徽医科大学实验动物中心SPF级动物房,每笼5只,给予实验动物中心配置的标准消毒饲料,放置消毒自来水自由饮用。
1.1.2仪器与试剂卡介苗 (北京生物制品所),Cyclopamine(美国Santa Cruz公司),总蛋白抽提液(上海普飞生物公司),硝酸纤维素膜(英国Whatman公司),显影液、定影液、胶片(美国柯达公司),Gli1抗体(美国 Santa Cruz 公司),TNF-α、IFN-γ、IL-6抗体(北京博奥森生物公司),二抗(美国Cell Signaling Technology 公司),BUN、Cr生化试剂盒(南京建成生物公司),LeicaRMZ135型石蜡切片机(德国徕卡公司),Elx-800 型酶标仪(美国Bio-Tek仪器公司);KS-TB 型足趾容积测量仪(济南益延科技发展有限公司) 。
1.2方法
1.2.1动物分组及AA模型制备在温度为20℃、相对湿度为62%的SPF级动物房中适应性饲养1周后,将40只SD大鼠随机分为空白组(n=8),Cyclopamine组(n=8),AA +Cyclopamine组(n=12),AA模型组(n=12)。模型制备方法参考文献报道成熟方法[9],具体步骤如下:将 BCG 80℃水浴灭活1 h,与高压灭菌的石蜡充分研磨、混匀,制成10 mg/ml弗氏完全佐剂(Freund complete adjuvant,FCA),造模第1天,AA+Cyclopamine组,AA模型组每只大鼠于右后足爪皮内注射 FCA 0.1 ml致炎。Cyclopamine组,AA +Cyclopamine组于第12天、第15天、第18天腹腔注射Cyclopamine 3次[10],注射剂量为10 mg/kg,空白组用生理盐水同法注射。
1.2.2佐剂性关节炎大鼠模型的评价
1.2.2.1全身评分从大鼠关节炎症出现后,每3 d进行全身表现评分,评分标准包括:(1)耳:0分,无结节和发红症状;1分,一只耳朵结节和发红症状;2分,两只耳朵结节和发红症状;(2)鼻:0分,无结缔组织肿胀;1分,明显结缔组织肿胀;(3)尾:0分,无结节;1分,有结节;(4)前足爪:0分,无肿胀;1分,一个前足爪肿胀,2分,两个前足爪肿胀;(5)后足爪:0分,无肿胀,1分,一个后足爪肿胀,2分,两个后足爪肿胀。每只大鼠最多评8分[11]。
1.2.2.2关节炎指数从大鼠关节炎症出现后,每隔3 d进行关节炎指数评分,观察每组大鼠的继发病变。每只足爪的关节炎指数评分标准:0分,正常;1分,踝关节出现红斑和轻微肿胀;2分,踝关节到跖关节或掌关节红斑和轻微肿胀; 3分,踝关节到跖趾关节或掌关节出现红斑和中度肿胀;4分,踝关节到趾关节出现红斑和重度肿胀。每只大鼠最多评12分[9]。
1.2.2.3足爪肿胀度测定致炎前用足容积测量仪测量每个大鼠左后足(非致炎侧) 容积,从炎症出现后,每隔3 d测量左后足容积,求出继发侧足爪肿胀度(Δml =︱注射后的足爪容积- 注射前的足爪容积︱)[9]。
1.2.3动物标本采集各组大鼠模型建立第24天麻醉处理,经腹主动脉取血,血清采集使用非抗凝5 ml采血管,静置充分凝固后,4 000 r/min,10 min离心分离血清,-80℃保存,取血后大鼠颈椎脱臼法处死,迅速摘取双侧肾脏,使用冷生理盐水冲洗后用滤纸吸干,称重。取不同组别同一侧边同一位置少量肾脏放入4%甲醛溶液,制成蜡块,制作5 μm石蜡切片,进行免疫组织化学方法检查,取米粒样大小于戊二醛固定液中,供电镜检测使用,同时取同一侧同一位置少量肾脏,-80℃保存留作Western blot检测。
1.2.4透射电子显微镜观察肾组织超微结构的变化1 mm3大小的肾组织在2.5%的戊二醛中于4℃条件下固定,脱水包埋,超薄切片机下0.5 nm切片,透射电子显微镜下观察并拍照。
1.2.5大鼠肾脏系数定义小鼠肾脏系数=小鼠肾脏湿重/小鼠体重。
1.2.6大鼠肾脏功能检测取各组大鼠血清样本,脲酶法检测肌酐(Cr)和尿素氮(BUN),操作步骤参照试剂说明书进行。
1.2.7Gli1蛋白表达检测使用Westren blot法检测肾脏组织中Gli1蛋白表达,肾脏组织提取总蛋白,于沸水中煮10 min使蛋白变性,SDS-PAGE凝胶电泳,蛋白条带半干电转移到PVDF膜上。室温下用TBS(100 mmol/L Tris-HCl,0.9%NaCl,0.1%吐温-20)阻断1 h,分别与一抗和IgG-HRP二抗孵育后,以ECL增强化学发光法检测。每个样本重复测定3次。
1.2.8肾脏组织TNF-α、IFN-γ、IL-6表达检测肾脏组织TNF-α、IFN-γ、IL-6细胞因子的表达采用免疫组化SP法进行检测。取制好的5 μm石蜡切片,参照试剂盒说明书进行实验,一抗浓度稀释至1∶300孵育,过夜,二抗孵育30 min,DAB染色,光镜下观察评分。IHC评定方法:对每张切片随机选取5个视野下的阳性结果进行评分,取平均值,然后求得每个剂量组的平均评分。结果判定标准如下:0分(阳性细胞数<5%),1分(6%<阳性细胞数<25%),2分(26%<阳性细胞数<50%),3分(51%<阳性细胞数<75%),4分(阳性细胞数>76%);染色强度:0分(染色阴性或微弱的黄色),1分(淡黄色),2分(棕黄色),3分(棕褐色);两者相加即为组织切片的最后综合评分。所有切片由2位病理医生分开观察并评分[12]。

2 结果
2.1各组大鼠足爪肿胀及肿胀度改变大鼠在注射FCA后,每3 d测量1次对侧(左后)足爪容积并计算足爪肿胀度,于第9天开始,AA模型组和AA+Cyclopamine组与对照组相比,肿胀度逐渐增高,同时Cyclopamine组与空白组相比,足爪肿胀度无明显改变,差异无统计学意义(P>0.05);AA模型组足爪肿胀度升高明显,且随着病程的延长,肿胀度逐渐升高,24 d处死时,足爪肿胀仍然明显;AA+Cyclopamine组于第12天、第15天、第18天连续注射抑制剂Cyclopamine,监测发现足爪肿胀度增长趋势在第15天有明显改善的趋势,与AA模型组比较有明显改善,差异有统计学意义(P<0.05),如图1。
2.2AA大鼠关节炎指数评分改变对AA模型组和AA+Cyclopamine组大鼠进行半定量法进行全身和关节指数评分,发现使用Cyclopamine处理后,关节炎全身评分及关节指数评分都较AA模型组有所下降,经非参数秩和检验分析,21 d和24 d AA+Cyclopamine组全身评分明显低于AA模型组,差异有统计学意义(P<0.05),如图2A;24 d AA+Cyclopamine组关节明显低于AA模型组,差异有统计学意义(P<0.05),如图2B。结果表明Cyclopa-mine对大鼠AA有一定抑制作用。
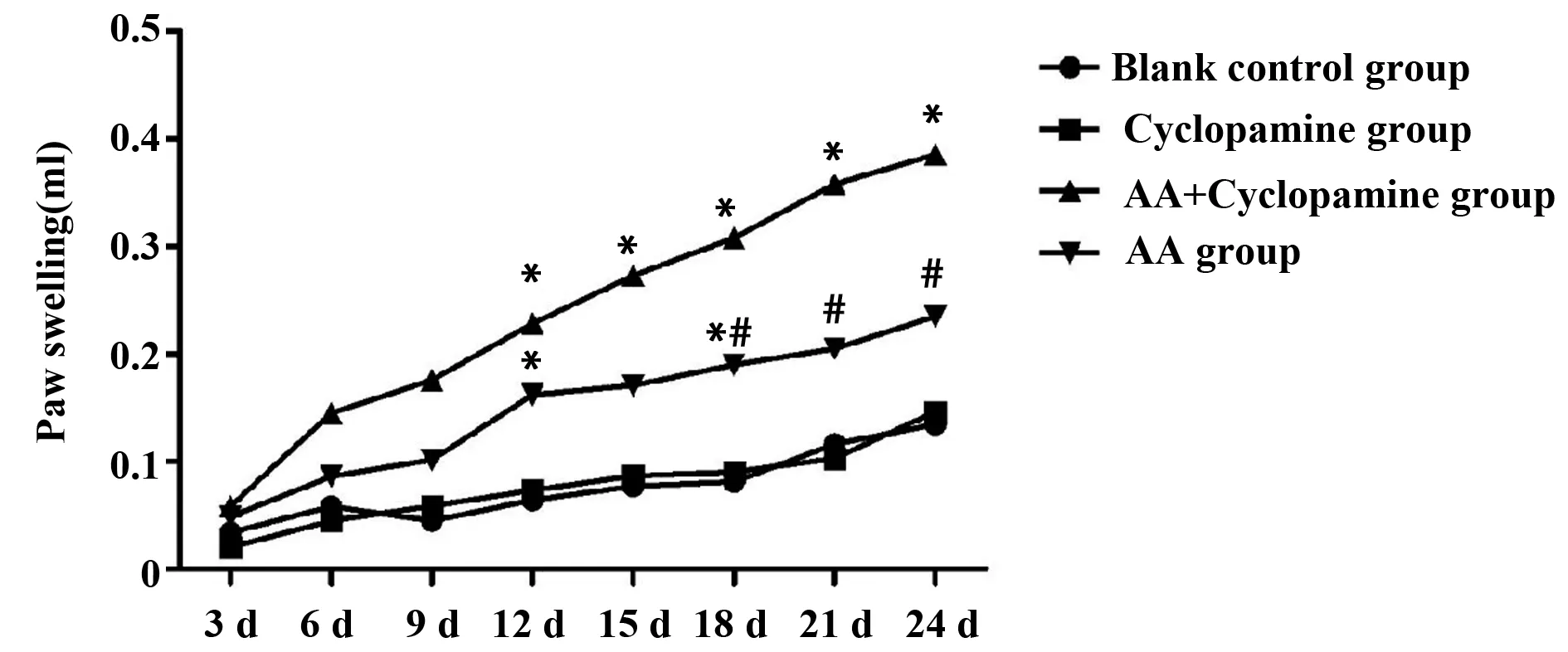
图1 各组大鼠足爪肿胀度变化Fig.1 Paw swelling change of rats in each groupNote: *.P<0.05,compared with the control group;#.P<0.05,compared with the AA model group.
2.3各组大鼠肾功能及脏器系数检测结果对照组与Cyclopamine组Cr、BUN含量比较未发现明显差异(P>0.05)。与空白组相比,AA模型组Cr、BUN含量均升高,且差异有统计学意义(P<0.05),AA +Cyclopamine组Cr、BUN含量与AA模型组相比,均有明显下降,且差异有统计学意义(P<0.05),见表1。
肾脏脏器系数检查结果如表1所示,对照组与Cyclopamine组比较未发现明显差异(P>0.05)。与空白组相比,AA模型组脏器系数明显升高,且差异有统计学意义(P<0.05),AA +Cyclopamine组脏器系数与模型组相比明显下降,且差异有统计学意义(P<0.05)。
2.4各组大鼠肾脏电镜检查结果各组佐剂性大鼠肾脏组织病理图片如图3所示,对照组和Cyclopamine组电镜下无明显改变,AA模型组大鼠肾脏均出现不同程度的损伤现象,镜下可见足细胞融合、脊柱断裂,足细胞线粒体空泡样变性,粗面内质网扩张,基底膜增厚或溶解,有大量的电子致密物沉积,AA+Cyclopamine组肾脏损伤较模型组及模型溶剂组明显减轻,有少量电子致密物沉积。
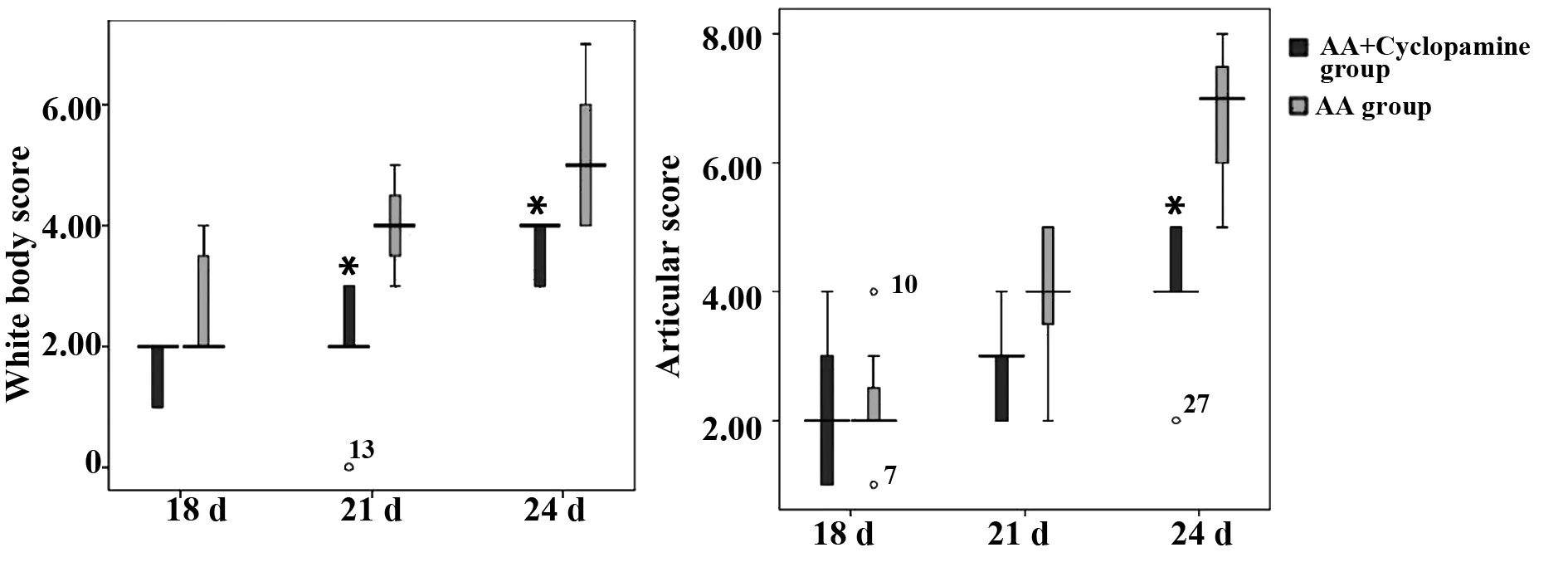
图2 AA大鼠全身和关节评分指数Fig.2 Whole body and articular score index of AA ratsNote: *.P<0.05(AA+Cyclopamine compare to AA model group with nonparametric rank sum test).
表1各组大鼠肾功能及脏器系数检测结果(n=10)
Tab.1Results rats renal function and organ coeffic-ient test(n=10)

GroupsCr(μmol/L)BUN(mmol/L)Organcoefficient(%)Blankcontrolgroup91.20±13.168.76±0.770.73±0.09Cyclopaminegroup95.95±11.488.48±0.600.80±0.05AA+Cyclopaminegroup115.08±19.001)2)9.82±0.722)0.82±0.042)AAgroup251.60±29.501)10.47±0.591)0.98±0.111)
Note:1)P<0.05,compared with the control group;2)P<0.05,compared with the AA model group.
2.5各组大鼠肾脏Gli1表达Western blot实验结果显示,对照组与Cyclopamine组相比Gli1蛋白表达无明显差异,差异无统计学意义(P>0.05);AA模型组及AA+Cyclopamine组Gli1蛋白表达量明显高于对照组,差异有统计学意义(P<0.05);AA+Cyclopamine组与AA模型组相比,Gli1蛋白表达水平明显有下降趋势,差异有统计学意义(P<0.05),见图4。
2.6各组大鼠肾组织炎性细胞因子表达使用免疫组化技术,检测肾脏组织中促炎因子TNF-α、IFN-γ、IL-6表达改变情况并进行半定量评分,研究发现,评分经非参数秩和检验发现各组大鼠肾脏组织TNF-α、IFN-γ、IL-6表达有明显差异(P<0.05),进一步使用非参数秩和检验两两比较(α=0.008 3),AA模型组及AA+Cyclopamine组肾脏TNF-α、IFN-γ表达较对照组明显升高,且使用Cyclopamine后,AA大鼠肾脏TNF-α、IFN-γ表达显著降低,差异有统计学意义(P<0.008 3),见图5、6;AA模型组肾脏IL-6表达较对照组明显升高,差异有统计学意义(P<0.008 3),见图7。
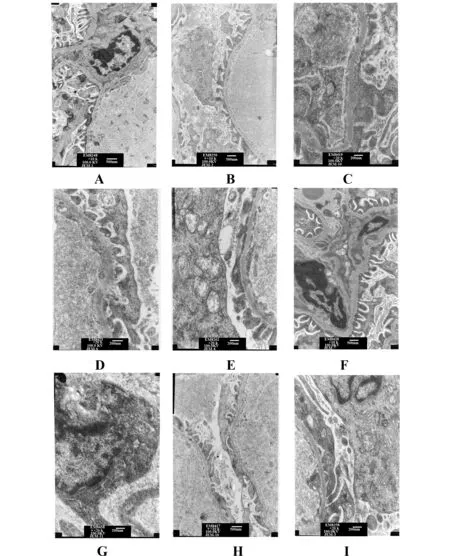
图3 各组大鼠肾脏电镜检查结果Fig.3 Renal TEM observation in each groupNote: A.Blank control group;B and C.There was no significant change;D,E and F.AA model group:different change of podocyte fusion,spinal fracture,mitochondrial vacuolar degeneration of podocytes,slightly dilated rough endoplasmic reticulum,basement membrane thickening or dissolved,a large number of electron dense deposits;G,H and I.AA+Cyclopamin group:a bit of electron dense deposits.
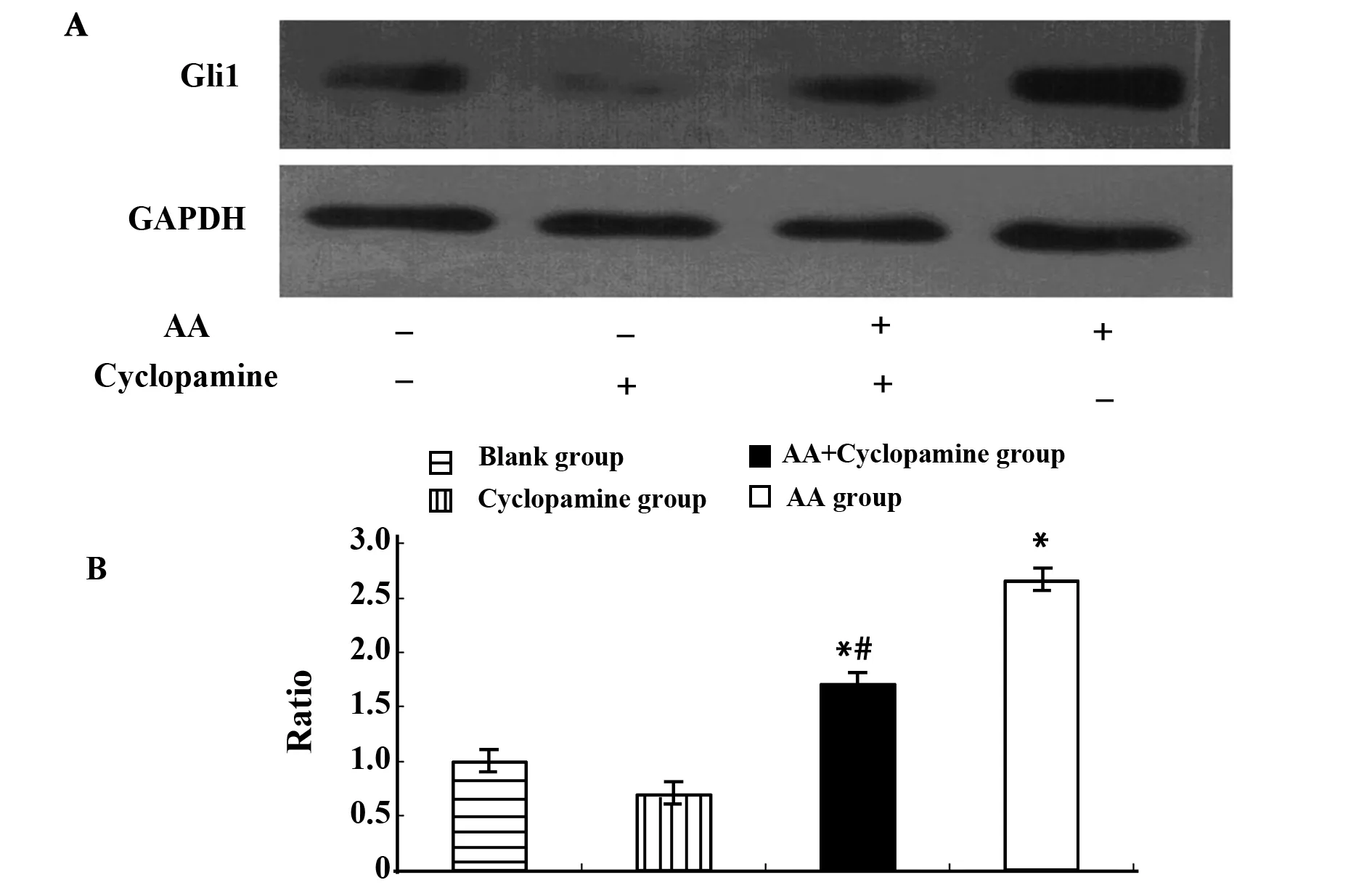
图4 各组大鼠肾脏Gli1蛋白表达Fig.4 Expression of kidney Gli1 protein in each groupNote: *.P<0.05,compared with the control group;#.P<0.05,compared with the AA model group.
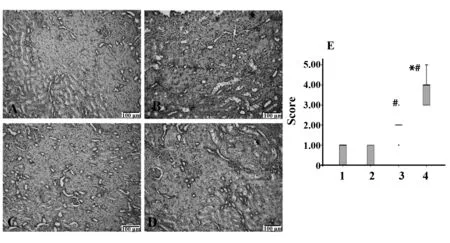
图5 各组大鼠肾脏TNF-α表达Fig.5 TNF-α expression of rats kidney in each groupNote: A.Blank control group;B.Cyclopamine group;C.AA+Cyclopamine group;D.AA model group;E.The picture shows the corresponding cytokine expression score.1.Blank group;2.Cyclopamine group;3.AA+Cyclopamine group;4.AA group.*.P<0.05,compared with the control group;#.P<0.05,compared with the AA model group(DAB staining,the positive expression is brown.200 folds).
3 讨论
RA是一种由于滑膜组织的炎症和增殖造成的慢性关节功能障碍引起的骨骼及软骨破坏的自身免疫性疾病[13],目前RA的发病机制尚不明确,临床缺少特异性的治疗方法。上世纪50年代细菌学家Fruend创立了佐剂性关节炎(Adjuvant arthritis,AA),又名弗氏佐剂关节炎,与RA在临床表现、病理学、免疫学特征等方面有着相似的特点,是探讨RA病理机制的经典动物模型[14],本实验中采用弗氏完全佐剂诱导SD大鼠,成功地建立了佐剂性关节炎大鼠模型。
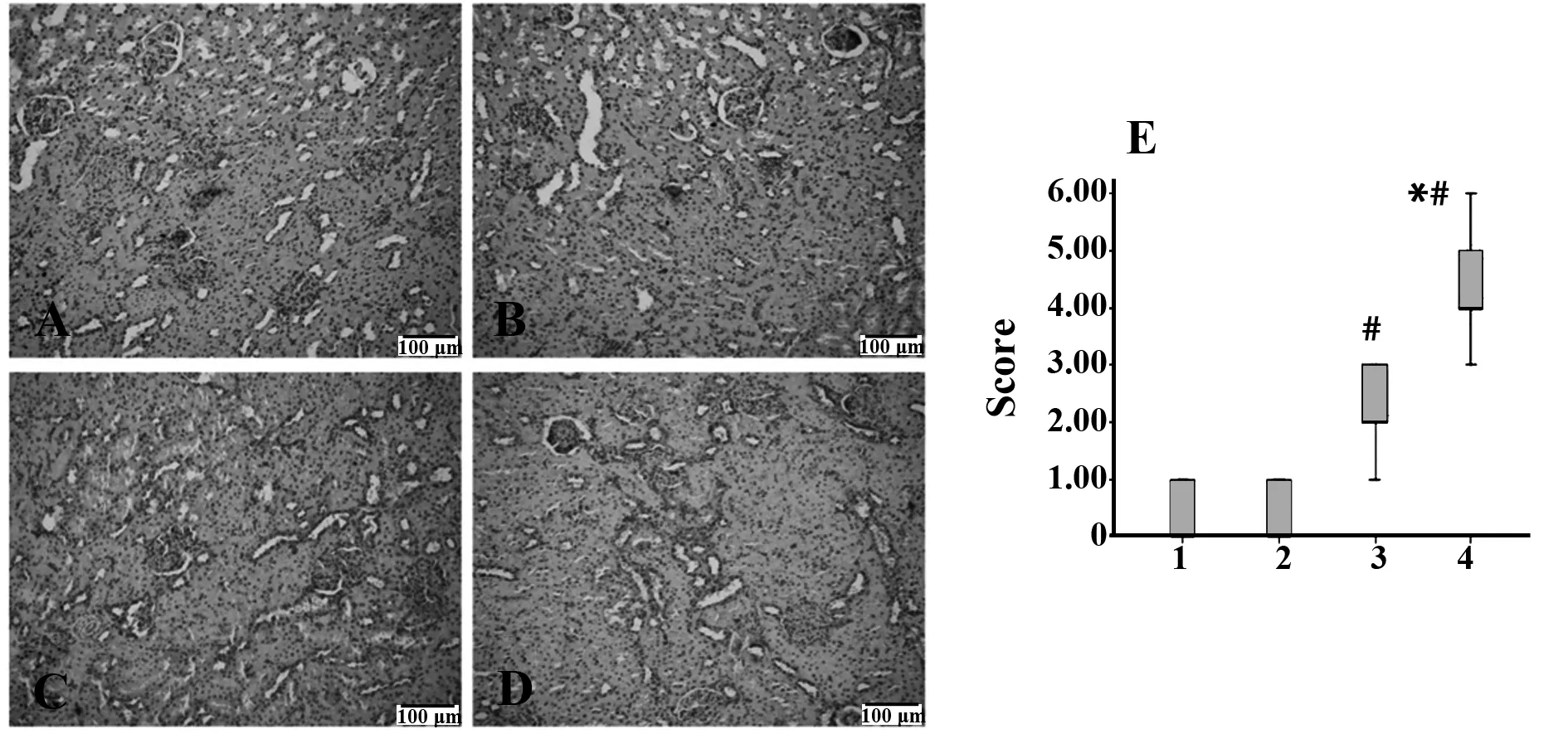
图6 各组大鼠肾脏IFN-γ表达Fig.6 IFN-γ expression of rats kidney in each groupNote: A.Blank control group;B.Cyclopamine group;C.AA+Cyclopamine group;D.AA model group;E.The picture shows the corresponding cytokine expression score.1.Blank group;2.Cyclopamine group;3.AA+Cyclopamine group;4.AA group.*.P<0.05,compared with the control group;#.P<0.05,compared with the AA model group(DAB staining,the positive expression is brown.200 folds).
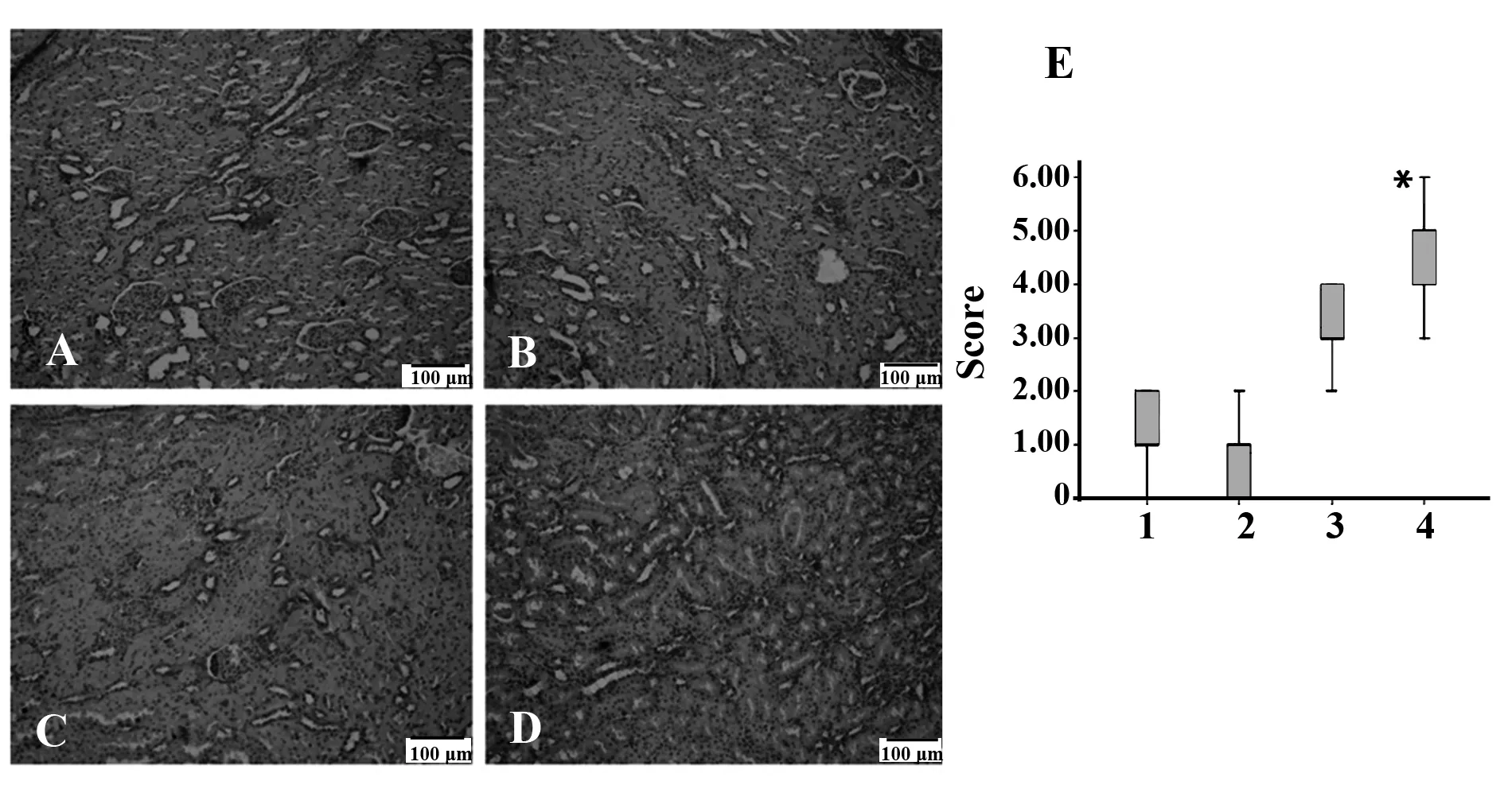
图7 各组大鼠肾脏IL-6表达Fig.7 IL-6 expression of rats kidney in each groupNote: A.Blank control group;B.Cyclopamine group;C.AA+Cyclopamine group;D.AA model group;E.The picture shows the corresponding cytokine expression score.1.Blank group;2.Cyclopamine group;3.AA+Cyclopamine group;4.AA group.*.P<0.05,compared with the control group;#.P<0.05,compared with the AA model group(DAB staining,the positive expression is brown.200 folds).
尽管骨和关节的破坏是RA的主要病理特点和临床表现,但对于RA患者,特别是患病期较长者,多系统器官的损害是一个不容忽视的问题,临床上RA通常合并肾脏的损伤性病变[15],其发病机理尚不清楚。有研究发现活化的Hedgehog信号通路参与了多种肾脏疾病的进展过程[16]。
哺乳动物的Hedgehog (Hh)信号通路包括四个组分:Hh 信号分子(Shh、Dhh、Ihh)、跨膜受体(Ptch、Smo)、核转录因子Glis家族和下游靶基因。生理情况下,Hh水平很低、无活性时,Ptch 直接与Smo相互作用,抑制Smo活性,阻止Hh信号传递,抑制炎性细胞等增殖;而当病理情况下,Hh蛋白与Ptch结合后,能解除Ptch对Smo的抑制,Smo的抑制效应解除后,便可激活下游的转录因子Gli,促进下游靶基因的转录与表达[17],促进炎症细胞的增殖,炎性因子分泌增加。
有研究发现TNF-α参与了炎症或肿瘤引起的骨质丢失[18],而采用TNF-α抑制剂可以减轻RA患者炎症反应[19]。IL-6是介导滑膜炎症的重要促炎细胞因子,IL-6受体拮抗剂用于RA患者可有效减少骨转换、保护骨组织[20]。因此细胞因子的表达异常及其相互作用可能在RA炎症、黏附、骨质减少和新生血管形成等方面发挥重要作用,是RA炎症和关节损伤的重要介质[21]。
本次研究成功建立了AA大鼠模型,并使用Hh信号通路抑制剂Cyclopamine观察AA大鼠关节炎症及肾脏损伤。研究结果发现使用Cyclopamine后,能够明显降低AA大鼠足爪肿胀度,与AA模型组相比具有统计学差异,同时使用半定量AA大鼠关节炎指数全身评分和关节评分,发现抑制剂Cyclopamine能够明显改善AA大鼠的关节炎指数,对其关节炎病变具有一定的保护作用。这与丁婧等[21]的研究结果相一致。临床上RA通常合并肾脏的损伤性病变,前期有研究发现AA大鼠的肾脏损伤,但其机制尚不清楚,本次研究发现AA模型组大鼠Cr、BUN和脏器系数出现明显的升高改变,差异有统计学意义,同时肾电镜检查结果发现AA模型组大鼠出现明显的病理改变;但AA大鼠使用抑制剂Cyclopamine后能够明显的降低Cr、BUN和脏器系数改变,并能明显减轻肾脏病理改变。为进一步探讨Cyclopamine减缓AA大鼠关节炎症及肾脏损伤的发生机制,本研究使用Western blot检测各组肾脏组织中Gli1的蛋白表达,发现对照组与Cyclopamine组相比Gli1蛋白表达无明显差异,AA模型组及AA+Cyclopamine组Gli1蛋白表达量明显高于对照组,差异有统计学意义,AA+Cyclopamine组与AA模型组相比,Gli1蛋白表达水平明显有下降趋势,差异有统计学意义;为进一步研究肾脏损伤的发生机制,我们使用免疫组化技术,检测肾脏组织中促炎因子TNF-α、IFN-γ、IL-6表达改变情况并进行半定量评分,研究发现各组大鼠肾脏组织TNF-α、IFN-γ、IL-6表达有明显差异,AA模型组肾脏TNF-α、IFN-γ表达较对照组明显升高,且使用Cyclopamine后,AA大鼠肾脏TNF-α、IFN-γ表达显著降低;AA模型组肾脏IL-6表达较对照组明显升高。本研究结果表明Cyclopamine可能通过抑制炎性因子的表达而改善AA大鼠的炎性损伤。
本实验采用弗氏完全佐剂成功建立了AA大鼠模型,使用Hh通路抑制剂Cyclopamine能够明显改善AA大鼠的关节炎症和肾脏损伤程度。研究结果为进一步治疗RA提供了理论依据,具有潜在的应用前景。
[1]Scott DL,Wolfe F,Huizinga TW.Rheumatoid arthritis[J].Lancet,2010,376(9746):1094-1108.
[2]McInnes IB,Schett G.The pathogenesis of rheumatoid arthritis[J].N Engl J Med,2011,365(23):2205-2219.
[3]温博,曾升平.类风湿关节炎的研究进展[J].世界中西医结合杂志,2014,9(9):1014-1016.
[4]Justilien V,Fields AP.Molecular pathways:novel approaches for improved therapeutic targeting of hedgehog signaling in cancer stem cells [J].Clin Cancer Res,2015,21(3):505-513.
[5]Long AB,Kaiser WJ,Mocarski ES,etal.Apaf1 apoptotic function critically limits Sonic hedgehog signaling during craniofacial development [J].Cell Death Differ,2013,20(11):1510-1520.
[6]Lin AC,Seeto BL,Bartoszko JM,etal.Modulating hedgehog signaling can attenuate the severity of osteoarthritis [J].Nat Med,2009,15(12):1421-1425.
[7]Fabian SL,Penchev RR,St-Jacques B,etal.Hedgehog-Gli pathway activation during kidney fibrosis[J].Am J Pathol,2012,180(4):1441-1453.
[8]李培培,解国雄,宋珊珊,等.大鼠佐剂性关节炎模型表现特征及评价指标[J].中国免疫学杂志,2012,28(5):453-457.
[9]郭小华,刘鹰翔.Hedgehog 信号传导途径抑制剂的研究发展[J].中国药物化学杂志, 2010,20(5):414-425.
[10]Li R,Cai L,Ding J,etal.Inhibition of hedgehog signal pathway by cyclopamine attenuates inflammation and articular cartilage damage in rats with adjuvant-induced arthritis[J].J Pharm Pharmacol,2015,67(7):963-971.
[11]Wang D,Chang Y,Wei W,etal.Therapeutic effects of TACI-Ig on rat with adjuvant arthritis[J].Clin Exp Immunol,2011,163(2):225-234.
[12]李树龙,俞韵,王慧,等.经水摄入三氯乙烯对 BALB/c小鼠干扰素-γ和白细胞介素-4的影响[J].中国科技论文,2014,9(9):1049-1051,1053.
[13]Wang XH,Jiang SM,Sun QW.Effects of berberine on human rheumatoid arthritis fibroblast-like synoviocytes[J].Exp Biol Med,2011,236:859-866.
[14]Chen XY,Wang ZC,Li J,etal.Regulation of synoviocyte activity by resveratrol in rats with adjuvant arthritis[J].Exp Ther Med,2013,6(1):172-176.
[15]Chiu HY,Huang HL,Li CH,etal.Increased risk of chronic kidney disease in rheumatoid arthritis associated with cardiovascular complications-A national population-based cohort study[J].PLoS One,2015,10(9):e0136508.
[16]Cain JE,Rosenblum ND.Control of mammalian kidney development by the Hedgehog signaling pathway[J].Pediatric Nephrol,2011,26(9):1365-1371.
[17]Pasca di Magliano M,Hebrok M.Hedgehog signalling in cancer formation and maintenance [J].Nat Rev Cancer,2003,3(12):903-911.
[18]Osta B,Benedetti G,Miossec P.Classical and paradoxical effects of TNF-alpha on bone homeostasis [J].Front Immunol,2014,5(48):1-7.
[19]Scott DL,Kingsley GH.Tumor necrosis factor inhibitors for rheumatoid arthritis [J].New Engl J Med,2006,355(7):704-712.
[20]Karsdal MA,Schett G,Emery P,etal.IL-6 receptor inhibition positively modulates bone balance in rheumatoid arthritis patients with an inadequate response to anti-tumor necrosis factor therapy:biochemical marker analysis of bone metabolism in the tocilizumab RADIATE study (NCT00106522) [J].Semin Arthritis Rheum,2012,42(2):131-139.
[21]Jung SM,Kim KW,Yang CW,etal.Cytokine-mediated bone destruction in rheumatoid arthritis [J].J Immunol Res,2014.doi.org/10.1155/2014/263625.
[21]丁婧,李荣,胡向阳,等.环巴胺对佐剂性关节炎大鼠关节软骨细胞增殖凋亡的影响及其抗凋亡机制[J].安徽医科大学学报,2015,50(4):446-451.
[收稿2015-10-05修回2015-11-11]
(编辑张晓舟)
Protective effects of Cyclopamine in adjuvant arthritis rats kidney injury and mechanism research
SONG Xian-Bing,LIU Mei-Mei,AN Mei,FANG An-Ning,CHEN Xiao-Yu,ZHANG Jun-Qiang.
Department of Human Anatomy and Histology and Embryology,Anhui Medical College,Hefei 230601,China
Objective:Observed activity of adjuvant arthritis (AA) rats Hedgehog signaling pathway and explore the effect of Cyclopamine on rat arthritis and kidney injury.Methods: 40 rats were randomly divided into control group,Cyclopamine group,AA+Cyclopamine group and AA model group.We used Freund′s complete adjuvant rat model with Cyclopamine intraperitoneal injection.By measuring paw swelling,systemic inflammation and arthritis semi-quantitative assessment methods of rats to evaluate the model.HE staining was used to detect the renal pathological changes of rats.Western blot was used to detect kidney Gli1 protein expression levels of the rats.Immunohistochemical staining was used to detect the rat kidney TNF-α,IFN-γ,IL-6 expression.Results: After using Cyclopamine,the AA rat paw swelling reduced and arthritis refers relieved significantly.Compared with the control group,Cr,BUN and organ coefficient increased significantly in AA model group,and the difference was statistically significant.Meanwhile renal TEM detection appeared obvious pathological changes in rats of AA model group.After using cyclopamine,the content of Cr,BUN and organ coefficient change reduced significantly,so did the pathological.Western blot detected kidney tissue Gli1 protein in each group.Compared to control group,there was no significant difference in Cyclopamine group.AA model group and AA+Cyclopamine group Gli1 protein expression was significantly higher compared with Cyclopamine Gli1 protein group,the difference was statistically significant.AA model group and AA Cyclopamine group Gli1 protein expression was significantly higher,the difference was statistically significant.Compared to the AA model group,AA+Cyclopamine group Gli1 protein levels have decreased significantly,the difference was statistically significant.Immunohistochemical assay detection found that kidney tissue proinflammatory cytokines TNF-α,IFN-γ,IL-6 expression and semiquantitative score changed.Compared with the control group,TNF-α,IFN-γ expression of AA model group were significantly increased.After using Cyclopamine,the expression of TNF-α,IFN-γ in kidney of AA model reduced significantly.IL-6 expression in AA model group was significantly higher than the control group.Conclusion: Cyclopamine AA can relieve arthritis and kidney injury in rats with arthritis AA,the Hh pathway was on activity state in the process,may altered expression of inflammatory factors.
Adjuvant arthritis;Hedgehog;Kidney damage
10.3969/j.issn.1000-484X.2016.09.007
宋先兵(1979年-),男,硕士,副教授,主要从事自身免疫性疾病损伤机制方面的研究,E-mail: 304717428@qq.com。
R593.2
A
1000-484X(2016)09-1276-07
①本文受安徽高校自然科学研究重点项目(KJ2015A350)和国家自然科学基金(81373421)资助。
②安徽医科大学组织胚胎学教研室,合肥230032。

