小鼠肺肿瘤发展过程中外周血NKT和MDSC细胞变化①
曹倩文 田 雨 宋天姣 王 娜 郝小惠 郑全辉
(华北理工大学,河北省慢性疾病重点实验室,唐山063000)
小鼠肺肿瘤发展过程中外周血NKT和MDSC细胞变化①
曹倩文田雨宋天姣王娜郝小惠郑全辉
(华北理工大学,河北省慢性疾病重点实验室,唐山063000)
目的:探讨小鼠肺癌细胞生长过程中自然杀伤性T细胞(NKT)和骨髓源性抑制细胞(MDSC)变化。方法:采用小鼠Lewis肺癌细胞系(LLC)制备小鼠皮下肿瘤模型,在肿瘤生长不同时间取鼠尾血,提取白细胞进行相关抗体染色,采用流式细胞仪进行NKT和MDSC细胞检测。结果:肺癌小鼠随着肿瘤增大外周血NKT细胞比例逐渐降低,而MDSC细胞比例逐渐增加,与正常对照小鼠相比,二者均存在显著差异。结论:小鼠NKT细胞和MDSC细胞在肺肿瘤发展过程中呈相反趋势变化,二者可作为肺癌发展的潜在监测指标。
肺癌; 自然杀伤性T细胞; 骨髓源性抑制细胞
肺癌是目前世界范围内发病率和死亡率最高的肿瘤之一。其发生和发展的病理机制目前仍不完全清楚。机体免疫功能变化与肿瘤的发展密切相关。自然杀伤性T细胞(NKT)和骨髓源性抑制细胞(MDSC)是两类具有重要免疫调节功能的细胞群,NKT细胞因其细胞表面既表达NK细胞表面标志CD56(小鼠NK1.1),又表达T细胞表面标志TCR-CD3复合体而命名[1]。NKT细胞识别CD1d提呈的脂类抗原,海绵提取物中α-半乳糖苷神经酰胺(α-Galcer)能特异激活NKT细胞,并通过产生Th2和Th1型细胞因子如IL-4和IFN-γ参与体液免疫应答或细胞免疫应答,增强机体抗感染和抗肿瘤作用[2]。骨髓源性抑制细胞(Myeloid-derived suppressor cells,MDSC)是一群由不成熟髓系细胞组成的异质性细胞群体,人的MDSC被确定为CD33+CD11b+HLA-DRlow-/-,小鼠的MDSC被确定为Gr1+CD11b+[3]。体外研究发现,MDSC能够显著抑制由同种抗原、抗CD3抗体以及多种丝裂原诱导的T细胞增殖,同时也能抑制NK细胞活性,表明MDSC具有抑制适应性免疫应答和固有免疫应答功能[4]。在此研究中,我们采用小鼠皮下肺肿瘤模型,观察了肿瘤细胞生长过程中NKT和MDSC细胞变化,以期深入了解肺癌病人发病过程中免疫功能变化,并为监测病情发展和治疗提供线索。
1 材料与方法
1.1材料
1.1.1细胞株小鼠Lewis肺癌细胞系(LLC)由北京北纳创联生物技术研究院提供,在含10% 胎牛血清及双抗(青霉素100 U/ml,链霉素100 μg/ml)的DMEM(Gibco公司)培养液中培养,条件是饱和湿度、37℃、5%CO2,2~3 d更换1次培养液。细胞总数达到95% 融合时用0.25%胰酶-0.02%EDTA消化、传代培养。
1.1.2动物C57BL/6 小鼠由中国食品药品检定研究院提供[许可证号:SCXK(京)2009-0017],SPF级环境培养。
1.1.3主要试剂及仪器肝素钠购自江苏万邦生化医药股份公司,用无菌蒸馏水溶解成250 U/ml,40 μl/EP管分装保存。荧光素标记的CD1d-α-Galcer四聚体购自日本麒麟公司。Fc受体阻断剂(2.4G2)、荧光素标记的抗小鼠TCR-β(H57-597)、抗B220(RA3-6B2)、抗Gr1(RB6-8C5)、抗CD11b(M1/70)抗体均购自美国BD公司。流式细胞仪FACS Calibur为美国BD公司产品。
1.2方法
1.2.1肺癌小鼠模型的制备消化、收集LLC细胞,离心去上清,用无菌生理盐水洗涤两次,将细胞悬浮于生理盐水中,台盼蓝染色细胞活力大于95%。 进行细胞计数,调整细胞浓度为×107ml-1,对小鼠进行皮下接种,具体如下:①分组:取6~8周龄,雌性C57BL/6小鼠24只,随机分成实验和对照两个组,每组12只。②接种:对小鼠腋下皮肤进行酒精消毒,实验组小鼠注射LLC细胞100 μl(1×106)/只,对照组小鼠注射等量生理盐水。
1.2.2小鼠外周血白细胞分离分别在LLC接种当天(0周)和接种后1周、2周、3周取对照组和实验组小鼠尾静脉血,溶于事先准备好的肝素钠抗凝管中,100 μl血/管,冰上放置。将抗凝后的鼠尾血用蒸馏水快速裂解30 s,加入10×PBS混匀终止裂解。1 700 r/min,5 min离心,去上清后加入0.5 ml 含2%小牛血清的PBS溶液(细胞染色液)重悬备用。
1.2.3流式细胞仪分析取以上外周血细胞悬液100 μl加入流式管中,加入2.4G2,4℃封闭10 min,对于NKT细胞染色,加入0.5 μl PE标记的CD1d-a-galcer 四聚体(CD1d-tetramer)冰上孵育30 min。用细胞染色液离心洗涤1次重悬细胞,分别加入per-CP标记B220和FITC 标记TCR-β抗体,冰上继续孵育30 min,用细胞染色液离心洗涤2次后上机检测;对于MDSC细胞染色,直接加入FITC标记的抗CD11b和PE标记的抗Gr1抗体各10 μl,4℃避光染色30 min后上机检测,数据分析采用CellQuest分析软件。

2 结果
2.1小鼠肺肿瘤随时间延长逐渐增大实验组小鼠LLC接种1周即可触及肿瘤产生,随接种时间延长瘤体逐渐增大,接种第1周瘤体重量(1.42±0.17)g,接种第2周瘤体重量(2.18±0.41)g,至LLC接种第3周时,肿瘤几乎累及小鼠整个腋窝,瘤体重量达(4.30±0.53) g,见图1。
2.2小鼠外周血NKT细胞随肿瘤增长逐渐降低分别在LLC接种当天和接种后1、2、3周,检测小鼠外周血B220阴性细胞群中NKT细胞含量。结果显示,与对照小鼠相比,LLC接种后1周实验组小鼠NKT细胞开始下降(0.08%±0.01% vs 0.12%±0.01%,P<0.05),至LLC接种2周和3周时,NKT细胞持续显著下降(P<0.01,图2A、B)。
2.3小鼠外周血MDSC随肿瘤增长逐渐增加检测LLC接种后各时间点MDSC细胞变化。结果显示,LLC接种后1周实验组和对照组小鼠相比,外周血MDSC比例没有显著差异(7.21%±2.24% vs 5.52%±1.57%,P>0.05),LLC接种后2周,实验组小鼠外周血MDSC开始增加(P<0.05),至第3周时,实验组小鼠外周血MDSC增加更为显著(P<0.01,图3A、B)。

图1 小鼠皮下肺肿瘤模型制备及肿瘤生长情况Fig.1 Mouse lung tumor models made by subcutaneous implantation of LLC cells and tumor growth at different time points after LLC implantation

图2 小鼠肺肿瘤增长过程中外周血NKT细胞变化Fig.2 NKT cell changes in peripheral blood of mice during growth of lung tumorNote: A.Representative dot plots of peripheral blood NKT cell staining at different time points of lung tumor growth;B.Statistic analysis of NKT cell changes during the growth of lung tumor in mice.*.P<0.05,**.P<0.01.
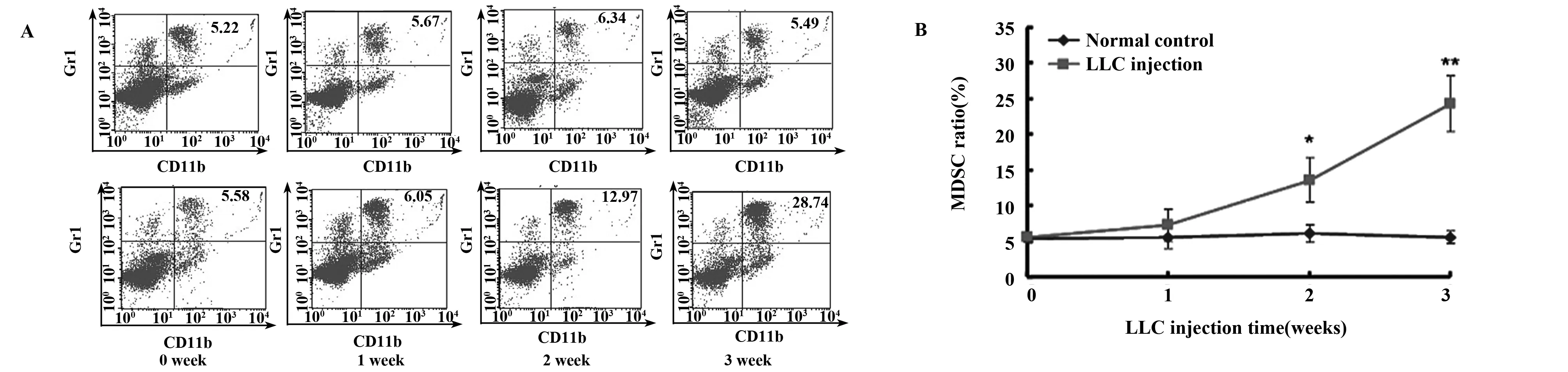
图3 小鼠肺肿瘤增长过程中外周血MDSC变化Fig.3 MDSC changes in peripheral blood of mice during growth of lung tumorNote: A.Representative dot plots of peripheral blood MDSC staining at different time points of lung tumor growth;B.Statistic analysis of MDSC cell changes during the growth of lung tumor in mice.*.P<0.05,**.P<0.01.
3 讨论
我们以往的实验结果发现,LLC接种诱导肺癌荷瘤小鼠脾脏、淋巴结适应性免疫应答CD4+和CD8+T细胞降低,而MDSC细胞增加[5]。 在此实验中,为了动态观察参与固有免疫应答NKT细胞和MDSC细胞在肿瘤发生、发展过程中的变化。我们在LLC接种不同时间采取小鼠外周血进行检测。结果显示,肺癌小鼠随肿瘤增大,外周血NKT细胞比例逐渐降低,而MDSC细胞比例逐渐增加。与正常对照小鼠外周血相比,二者均存在显著差异。由此可见,在肺肿瘤发展过程中,NKT细胞的数量下降与MDSC数量的上升也可能存在联系。
已有研究表明,机体多数NKT细胞TCR由Vα14(人是Vα24)Jα18基因片段编码,被称为恒定型NKT细胞(iNKT)[1]。人和小鼠的iNKT均能被α-Galcer荷载的CD1d四聚体(CD1d-tetramer)所特异识别和激活。活化iNKT细胞主要通过产生IL-12、IFN-γ、TNF,进而激活CD8+CTL和NK细胞杀伤肿瘤,也可以通过产生穿孔素和颗粒酶发挥直接杀瘤效应[6]。目前国内外对NKT细胞在荷瘤机体中的变化报道不一。Dhodapkar等报道NKT细胞在多发性骨髓瘤病人中显著降低;Molling等报道头颈癌患者NKT细胞显著降低,并且其降低程度与病情的恶化程度呈正相关[7,8]。相反,吴军等报道恶性肿瘤患者外周血中NKT样细胞较健康人有明显升高的趋势[9],谢澎等[10]发现甲状腺乳头状癌患者外周血中NKT细胞比率明显高于对照组。以上NKT细胞变化差异可能缘于肿瘤性质不同,也可能缘于不同的NKT检测方法,前者采用CD1d-tetramer四聚体,而后者采用抗CD3和抗CD56(小鼠NK1.1)抗体检测NKT细胞。本次实验采用CD1d-tetramer四聚体检测肺癌小鼠外周血NKT细胞变化,其变化趋势与相同方法检测的其他肿瘤NKT变化一致,并且发现NKT细胞在肺癌发展早期(1周)即有明显降低,以后随肿瘤增大与对照组相比降低更加显著,提示NKT细胞数量变化与肺癌的发展呈明显负相关。
我们观察到MDSC在肿瘤发展早期(1周)与正常对照小鼠相比没有显著差异,但在肿瘤发展中晚期显著增加,表明MDSC在荷瘤小鼠中的变化与肿瘤发展程度或肿瘤大小密切相关。众多研究发现,肿瘤生长过程中机体抗肿瘤免疫伴随慢性炎症反应,由肿瘤微环境释放的多种炎症因子如IL-1β、IL-6、PGE2等促进MDSC的产生,抑制包括T细胞、巨噬细胞、NK、NKT 等多种细胞的增殖和抗瘤活性[11]。相反,Ko等[12]发现活化NKT细胞能够通过某种未知机制显著提高MDSC中CD11b、CD11c 和共刺激分子CD86的表达,促进MDSC向成熟巨噬细胞和树突状细胞转化,利于T细胞介导的抗肿瘤免疫应答。因此,肿瘤发展过程中NKT细胞减少是导致MDSC数量增加和肿瘤增长的因素之一。
总之,本研究结果显示,肺肿瘤发展过程中外周血NKT和MDSC细胞比例呈相反趋势变化,由于NKT主要发挥抑瘤作用而MDSC促进肿瘤的发展。因此,二者即可作为肺癌免疫治疗的潜在靶点,也可用于肺癌发展或治疗预后的监测指标。
[1]Lan Wu,Luc Van Kaer.Natural killer T cells in health and disease[J].Front Biosci(Schol Ed),2011,3(1):236-251.
[2]Anderson BL,Luc Teyton,Albert Bendelac,etal.Stimulation of natural killer T cells by glycolipids[J].Molecules,2013,18(12):15662-15688.
[3]Diaz-Montero CM,Finke J,Montero AJ.Myeloid-derived suppressor cells in cancer:therapeutic,predictive,and prognostic implications[J].Semin Oncol,2014,41(2):174-184.
[4]Monu NR,Frey AB.Myeloid-derived suppressor cells and anti-tumor T cells:a complex relationship[J].Immunol Invest,2012,41(6-7):595-613.
[5]郑全辉,刘英文,张雪梅.肺癌小鼠MDSC和T细胞变化[J].中国免疫学杂志,2015,31(5):595-599.
[6]Faith CR,Jay A,Masaki T,etal.NKT cell networks in the regulation of tumor immunity[J].Front Immunol,2014,5(5):543-553.
[7]Dhodapkar MV,Geller MD,Chang DH,etal.A reversible defect in natural killer T cell function characterizes the progression of premalignant to malignant multiple myeloma[J].J Exp Med,2003,197(12):1667-1676.
[8]Molling JW,Langius JA,Langendijk JA,etal.Low levels of circulating invariant natural killer T cells predict poor clinical outcome in patients with head and neck squamous cell carcinoma[J].J Clin Oncol,2007,25(6):862-868.
[9]吴军,李薇,钱云峰,等.初诊恶性肿瘤患者外周血CD3+CD56+NKT样细胞的检测[J] .实用医学杂志,2015,31(5):756-759.
[10]谢澎,苏文,王艳峰,等.CD3+CD56+NKT细胞及亚群在甲状腺癌患者的表达及临床意义[J].中国医疗前沿,2011,6(5):13-14.
[11]Suzanne O,Pratima S.Myeloid-derived suppressor cells:linking inflammation and cancer[J].J Immunol,2009,182(8):4499-4506.
[12]Ko HJ,Lee JM,Kim YJ,etal.Immunosuppressive myeloid-derived suppressor cells can be converted into immunogenic APCs with the help of activated NKT cells:an alternative cell-based antitumor vaccine[J].J Immunol,2009,182(3):1818-1828.
[收稿2015-11-07]
(编辑张晓舟)
Changes of NKT and MDSC during development of mouse lung tumor
CAO Qian-Wen,TIAN Yu,SONG Tian-Jiao,WANG Na,HAO Xiao-Hui,ZHENG Quan-Hui.
North China University of Science and Technology,Hebei Key Laboratory for Chronic Diseases,Tangshan 063000,China
Objective:To investigate the change of nature killer T cell(NKT)and myeloid derived suppressor cells(MDSC)during the development of mouse lung tumor.Methods: Lung tumor mouse models were made by subcutaneous injection of Lewis lung tumor cells(LLC),peripheral blood leukocytes were extracted from mouse tail blood at different time points after LLC injection.NKT and MDSC were detected by flow cytometry after relative antibody staining.Results: With the increasing volume of lung tumor,the ratio of NKT cells decreased gradually,while the ratio of MDSC increased gradually in the peripheral blood of LLC-injected mice.Both NKT and MDSC showed significantly changes in LLC-injected mice compared with that of normal control mice.Conclusion: NKT and MDSC in LLC-injected mice show opposite changes during the development of lung tumor,so,they can be used as potential monitoring index for lung tumor development.
Lung tumor;Nature killer T cells;Myeloid derived suppressor cells
10.3969/j.issn.1000-484X.2016.09.006
曹倩文(1985年-),女,主要从事肿瘤免疫学研究。
及指导教师:郑全辉(1973年-),男,博士,副教授,主要从事免疫调节细胞发育功能研究,E-mail:zhqhdlp@sohu.com。
R392.12
A
1000-484X(2016)09-1272-04
①本文为国家自然科学基金项目(81373111)、河北省自然科学基金项目(H2013209019)和华北理工大学大学生创新创业训练计划项目(X2015153)。

