NF-κB介导的促凋亡蛋白Bak表达在溃疡性结肠炎发病中的作用研究
陈 晓 王启之 郦忆文 马文静 于东红
(蚌埠医学院第一附属医院,蚌埠233000)
NF-κB介导的促凋亡蛋白Bak表达在溃疡性结肠炎发病中的作用研究
陈晓王启之①郦忆文马文静于东红
(蚌埠医学院第一附属医院,蚌埠233000)
目的:探讨核因子-κB(Nuclear factor kappa B,NF-κB)介导的促凋亡蛋白Bak(Bcl-2 associated K protein gene,Bak)及TNF-α的表达在溃疡性结肠炎(Ulcerative colitis,UC)发病中的作用机制。方法:选购80只清洁级SD大鼠,分为模型组和对照组。UC大鼠模型制造采用“三硝基苯磺酸+乙醇”方法,模型制造成功后观察、评估结肠黏膜的大体形态及组织学变化。用免疫组织化学及RT-PCR法检测模型组与对照组中的NF-κB、Bak、TNF-α的表达水平,并分析相互之间关系。结果:UC大鼠模型制造成功率为97%。模型组固有层和黏膜层内炎性细胞浸润较对照组明显增多(P<0.01);NF-κB、TNF-α蛋白及mRNA表达水平模型组较对照组明显升高(P<0.01);Bak蛋白在模型组的炎细胞中表达明显低于对照组(P<0.01),而在结肠黏膜上皮细胞中的水平与对照组无明显差异(P>0.05)。NF-κB、TNF-α蛋白阳性细胞百分数及mRNA水平随模型组的组织学等级升高而增强,而Bak蛋白阳性细胞百分数是减弱的(P<0.05);且模型组中NF-κB与Bak蛋白的表达水平呈负相关(r=-0.793,P<0.01),NF-κB与TNF-α蛋白表达成正相关(r=0.892,P<0.01)。结论:NF-κB介导的促凋亡蛋白Bak的表达参与了UC的发生、发展。
核因子-κB; Bak;溃疡性结肠炎
溃疡性结肠炎的临床主要特点是腹痛、腹泻反复发作,不易治愈。其发病率在我国有逐年上升趋势。UC的发病一直被认为与免疫学相关,但具体机制至今尚未完全明确[1],因此其有效的治疗靶点的发现是值得大家研究的。近年来有研究发现一些自身免疫性疾病与凋亡蛋白Bcl-2家族异常表达有关[2,3],随着黏膜免疫学研究的不断深入,有学者提出UC的发生可能与结肠上皮细胞的凋亡有关[4]。作为凋亡蛋白Bcl-2家族的一关键成员——Bak在UC发病中作用也是值得研究的。NF-κB作为可以调控机体免疫及细胞增殖、分化、凋亡,基因表达的重要分子,当其被转运入细胞核可促进多个凋亡蛋白和促炎蛋白启动子的转录[5,6],包括对促凋亡蛋白Bak及促炎因子TNF-α[7]的转录。因此我们推测在UC的发病过程中可能与其结肠组织中NF-κB介导的Bak及TNF-α蛋白的异常表达有关。本实验采用免疫组织化学及RT-PCR方法检测UC大鼠结肠黏膜组织中上述分子的蛋白及基因的表达水平,统计并分析相互之间的关系,从而进一步了解NF-κB介导的凋亡通路在UC发病中的作用。
1 材料与方法
1.1材料
1.1.1实验动物80只SD大鼠,清洁级(购自蚌埠医学院动物房),模型组:随机抽取60只;对照组:剩余20只。体重175~255 g,食欲良好,无疾病。
1.1.2主要试剂三硝基苯磺酸(TNBS)购自Sigma公司;NF-κB兔抗大鼠多克隆抗体购自北京博枫科生物技术有限公司;Bak兔抗大鼠抗体、TNF-α兔抗大鼠抗体均购自美国RND公司;即用型免疫组化染色ElivisionTMplus试剂盒购自武汉博士德试剂公司。引物由Primer 5软件设计,引物序列为:NF-κB(282 bp):上游5′-CCA GGC GGA CAT CTA CAA-3′,下游:5′-CAA GGC CAA ATG AAA GGA-3′;TNF-α(365 bp):上游5′-GGT GAT CGG TCC CAA CAA GG -3′,下游5′-CCT CCC AGG TAC ATG GGC TC-3′;GAPDH(452 bp):上游5′-ACC ACA GTC CAT GCC ATC AC-3′,下游5′-TCC ACC ACC CTG TTG CTG TA-3′。
1.2方法
1.2.1模型制备[8]实验大鼠于SPF级动物房适应性喂养1周后禁食24 h,10%水合氯醛(3 ml/kg)腹腔注射,大鼠麻醉后用硅胶管插进肛门,深度约8 cm,向肠管内注入TNBS(100 mg/kg)和50%乙醇溶液共0.5 ml,之后注射约少量空气约0.2 ml,使大鼠倒立1 min后平放,灌肠后正常喂养。
1.2.2标本的留取方法与保存模型组的大鼠在灌肠后分别于第2~3天、第6~7天、第13~14天处死,截取整段结肠,选取红肿、糜烂、溃疡较明显处及1、4、8 cm处肠段,用生理盐水冲净,一半用10%甲醛溶液固定留做HE染色、免疫组化,一半放-20℃冰箱留做RT-PCR。
1.2.3模型组UC大鼠的分级疾病活动指数(Disease activity index,DAI)[9]:造模后大鼠每天称重,首先计算:大鼠体质量下降百分比=(处死当天体质量-第1天体质量)/第1天体质量×100%。体质量无下降为0分,下降1%~5%:1分,下降6%~10%:2分,下降11%~15%:3分,下降>15%:4分;其次观察大便稀松度:正常:0分,大便松散:2分,腹泻:4分;再次检测大便出血情况:正常:0分,隐血阳性:2分,显性出血:4分。将以上3种情况的分数相加除以3即为DAI值。
组织学评分:根据Dieleman[10]提出的评分标准,将标本石蜡包埋,病理切片及HE染色后观察:无溃疡:0分,溃疡直径小于0.3 cm为1分,大于0.3 cm为2分;无炎症:0分,轻度炎症为1分,重度为2分;无肉芽肿:0分,有为1分;病变深度累及黏膜下层为1分,肌层为2分,浆膜层为3分;无纤维化:0分,轻度纤维化为1分,重度纤维化为2分。
结肠黏膜损伤指数[11]:即对结肠黏膜大体损伤进行评分:表面光滑无损伤为0分;只有轻度充血水肿为1分;轻、中度充血水肿,伴糜烂为2分;重度充血水肿,伴溃疡及坏死,但溃疡最大直径小于1 cm为3分;在3分基础上溃疡直径>1 cm或全肠壁坏死为4分。
模型组UC大鼠的分级:根据DAI、组织学评分、结肠黏膜损伤指数三者之和将UC大鼠划分为:轻度(Ⅰ级):0~5分;中度(Ⅱ级):6~12分;重度(Ⅲ级):13~18分。
1.2.4免疫组化及结果判断标准按照Elivision两步法进行操作,光镜下按阳性标准计数。以试剂公司提供的阳性对照片作为阳性对照,以PBS缓冲液(0.01 mol/L,pH7.4)代替一抗作为阴性对照。结果以胞质、包膜和胞核出现棕黄色或褐色颗粒状物者为阳性细胞。阴性对照无棕黄色反应产物。随机取5个不重复的视野,应用图像处理系统进行扫描分析,计算每个视野阳性细胞面积占所有细胞面积的百分比,取5个高倍视野的均数,如大于15%则为阳性;小于15%为阴性。
1.2.5半定量RT-PCR检测NF-κB、TNF-α mRNA的表达及PCR产物鉴定首先对预留标本进行RNA的提取,然后对RNA质量及浓度、纯度进行鉴定,最后按两步法进行cDNA提取及PCR扩增。取5 μl扩增产物,加入1 μl×6 Loading buffer,在1×TAE中行2%琼脂糖凝胶电泳,0.02%EB染色,天能Gis 2000凝胶成像分析系统,分析目的基因与内参照面积灰度积分比值。

2 结果
2.1各组大鼠结肠病理改变模型组大鼠结肠组织中固有层和黏膜层内可见弥漫性中性粒细胞、单核细胞、浆细胞浸润,结肠黏膜腺体排列紊乱,杯状细胞减少,随着模型组等级升高,炎性细胞浸润越多,结肠黏膜腺体排列越紊乱。对照组大鼠结肠组织中固有层和黏膜层内只有少许炎性细胞浸润,明显少于模型组(χ2=46.52,P<0.01)。模型组分级:Ⅰ级为20例;Ⅱ级为19例;Ⅲ级为19例。对照组为20例。UC模型制造97%的成功率。
2.2各组大鼠结肠组织中NF-κB、Bak、TNF-α蛋白的检测NF-κB、TNF-α蛋白主要表达在黏膜炎症、溃疡处,模型组的结肠黏膜上皮细胞及炎细胞中(如:中性粒细胞、单核细胞、浆细胞等)NF-κB、TNF-α表达水平明显增强(P<0.01),而对照组结肠黏膜下层、炎细胞的胞膜、胞质和胞核中只有少许散在表达。Bak蛋白在模型组炎细胞中(如:中性粒细胞、单核细胞、浆细胞等)表达水平明显低于对照组(P<0.01),而在黏膜上皮细胞中的表达与对照组无统计学差异(P>0.05),见图1、2,表1~3。
2.3NF-κB、Bak、TNF-α的表达水平与模型组分级之间的关系经统计学分析:NF-κB、TNF-α蛋白阳性细胞百分数随模型组等级增高表达增强(P<0.05);而Bak蛋白表达逐渐减弱(P<0.05),见表4。

图1 NF-κB、Bak、TNF-α在对照组结肠黏膜中的表达(×400,IHC)Fig.1 Expression of NF-κB,Bak and TNF-α in control group(×400,IHC)Note: A.NF-κB;B.Bak;C.TNF-α.
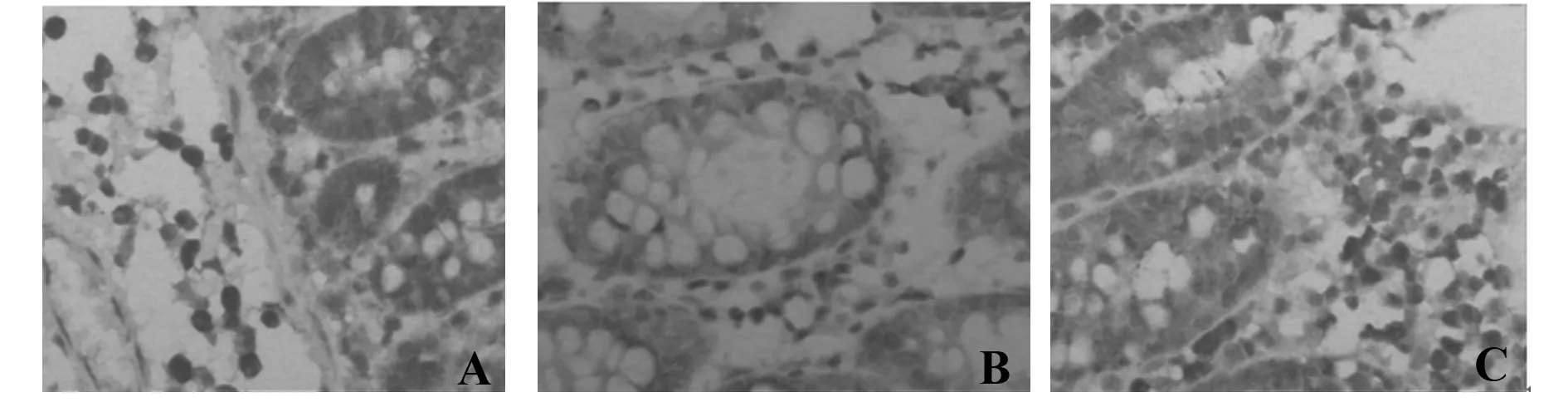
图2 NF-κB、Bak、TNF-α在模型组结肠黏膜中的表达(×400,IHC)Fig.2 Expression of NF-κB,Bak and TNF-α in mode group(×400 ,IHC)Note: A.NF-κB;B.Bak;C.TNF-α.
2.4NF-κB与Bak表达之间的关系模型组共58例,其中51例NF-κB阳性,10例Bak阳性,41例阴性;而在NF-κB阴性的7例中,Bak表达阴性7例,阳性无。经Spearman法得出:模型组的NF-κB和Bak表达呈负相关(r=-0.793,P<0.01)。
2.5NF-κB与TNF-α表达之间的关系模型组共58例,其中51例NF-κB阳性,49例TNF-α阳性,阴性无;而在NF-κB阴性的7例中,TNF-α表达阴性6例,阳性1例。经Spearman法得出:模型组的NF-κB和TNF-α表达呈正相关(r=0.892,P<0.01)。
表1NF-κB在模型组与对照组中的表达
Tab.1Expression of NF-κB in model group and normal group
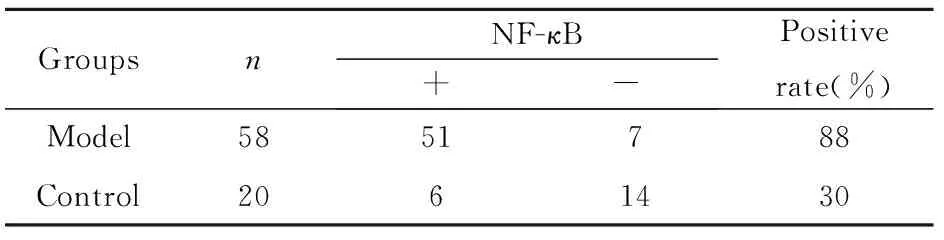
GroupsnNF-κB+-Positiverate(%)Model5851788Control2061430
Note:χ2=25.37 ,P<0.01.
表2Bak在模型组与对照组中的表达
Tab.2Expression of Bak in model group and normal group
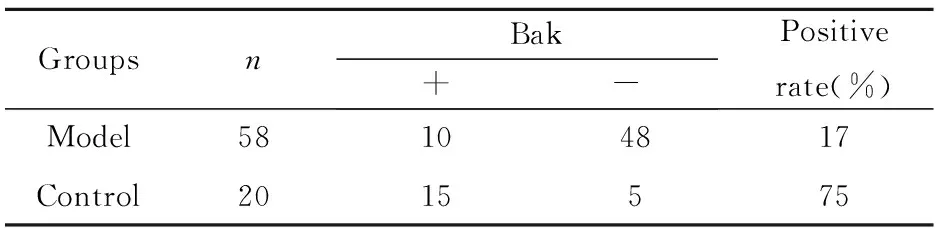
GroupsnBak+-Positiverate(%)Model58104817Control2015575
Note:χ2=22.78,P<0.01.
表3TNF-α在模型组与对照组中的表达
Tab.3Expression of TNF-α in model group and normal group
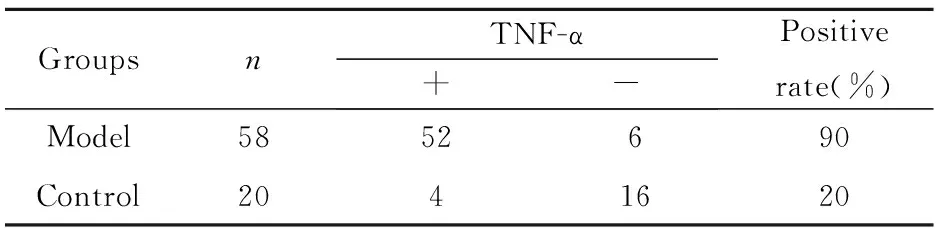
GroupsnTNF-α+-Positiverate(%)Model5852690Control2041620
Note:χ2=27.76 ,P<0.01.
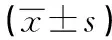
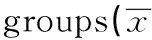

GroupsNF-κBBakTNF-αGradeⅠ27.6±6.216.2±5.828.7±7.8GradeⅡ16.2±5.81)11.8±4.11)54.3±8.51)GradeⅢ65.8±8.91)2)6.3±2.31)2)72.0±10.11)2)
Note:Compared with gradeⅠ,1)P<0.05;compared with grade Ⅱ,2)P<0.05.
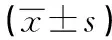
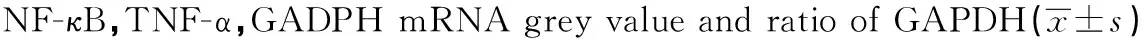

GroupsNF-κBGreyvalue /GAPDH(%)TNF-αGreyvalue/GAPDH(%)GAPDHGreyvalueControl55.2±3.412.9±2.285.2±8.922.5±3.2405.6±8.9GradeⅠ173.6±7.843.2±4.21)269.5±6.564.8±5.41)409.7±19.0GradeⅡ225.4±4.553.6±3.31)2)322.2±5.379.6±3.61)2)419.3±14.5GradeⅢ266.6±8.965.6±4.11)3)378.3±12.392.3±4.91)3)407.2±13.9
Note:Compared with control group,1)P<0.01;compared with grade Ⅰ,2)P<0.05;compared with grade Ⅱ,3)P<0.05.
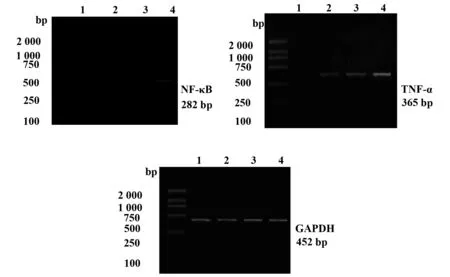
图3 NF-κB、TNF-α、GADPH mRNA在模型组及对照组结肠上皮中的表达Fig.3 Expression of NF-κB,TNF-α and GADPH mRNA in model group and normal groupNote: 1.Control;2.GradeⅠ;3.GradeⅡ;4.GradeⅢ.
2.6RT-PCR测定各组大鼠结肠黏膜NF-κB、TNF-α、GADPH mRNA的表达NF-κB:F=1 813.1,P<0.05;TNF-α:F=1 224.5,P<0.05。两个因子四组灰度比值总体均数有显着差异,两因子各自不同等级之间需进一步两两比较q检验,得出:正常对照组结肠上皮GAPDH mRNA的表达无显著差异(P>0.05)。NF-κB及TNF-α mRNA在对照组结肠上皮无明显表达,模型组不同等级的结肠上皮均有表达,明显高于对照组(P<0.01),随模型组等级增高表达逐渐增强,Ⅲ级>Ⅱ级>Ⅰ级(P<0.05)。见图3。
3 讨论
溃疡性结肠炎的发病机制至今仍未明确,随着免疫因素在其发病机制中的认可,NF-κB介导的信号通路在UC发病中的作用研究一直是热点[12,13]。当NF-κB被活化后转运入细胞核可启动多种靶基因的转录,介导细胞的增殖、凋亡,炎症发生等[5,6]。近几年NF-κB介导的凋亡蛋白的表达在一些自身免疫性疾病,多发性硬化等疾病中的作用得到证实[3]。其中研究较多为Bcl-2家族,Bcl-2家族根据其成员结构及功能特点分为抗凋亡蛋白及促凋亡蛋白,Bak为其重要的促凋亡蛋白。Bak被激活后,主要通过分子内或分子间组装形成多聚体,在线粒体外膜上实行开孔,促使细胞凋亡[14]。然而,NF-κB介导的凋亡蛋白Bak在UC发病中的研究较少。
本实验采用“三硝基苯磺酸+乙醇”的方法制造UC大鼠模型,此方法造模与人类UC的结肠病理表现有较多相似之处,是较为理想的结肠炎模型。造模成功后,HE染色发现模型组大鼠结肠组织中固有层和黏膜层内可见弥漫性中性粒细胞、单核细胞、浆细胞浸润,明显多于对照组(P<0.01),且结肠黏膜腺体排列紊乱,杯状细胞减少,随着模型组等级升高,炎性细胞浸润越多,结肠黏膜腺体排列越紊乱。随后通过使用免疫组化及RT-PCR方法从蛋白及基因水平对大鼠结肠黏膜组织中NF-κB、Bak、TNF-α的表达进行检测,发现对照组中炎性细胞浸润较少,且NF-κB、TNF-α蛋白在对照组结肠黏膜下层、炎性细胞的胞膜、胞质和胞核中表达也极少;而在模型组的结肠黏膜炎性细胞浸润明显增多,NF-κB、TNF-α蛋白在上皮细胞及中性粒细胞、单核细胞、浆细胞等炎细胞中表达水平明显增强,且其在模型组的mRNA表达水平较对照组也是明显升高的(P<0.01);Bak蛋白在模型组的炎细胞中表达水平明显低于对照组(P<0.01),而在结肠黏膜上皮细胞中的表达水平与对照组无统计学差异(P>0.05)。本实验通过统计分析得出:模型组随着等级升高,NF-κB、TNF-α蛋白阳性细胞百分数及mRNA水平逐渐增强,而Bak蛋白阳性细胞百分数逐渐减弱,且通过相关性分析:NF-κB与TNF-α蛋白的表达呈正相关,与Bak蛋白的表达呈负相关(P<0.01)。由上述我们得出结论:在UC的发生过程中,结肠组织中固有层和黏膜层内大量的炎性细胞浸润,如中性粒细胞、单核细胞、浆细胞等,NF-κB介导的信号通路在炎性细胞中对Bak蛋白的表达呈负调控作用,而结肠上皮细胞中调控作用不强,最终导致炎性细胞凋亡减慢,结肠上皮坏死脱落加速,溃疡形成;同时NF-κB介导的信号通路对TNF-α的表达启正调控作用,结肠黏膜上皮细胞及炎性细胞中的TNF-α大量表达激活了巨噬细胞、白细胞促进血小板激活因子、前列腺素、NO和白三烯等,诱发炎症介质如IL-1、IL-6、IL-8的释放,造成炎症因子一系列的连锁反应[15,16],最终结肠炎症的爆发。结肠组织中炎性细胞浸润越明显,NF-κB及致炎因子TNF-α的表达水平越高,Bak表达越低,UC的病情越严重。本实验不仅阐释了NF-κB介导的促凋亡蛋白Bak参与了UC的发病机制同时也为UC的病情进展、严重程度及预后的判定提供的新的参考指标,为临床治疗药物的研发提供新的靶点。虽然在UC的发病过程中,NF-κB介导的促凋亡蛋白Bak的作用在本实验中得到证实,但其具体的调控机制及凋亡通路中其他重要分子还有待我们进一步探究。
[1]刘昌恩,黄玉红.溃疡性结肠炎PTPN2和NF-κB单核苷酸多态性的研究进展[J].世界华人消化杂志,2015,1(3):71-77.
[2]Seidehn JB,Nielsen OH.Epithelial apoptosis:cause or consuenee of ulcerative colitis[J].Scand J Gastroenterol,2009,44(12):1429-1434.
[3]陈小艳,范 恒,张丽娟,等.DOR-β-arrestinl-Bcl-2/NF-JcB信号转导通路在溃疡性结肠炎发病机制中的研究[J].中西医结合研究,2011,8(4):197-202.
[4]Protrka Z,Juric J,Prtrka O,etal.The possible role of Bcl-2 expression of tunlors of the uterine cervix[J].J Buon,2010,15(2):323-329.
[5]乔俏,姜元军,李光.NF-JcB抑制与X射线诱导的人非霍奇金淋巴瘤细胞凋亡的研究[J].中华放射医学与防护杂志,2012,32(10):182-185.
[6]Soubh AA,Abdallah DM,El-Abhar HS,etal.Geraniol ameliorates TNBS-induced colitis:involvement of Wnt/β-catenin,p38MAPK,NFκB,and PPARγ signaling pathways[J].Life Sci,2015,136(1):142-150.
[7]Hsieh IN,Chang AS,Teng CM,etal.Aeieulatin inhibits lipopolysae-charide-mediated inducible nitric oxide synthase and cyclooxygenase-2 expression via suppressing NF-kappaB and JNK/p38 MAPK activation pathways[J].Biomed Sci,2011,18(3):28.
[8]Wengrower D,Zannineli G,Pappo O,etal.Prevention of fibrosis in experimental colitis by captopril:the role of tgf-1[J].Inflammatory Bowel Diseases,2004 ,10(5):536.
[9]Sanchez F,Cardeno A,Sanchez,etal.Dietary extra virgin olive oil polyphenols supple mentation modulates DSS.induced chronic colitis in micer[J].J Nutr Biochem,2013,24(7):1401-1413.
[10]Dieleman LA,Palmen MJ,Akol H,etal.Chronic experimental colitis induced by dextran sulphate sodium(DSS)is characterized by Thl and Th2 tokines[J].Clin Exp Immunol,1998,21(114):385-391.
[11]Mao JW,He XM,Tang HY,etal.Protective role of met alloproteinase inhibitor(AE-941)on ulcerative colitis in rats[J].World J Gastroenterol,2012,18(47):7063-7069.
[12]Razani B,Reichardt AD,Cheng G.Non-canonical NF-kappaB signaling activation and regulation:principles and perspectives[J].Immunol Rev,2011,244(1):44-54.
[13]何雁,王启之,燕善军,等.Toll样受体9和核因子-κBp65在大鼠溃疡性结肠炎模型结肠组织中的表达及其相关性的研究[J].国际免疫学杂志,2011,11(34):384-389.
[14]梁芙蓉,秦建全,沈晓云.凋亡通路中Bax和Bak蛋白的激活模型[J].生命的化学,2011,31(6):856-861.
[15]Chassaing B,Darfeuille MA.The commensal microbiota and enteropathogens in the pathogenesis of inflammatory bowel diseases[J].Gastroenterology,2011,140(4):1720-1728.
[16]Galvez-Llompart M,Recio MC,Garcia-Dome-Nech R.Topological virtual screening:a way to find new compounds active in ulcerative colitis by inhibiting NF-κB[J].Mol Divers,2011,15(4):917-926.
[收稿2015-11-09修回2015-12-28]
(编辑许四平)
Research of roles of NF-κB and promote apoptosis protein Bak in ucelrative colitis
CHEN Xiao,WANG Qi-Zhi,LI Yi-Wen,MA Wen-Jing,YU Dong-Hong.
The First Affiliated Hospital of Bengbu Medical College,Bengbu 233000,China
Objective:To study the expression levels of nuclear factor kappa B,Bcl-2 associated K and TNF-α proteins to discuss the effects of NF-κB and Bak proteins in the pathogenesis of UC.Methods: Eighty clean grade of adult Sprague-Dawley(SD)rats were used,male and female in half and then rando mly selected sixty as the model group,another twenty as the control group.SD rats model were manufactured by a compound method:Trinitrobenzene sulfonic acid(TNBS)+ ethanol.We observed and assessed colonic mucosa by the general morphology and histological changes.To applicated immunohistochemistry and RT-PCR methods to detected the protein and mRNA expression levels of NF-κB,Bak and TNF-α in the model groups and the control group and to analysed their relationships.Results: The successful rate of making model was 97%.The number of inflammatory cells in the model groups more than the control(P<0.01).Group immunohistochemical and RT-PCR,NF-κB and TNF-α proteins and mRNA in UC colon epithelium cells and inflammatory cells were higher than the control(P<0.01).Bak protein in inflammatory cells were lower than the control(P<0.01),but there was no statistical significance in epithelial cells(P>0.05).The expression levels of NF-κB,TNF-α increased as the histological grade increased(P<0.05),however,the expression level of Bak decreased(P<0.05).NF-κB in colonic mucosa of rats with UC had a significantly positive correlation with that of TNF-α(r=0.892,P<0.01),and negatively correlated with that of Bak(r=-0.793,P<0.01).Conclusion: The levels of NF-κB and Bak may be related to the occurrence and development of UC.
NF-κB; Bak;Ucelrative colitis
10.3969/j.issn.1000-484X.2016.09.009
,E-mail:wangqiz2004@sina.com。
陈晓(1984年-),女,硕士,主治医师,讲师,主要从事胃肠道疾病研究,E-mail:chenxiao-0552@163.com。
R574.1
A
1000-484X(2016)09-1286-04

