欧洲女贞花粉主要过敏原Lig v 1理化性质与结构的生物信息学分析①
曹淑芬 李 文 何 颖 邹泽红 李林梅 艾云灿
(中山大学生命科学学院/有害生物控制与资源利用国家重点实验室,广州510275)
·中医中药与免疫·
欧洲女贞花粉主要过敏原Lig v 1理化性质与结构的生物信息学分析①
曹淑芬李文②何颖②邹泽红②李林梅艾云灿
(中山大学生命科学学院/有害生物控制与资源利用国家重点实验室,广州510275)
目的:运用生物信息学相关软件,预测欧洲女贞花粉主要过敏原Lig v 1的理化性质和结构,为Lig v 1重组表达系统的选择和过敏原性改造提供参考。方法:查询文献获得Lig v 1的氨基酸序列,运用生物信息学软件分析其理化性质(ProtParam)、信号肽(SignalP 4.1 Server)、跨膜区(TMHMM Server v.2.0)、二级结构(GOR4)、MHCⅡ类抗原表位(NetMHCⅡ 2.2 Server)、B细胞抗原表位(ProteanTM5.01)以及系统发生树(MEGA 6)。结果:Lig v 1在大肠杆菌中稳定性较好,不存在信号肽与跨膜区;二级结构中无规则卷曲占大多数;Lig v 1潜在MHCⅡ类抗原表位为30~44区域;B细胞抗原表位既具有连续的氨基酸序列,也具有不连续的氨基酸序列;Lig v 1与欧洲白蜡以及木犀榄的同源蛋白进化距离最近。结论:大肠杆菌是适合重组Lig v 1的表达系统,Lig v 1抗原表位分析为低过敏原性改造提供参考。
欧洲女贞;过敏原;生物信息学软件;Lig v 1;抗原表位
过敏性疾病是当今世界性的重大卫生学问题。世界变态反应组织对30个国家过敏性疾病流行病调查结果表明,在这些国家的12亿人口中,22%的人口患有依赖于IgE介导的各类过敏性疾病,如过敏性哮喘、过敏性鼻炎、食物过敏、药物过敏,过敏性疾病严重影响了人们的生活质量,甚至威胁人类生命[1]。过敏原特异性免疫治疗是唯一可以改变过敏性疾病自然进程的治疗方法,成功的过敏原特异性免疫治疗取决于标准化、可持续生产、高质量的过敏原疫苗;过敏原提取物的质量对临床特异性诊断的准确性及治疗的有效性都是至关重要的[2]。国际上使用的过敏原疫苗有过敏原提取物和重组过敏原,过敏原提取物成分复杂,过敏原标准化程序繁琐,而重组过敏原成分明确,有利于标准化生产,可以保证治疗的疗效和安全性,同时重组过敏原可以有针对性地改造过敏原的抗原表位,降低过敏原性,从而获得低过敏原性的过敏原疫苗,提高疫苗的安全性[3,4]。
前期研究中,我们对510个过敏原进行聚类分析,并将蛋白质数据库中不同物种来源的60条主要过敏原序列聚类成有着明显差异的7个簇以后,逐步聚类缩减到21个氨基酸序列无任何相关性的代表性过敏原,大大减少了重组过敏原的工作量[5,6]。欧洲女贞(Ligustrum vulgare) 花粉主要过敏原Lig v 1是21个代表性过敏原之一,有关Lig v 1的结构与功能报道较少。本研究利用生物信息学技术分析Lig v 1的理化性质和结构,为Lig v 1重组表达系统的选择和低过敏原性改造提供参考。
1 材料与方法
1.1 Lig v 1的氨基酸序列获取查询文献,搜索欧洲女贞花粉主要过敏原Lig v 1的氨基酸序列。
1.2Lig v 1的理化性质预测使用ProtParam(http://web.expasy.org/protparam/),预测Lig v 1的理化性质,包括分子量、等电点、氨基酸组成、原子组成、消光系数、半衰期、不稳定指数、脂肪指数以及总平均亲水值。预测Lig v 1水溶液(1 g/L)在280 nm处光吸收。不稳定指数小于40,则预测该蛋白为稳定;不稳定指数大于40,则预测该蛋白为不稳定。
1.3Lig v 1的信号肽预测通过SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP)[7],预测Lig v 1的信号肽。C-score表示原始切割位点评分,用于判断信号肽切割位点,紧随信号肽切割位点后的位置(即成熟蛋白的第一个氨基酸残基)具有C-score高峰。S-score表示信号肽评分,用于区分信号肽与成熟蛋白以及无信号肽的蛋白。Y-score表示综合切割位点评分,通过几何平均综合S-score的斜率与C-score而获得。一段氨基酸序列中可能存在多个C-score高峰,选择同时具有C-score高峰与S-score高斜率的位点作为切割位点。S平均值表示信号肽(第一个氨基酸残基至Y-score的前一个氨基酸残基)的S-score平均值。D-score表示区别评分,为S平均值与Y-score最高峰的加权平均数,用于区别信号肽与非信号肽序列。对于非分泌蛋白,以上评分均极低,接近阴性值0.1。
1.4Lig v 1的跨膜区预测运行TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMH-MM)[8],预测Lig v 1的跨膜区。若预测获得的跨膜区多于18个氨基酸,则该蛋白极可能具有跨膜区或信号肽。蛋白前60个氨基酸中,若存在数个跨膜氨基酸,则需考虑N端的跨膜区是否为信号肽。若整个序列被标注为inside或outside(不能用于预测蛋白定位),则表示该蛋白不存在跨膜区。
1.5Lig v 1的二级结构预测采用GOR4(http://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)[9],预测Lig v 1的二级结构。
1.6Lig v 1的MHCⅡ类抗原表位预测运用NetMHCⅡ 2.2 Server(http://www.cbs.dtu.dk/services/NetMHCⅡ/),预测Lig v 1 的MHCⅡ类抗原表位[10,11]。以每13个相邻氨基酸为一段待测多肽,预测其与MHCⅡ类亲和力(Affinity),强亲和力阈值50 nmol/L,弱亲和力阈值500 nmol/L,转化为数值1-log(Affinity)/log(50 000),分别为0.638 4与0.425 6[12]。
1.7Lig v 1的B细胞抗原表位预测采取ProteanTM5.01(DNASTAR,Madison,WI)中的Jameson-Wolf方案预测Lig v 1的抗原指数,选取抗原指数不低于1的位点作为B细胞抗原表位[13]。
1.8Lig v 1的交叉过敏反应预测选择BLAST工具(http://www.uniprot.org/blast/),搜索Lig v 1潜在的同源蛋白,入选标准:连续80个氨基酸同一性大于35%[14]。经由Clustal Omega工具(http://www.ebi.ac.uk/Tools/msa/clustalo/)进行氨基酸序列比对。选取MEGA 6软件中的邻位相连(N-J)方法得到系统发生树[15]。
2 结果
2.1Lig v 1的氨基酸序列获取Batanero等[16]报道了欧洲女贞花粉主要过敏原Lig v 1的氨基酸序列,该过敏原被UniProt数据库收录为O82015。
2.2Lig v 1的理化性质预测Lig v 1等电点为5.91,由145个氨基酸组成,含有18个带负电氨基酸(天冬氨酸与谷氨酸)、17个带正电氨基酸(精氨酸与赖氨酸),谷氨酸含量(12个,占8.3%)最高,其次为甘氨酸、亮氨酸、赖氨酸、脯氨酸、苏氨酸以及缬氨酸(均为11个,分别占7.6%)。分子式为C732H1147N191O218S9,分子量为16 399.8 Da。若半胱氨酸均形成胱氨酸,则其消光系数为13 325 M-1cm-1,吸光度为0.813;若半胱氨酸均不形成胱氨酸,则其消光系数为12 950 M-1cm-1,吸光度为0.79。Lig v 1在大肠杆菌、哺乳动物网状细胞(体外)以及酵母中半衰期分别为10 h以上、1 h以及30 min。Lig v 1不稳定指数为40.3,提示其为不稳定蛋白。Lig v 1脂肪系数为75.17,提示其不耐热。Lig v 1总平均亲水值为-0.376,提示其易溶于水。
2.3Lig v 1的信号肽预测Lig v 1信号肽预测结果(图1)显示,第25个位点精氨酸的C-score为最大值0.137;第25个位点精氨酸的Y-score为最大值0.114;第38个位点甘氨酸的S-score为最大值0.137;第1至24个位点的S平均值为0.095;第1至24个位点的D-score为0.104,远低于D-score阈值0.45,预测Lig v 1不存在信号肽。
2.4Lig v 1的跨膜区预测Lig v 1跨膜区预测结果(图2)显示,跨膜区氨基酸数目、蛋白前60个位点存在的跨膜氨基酸数目,以及N端存在于细胞质一侧的可能性均约为0,整个序列被标注为outside,因此不存在跨膜区。
2.5Lig v 1的二级结构预测Lig v 1二级结构预测结果(图3)显示,无规则卷曲占大多数(64.83%);其次为延伸链(27.59%);α-螺旋所占比例最少(7.59%),集中于第60至第69位氨基酸。
2.6Lig v 1的MHCⅡ类抗原表位预测MHCⅡ类抗原表位预测结果(图4)显示,Lig v 1有43个肽段与MHCⅡ具有强亲和力,包括以下区域:22~45,52~92、99~145,亲和力最强为32~44区域;具有弱亲和力的肽段为102个。潜在MHCⅡ类抗原表位为30~44区域。与强亲和力相关的基因型为HLA-DQA10501-DQB10301、HLA-DRB10101、HLA-DRB10301、HLA-DRB10401、HLA-DRB10404、HLA-DRB10405、HLA-DRB10701、HLA-DRB10901、HLA-DRB11101、HLA-DRB11302与HLA-DRB50101,提示具有以上基因型的人对Lig v 1产生过敏反应的可能性较高。
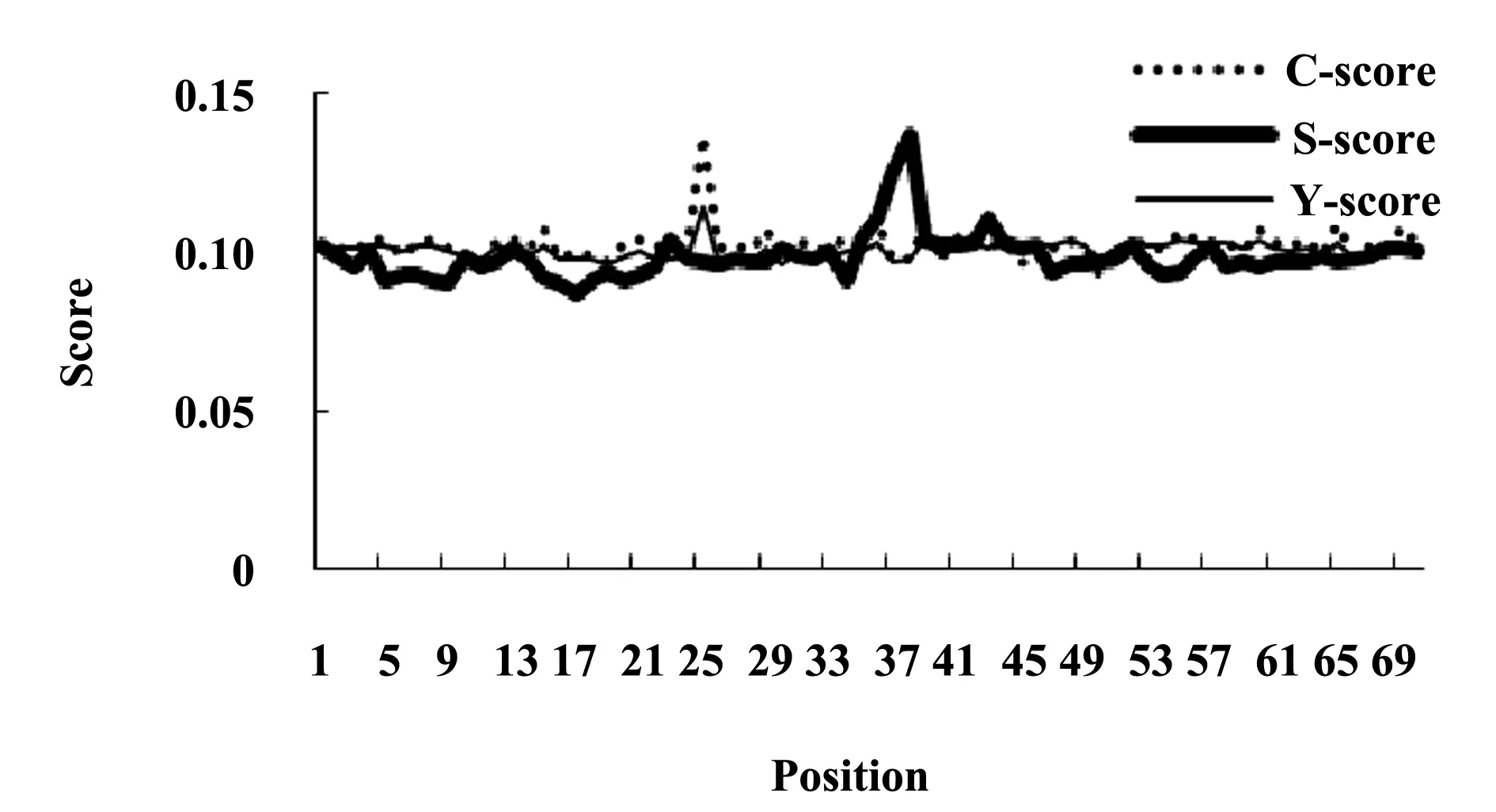
图1 Lig v 1的信号肽预测Fig.1 Prediction of signal peptide:Lig v 1
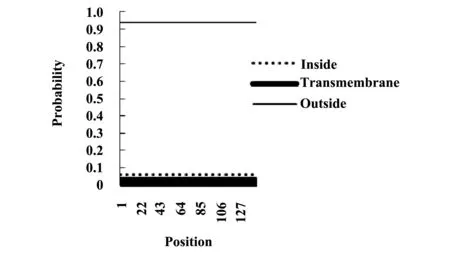
图2 Lig v 1的跨膜区预测Fig.2 Prediction of transmembrane helix:Lig v 1
2.7Lig v 1的B细胞抗原表位预测预测结果(图5)显示,Lig v 1的B细胞抗原表位存在连续的氨基酸序列与单个氨基酸,推测B细胞抗原表位由线性表位与构象表位组成。潜在B细胞抗原表位存在于以下氨基酸位点:1~7、21~23、26、42~50、52、84~95、97~99、102、103、111~113、126~131。
2.8Lig v 1的交叉过敏反应预测在UniProt数据库中搜索获得Lig v 1潜在的同源蛋白,所属物种及登录号如下:梣属欧洲白蜡(Q7XAV4)、木犀榄属木犀榄(P19963)、拟南芥属拟南芥(Q9LP44)、芸苔属欧洲油菜(A0A078EG50)、鼠耳芥属琴叶拟南芥(D7MCQ3)、可可属可可树(A0A061GFS0)、桦木属垂枝桦(O49813)以及苜蓿属蒺藜苜蓿(B7FGN2)。Lig v 1与欧洲白蜡及木犀榄中同源蛋白的序列相似度较高,分别为91.0%及86.9%,并且系统发生树(图6)显示,Lig v 1与这两种蛋白进化距离最近,更可能发生交叉过敏反应。
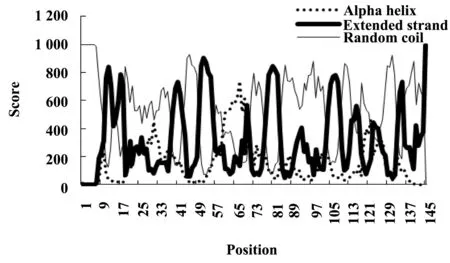
图3 Lig v 1的二级结构预测Fig.3 Prediction of secondary structure:Lig v 1
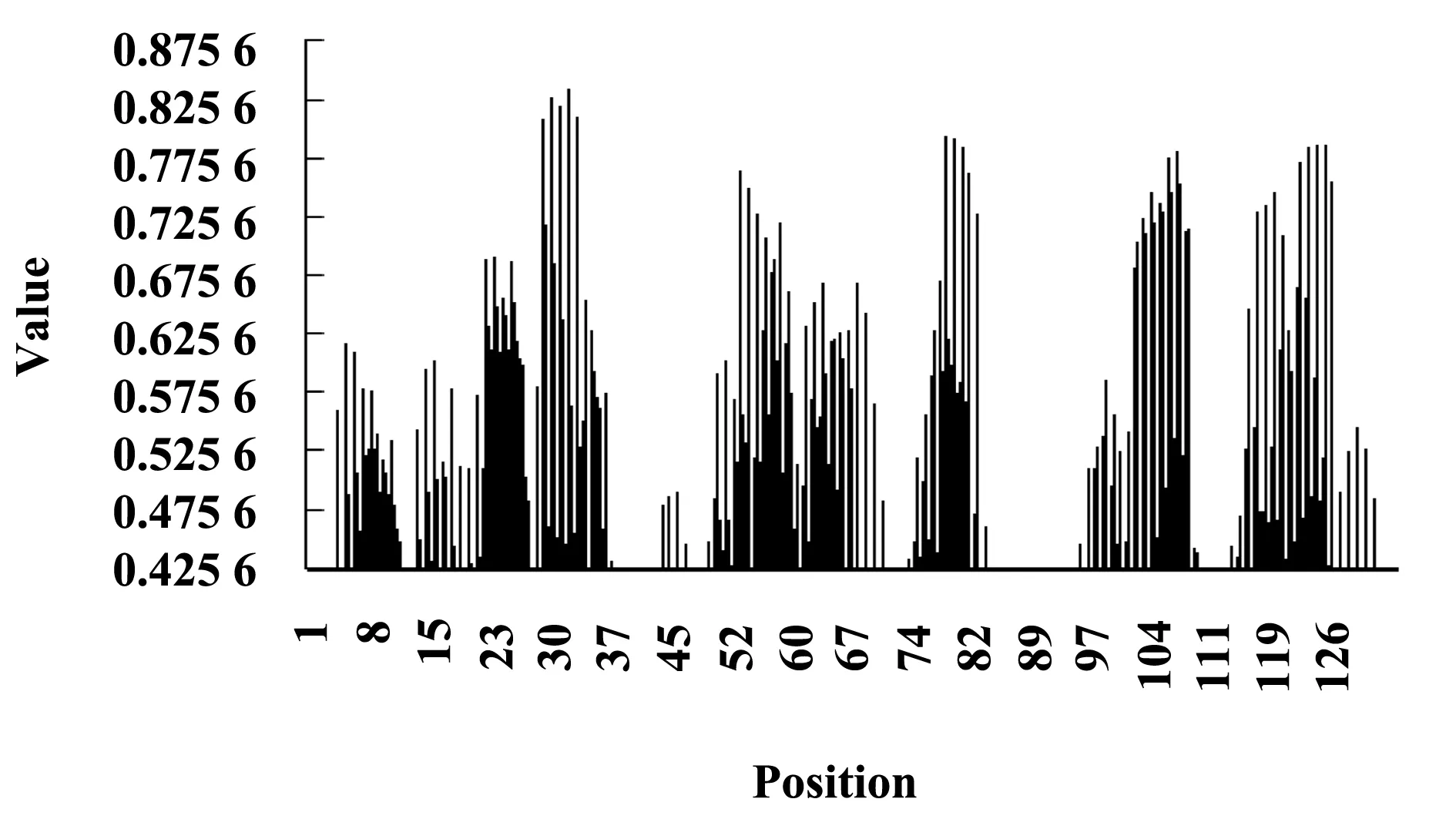
图4 Lig v 1的MHCⅡ类抗原表位预测Fig.4 Prediction of MHCⅡ epitopes:Lig v 1
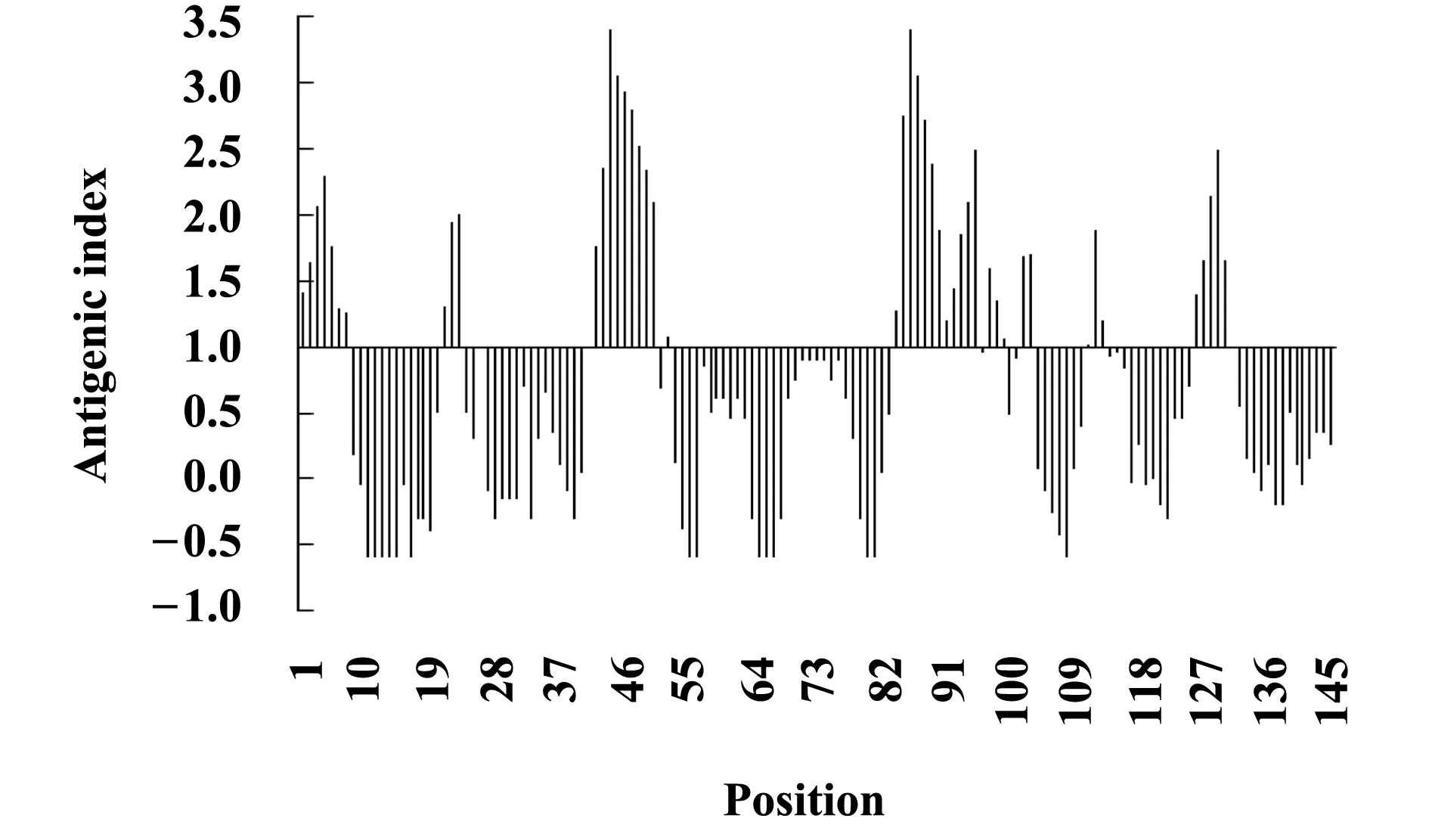
图5 Lig v 1的B 细胞抗原表位预测Fig.5 Prediction of B-cell epitopes:Lig v 1
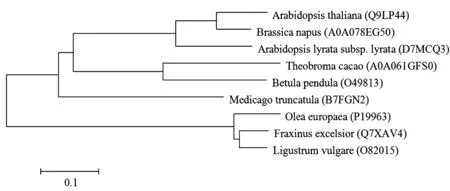
图6 Lig v 1的系统发生树Fig.6 Phylogenetic tree for Lig v 1
3 讨论
常见的重组蛋白表达系统包括大肠杆菌、枯草芽孢杆菌、链霉菌、酵母、昆虫、杜氏盐藻、植物和哺乳动物细胞,其中大肠杆菌、酵母表达重组蛋白具有流程简单、成本低和产量高的特点,广泛应用于过敏原的重组表达[16,17]。Lig v 1在大肠杆菌中半衰期大于10 h,而在酵母中半衰期仅为30 min,这提示用大肠杆菌表达Lig v 1更稳定,表达重组过敏原Lig v 1优先选择大肠杆菌。不稳定指数与脂肪系数预测结果提示,Lig v 1可能不稳定且不耐热,在蛋白表达、纯化与保存等操作中应在低温下进行。Lig v 1的总平均亲水值预测其为亲水蛋白,可能较易溶于水溶液,如生理盐水和磷酸盐缓冲液,利于动物模型建立与细胞实验等方面的应用。此外,Lig v 1不存在信号肽与跨膜区(图1、2),这提示该蛋白不是分泌蛋白和跨膜蛋白。
自从Freeman首次使用过敏原特异性免疫治疗成功治疗枯草热,过敏原特异性免疫治疗已经有100多年历史[18]。传统的过敏原特异性免疫治疗都采用过敏原提取液,最近人们开始探索表位疫苗和低过敏原性的过敏原疫苗的应用。Chen等[19]构建屋尘螨过敏原Der p 1/Der p 2的多表位疫苗,该疫苗缺乏IgE反应性,但保留T细胞反应性,能够诱导产生IgG,从而阻断IgE反应,具有潜在治疗效果。Marazuela等[17]在桦树花粉中发现一种与Ole e 1同源的非过敏性蛋白,在此基础上对Ole e 1过敏原4个氨基酸位点进行突变,获得的Ole e 1突变体T细胞反应性不变而IgE反应性降低。设计表位疫苗或低过敏原性的过敏原疫苗首先要求对过敏原的抗原表位进行分析和鉴定。Karplus等[20]认为,蛋白质结构中柔韧性大的区域易形成抗原表位。由于α-螺旋与延伸链这两种二级结构由氢键维系,结构稳定,柔韧性低于无规则卷曲,所以抗原表位常见于无规则卷曲。本研究利用生物信息学软件预测Lig v 1的MHCⅡ类抗原表位和B细胞抗原表位,发现大部分均由无规则卷曲组成(图4、5)。后续研究将对Lig v 1的MHCⅡ类抗原表位进行定点突变,降低其过敏原性,为欧洲女贞花粉过敏性疾病提供安全有效的候选疫苗。系统发生树分析表明,Lig v 1与欧洲白蜡以及木犀榄的同源蛋白进化距离最近(图6),且这三者同属于木犀科植物,提示这三种过敏原可能存在交叉过敏反应,未来通过定点突变获得低过敏原性Lig v 1突变体,将对三种过敏原引起的过敏性疾病都有潜在的治疗效果。
本研究利用生物信息学软件分析欧洲女贞花粉主要过敏原Lig v 1的理化性质和结构,为蛋白克隆表达及纯化提供理论支持,而MHCⅡ类抗原表位及系统发生树分析为后续Lig v 1 的单克隆抗体设计、抗原表位疫苗设计、过敏原性改造乃至脱敏治疗等深入研究提供了参考。
[1]Warner JO,Kaliner MA,Crisci CD,etal.Allergy practice worldwide:a report by the World Allergy Organization Specialty and Training Council[J].Int Arch Allergy Immunol,2006,139(2):166-174.
[2]Bousquet J,Lockey R,Malling HJ.Allergen immunotherapy:therapeutic vaccines for allergic diseases.A WHO position paper[J].J Allergy Clin Immunol,1998,102(4 Pt 1):558-562.
[3]Valenta R,Niespodziana K,Focke-Tejkl M,etal.Recombinant allergens:what does the future hold?[J].J Allergy Clin Immunol,2011,127(4):860-864.
[4]Valenta R,Linhart B,Swoboda I,etal.Recombinant allergens for allergen-specific immunotherapy:10 years anniversary of immunotherapy with recombinant allergens[J].Allergy,2011,66(6):775-783.
[5]陶爱林,邹泽红,赖荷,等.主要过敏原的物种分布及逐步聚类分析[J].中华微生物学和免疫学杂志,2007,27(5):451-456.
[6]He Y,Liu X,Huang Y,etal.Reduction of the number of major representative allergens:from clinical testing to 3-dimensional structures[J].Mediators Inflamm,2014,2014(1):1-11.
[7]Petersen TN,Brunak S,von Heijne G,etal.SignalP 4.0:discri minating signal peptides from transmembrane regions[J].Nat Methods,2011,8(10):785-786.
[8]Sonnhammer EL,von Heijne G,Krogh A.A hidden Markov model for predicting transmembrane helices in protein sequences[J].Proc Int Conf Intell Syst Mol Biol,1998,6:175-182.
[9]Combet C,Blanchet C,Geourjon C,etal.NPS@:network protein sequence analysis[J].Trends Biochem Sci,2000,25(3):147-150.
[10]Nielsen M,Lund O.NN-align.An artificial neural network-based alignment algorithm for MHC class Ⅱ peptide binding prediction[J].BMC Bioinformatics,2009,10(296):1-10.
[11]Nielsen M,Lundegaard C,Lund O.Prediction of MHC class II binding affinity using SMM-align,a novel stabilization matrix alignment method[J].BMC Bioinformatics,2007,8(238):1-12.
[12]Nielsen M,Lundegaard C,Worning P,etal.Reliable prediction of T-cell epitopes using neural networks with novel sequence representations[J].Protein Sci,2003,12(5):1007-1017.
[13]Jameson BA,Wolf H.The antigenic index:a novel algorithm for predicting antigenic deter minants[J].Comput Appl Biosci,1988,4(1):181-186.
[14]Goodman RE.Practical and predictive bioinformatics methods for the identification of potentially cross-reactive protein matches[J].Mol Nutr Food Res,2006,50(7):655-660.
[15]Tamura K,Stecher G,Peterson D,etal.MEGA6:molecular evolutionary genetics analysis version 6.0[J].Mol Biol Evol,2013,30(12):2725-2729.
[16]Batanero E,González de la Pea MA,Villalba M,etal.Isolation,cDNA cloning and expression of Lig v 1,the major allergen from privet pollen[J].Clin Exp Allergy,1996,26(12):1401-1410.
[17]Marazuela EG,Hajek R,Villalba M,etal.A non-allergenic Ole e 1-like protein from birch pollen as a tool to design hypoallergenic vaccine candidates[J].Mol Immunol,2012,50(1-2):80-90.
[18]Freeman J.Vaccination against hay fever:report of results during the first three years[J].Lancet,1914,183(4730):1178-1180.
[19]Chen KW,Blatt K,Thomas WR.Hypoallergenic Der p 1/Der p 2 combination vaccines for immunotherapy of house dust mite allergy[J].J Allergy Clin Immunol,2012,130(2):435-443.
[20]Karplus PA,Schulz GE.Prediction of chain flexibility in proteins[J].Naturwissenschaften,1985,72(4):212-213.
[收稿2015-11-06修回2015-11-30]
(编辑倪鹏)
In silico prediction for physicochemical properties and structure of major pollen allergen Lig v 1 in Ligustrum vulgare
CAO Shu-Fen,LI Wen,HE Ying,ZOU Ze-Hong,LI Lin-Mei,AI Yun-Can.
School of Life Sciences/State Key Laboratory of Biocontrol,Sun Yat-Sen University,Guangzhou 510275,China
Objective:To analyse the physicochemical properties and structure of major privet pollen allergen Lig v 1 using bioinformatics software and provide a reference for choosing suitable recombinant expression system for Lig v 1 and modifying the allergen Lig v 1 experimentally.Methods: The physicochemical properties were analysed by ProtParam,the signal peptide by SignalP 4.1 Server,the transmembrane helix by TMHMM Server v.2.0,the secondary structure by GOR4,MHCⅡ epitopes by NetMHCⅡ 2.2 Server,B-cell epitopes by ProteanTM5.01 and the phylogenetic tree by MEGA 6.Results: Privet major pollen allergen Lig v 1 was stable in Escherichia coli and it doesn′t possess any signal peptide and transmembrane helix.Most secondary structures of Lig v 1 were random coils.Potential region of MHCⅡ epitope of Lig v 1 was 30-44.Potential B-cell epitopes possess discontinuous and continuous a mino acid sequences.Lig v 1 and its counterparts from Fraxinus excelsior and Olea europaea were clustered into one group.Conclusion: Escherichia coli is the suitable expression system for recombinant Lig v 1.In silico prediction of the epitopes of Lig v 1 provides a reference for modifying the allergen Lig v 1 experimentally.
Ligustrum vulgare;Allergen;Bioinformatics software;Lig v 1;Epitope
10.3969/j.issn.1000-484X.2016.09.010
曹淑芬(1990年-),女,在读硕士,主要从事重组过敏原蛋白的过敏原性评价方面的研究,E-mail: caosf@hotmail.com。
及指导教师:艾云灿(1963年-),男,博士,教授,主要从事微生物学方面的研究,E-mail: lssayc@mail.sysu.edu.cn。
R392.8
A
1000-484X(2016)09-1291-05
①本文为国家重大科技专项(2014ZX0801105B)。
②呼吸疾病国家重点实验室变态反应研究室/变态反应国家临床重点专科/广东省过敏反应与免疫重点实验室/广州医科大学附属第二医院,广州510260。

