伊马替尼诱导原代T细胞凋亡作用机制研究①
陈小华 邱华云 施珊珊 吴 莎 林 晨 李扬秋
(韶关学院医学院,韶关512000)
伊马替尼诱导原代T细胞凋亡作用机制研究①
陈小华邱华云施珊珊②吴莎②林晨②李扬秋③
(韶关学院医学院,韶关512000)
目的:研究伊马替尼(IM)诱导正常人原代CD3+T细胞凋亡的分子机制。方法:0~100 nmol/L的IM作用原代T细胞24 h后,应用流式细胞术检测细胞凋亡情况;应用实时荧光定量PCR技术检测Caspase-3、Caspase-8、A20和NF-κB基因表达变化;应用Western blot技术检测A20和NF-κB蛋白表达变化。结果:IM具有明显促T细胞凋亡能力,其凋亡分子Caspase-3 和A20基因表达水平均上调,而NF-κB的基因和蛋白水平均下调。结论:IM通过上调A20的表达诱导了T细胞的凋亡。
伊马替尼;原代CD3+T细胞;TNF-α诱导蛋白3;核转录因子
慢性粒细胞白血病(Chronic myeloid leukemia,CML)是一类髓系增生性血液肿瘤,染色体异常是CML的直接病因,由9、22号染色体转位而成并含有bcr/abl融合基因,该基因转录翻译为BCR/ABL融合蛋白,而该融合蛋白的靶向药物伊马替尼(Imatinib mesylate,IM),是目前临床上用于治疗CML慢性期的一线药物[1,2]。但临床研究报道其具有抑制机体免疫功能的副作用,尤其是抑制T细胞的能力[2-4]。细胞免疫在抗肿瘤中发挥重要的作用,T细胞的凋亡活动与细胞内一系列信号分子的转导有关,如Caspase-3、Caspase-8、A20和NF-κB等[5]。
1 材料与方法
1.1材料1640培养基购自Gibco;小牛血清购自Hyclone;TRIzol购自康为世纪公司;伊马替尼购自Sigma;逆转录和荧光定量PCR试剂盒购自Toyobo;细胞裂解液和BCA试剂盒购自凯基生物公司;A20抗体购自Abcam、NF-κB p65抗体购自CST;凋亡试剂盒购自联科生物公司;引物由上海生工公司合成。
1.2方法
1.2.1分离人外周血单个核细胞实验所需人外周血在征得本人同意后,采自5位正常人。步骤如下:静脉抽血10 ml,加到准备好的抗凝管中,混匀。将血液转移至50 ml离心管中,用PBS将血稀释一倍[6]。稀释好的血液沿管壁缓慢加到淋巴细胞分离液中,2 000 r/min水平离心×20 min。小心吸取单个核细胞至新离心管。PBS洗细胞2次,每次1 000 r/min×10 min。
1.2.2CD3+T细胞分选取得到的PBMCs细胞,应用MACS技术分选CD3+T:分离缓冲液(含2 mol/L EDTA和0.5%胎牛血清)洗涤PBMCs 2次,调整细胞悬液浓度为1×107个/ml;将悬浮细胞离心弃上清,按107个总细胞加入40 μl PBS缓冲液和10 μl CD3磁珠单抗,充分混匀,4 ℃孵育15~30 min;加入1 ml缓冲液混匀,1 500 r/min离心10 min,弃上清;加入500 μl缓冲液混匀配制细胞悬液;将500 μl缓冲液缓慢流过磁柱,冲洗磁柱一遍,500 μl总细胞悬液缓慢通过磁柱,收集非CD3+细胞,将500 μl缓冲液缓慢冲洗并收集流出液,重复洗涤2遍;将磁柱从磁座移开,更换离心管。将500 μl缓冲液加入磁柱,用推进器用力加压,收集CD3+T细胞。加入500 μl缓冲液重复洗涤2次,收集CD3+T细胞,将收集的CD3+T细胞计数。
表1实时荧光定量PCR引物
Tab.1Primers for Real-time fluorescence quantitative PCR

TargetAccessionNo.ForwardReverseLength(bp)β2mNMOL/L_004048.2TACACTGAATTCACCCCCACCATCCAATCCAAATGCGGCA145A20NMOL/L_001270508.1CTGGGACCATGGCACAACTCCGGAAGGTTCCATGGGATTC182NF-κBp65NMOL/L_001165412.1CCACAAGACAGAAGCTGAAGAGATACTATCTGTAAGTGAACC149Caspase-3NM_004346.3TCCTTTTCCTTTGACGCTACTTCCACCAACCAACCATTTCTTTA109Caspase-8NM_001080124.1GATTCAGAGGAGCAACCCTATTTCATCCCCAGCAGAAAGTCAG90
1.2.3细胞凋亡测定(Annexin V- PI双染)调整原代T细胞数量为4×106个/ml,细胞悬液加入24孔板中,每孔100 μl;IM刺激组(25~100 nmol/L);SEA联合IM组:SEA(10 ng/ml)预处理4 h,接着IM处理24 h;同时设空白对照,每组设置三个复孔。37 ℃培养箱中培养24 h后,离心收集细胞。PBS洗一遍后重悬,送样,正常细胞分出200 μl不染色。1 000 r/min离心5 min离心弃上清,加200 μl Binding Buffer混匀。加5 μl Annexin V-FITC,室温避光孵育10 min。离心弃上清,加200 μl Binding Buffer混匀后再染色,上机。
1.2.4RNA提取将原代T细胞置于完全培养液中,于恒温培养箱中培养。取对数期的原代T细胞离心、洗涤、细胞计数后,分别接种于24孔板中,每孔2 ml,含4 × 106个细胞。分组:50 nmol/L IM刺激原代T细胞组,阴性对照组。各组复孔。持续刺激24 h后,采用异硫氰酸胍-苯酚-氯仿法提取RNA,并依据试剂盒说明书,用随机引物合成cDNA 第一链。
1.2.5实时荧光定量PCRβ2m、A20和NF-κB p65亚单位基因序列根据文献提取[7],Caspase-3和Caspase-8则自己设计,见表1。反应体系为20 μl,其中含上下游引物浓度为0.3 μmol/L,cDNA 1.0 μl,去离子水12.8 μl ,MasterMix 10 μl。反应条件为预变性95℃ 3 min,扩增40个循环,每循环包括95℃变性1 min,60℃退火30 s,72℃,于68℃读板一次,最后以0.15℃/s的速度从55℃到95℃每隔1 s记录一次荧光值,获得融解曲线。所有反应均在Bio-Rad实时荧光定量PCR仪上进行[7]。
1.2.6相对定量分析采用相对定量法分析各组基因表达水平的差异,以β2m为内参对照,计算公式为相对表示量=2-ΔΔCt,其中Ct值为扩增曲线达到阈值所需循环数,ΔCt为组内目的基因与内参Ct值之差,ΔΔCt为组间ΔCt之差。2-ΔΔCt<1表示基因表达减少,2-ΔΔCt>1则表示基因表达增高。
1.2.7Western blot
1.2.7.1蛋白提取反应体系分为两组:对照组和IM 处理组,各组复孔,24 h后收集细胞并离心,加入200 μl细胞裂解液,置冰上裂解30 min,每隔10 min轻轻振荡1次,4 ℃ 12 000 r/min离心20 min,保留上清,用BCA法测定样品蛋白浓度。
1.2.7.2SDS-PAGE电泳等量蛋白上样(50 μg),10% SDS-PAGE电泳,采用半干转的方式将蛋白转移到PVDF膜上,将膜室温封闭30 min,PBST洗涤3次,每次10 min。将膜放入新配置一抗溶液中4 ℃过夜。PBST洗3次,每次10 min,将膜放入新配置二抗溶液中,室温下2~4 h,PBST洗3次,每次10 min,ECL室温显色。
2 结果
2.1IM对T细胞凋亡影响不同浓度的IM(10、50、100 nmol/L)刺激CD3+T细胞24 h后,利用Annexin V-PI双染流式细胞术检测细胞凋亡情况,结果显示与对照组相比,50和100 nmol/L IM均可促进T细胞凋亡,而超抗原SEA则可抑制IM对T细胞的促凋亡作用,见图1。
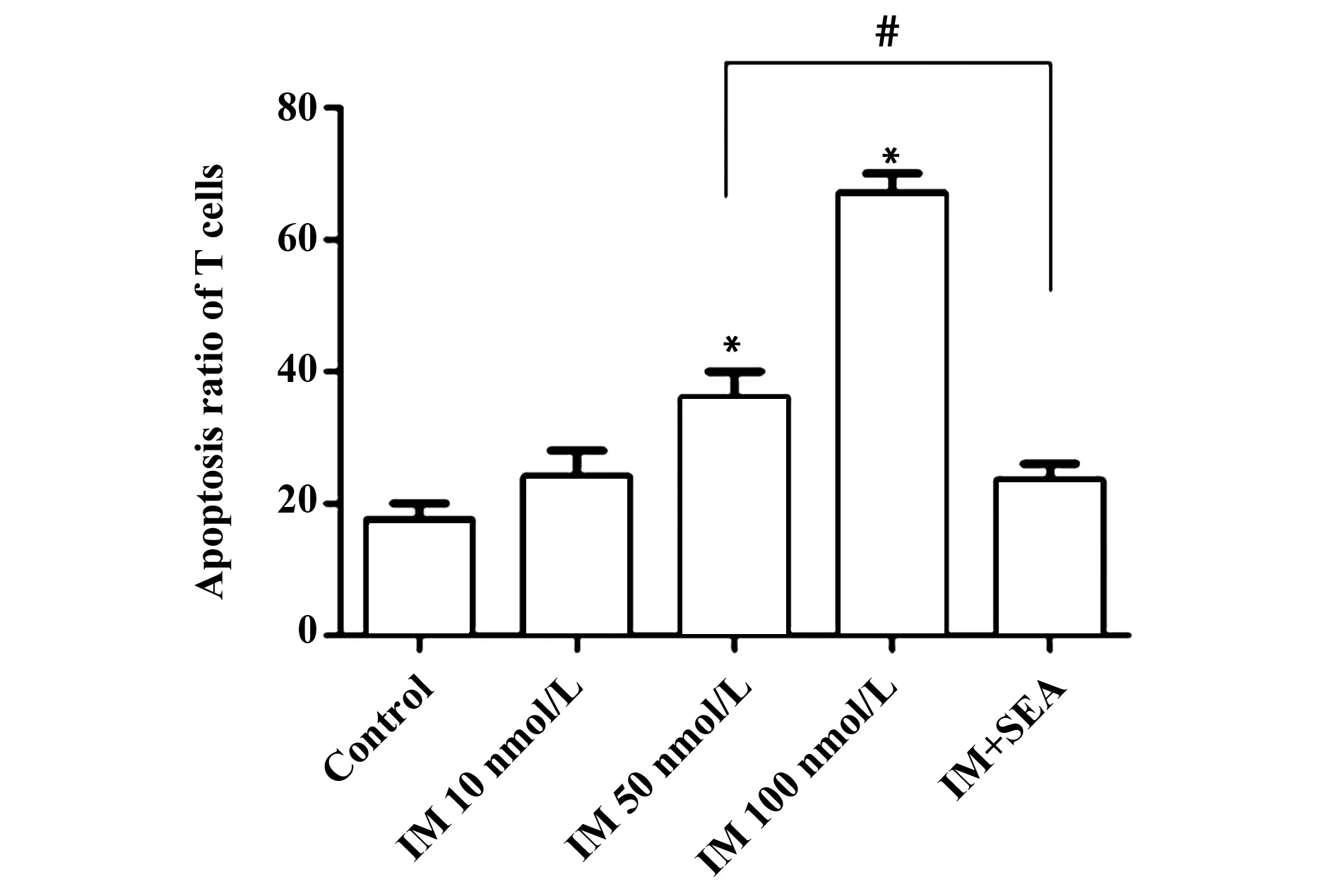
图1 不同浓度IM刺激CD3+T细胞24 h的凋亡作用Fig.1 Apoptosis of CD3+T cells stimulated with different concentrations of IMNote: *.P<0.05 vs control;#.P<0.05.

图2 实时荧光定量基因融解曲线Fig.2 Real-time fluorescence quantitative PCR melt-ing curves
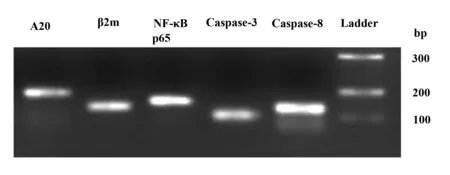
图3 实时荧光定量PCR产物鉴定Fig.3 Identification of RT-PCR products
2.2PCR产物的鉴定分析为了评估PCR反应的特异性,对各基因(Caspase-3、Caspase-8、A20、NF-κB p65亚单位、β2m)融解曲线进行分析,结果显示各基因分别在80.0℃、81.5℃、85.5℃、85.0℃和85.0℃均只有一个单峰(图2)。10 g/L琼脂糖电泳随机标本中Caspase-3、Caspase-8、A20、NF-κB p65亚单位和β2m,结果显示PCR产物片段大小分别为109、90、182、149和145 bp,说明PCR结果准确无误(图3)。
2.3对凋亡相关基因表达的影响5例正常人外周血CD3+T细胞,在50 nmol/L浓度IM作用下,Caspase-3 和A20基因的表达水平>1,表示两者基因表达均上调;NF-κB p65亚单位基因的表达水平<1,表示NF-κB p65亚单位基因表达下调,见图4。
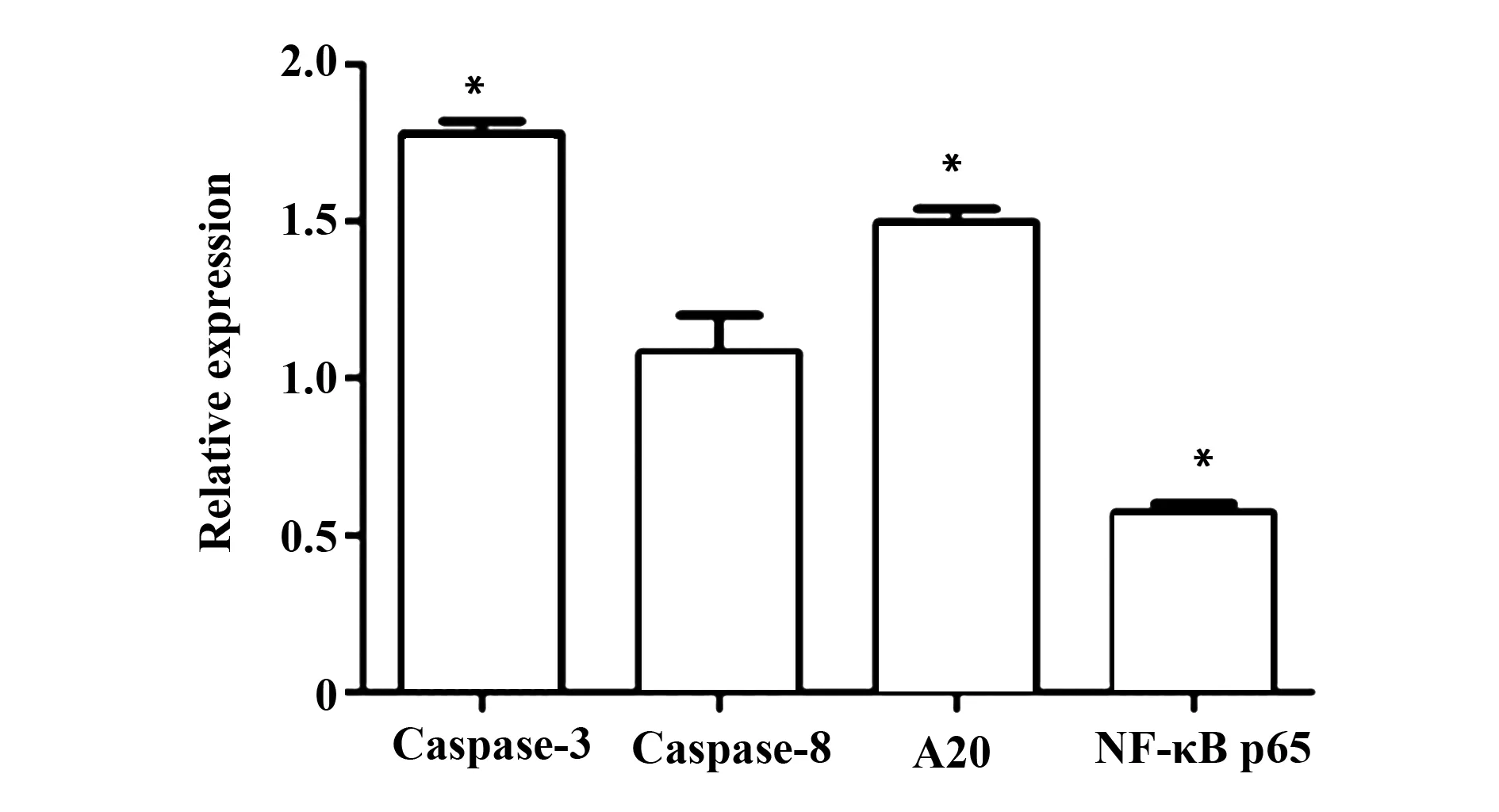
图4 IM刺激T细胞24 h后基因表达情况Fig.4 Changes of gene expression after T cells stimulated by 50 nmol/L IMNote: *.P<0.05 vs control.
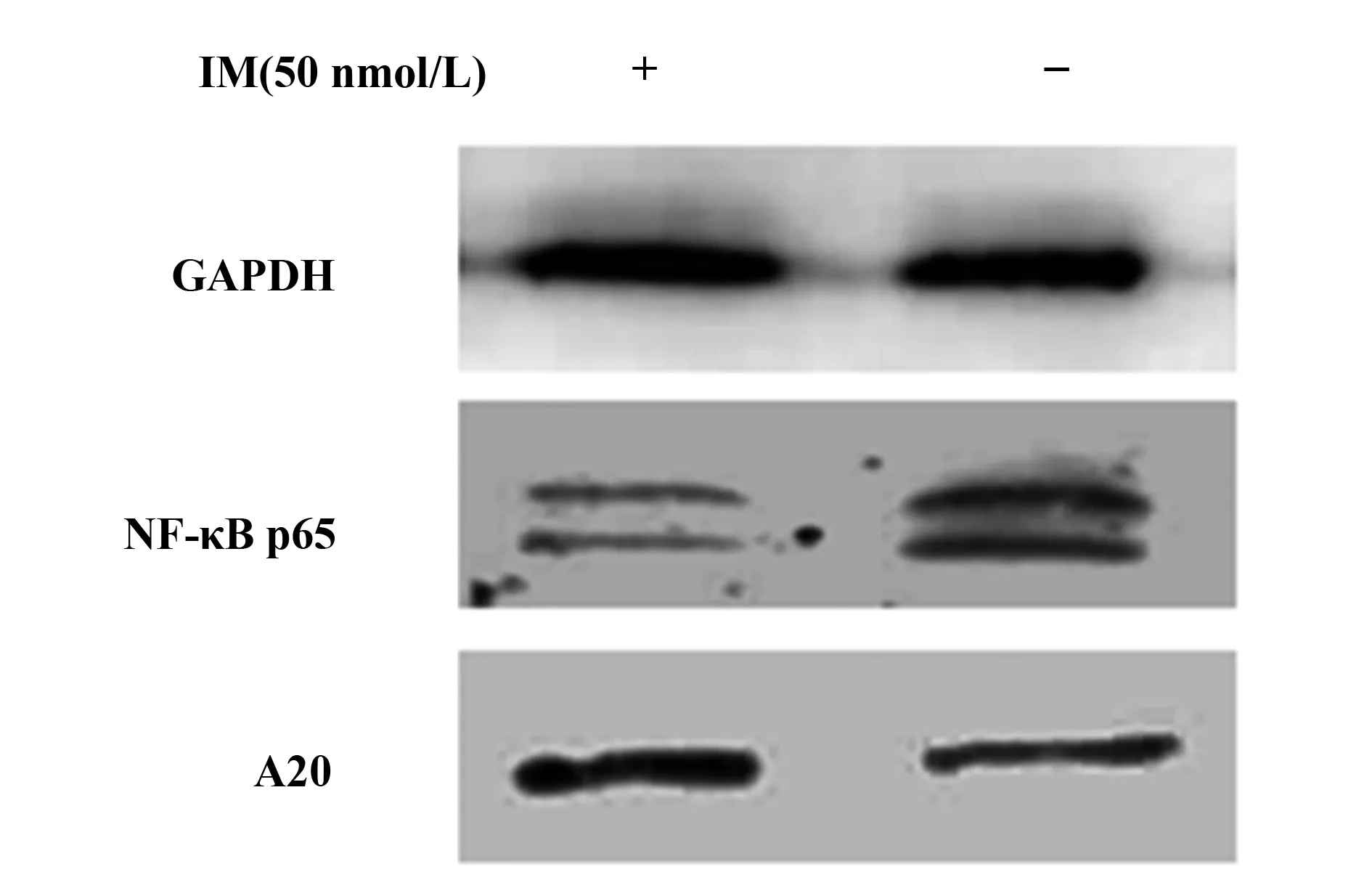
图5 50 nmol/L IM刺激T细胞24 h后NF-κB p65和A20蛋白表达情况Fig.5 NF-κB and A20 protein expression after stimulated by 50 nmol/L IM for 24 h
2.4 NF-κB p65亚单位 、A20蛋白表达的情况考虑NF-κB与凋亡的关联性,我们使用50 nmol/L浓度IM作用 T细胞24 h,与对照组相比,NF-κB p65亚单位蛋白的表达水平明显下调,而A20蛋白的表达水平明显上调,这与其基因表达变化一致,见图5。
3 讨论
实时荧光定量PCR技术是通过检测靶基因转录水平,间接反映目标蛋白表达的方法。尽管,近来有学者对该技术检测的结果提出质疑,但一直以来仍被许多实验室采用[8,9]。当然,实时荧光定量PCR技术只是初步观察变化情况,并不是唯一的观察指标,还需要结合其他方法加以佐证,如WB等。
IM因具有靶向抑制BCR/ABL激酶作用而作为临床治疗CML慢性期的一线药物,但临床使用的同时也发现其具有抑制患者免疫功能的作用,特别是抑制T细胞激活的能力[2-4]。有文献报道NF-κB信号通路与细胞的激活密切相关。毛细胞白血病(HCL)是一种罕见的慢性B细胞增生性疾病,Nagel等[10]报道不管是HCL细胞株还是HCL病人的样本中,NF-κB通路均被异常激活,导致了B细胞的持续增生和凋亡抑制。Wei等[11]也发现SQSTM1基因存在于自噬缺陷的肿瘤细胞中,SQSTM1代偿性地激活NF-κB信号通路促进了肿瘤细胞的生长。
NF-κB信号通路参与炎症反应,与凋亡途径密切相关。细胞凋亡涉及一系列蛋白,如Caspase家族蛋白、p53蛋白和Bcl-2家族蛋白、Survivin,其中Caspase 家族蛋白分为三大类:凋亡启动因子、凋亡执行因子和炎症介导因子,构成了级联放大效应[12]。其中Caspase-8为凋亡启动因子,能在其它蛋白辅助下发生自我活化并激活下游的Caspase。Caspase-3为凋亡执行因子,作用于其特异性底物并导致细胞凋亡,是凋亡进入不可逆阶段的标志。NF-κB具有抗细胞凋亡作用被许多文献报道,李淑莲等[13]发现在mDRA-6诱导白血病Jurkat细胞凋亡过程中激活了NF-κB,而激活的NF-κB能够抑制其诱导凋亡的能力,表明NF-κB具有抗细胞凋亡作用。化疗药物TMZ在治疗胶质母细胞瘤过程中产生耐药性,Chen等[14]研究其耐药发生的机制,发现肿瘤的周期性缺氧(Cycling hypoxia)通过激活ROS介导的NF-κB,诱导Bcl-xL的表达,促进了肿瘤细胞的抗凋亡作用,从而产生对化疗药物的耐药性[14]。
免疫应答中,抗原与TCR结合后募集下游信号分子形成了CARMA1-BCL10-MALT1(CBM)复合物,此复合物募集泛素连接酶TRAF6,TRAF6对IKKγ泛素结合位点进行泛素化,从而激活了下游IκB激酶(IKK)复合物和NF-κB,NF-κB进入核内指导相关炎性细胞因子基因表达,合成释放TNF-α、IL-1、IL-2等,表现出T细胞激活增殖。在有关信号通路途径中,针对相关的蛋白激酶,或转录因子的检测基本是在基因水平、蛋白水平或自身蛋白的磷酸化层面上。三者之间的变化关系,既有同步变化的报道也有不同步报道。如Ko[15]报道氧化铜纳米粒子作用人上皮细胞可以上调MAPK的表达,而MAPK抑制剂可以下调MAPK的表达,均表现出基因水平、蛋白水平以及自身蛋白磷酸化水平的同步变化[15]。而Gao[16]发现电针刺激后五组小鼠NR2B基因、蛋白水平没有显著差异,但其中有两组小鼠NR2B磷酸化水平有显著差异。这也表明靶基因、靶蛋白与靶蛋白磷酸化水平表达变化也可以不同步。不过,尚未见有文献报道:仅靶基因、蛋白表达水平的变化而无靶蛋白自身磷酸化的改变。因此,本研究通过检测NF-κB基因和蛋白水平的变化情况,间接地说明伊马替尼可以通过TCR-CBM复合物-NF-κB-凋亡途径诱导T细胞的凋亡。
已有的研究表明[5],A20最初是作为TNF-α诱导内皮细胞反应中的一个诱导性蛋白而鉴定,是一个重要的NF-κB负调控因子。A20为具有去泛素化酶功能,通过抑制泛素连接酶TRAF6对IKKγ泛素化,抑制了IKK复合物的激活,从而达到抑制NF-κB转录因子的功能[17]。A20本身不具备促细胞凋亡的能力,而是通过抑制NF-κB的抗凋亡作用,间接表现其促凋亡效应。A20表达过低或失活会导致NF-κB持续活化,致使多种疾病的发生。临床上已经发现多种淋巴瘤中存在A20缺失[17,18]。Chen等[19]对143例临床肝癌病人标本研究发现,A20的表达与肿瘤大小呈负相关,且A20高表达的病人具有更长的无病生存期,无论是体内还是体外实验均表明:促进A20的表达均可抑制肝癌细胞的增殖和转移,而敲除A20基因则正好相反,因此,A20可作为肝癌病人预后的新指标和潜在的治疗靶点[19]。
我们的实验结果表明,IM作用正常人外周血CD3+T细胞后,具有诱导T细胞凋亡的效应(图1)。实时荧光定量结果显示Caspase-3和A20基因表达上调,NF-κB基因表达下调;Western blot结果与实时荧光定量结果变化一致(图4、5)。我们推测,IM诱导T细胞凋亡的作用机制是IM可能经TCR途径,作用于上游负反馈蛋白A20,通过增强A20蛋白的功能,抑制下游P65蛋白的表达,进而抑制下游NF-κB转录因子的活性,促进T细胞凋亡效应。此外,我们的实验发现,超抗原SEA能够拮抗IM对T细胞凋亡诱导的作用(图1),也佐证了IM对T细胞抑制的机制。当然,也可能在这条信号通路中A20并非IM作用的唯一靶点。因此,还需要进一步实验研究证实。
综上所述,IM能够通过上调A20分子的表达,通过NF-κB信号途径诱导T细胞的凋亡,这不利于清除白血病残余细胞。因此,如何逆转IM对T细胞的抑制作用值得深入研究。
[1]Morozova EV,Vlasova YY,Pryanishnikova MV,etal.Efficacy of dasatinib in a CML patient in blast crisis with F317L mutation:a case report and literature review[J].Biomark Insights,2015,10(3):43-47.
[2]Dervis E,Ayer M,Akin BA,etal.Cutaneous adverse reactions of imatinib therapy in patients with chronic myeloid leukemia:A six-year follow up [J].Eur J Dermatol,2016,26(2):133-137.
[3]Yilmax M,Jabbour E.Tyrosine kinase inhibitors early in the disease course:lessons from chronic myelogenous leukemia [J].Semin Oncol,2015,42(6):876-886.
[4]Farag S,Verschoor AJ,Bosma JW,etal.Imatinib-induced agranulocytosis in patients with gastrointestinal stromal tumors [J].J Clin Pharmacol,2015,55(8):920-925.
[5]李扬秋.A20的免疫调节作用及其临床意义[J].中国实验血液学杂志,2011,19(4):851- 856.
[6]Wang G,Yan Y,Chen X,etal.SEA antagonizes the imatinib-meditated inhibitory effects on T cell activation via the TCR signaling pathway [J].Biomed Res Int,2014,2014.doi:10.1155/2014/6820.
[7]陈小华,颜宇辉,王冠明,等.伊马替尼抑制Jurkat T细胞增殖与影响A20和NF-κB表达相关 [J].免疫学杂志,2013,29(10):854-858.
[8]Du Y,Zhang J,Xi Y,etal.β1-Adrenergic blocker bisoprolol reverses down-regulated ion channels in sinoatrial node of heart failure rats [J].J Physiol Biochem,2016,72(2):293-302.
[9]Ratnappan R,Vadnal J,Keaney M,etal.RNAi-mediated gene knockdown by microinjection in the model entomopathogenic nematode heterorhabditis bacteriophora [J].Parasit Vectors,2016,9(1):160-169.
[10]Nagel S,Ehrentraut S,Meyer C,etal.NF-κB is activated by multiple mechanisms in hairy cell leukemia [J].Genes Chromosomes Cancer,2015,54(7):418-432.
[11]Wei H,Guan JL.Blocking tumor growth by targeting autophagy and SQSTM1 in vivo [J].Autophagy,2015,11(5):854-855.
[12]Adrain C,Brumatti G,Martin SJ.Apoptosomes protease activation platforms to die from[J].Trends Biochemical Sci,2006,31(5):243-247.
[13]李淑莲,王靖,王赟,等.NF-κB在抗人DR5抗体诱导白血病细胞系凋亡中的作用[J].现代免疫学,2010,30(4):328-332.
[14]Chen WL,Wang CC,Lin YJ,etal.Cycling hypoxia induces chemoresistance through the activation of reactive oxygen species-mediated B-cell lymphoma extra-long pathway in glioblastoma multiforme [J].J Transl Med,2015,13(1):1-13.
[15]Ko JW,Park JW,Shin NR,etal.Copper oxide nanoparticle induces inflammatory response and mucus production via MAPK signaling in human bronchial epithelial cells [J].Environ Toxicol Pharmacol,2016,43:21-26.
[16]高永辉,陈淑萍,王俊英,等.电针对甲状腺区炎性痛大鼠痛行为反应及脊髓N-甲基-D-天门冬氨酸受体亚型NR2B表达和磷酸化水平的影响[J].针刺研究,2009,34 (6):376-382.
[17]Thome M.Multifunctional roles for MALT1 in T-cell activation [J].Nat Rev Immunol,2008,8(7):495-500.
[18]李扬秋,杨力建,陈少华,等.从炎症调节因子到肿瘤抑制因子A20的特点及其在淋巴细胞肿瘤发生中的作用[J].循证医学,2011,11(1):54-59.
[19]Chen H,Hu L,Luo Z,etal.A20 suppresses hepatocellular carcinoma proliferation and metastasis through inhibition of Twist1 expression [J].Mol Cancer,2015,14:186.
[收稿2016-02-26修回2016-04-08]
(编辑许四平)
Mechanisms of imatinib mesylate induced apoptosis of primary T cells
CHEN Xiao-Hua,QIU Hua-Yun,SHI Shan-Shan,WU Sha,LIN Chen,LI Yang-Qiu.
Medical College of Shaoguan University,Shaoguan 512000,China
Objective:To investigate mechanism of imatinib mesylate induced apoptosis of primary CD3+T cells.Methods: The CD3+T cells were stimulated by 0-100 nmol/L imatinib for 24 h,cell apoptosis was detected by flow cytometry;Caspase-3,Caspase-8,A20 and NF-κB expression levels were detected by Real-time quantitative PCR and Western blot.Results: IM significantly increased apoptosis of T cell;Caspase-3 and A20 gene expression levels were upregulated and NF-κB expression level was downregulated both in gene and protein levels.Conclusion: IM increased apoptosis of T cell by upregulating A20 expression.
Imatinib mesylate;Primary CD3+T cells;A20;NF-κB
10.3969/j.issn.1000-484X.2016.09.005
陈小华(1987年- ),男,硕士,助教,主要从事分子免疫学方面的研究,E-mail: 627489541@qq.com。
及指导教师:林晨(1961年-),男,硕士,教授,硕士生导师,主要从事白血病发病机制的研究,E-mail: tlinc@jnu.edu.cn。
R364.1+4
A
1000-484X(2016)09-1268-05
①本文受国家自然科学基金(91129720)和广东省科技计划(国际合作)项目(2012B050600023)资助。
②暨南大学医学院微生物与免疫学系,广州510632。
③暨南大学医学院血液病研究所,广州510632。

