HLA-DQB1等位基因多态性及Th1/Th2细胞相关因子与广西瑶族肝癌家族聚集性的相关性①
卢庭婷 梁惠萍 李致忠 黄 兰 吴继周 陈婉玲
(广西卫生职业技术学院,南宁530021)
HLA-DQB1等位基因多态性及Th1/Th2细胞相关因子与广西瑶族肝癌家族聚集性的相关性①
卢庭婷梁惠萍李致忠黄兰吴继周②陈婉玲②
(广西卫生职业技术学院,南宁530021)
目的:探讨HLA-DQB1等位基因多态性及相应位点下Th1/Th2细胞相关因子IL-2、IL-4及IL-10对广西瑶族原发性肝癌家族聚集性的影响,为寻找广西瑶族原发性肝癌的遗传易感基因或拮抗基因提供线索。方法:在广西肝癌高发区选取民族为瑶族的肝癌高发家族成员、无癌家族成员各40例作为研究对象(采用相同性别、年龄±5岁配对方法),采集研究对象外周血并提取全血DNA,应用PCR-SSP的方法对HLA-DQB1等位基因进行检测,应用ELISA法检测IL-2、IL-4、IL-10的水平。结果:(1)广西瑶族肝癌高发家族组的HLA-DQB1*02/09等位基因表达频率高于无癌家族组,两组比较差异明显,具有统计学意义(P<0.05);而两组间的HLA-DQB1*04/05/06/07/08等位基因表达频率无显著性差异(P>0.05)。(2)HLA-DQB1各等位基因在乙型肝炎病毒感染组(HBsAg阳性组)及非乙型肝炎病毒感染组(HBsAg阴性组)间的分布频率比较无显著性差异(P值均>0.05)。(3)广西瑶族肝癌高发家族成员组中Th2细胞相关因子IL-4、IL-10平均表达水平高于无癌家族成员组,差异具有统计学意义(P<0.05),而两组间的IL-2浓度无显著性差异(P>0.05)。(4)两组中HLA-DQB1*02阳性成员的IL-10平均表达水平高于HLA-DQB1*02阴性成员,差异具有统计学意义(P<0.05)。(5)两组中HLA-DQB1*09阳性成员的IL-4平均表达水平高于HLA-DQB1*09阴性成员,差异具有统计学意义(P<0.05)。结论:(1)HLA-DQB1*02/09等位基因可能是广西瑶族居民原发性肝癌发生的易感基因。(2)HLA-DQB1各等位基因与广西瑶族居民的HBV感染可能无显著相关性。(3)IL-4、IL-10表达水平失衡可能是广西瑶族肝癌家族聚集性的危险因素。(4)IL-10表达水平失衡可能与HLA-DQB1*02等位基因的携带有关,而IL-4表达水平失衡可能与HLA-DQB1*09等位基因的携带有关,它们之间共同作用可能与广西瑶族肝癌家族聚集性的发生有相关性。
HLA-DQB1;Th1/Th2细胞相关因子;原发性肝癌;家族聚集性
原发性肝癌(Hepatocellular carcinoma,HCC)是全世界最常见的恶性肿瘤之一,我国肝癌患者数量超过全球的一半以上,并有持续升高的趋势[1,2]。而广西地区是全国原发性肝癌的高发区之一[3],流行病学调查研究发现,原发性肝癌的发生存在有明显的家族聚集性[4]。原发性肝癌的发病机制目前暂不明确,但既往研究发现,其发病原因不仅与HBV的感染有关,还可能与机体免疫功能状态和遗传因素有关[5]。当机体的免疫水平低下或受到抑制时,肿瘤的发生率就会增高,Th1/Th2细胞亚群失调可能是导致HBV慢性感染、肿瘤免疫逃逸的原因之一[6]。而机体的免疫应答水平又主要是由遗传因素决定的,如人类白细胞抗原(Human leukoyte antigen,HLA)在抗原识别、递呈、免疫应答与调控等方面发挥了至关重要的作用,被认为与肝癌的发生发展有密切的关系。HLA复合体分为Ⅰ、Ⅱ、Ⅲ类基因区,其中Ⅱ类基因中的HLA-DQB1几乎所有基因都显示有免疫相关功能,且呈现出复杂的多态性[7]。而广西瑶族的遗传背景有别于我国其他民族,为了明确HLA-DQB1与Th1/Th2对广西瑶族居民肝癌家族聚集性的影响及相关性,本实验采用PCR-SSP和ELISA技术就HLA-DQB1等位基因多态性及相应位点下Th1/Th2细胞相关因子对广西瑶族居民肝癌家族聚集性的影响及相关性展开研究,为寻找广西瑶族居民肝癌高发区的遗传易感基因或拮抗基因提供线索。
1 材料与方法
1.1材料选择广西民族为瑶族的肝癌高发家族成员40例作为实验组,为了控制混杂因素对研究结果的影响,采用配对方法选择与高发家族成员生活环境、生活条件、生活水平以及生活习惯相同的同一村屯、相同性别、年龄±5岁的无癌家族成员40例作为对照组,肝癌高发家族组及无癌家族组间性别、年龄、肝功能、乙型肝炎病毒(Hepatitis B virus,HBV)感染情况比较,两组间的差异小,均无统计学意义(P>0.05)。所有肝癌病例的诊断均符合第四届全国肝癌学术会议修订的肝癌诊断标准。肝癌高发家族的定义为[8]:有血缘关系的家族成员中发生过2例及2例以上的原发性肝癌(HCC)病例;无癌家族的定义为:直系亲属中未发生过任何恶性肿瘤病例的家族。其中,肝癌高发家族成员中男20例,女20例,无癌家族成员中男20例,女20例;HBsAg阳性共26例(其中两组各为13 例),HBsAg阴性共54例;丙型肝炎病毒(Hepatitis C virus,HCV)抗体均为阴性。
1.2.1 标本的采集与处理采集受检者空腹时外周静脉血10 ml,分别注入有盖普通无菌干燥管和依地酸二钠(EDTA)抗凝管各5 ml。其中,普通无菌干燥管自凝血离心后留取血清,用于乙肝两对半(HBsAg、HBsAb、HBeAg、HBeAb、HBcAb)、HBV-DNA、丙肝抗体、肝功能等项目的检测,剩下的血清分装到100 μl的离心管中,-80℃冰箱保存,待检测血清中的细胞因子浓度。抗凝血混匀后进行500 μl/管分装,保存于-80 ℃冰箱中,待提取外周血白细胞DNA。
1.2.2 血清各细胞因子浓度的检测采用ELISA法检测血清中IL-2、IL-4、IL-10的水平,使用IL-2、IL-4、IL-10试剂盒(武汉华美生物技术有限公司)检测血清中IL-2、IL-4、IL-10的水平,采用同批次产品并严格按试剂盒使用说明书操作,使用美国全自动酶标仪Multiskan MK3 Labsystems进行检测。
1.2.3基因组DNA的提取取冷冻的血样500 μl,按照艾德莱生物科技有限公司的人基因组DNA试剂盒使用说明书提取DNA,提取后的DNA用琼脂糖凝胶电泳检测其完整性,用超微量紫外分光光度计NanoDrop 2000检测其纯度和浓度,选取DNA纯度(A260/A280值)在1.6~1.8之间,DNA浓度在30~100 ng/μl之间,电泳条带单一、清晰的样品,保存于-80 ℃冰箱中待测。
1.2.4基因型检测采用天津秀鹏公司的HLA-DQ基因分型低分辨检测试剂盒(PCR-SSP法,经过国家食品药品监督管理局天津医疗器械质量监督检验中心认证),严格按照试剂盒使用说明书进行检测。
1.2.5PCR反应体系及扩增条件(1)PCR反应体系:先配制dNTP-Buffer工作液:440 μl 浓缩dNTP-Buffer +560 μl 无菌水=1 000 μl dNTP-Buffer工作液;再配制Buffer-酶-样本混合液:每人份用量80 μl dNTP-Buffer工作液 +0.7 μl Taq酶 +8 μl DNA = 88.7 μl 混合液,漩涡混匀Buffer-酶-样本混合液,800 r/min瞬时离心5~10 s,使管壁残留的液体聚于管底,然后向每个引物孔各加入10 μl 上述混合液。最后每孔再加入15 μl 石蜡油,用密封膜封好PCR反应板(引物板)。(2)PCR扩增条件:将PCR反应板放入设置好循环参数的PCR仪内,关上PCR仪,启动程序直至循环结束。PCR循环参数见表1。(3)PCR产物鉴定:取出PCR反应板,点动离心后,轻轻撕掉密封膜,防止样品溅出。将PCR反应产物7 μl加样到2.5%琼脂糖凝胶孔中,145 V电泳15 min,内参带和阳性带清晰分开即可停止电泳。
1.2.6观察及判读结果在凝胶成像系统下观察结果并拍摄成像,根据试剂盒提供的结果分型表进行结果判读(图1、2)。
参照结果分型表,标本号136在第4和第7泳道出现阳性带,为HLA-DQB1*07纯合子;标本号140在第1泳道出现阳性带,为HLA-DQB1*05纯合子;标本号143在第1泳道出现阳性带,为HLA-DQB1*05纯合子。
参照结果分型表,标本号114在第1、4和7泳道出现阳性带,为HLA-DQB1*05和HLA-DQB1*07的杂合体;标本号164在第1和第2泳道出现阳性带,为HLA-DQB1*05和HLA-DQB1*06的杂合体。
表1PCR扩增条件
Tab.1PCR amplified condition
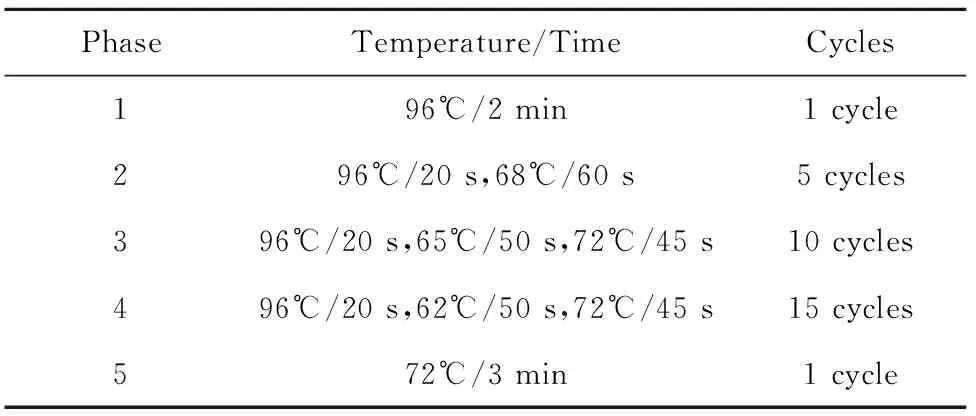
PhaseTemperature/TimeCycles196℃/2min1cycle296℃/20s,68℃/60s5cycles396℃/20s,65℃/50s,72℃/45s10cycles496℃/20s,62℃/50s,72℃/45s15cycles572℃/3min1cycle
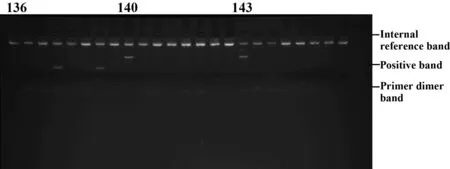
图1 HLA-DQB1等位基因的PCR扩增电泳图(纯合子)Fig.1 PCR amplification electrophoresis of HLA-DQB1 allele(homozygote)
1.2.7HBV血清学标志物检测HBsAg、HBsAb、HBeAg、HBeAb、HBcAb的检测采用ELISA法,试剂盒购自上海劲马生物有限公司。
2017年建立马铃薯种植综合标准化示范区135.38 hm2,标准覆盖率100%,涉及农户852户,实现总产量444.65×104kg(单产32844kghm-2),总产值449.24万元;新增产量68.0×104kg,新增产值97.98万元,农户年增收入1150.0元。辐射示范1200hm2,涉及农户7800户;常规种植区马铃薯单产25308.75kghm-2。通过示范区建设及辐射,增加了农民标准化生产意识,激发了农民种植马铃薯标准化生产积极性,提高了马铃薯生产标准化水平。

2 结果
2.1HLA-DQB1各等位基因在肝癌高发家族组与无癌家族组中表达频率的比较HLA-DQB1*02等位基因在广西瑶族肝癌高发家族组及无癌家族组的阳性率分别为25.0%和0.0%,两组间比较存在显著差异(P<0.05);HLA-DQB1*09等位基因在广西瑶族肝癌高发家族组及无癌家族组的阳性率分别为32.5%和10.0%,两组间比较存在显著差异(P<0.05);而HLA-DQB1*04/05/06/07/08等位基因在两组间的频率分布均无显著性差异(P>0.05),见表2。HLA-DQB1*04/08等位基因在两组成员中均未检出,而HLA-DQB1*05基因表达频率最高,且以纯合子多见(52.5%和57.5%),这可能与瑶族人很少与外族通婚的习俗有关。
2.2 HLA-DQB1各等位基因的表达与HBV感染的相关性经统计学分析,HLA-DQB1各等位基因与HBV感染无显著相关性(P>0.05),见表3。
2.3 肝癌高发家族组与无癌家族组各细胞因子表达水平的分析比较结果见表4,肝癌高发家族组成员的IL-4、IL-10浓度明显高于无癌家族组成员,差异具有统计学意义(P<0.05),而两组间的IL-2浓度差异无统计学意义(P>0.05)。
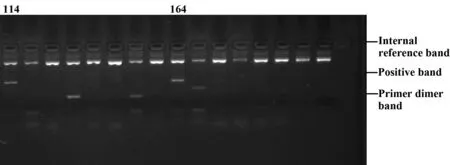
图2 HLA-DQB1等位基因的PCR扩增电泳图(杂合体)Fig.2 PCR amplification electrophoresis of HLA-DQB1 allele(heterozygote)
表2瑶族肝癌高发家族及无癌家族成员中HLA-DQB1各等位基因频率分布比较[n(%)]
Tab.2Gene frequency of HLA-DQB1 alleles in case group was compared with that in controls[n(%)]
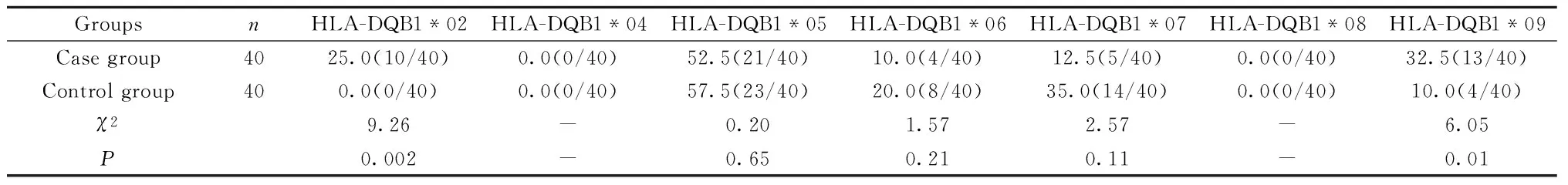
GroupsnHLA-DQB1*02HLA-DQB1*04HLA-DQB1*05HLA-DQB1*06HLA-DQB1*07HLA-DQB1*08HLA-DQB1*09Casegroup4025.0(10/40)0.0(0/40)52.5(21/40)10.0(4/40)12.5(5/40)0.0(0/40)32.5(13/40)Controlgroup400.0(0/40)0.0(0/40)57.5(23/40)20.0(8/40)35.0(14/40)0.0(0/40)10.0(4/40)χ29.26-0.201.572.57-6.05P0.002-0.650.210.11-0.01
表3HLA-DQB1等位基因在HBsAg阳性组及HBsAg阴性组间分布频率比较[n(%)]
Tab.3Gene frequency of HLA-DQB1 alleles in HBsAg positive group was compared with that in HBsAg negative group[n(%)]

GroupsnHLA-DQ2-(%)+(%)HLA-DQ5-(%)+(%)HLA-DQ6-(%)+(%)HLA-DQ7-(%)+(%)HLA-DQ9-(%)+(%)HBsAg(+)group2625(96.15%)1(3.85%)8(30.77%)18(69.23%)24(92.31%)2(7.69%)18(69.23%)8(30.77%)22(84.61%)4(15.38%)HBsAg(-)group5445(83.33%)9(16.67%)28(51.85%)26(48.15%)44(83.33%)10(81.48%)43(79.63%)11(20.37%)41(75.93%)13(24.07%)χ21.5953.1520.8761.0480.792P0.2070.0760.3490.3060.374
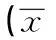
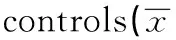
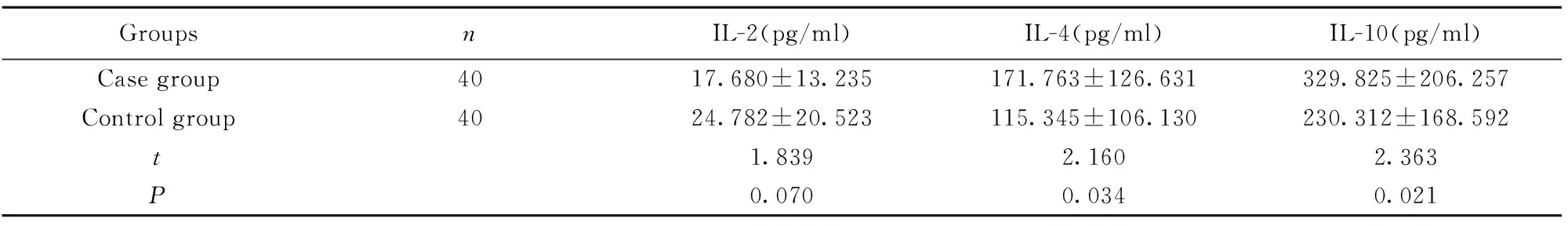
GroupsnIL-2(pg/ml)IL-4(pg/ml)IL-10(pg/ml)Casegroup4017.680±13.235171.763±126.631329.825±206.257Controlgroup4024.782±20.523115.345±106.130230.312±168.592t1.8392.1602.363P0.0700.0340.021
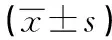
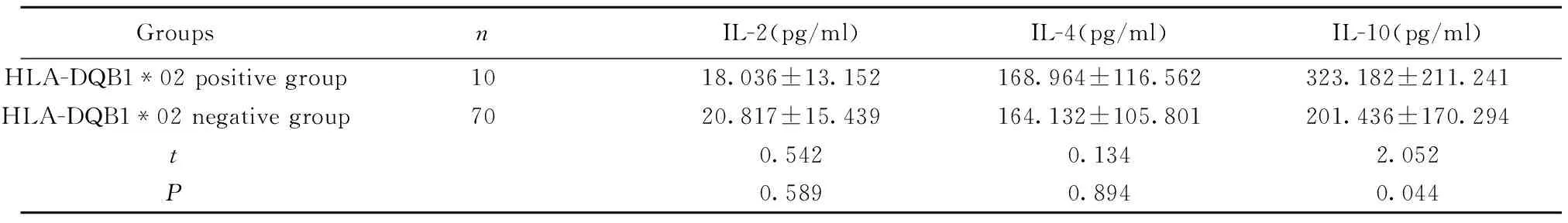
GroupsnIL-2(pg/ml)IL-4(pg/ml)IL-10(pg/ml)HLA-DQB1*02positivegroup1018.036±13.152168.964±116.562323.182±211.241HLA-DQB1*02negativegroup7020.817±15.439164.132±105.801201.436±170.294t0.5420.1342.052P0.5890.8940.044
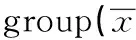
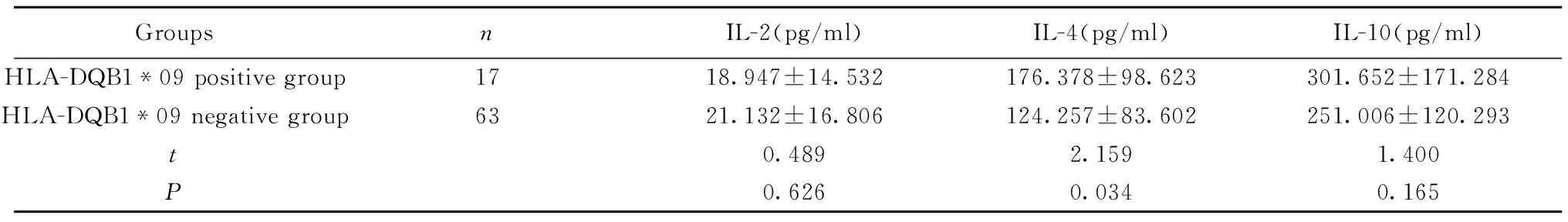
GroupsnIL-2(pg/ml)IL-4(pg/ml)IL-10(pg/ml)HLA-DQB1*09positivegroup1718.947±14.532176.378±98.623301.652±171.284HLA-DQB1*09negativegroup6321.132±16.806124.257±83.602251.006±120.293t0.4892.1591.400P0.6260.0340.165
2.4 两组中HLA-DQB1*02阳性成员及HLA-DQB1*02阴性成员之间各细胞因子水平的分析比较结果见表5,两组中HLA-DQB1*02阳性成员的IL-10平均表达水平高于HLA-DQB1*02阴性成员,差异具有统计学意义(P<0.05)。而IL-2、IL-4的浓度在两组间的差异无统计学意义(P>0.05)。
2.5 两组中HLA-DQB1*09阳性成员及HLA-DQB1*09阴性成员之间各细胞因子水平的分析比较结果见表6,两组中HLA-DQB1*09阳性成员的IL-4平均表达水平高于HLA-DQB1*09阴性成员,差异具有统计学意义(P<0.05)。而IL-2、IL-10的浓度在两组间的差异无统计学意义(P>0.05)。
3 讨论
人类白细胞抗原系统(HLA) 是目前已知的最为复杂的遗传多态性系统,可能参与了免疫应答的遗传调控[9,10]。既往研究表明,HLA Ⅱ类抗原在部分肿瘤的表达中存在差异,不同国家、不同民族及地区,研究的结果差异较大[5]。EI-chennawi等[11]对埃及肝癌病人HLA-DQB1等位基因研究表明,DQB1*02在肝癌患者中的基因频率明显高于正常对照组,而DQB1*06则相反,明显低于正常对照组,从而推测DQB1*02可能为埃及人肝癌的易感基因,而DQB1*06可能为其保护基因。Pradat等[12]对欧洲地区人群的长期研究结果表明,HLADQ02等位基因阳性是HCV患者疾病发展为肝细胞癌的独立的危险因素。Vaughan等[13]发现波兰人HBV感染者携带HLA-DQB1*0303(血清型DQB1*09)基因频率高于健康人群。Akcam 等[14]发现土耳其人HBV持续感染与DQB1*02和DQB1*05有关。梁军等[15]研究发现,HLA-DQB1*0201(血清型DQB1*02)是新疆维吾尔族HBV抗性基因,DQB1 *0301与HBV的持续感染有关,DQB1* 0303 是ASC易感基因,可能与病毒清除效率较低有关。
本研究结果显示,广西瑶族肝癌高发家族组的HLA-DQB1*02/09等位基因表达频率显著高于无癌家族组,差异具有统计学意义(P<0.05)。表明HLA-DQB1*02/09基因可能是广西肝癌高发区瑶族居民肝癌发生的易感基因。而两组间的HLA-DQB1*04/05/06/07/08等位基因表达频率无显著性差异(P>0.05),由此推测HLA-DQB1*04/05/06/07/08等位基因可能不是广西瑶族肝癌家族聚集性的危险因素。本次收集的样本中,两组成员的地域及民族是一致的,从而排除了地域、民族这些混杂因素对结果的影响。此结果与EI-chennawi、Pradat、Vaughan、Akcam等人的结果相接近,但却与梁军的结果相矛盾。考虑可能的原因是HLA-DQB1等位基因多态性与不同人种、民族、地域差异有关,也可能是所研究基因与真正的致病基因存在连锁不平衡的关系[16]。另外,HLA-DQB1*04/08等位基因的缺省,较多HLA-DQB1*05基因纯合子的出现,可能是广西瑶族人群的遗传特征之一[17],而我们的研究结果显示HLA-DQB1*05基因与原发性肝癌的遗传易感性无明显关联。以往的研究结果显示,广西肝癌高发区的肝癌家族聚集性与HBV感染相关[18],但在本研究中HLA-DQB1各等位基因与HBV感染无显著相关性(P>0.05),提示广西肝癌高发区瑶族居民肝癌的家族聚集性可能不是由于HLA-DQB1各等位基因的携带造成机体对HBV感染的遗传易感性,而是HLA-DQB1*02/09基因本身可能是导致广西肝癌高发区瑶族居民肝癌家族聚集的危险基因。
不同的细胞因子具有不同的免疫效应。IL-2是由Th1细胞分泌的,在肝癌中,它可能起抑制作用[19],它可以抑制肿瘤细胞对细胞外基质成分的亲和力,抑制肝癌细胞的聚集能力。而Th2细胞分泌IL-4、IL-10,IL-4与组织损伤修复及细胞外基质沉积密切相关,并且有胶原诱导活性,具有促纤维化作用[20]。IL-10具有很强的抗炎及免疫抑制活性,可降低巨噬细胞炎症反应、降低单核细胞的抗原提呈能力、使T细胞增殖能力下降[21]。Th1和Th2细胞通过分泌不同的细胞因子来调节机体的免疫状态,使机体的免疫系统能发挥抵御病毒感染及清除自身癌变细胞的作用。一旦出现Th1/Th2失衡,机体的免疫状态被打破,则容易导致HBV感染的慢性化和肿瘤细胞的免疫逃逸[22]。早在二十世纪90年代,Yamamura等[23]和Kharkevitch等[24]就发现肿瘤患者体内Th2型细胞占优势状态。梁陶等[25]用ELISA法检测发现,原发性肝癌患者外周血IL-2浓度较正常人显著降低,而IL-4、IL-10浓度显著高于正常人。而本研究结果与上述研究结果相接近,本研究结果表明,广西瑶族肝癌高发家族组成员外周血中Th2类细胞因子IL-4、IL-10浓度明显高于无癌家族组成员,差异具有统计学意义(P<0.05),而两组间的Th1类细胞因子IL-2浓度无显著性差异(P>0.05)。提示广西瑶族肝癌高发家族成员由于Th2型细胞反应占优势状态,Th1/Th2表达失衡造成免疫状态的失衡,机体抗肿瘤及清除自身癌变细胞的能力下降,从而使肝癌细胞得以生存发展。
综上所述,在广西瑶族肝癌高发家族中,HLA-DQB1*02/09等位基因的携带及Th1/Th2浓度水平的失衡可能是肝癌家族聚集性的危险因素。IL-10表达水平失衡可能与HLA-DQB1*02等位基因的携带有关,而IL-4表达水平失衡可能与HLA-DQB1*09等位基因的携带有关,它们之间可能通过某种通路共同作用,从而导致广西瑶族肝癌家族聚集现象的发生。由于实验组和对照组数量有限,本实验研究还存在一定的局限性,未能充分揭示HLA-DQB1基因多态性及相应位点下Th1/Th2细胞相关因子与广西瑶族肝癌家族聚集性的相关性,有必要在今后的研究中再进一步扩大标本量,以期在基因水平上进一步了解原发性肝癌的家族聚集性。
[1]Schutte K,Bornschein J,Malfertheiner P,etal.Hepatocellular carcinoma epidemiological trends and risk factors[J].Dig Dis,2009,27(2):80-92.
[2]Liu Y,Wu F.Global burden of aflatoxin-induced hepatocellular carcinoma:a risk assessment [J].Environ Health Perspect,2010,118(6):818-824.
[3]张春燕,黄天壬,余家华,等.2004-2005年广西肝癌的流行现况[J].肿瘤,2011,31(5):474-476.
[4]陈务卿,吴继周,李国坚,等.广西新发现肝癌高发点HBV,HCV感染与HCC家庭聚集性的研究[J].实用医学杂志,2011,26(24):4494-4496.
[5]Nieters A,Yuan JM,Sun CL,etal.Effects of cytokine genotypes on the hepatitis B virus-hepatocellular carcinoma association[J].Cancer,2005,103(4):740-748.
[6]游晶,庄林,马永良,等.慢性乙型肝炎的Th细胞亚群及相关细胞因子网络失衡[J].世界华人消化杂志,2007,15(8):791-799.
[7]Clifford RJ,Zhang J,Meerzaman DM,etal.Genetic variations at loci involved in the immune response are risk factors for hepatocellular carcinoma[J].Hepatology,2010,52(6):2034-2043.
[8]中华人民共和国卫生部.原发性肝癌诊断规范(2011年版)[J].临床肿瘤学杂志,2011,16(10):929-946.
[9]安纪红,新燕.蒙古族慢性乙型肝炎患者HLA-DRB1基因多态性与乙型肝炎病毒高复制状态的相关性研究[J].中华实验和临床感染病杂志(电子版),2011,5(3):53-55.
[10]樊晓妹,单保恩,李魁秀.基因多态性与宫颈癌易感性研究进展.[J].中华肿瘤防治杂志,2014,21(14):1125-1128.
[11]EI-chennawi FA,Auf FA,Metwally SS,etal.HLA-class II alleles in Egyptian patients with hepatocellular carcinoma[J].Immunol Invest,2008,37(7):661-674.
[12]Pradat P,Tillmann HL,Sauleda S.Long-term follow-up of the hepatitis C HENCORE cohort response to therapy and occurrence of liverrelated complications[J].J Viral Hepat,2007,14(8):556-563.
[13]Vaughan RW,Zurowska A,Moszkowska G,etal.Class II HLA alleles and hepatitis B virus persistence in African Americans [J].J Infect Dis,1998,179(4):1004-1006.
[14]Akcam Z,Sunbul M,Durupinar B,etal.Tissue types as prognostic risk factor in hepatitis B virus infection [J].Indian J Gastroententerol,2002,21(4):139-141.
[15]梁军,张永萍,杨晓筠,等.新疆维吾尔族HLA-DQB1基因多态性与HBV感染结局的相关性[J].安徽医科大学学报,2013,48(5):530-534.
[16]黄爱春,吴继周,吴建林.HLA-DQB1*14及*15等位基因与原发性肝癌的相关性[J].临床肝胆病杂志,2010,26(14):420-422.
[17]马莎莎,吴继周,吴健林,等.HLA-DRB1*03/04等位基因与广西原发性肝癌家族聚集性的相关性[J].世界华人消化杂志,2013,21(4):346-351.
[18]吴继周,汤春园,蒋杰球,等.HBV感染及复制状态在HCC家族聚集性中的作用研究[J].广西预防医学,1997,3(5):264-266.
[19]黄传钟,李洁羽,陈淑萍等.IL-2、IL-4、IL-6、IFN-γ、IL-17A在肝癌组织中表达及其与乙肝病毒感染的关系[J].中国免疫学杂志,2015,31(4):527-530.
[20]Kelly-Welch AE,Hanson EW,Boothby MR,etal.Interleukin-4 and interleukin-13 signaling connections maps[J].Science,2003,300(5625):1527-1528.
[21]张道杰,段朝霞.IL-10的研究进展[J].国外医学·免疫学分册,2003,26(1):39-41.
[22]Agarwal A,Rani M,Saha G,etal.Disregulated expression of the Th2 cytokine gene in patients with intraoral squamous cell carcinoma[J].Immunol Invest,2003,32(1-2):17-30.
[23]Yamamura M,Modlin R,Ohmen J,etal.Local expression of anti-inflammatory cytokines in cancer[J].J Clin Invest,1993,91(3):1005.
[24]Kharkevitch DD,Seito D,Balch GC,etal.Characterization of autologous tumor-specific T-helper 2 cells in tumor-infiltrating lymphocytes from a patient with metastatic melanoma[J].Int J Cancer,1994,58(3):317-323.
[25]梁陶,吴平,陈捷,等.原发性肝癌患者外周血Th1/Th2细胞因子检测的临床意义[J].华夏医学,2005,18(2):168-170.
[收稿2015-11-24修回2015-12-22]
(编辑张晓舟)
Relationship between HLA-DQB1 allele as well as expression level of Th1/Th2 cytokines with familial clustering of hepatocellular carcinoma in Guangxi yao
LU Ting-Ting,LIANG Hui-Ping,LI Zhi-Zhong,HUANG Lan,WU Ji-Zhou,CHEN Wan-Ling.
Guangxi Medical College,Nanning 530021,China
Objective:To elucidate the relationship between HLA-DQB1 allele polymorphism as well as the expression level of Th1/Th2 cytokines with familial clustering of hepatocellular carcinoma (HCC) to provide some evidence for the seeking susceptibility gene or resistant gene of HCC in Guangxi yao,China.Methods: With the same sexuality,age ±5 year,40 members whose families have had two or more HCC patients(high-occurrence families) were selected as the case group,and 40 members whose families have no any cancer patient were selected as the controls.Peripheral blood samples were collected to extract DNA,PCR-SSP was used to detect HLA-DQB1 alleles and ELISA was used to detect IL-2,IL-4 and IL-10.Results: (1)The gene frequency of the HLA-DQB1*02/09 alleles in the case group was higher than that in the controls(P<0.05);but the gene frequency of the HLA-DQB1*04/05/06/07/08 alleles were never significant difference between two groups (P> 0.05).(2)The gene frequency of alleles HLA-DQB1 in HBsAg positive group and HBsAg negative group were never significant difference (P> 0.05).(3)The expression levels of IL-4,IL-10 in the case group was higher than that in the control(P<0.05).(4)The expression level of IL-10 in the positive group of the HLA-DQB1*02 allele was higher than that in the negative group of the HLA-DQB1*02 allele(P<0.05).(5)The expression level of IL-4 in the positive group of the HLA-DQB1*09 allele was higher than that in the negative group of the HLA-DQB1*09 allele(P<0.05).Conclusion: (1)HLA-DQB1*02/09 seem to be susceptibility genes of hepatocellular carcinoma in high HCC incidence areas of Guangxi yao.(2) There may be not significant correlation bewteen HLA-DQB1 alleles and the susceptibility of HBV infection in high HCC incidence areas of Guangxi yao.(3)The imbalance of IL-4,IL-10 might be associated with familial clustering of hepatocellular carcinoma in Guangxi yao.(4)The imbalance of IL-10 might be due to the carrying of HLA-DQB1*02;the imbalance of IL-4 might be due to the carrying of HLA-DQB1*09.Through the same approaches,these might lead to the phenomenon of familial aggregation of HCC in Guangxiyao.
HLA-DQB1;Th1/Th2 cytokines;Hepatocellular carcinoma;Familial clustering
10.3969/j.issn.1000-484X.2016.09.004
卢庭婷(1979年-),女,硕士,讲师,主要从事生物化学与分子生物学研究。
及指导教师:梁惠萍(1978年-),女,副教授,主要从事肝脏疾病的发病机理及诊疗方面的研究。
R392.11
A
1000-484X(2016)09-1262-06
①本文受国家自然科学基金项目(30960170)、广西高校科学技术研究项目(YB2014546)和广西教育厅课题(KY2016YB740)资助。
②广西医科大学第一附属医院感染性疾病科,南宁530021。

