基于滤纸的多电极原电池实验设计
刘玲 丁伟
摘要:金属片电极与浸渍相应金属盐溶液的滤纸可以组成原电池。如用铜片、锌片、铅片和锡片4种电极组成的两个原电池整合在一个装置内,便于对比分析各电极反应,同时又能节约实验药品。该原电池具有整合度高、装置简易等特点,既有利于教师进行课堂演示,又方便学生自主进行实验。
关键词:滤纸;多电极;原电池;电极电势;实验设计
文章编号:1005–6629(2016)9–0049–03 中图分类号:G633.8 文献标识码:B
1 研究背景
原电池是电化学教学的重点和难点,其涉及氧化还原反应、电解质溶液和物理学中相关的电学知识,知识的认知难度较大[1],且内容抽象、理论性强,因此,纯理论的教授方式往往达不到理想的教学效果。如果通过对原电池实验的探究,将有效地提高这部分知识的教学成效,加深学生对原电池的感性认知,促进其对知识的有意义的建构,故原电池实验对于相关知识的教学意义重大。
人教版选修《化学反应原理》教材[2]中关于原电池的实验是将铜片和锌片分别插入硫酸铜和硫酸锌溶液中,使用盐桥连接两种溶液,外接电流计测量产生的电流。但实验演示效果并不理想,且存在铜锌原电池装置所用到的盐桥制作繁琐、使用时间间隔不能过长[3]、实验消耗药品的量很大等不足,因此,有必要作进一步的深入研究。
2 实验方案
2.1 实验设计思路
以往研究有针对盐桥制作较复杂的情况进行改进:用橡皮管将两侧均带有支管的U形管与具支试管连接起来,橡皮管中充入琼脂(或果冻),U形管中注入饱和的氯化钾溶液,用作盐桥[4];有针对原电池电压较小且不稳定而对实验装置进行的改进:使用具有双槽的容器,两槽内均具有一对电极而使两个原电池串联起来以增大电压[5];有为了克服演示实验过程中观赏性差、浪费大且有污染等不足的微型化改进:将玻璃管烧制成微型U形管用作电解槽,利用金属丝做电极[6];还有为引起学生兴趣而进行的趣味化改进:于永民[7]将市场上会吸水的玩具海洋宝宝球浸入稀硫酸中,将金属丝插入其中观察电流表数字变化等改进。综合这些研究发现,这些改进都很有创意,但主要针对铜锌原电池的电解质溶液、盐桥和装置结构等某一方面进行改进,大多数改进装置中只有一对电极,而关于电极的改进则很少。基于此,本文设计了一个具有多对电极的原电池。考虑选用何种金属作电极,首先,排除一些特别活泼的金属,如钠、镁等;其次,铁虽易得但Fe2+极不稳定易导致实验失败,故不选用;因银比较昂贵所以也不选用;相比之下锡和铅虽然在中学化学中不太常见,但在渔具店或市场上均易购买。最后选定用铜、锌、锡、铅四种金属片做电极。为便于制作,体现微型化实验设计,所以选用滤纸作为载体。
2.2 实验仪器、药品及材料
1 mol/L的盐溶液[CuSO4、ZnSO4、Pb(NO3)2、KNO3以及SnCl2溶液]、金属片(铜片、锌片、铅片和锡片)、定性滤纸(11cm)、蜡烛、酒精灯(或电热板)、垫板、模板、刻刀、铅笔、砂纸、万用表(胜利仪器数字多用表,VC890D)和一次性手套
2.3 实验内容
2.3.1 制作模板
选取一个硬纸板,利用刻刀制作有四个分区的模板。用铅笔按照模板将滤纸划分为四个分区,再用火柴梗蘸取蜡油,沿着铅笔印迹涂抹。全部画好后,将滤纸放在小蜡烛火焰上方(或电热板)加热一分钟左右。使滤纸上的蜡融化并渗透到滤纸中,形成一个蜡的屏障以减小实验过程中各分区溶液间的相互渗透。运用蜡油涂抹铅笔印迹和滤纸烘烤时要仔细,要确保涂抹无遗漏。在烘烤滤纸时也要小心谨慎,既要确保蜡油渗透进滤纸,也要防止将滤纸引着,所以如果条件允许尽量使用电热板。
2.3.2 制作电极
裁剪金属片,将金属片剪成1cm×2cm的薄片。为使实验结果更精确,用砂纸仔细打磨金属片,除去其表面的氧化层。
2.3.3 制电解液
配制1 mol/L与金属片相应的盐溶液和KNO3溶液,装入滴瓶中待用。SnCl2溶液要现用现配,因为SnCl2易水解氧化,在配制时需要先用浓度至少为3 mol/L的盐酸在通风橱中溶解后再加水稀释至所需浓度,在其溶解过程中尽量不要搅拌,并在溶液中放些许锡粒。在配制Pb(NO3)2溶液时,先在蒸馏水中加入两滴稀HNO3,然后再放入称量好的Pb(NO3)2固体进行溶解。目的是防止铅离子水解生成不溶性的Pb(OH)2。
2.3.4 制原电池
将四个金属片放入滤纸的四个分区内(也可以用胶带固定),并在每个金属片的相应分区滴上相应的金属盐溶液,每个金属区域就是一个电极,中间区域滴两滴1 mol/L的KNO3溶液。该区域起到盐桥的作用,为加强实验效果起着至关重要的作用。然后将“滤纸电池”放到垫板上。
2.3.5 测量电压
打开万用表,将量程调至为0~2V,用万用表分别测量四个金属片两两做电极的原电池电动势并记录(铜锌原电池电动势的测定情况如图1所示)。
2.4 实验结果及分析
为检验改进装置的有效性,将计算的标准电动势与实测电动势进行比较,标准电动势的计算方法如下:
当温度为298K,参与电极反应的所有离子浓度均为1 mol/L,所有气体的压强为100kPa时,该电极的电极电势是标准电极电势。将正负两极的标准电极电势相减即得到原电池的标准电动势:Eθ=φθ+-φθ-。以铜锌原电池为例,计算电池Zn(s)|Zn2+||Cu2+|Cu(s)的标准电动势Eθ。查表[8]可知正极φθ(Cu2+/Cu)=+0.3419V,负极φθ(Zn2+/Zn)=-0.7618V,电池的标准电动势Eθ=φθ(Cu2+/Cu)-φθ(Zn2+/Zn)=(+0.3419V)-(-0.7618V)=1.104V(为方便与实测值比较保留三位小数)。依次求出ZnPb、Zn-Sn、Sn-Cu、Sn-Pb和Pb-Cu原电池的标准电动势,分别为0.636V、0.626V、0.478V、0.010V和0.468V。因该实验中所配制的盐溶液浓度为1 mol/L,室内温度也约为298K,反应中无气体产生,因此可将实测电动势与标准电动势进行比较。各原电池的标准电动势与实测电动势如表1所示。
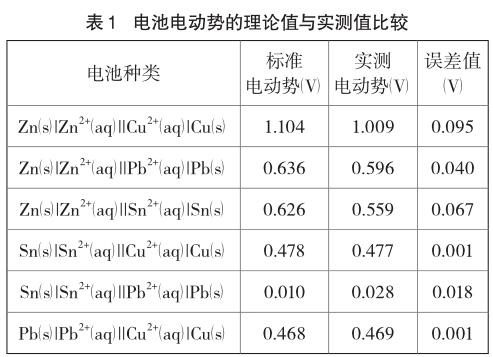
通过上表中数据可以看到,最小误差只有0.001V,最大误差也仅为0.095V。相对误差较小,说明该改进实验是有效的。总的来说该改进实验的创新点在于:
(1)整合性。在教材知识的基础上,另添加两个电极并整合进一个装置,可直观地观察到多对电化学反应现象。同时该实验可作为拓展兴趣实验,利用该实验既可以加深学生对电化学的理解,又可以拓宽学生的知识面,有利于发散性思维的发展。
(2)简易性。改进装置简单、制作容易、操作便捷、取材方便;实验现象明显,且容易保存。
(3)灵活性。该装置在使用时可灵活运用,使学生在学习中能运用归纳或演绎思维:学生可以通过观察电极反应现象,判断电池的正负极,加深对金属活动性顺序的认知;也可以基于初中阶段有关金属活动性顺序的知识,先判断电池的正负极,再通过观察实验现象进行验证。
(4)辅助性。在原电池实验中可以使用盐桥加强实验效果来辅助实验。但盐桥的制作和存储非常不便。本实验起盐桥作用的硝酸钾溶液在实验室中比较常见,可就地取材。对于辅助实验起到很重要的作用。
此外,可以通过增大电池的电压(如增大电极的面积或电解液的浓度),或者串联两到三个电极使电压能够令二极管发光(小灯泡)或使小功率的音乐卡片或喇叭发声,使实验现象更加直观,更加能够吸引学生的注意力,从而提高学生学习化学的兴趣。
3 结论
改进后的实验装置精简、经济。既利于教师进行演示,又可以提升学生的科学思维能力和科学探究能力。同时节约药品也体现了绿色化学的理念,符合时代的要求。
参考文献:
[1]洪燕芬.追溯历史拓展实验凸显探究——“原电池”教学设计与反思[J].化学教学,2014,(6):41-43.
[2]人民教育出版社化学室.全日制普通高级中学教科书·化学[M].北京:人民教育出版社,2001.
[3]张艳.铜锌原电池演示实验装置改进[J].化学教育,2013,(8):63.
[4]刘影,张勇,马双.原电池实验改进[J].教学仪器与实验,2012,4(28):14~15.
[5]庄如平.原电池实验器的改进[J].教学仪器与实验,2002,3(18):29.
[6]张新平.原电池原理微型实验的研究[J].化学教育,2008,(8):63.
[7]于永民.若干电化学微型实验的设计[J].化学教学,2013,(7):44~47.
[8]朱元保,沈子琛.电化学数据手册[M].长沙:湖南科学技术出版社,1984.

