氢氧化亚铁制备实验的改进与创新
陈彩凤 陈迪妹 胡加烽 沈怡
摘要:传统化学教材氢氧化亚铁的制备实验中难以保证“白色”沉淀这一现象的稳定性,影响学生对实验现象的观察。本研究主要对氢氧化亚铁制备原理和实验装置作改进。根据双水解反应原理,通过定性实验比较Fe2+与碳酸根或碳酸氢根的双水解,通过定量实验探究最佳浓度,以提高实验成功率。同时对实验装置进行了微型化设计,增强了实验的趣味性。
关键词:氢氧化亚铁制备;微型化实验;双水解;实验改进
文章编号:1005–6629(2016)9–0046–03 中图分类号:G633.8 文献标识码:B
1 问题的提出
氢氧化亚铁的制备实验中白色的氢氧化亚铁会逐渐转变为灰绿色的氢氧化铁,使学生误认为氢氧化亚铁的颜色是灰绿色。有不少研究者都从避开氧气的角度对该实验进行了改进。
其中一类是将NaOH溶液煮沸以除去其中的溶解氧[1]。此方法有一定效果,但是煮沸难以将溶解氧全部除尽,所以白色沉淀能维持的时间要略长一些,但仅几分钟而已。
另一类是利用煤油、石蜡油等有机物对反应体系进行液封。由于反应时体系难以与外界空气接触,就会相应延缓氢氧化亚铁被氧化的速率。最常见到的改进一般是将这几种思路进行混合,将各自的优点进行融合,以达到更佳的除氧效果,延缓氧化速率[2]。但这些改进均不是很理想,白色沉淀存在时间仍比较短。
还有一类是通过离心技术来尽可能地除去反应体系中的氧气。一般利用试管中生成的Fe(OH)2除去NaOH、FeSO4溶液中的溶解氧。首先是在已生成Fe(OH)2沉淀的试管中加入过量NaOH溶液,利用Fe(OH)2除去NaOH溶液中的溶解氧;另外也在已生成Fe(OH)2沉淀的试管中加入过量FeSO4溶液,利用Fe(OH)2除去FeSO4溶液中的溶解氧。接着取2种溶液相互滴加,这样处理之后生成的Fe(OH)2基本上处于无氧环境中,不易被氧化[3],白色沉淀的维持时间最长可达2h以上。但是这样改进的最大缺点就在于操作复杂,很难在课堂上实施演示,失去其实际意义。
鉴于以上种种改进方法,本文也从减少氧气的角度出发,结合煮沸除去溶解氧,而且将横截面积小于试管的软管作为反应容器,来减少反应中接触到的氧气。除此之外,还改变了反应方式,利用Fe2+与HCO3-的双水解产生二氧化碳以排出氧气,以延长白色沉淀的存在时间。同时由于该反应原理为双水解,反应处于动态平衡之中,受外界干扰较小。通过透明软管将此实验进行微型化设计,简化了步骤,增强了趣味性,有利于课堂实验的展开与实验现象的观察。
2 实验原理探究
2.1 产生浅绿色的原理
Fe2++2OH-=Fe(OH)2↓
该反应生成的氢氧化亚铁是白色胶状沉淀,因吸附了溶液中浅绿色的亚铁离子,而使白色沉淀变成浅绿色。氢氧化亚铁沉淀的颜色与吸附过量的浅绿色的亚铁离子有关[4,5]。通过双水解促进亚铁离子水解生成白色氢氧化亚铁,从而使沉淀变成较纯白色,便于观察。
2.2 双水解的原理
2.2.1 实验原理
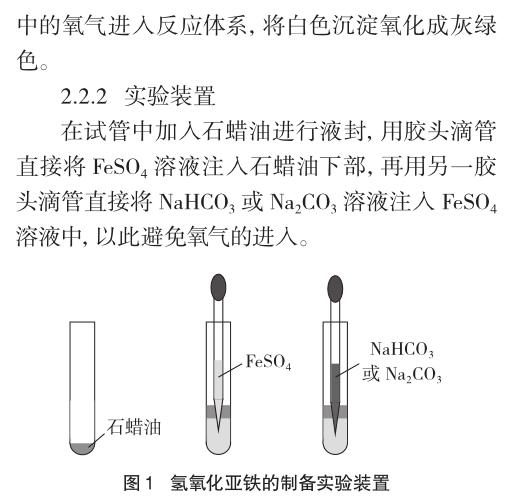
2.2.3 实验内容
(1)液封:用石蜡油将试管液封,用滴管分别在9支试管底部注入2mL 0.5 mol/L的FeSO4溶液。
(2)不同浓度Na2CO3溶液对比:用滴管分别将2mL的0.1 mol/L、0.5 mol/L、1.0 mol/L、1.5 mol/L的Na2CO3溶液注入上述4支FeSO4溶液中,使其发生反应,分别观察实验现象。
(3)不同浓度NaHCO3溶液对比:用滴管分别将2mL的0.1 mol/L、0.5 mol/L、1.0 mol/L、1.5 mol/L、2.0 mol/L的NaHCO3溶液注入上述另5支FeSO4溶液中,使其发生反应,分别观察实验现象并进行对比。
(4)实验现象对比:
不同浓度Na2CO3溶液对比:随着浓度的增大,白色沉淀的存在时间增长。
不同浓度NaHCO3溶液对比:随着浓度的增大,白色沉淀的存在时间增长。
从实验过程与现象可以看出,在相同处理的情况下,同浓度的NaHCO3溶液的反应效果要优于Na2CO3溶液。因此,我们选用NaHCO3溶液进行实验。
3 实验试剂最佳浓度探究
分别用2mL的0.1 mol/L、0.5 mol/L、1.0 mol/L、1.5 mol/L、2.0 mol/L NaHCO3溶液与FeSO4溶液反应,实验现象见表1。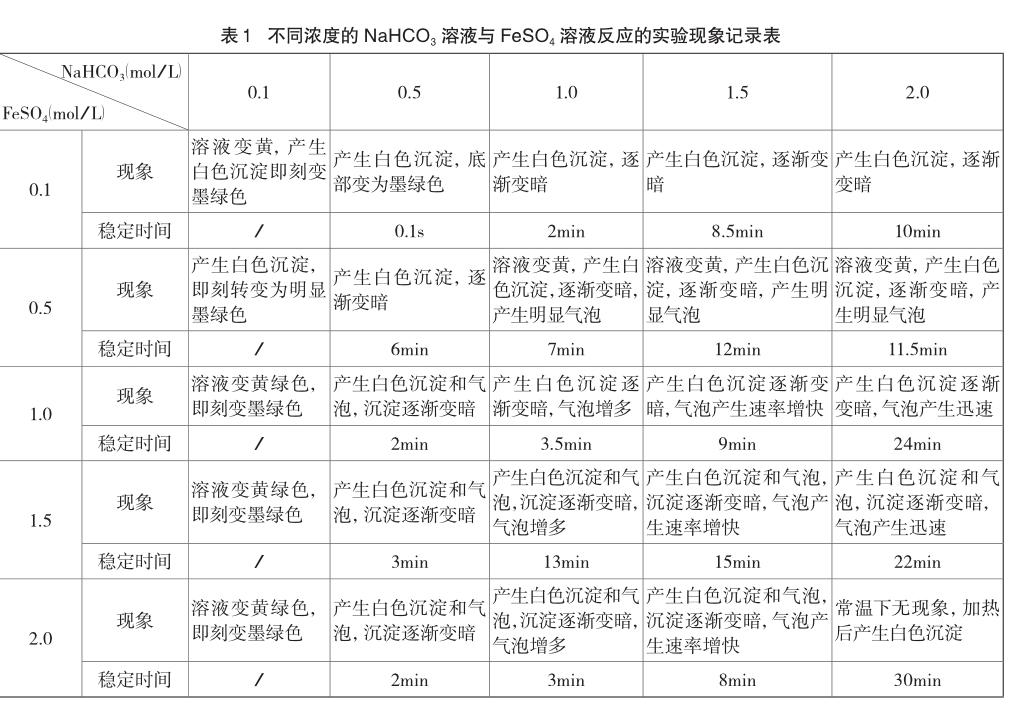
从实验现象与数据中可以看到反应物浓度偏大时白色沉淀较纯,且维持时间较长。但当浓度大于2 mol/L时,由于溶液在常温下达到过饱和状态会产生干扰现象。于是得出最佳浓度是NaHCO3溶液:1.0~2.0 mol/L;FeSO4溶液:1.0~1.5 mol/L。
4 新实验设计方案
4.2 实验仪器和试剂
(1)实验仪器:长15cm白色透明橡胶管、2支50mL注射器、酒精灯、150mL烧杯、三脚架、石棉网、火柴
(2)实验试剂:1.5 mol/L NaHCO3溶液、1.5 mol/L FeSO4溶液(含还原铁)
4.3 实验装置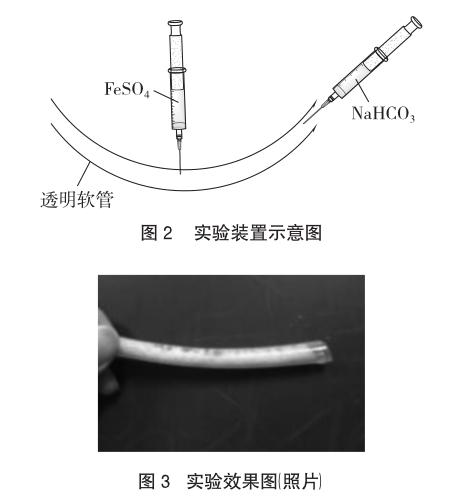
4.4 实验步骤
(1)除去溶解氧:点燃酒精灯,将1.5 mol/L NaHCO3溶液加热至80℃左右,以除去溶液中的溶解氧。
(2)搭建装置:将长15cm白色透明橡胶管卡在150mL烧杯口,呈“V”形。两支注射器分别吸取2mL 1.5 mol/L热NaHCO3溶液和2mL 1.5 mol/L FeSO4溶液。
(3)加料:将2mL 1.5 mol/L热NaHCO3溶液从管口注射入橡胶管中,另一只注射器在橡胶管中部刺入,将2mL FeSO4溶液注射入NaHCO3溶液中(如图2所示),使其发生反应。
(4)观察实验现象:从中部开始逐渐产生白色沉淀,且维持时间较长,2min左右橡胶管两端的沉淀开始转变为灰绿色。
4.5 实验注意事项
(1)FeSO4溶液中加入少量还原铁粉,防止实验过程中被氧化,避免溶液中产生Fe3+。
(2)NaHCO3溶液加热时要注意温度,尽可能将溶解氧除去,但是要避免沸腾再次溶入氧气。
(3)注射溶液时注意速度,避免从另一管口溢出。
5 实验创新点
(1)使用双水解的原理,将反应维持在动态平衡中,延长了白色沉淀的稳定时间,克服了这个实验的最大难点,同时也便于学生观察与记录现象。
(2)加热NaHCO3溶液除去溶解氧,直接将FeSO4溶液注入NaHCO3溶液中部,省去了液封这一步骤,简化了实验。
(3)反应生成的二氧化碳将氧气排出软管,减少并延缓产物Fe(OH)2被氧化。
(4)设计成微型化实验,既增强趣味性,又减少实验试剂的用量,使实验更加环保。还可以安排让学生分组实验。
(5)可以将本实验用于双水解的知识新授课。
参考文献:
[1]赵亭.氢氯混合气体光照爆炸实验和氢氧化亚铁制备实验的再改进[J].化学教育,2012,(12):77.
[2]程伟平.氢氧化亚铁的制备实验改进[J].化学教育,2013,(4):75.
[3]吴名胜.再议制备氢氧化亚铁的实验改进[J].化学教育,2010,(6):84.
[4]徐建飞,张平,杜淑贤.制备氢氧化亚铁实验方案再探究[J].化学教学,2015,(7):54~57.
[5]刘彩虹,张文兰,刘丽君.氢氧化亚铁制备实验的设计[J].化学教学,2014,(9):52~54.

