IgA肾病胰岛素抵抗相关因素研究
林子淇,孙广萍,李鹂鸥,云 扬,李德天,张蓓茹,王艳秋
·论著·
IgA肾病胰岛素抵抗相关因素研究
林子淇,孙广萍,李鹂鸥,云 扬,李德天,张蓓茹,王艳秋
背景胰岛素抵抗(IR)是代谢综合征发病的中心环节及致病基础,也是发生肾损害、最终导致肾衰竭的独立危险因素。目的探讨IgA肾病(IgAN)患者IR的发生情况以及IR和IgAN基础临床指标、肾素-血管紧张素-醛固酮系统(RAAS)活性及病理严重程度之间的关系。方法回顾性选择2013年6月—2014年12月就诊于中国医科大学附属盛京医院第一肾内科且符合纳入标准的患者94例为研究对象。根据最终诊断结果将其分为IgAN组(44例)、膜性肾病(MN)组(26例)、微小病变肾病(MCD)组(24例)。收集患者一般资料,包括性别、年龄、体质指数(BMI)、收缩压、舒张压、24 h尿蛋白定量、清蛋白、血红蛋白、肌酐、肾小球滤过率(eGFR)、尿酸、空腹血糖(FBG)、空腹胰岛素(FINS)、肾素、血管紧张素Ⅱ(AngⅡ)、醛固酮、三酰甘油、胆固醇、低密度脂蛋白、C反应蛋白(CRP);计算稳态膜型的胰岛素抵抗指数(HOMA-IR),记录IR发生率;评估IgAN病理严重程度,包括MEST评分、肾小球硬化率、新月体率。结果MN组BMI、24 h尿蛋白定量、eGFR、三酰甘油、胆固醇、低密度脂蛋白水平高于IgAN组,清蛋白、肌酐、AngⅡ水平低于IgAN组(P<0.05);MCD组24 h尿蛋白定量、eGFR、三酰甘油、胆固醇、低密度脂蛋白水平高于IgAN组,清蛋白、肌酐、AngⅡ水平低于IgAN组(P<0.05)。MN组、MCD组HOMA-IR、IR发生率低于IgAN组(P<0.05)。HOMA-IR与年龄、24 h尿蛋白定量、清蛋白、血红蛋白、eGFR、肾素、醛固酮、胆固醇、低密度脂蛋白、MEST评分、肾小球硬化率、新月体率无直线相关关系(P>0.05);HOMA-IR与BMI、收缩压、舒张压、肌酐、尿酸、AngⅡ、三酰甘油、CRP呈正相关(P<0.05)。线性回归分析结果显示,HOMA-IR与BMI、收缩压、舒张压、肌酐、尿酸、AngⅡ、三酰甘油、CRP存在回归关系(P<0.05)。结论大部分IgAN患者存在IR,且与基础临床指标(BMI、收缩压、舒张压、肌酐、尿酸、三酰甘油、CRP)、RAAS活性呈正相关,但与病理严重程度无关。
肾小球肾炎,IGA;胰岛素抵抗;肾素-血管紧张素系统
林子淇,孙广萍,李鹂鸥,等.IgA肾病胰岛素抵抗相关因素研究[J].中国全科医学,2016,19(27):3270-3274.[www.chinagp.net]
LIN Z Q,SUN G P,LI L O,et al.Factors related to insulin resistance in IgA nephropathy[J].Chinese General Practice,2016,19(27):3270-3274.
IgA肾病(IgAN)是目前最常见的原发性肾小球肾炎之一,15%~20%的IgAN患者在确诊后10年内、30%~35%在确诊后20年内进入终末期肾衰竭[1]。目前认为,影响IgAN预后的因素可能为男性、年龄、蛋白尿、高血压、高尿酸、脂代谢异常、胰岛素抵抗(IR)、肥胖等[2-3]。IR是指体内胰岛素促进外周组织摄取并利用葡萄糖,抑制肝糖原输出的生物学效应减弱,而表现为高胰岛素血症和/或血糖升高,最常发生于代谢综合征患者,是代谢综合征发病的中心环节及致病基础;其不仅是新发糖尿病、心血管事件及全因死亡的危险因素,也是发生肾损害、最终导致肾衰竭的独立危险因素[4-6]。IgAN、膜性肾病(MN)、微小病变肾病(MCD)是临床常见的肾小球疾病,本研究旨在通过检测原发性IgAN患者与MN患者及MCD患者的相关临床指标,探讨IgAN患者IR发生情况,并分析IR与IgAN基础临床指标、肾素-血管紧张素-醛固酮系统(RAAS)活性及病理严重程度之间的关系,以利于临床早期发现IgAN的危险因素,早期干预,改善肾脏预后。
1 对象与方法
1.1纳入与排除标准纳入标准:经肾活检诊断为原发性IgAN、MN或MCD。排除标准:(1)肿瘤相关性肾损害、肝炎病毒相关性肾损害、自身免疫性疾病等继发性肾损害;(2)糖尿病、已服用血管紧张素转化酶抑制剂(ACEI)及血管紧张素Ⅱ(AngⅡ)受体阻滞剂(ARB)类降压药、服用糖皮质激素的患者。
1.2研究对象回顾性选择2013年6月—2014年12月就诊于中国医科大学附属盛京医院第一肾内科且符合纳入标准的患者94例为研究对象。其中男39例,女55例;年龄16~72岁,平均年龄(40.2±14.0)岁;IgAN 44例(IgAN组),MN 26例(MN组),MCD 24例(MCD组)。本研究经中国医科大学附属盛京医院伦理委员会审批通过。
1.3研究方法
1.3.1收集一般资料记录患者性别、年龄、身高、体质量、清晨血压等指标,计算体质指数(BMI)。收集24 h尿液,测定24 h尿蛋白定量。禁食8 h后于清晨空腹抽取外周静脉血2 ml,测定清蛋白、血红蛋白、肌酐、肾小球滤过率(eGFR)、尿酸、空腹血糖(FBG)、空腹胰岛素(FINS)、肾素、AngⅡ、醛固酮、三酰甘油、胆固醇、低密度脂蛋白、C反应蛋白(CRP)水平。血液及尿液样本检测均由本院检验科进行。所有患者行肾穿刺活检,并进行光镜、电镜、免疫荧光检查。应用肾脏病饮食改良(MDRD)简化公式计算eGFR:eGFR〔ml·min-1·(1.732 m2)-1〕=1.86×肌酐(mg/dl)-1.154×年龄-0.203×(0.742女性)。
1.3.2评估IR应用稳态模型的胰岛素抵抗指数(HOMA-IR)公式评估IR,HOMA-IR=(FBG×FINS)/22.5。HOMA-IR>1.0表示存在IR,记录IR发生率。
1.3.3评价IgAN病理严重程度采用Oxford-MEST评分系统评估IgAN病理严重程度,包括MEST评分、肾小球硬化率、新月体率;其中MEST评分包含系膜细胞增殖积分(M)、毛细血管内增生性病变积分(E)、节段硬化或粘连积分(S)、间质纤维化或小管萎缩积分(T)[7]。
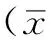
2 结果
2.1一般资料比较3组性别、年龄、收缩压、舒张压、血红蛋白、尿酸、肾素、醛固酮、CRP水平比较,差异无统计学意义(P>0.05);3组BMI、24 h尿蛋白定量、清蛋白、肌酐、eGFR、AngⅡ、三酰甘油、胆固醇、低密度脂蛋白水平比较,差异有统计学意义(P<0.05)。MN组BMI、24 h尿蛋白定量、清蛋白、肌酐、eGFR、AngⅡ、三酰甘油、胆固醇、低密度脂蛋白水平与IgAN组比较,差异有统计学意义(P<0.05);MCD组24 h尿蛋白定量、清蛋白、肌酐、eGFR、AngⅡ、三酰甘油、胆固醇、低密度脂蛋白水平与IgAN组比较,差异有统计学意义(P<0.05,见表1)。
2.2HOMA-IR、IR发生率比较3组HOMA-IR、IR发生率比较,差异有统计学意义(P<0.05);MN组、MCD组HOMA-IR、IR发生率低于IgAN组,差异有统计学意义(P<0.05,见表2)。
2.3IgAN病理严重程度MEST评分(1):M:M0 5例,M1 39例;(2)E:E0 38例,E1 6例;(3)S:S0 32例,S1 12例;(4)T:T0 24例,T1 12例,T2 8例。肾小球硬化率为(14.0±13.3)%;新月体率为(22.8±20.8)%。
2.4IgAN组HOMA-IR和各临床指标及病理指标之间的关系
2.4.1相关性分析HOMA-IR与年龄、24 h尿蛋白定量、清蛋白、血红蛋白、eGFR、肾素、醛固酮、胆固醇、低密度脂蛋白、MEST评分、肾小球硬化率、新月体率无直线相关关系(P>0.05);HOMA-IR与BMI、收缩压、舒张压、肌酐、尿酸、AngⅡ、三酰甘油、CRP呈正相关(P<0.05,见表3)。
2.4.2线性回归分析将与HOMA-IR有直线相关关系的各临床指标纳入线性回归分析,结果显示,HOMA-IR与BMI、收缩压、舒张压、肌酐、尿酸、AngⅡ、三酰甘油、CRP存在回归关系(P<0.05,见表4)。
3 讨论
IR是发生肾损害,最终导致肾衰竭的独立危险因素[4-6]。但IR与IgAN病理改变是否相关尚存在争议。研究指出,利用Oxford-MEST评分系统对IgAN进行病理分型后,IR与IgAN病理分型中的M存在相关关系[8]。本研究通过检测原发性IgAN患者与MN患者及MCD患者的相关临床指标,探讨IgAN患者IR发生情况,并利用Oxford-MEST评分系统对IgAN进行病理分型,进而分析IR与IgAN基础临床指标、RAAS活性及病理严重程度之间的关系。
本研究结果显示,IgAN组BMI小于MN组,却与MCD组无差异,考虑因MN组患者大部分为肾病综合征,存在大量蛋白尿、明显的水肿和高脂血症,故MN组可能因高度水肿而引起BMI升高。研究认为,高脂血症和BMI与IR存在相关性[9]。MN组、MCD组肌酐水平、AngⅡ水平、HOMA-IR、IR发生率低于IgAN组,三酰甘油、胆固醇、低密度脂蛋白水平均高于IgAN组。推测在IgAN患者中,肌酐、AngⅡ等指标对IR的影响超过BMI以及高脂血症对IR的影响。
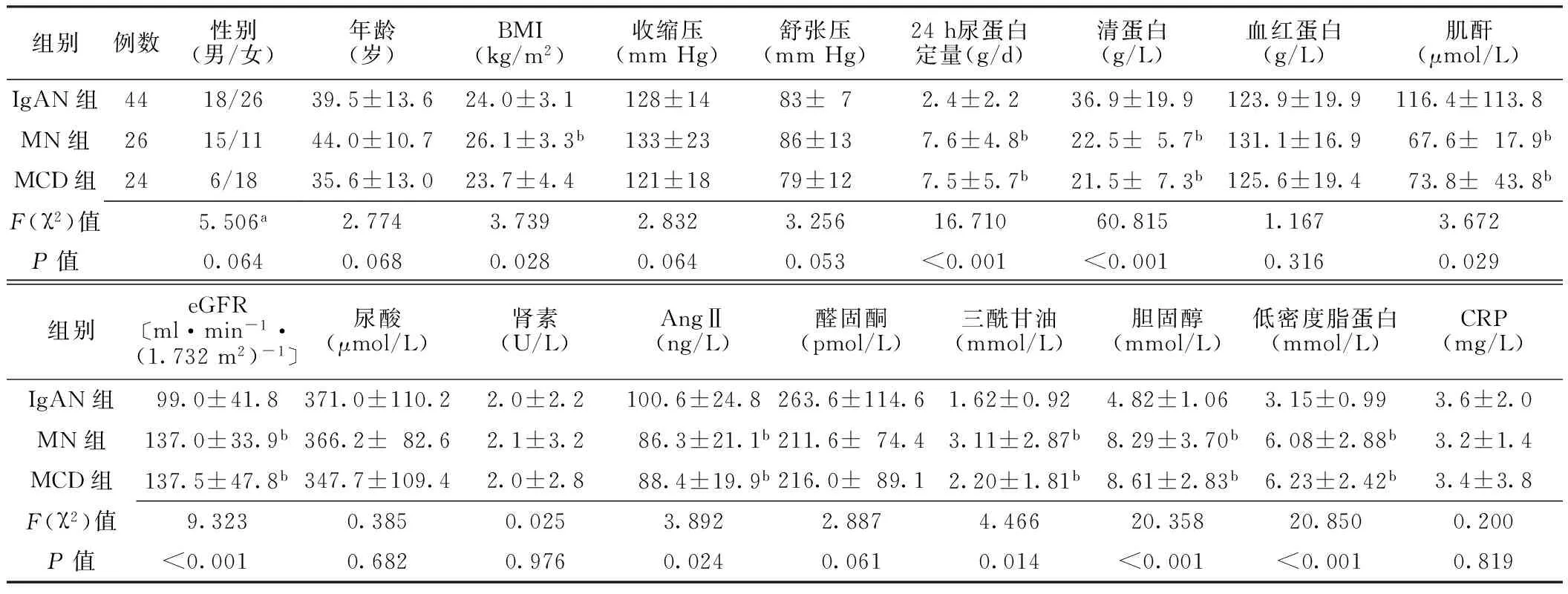
表1 3组患者一般资料比较
注:IgAN=IgA肾病,MN=膜性肾病,MCD=微小病变肾病,BMI=体质指数,eGFR=肾小球滤过率,AngⅡ=血管紧张素Ⅱ,CRP=C反应蛋白,1 mm Hg=0.133 kPa;a为χ2值;与IgAN组比较,bP<0.05
表23组患者HOMA-IR、IR发生率比较
Table 2Comparison of HOMA-IR and incidence of IR among the three groups
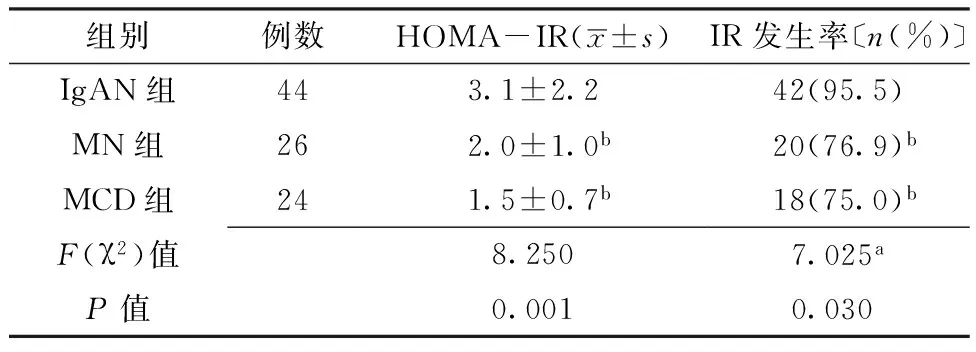
组别例数HOMA-IR(x±s)IR发生率〔n(%)〕IgAN组443.1±2.242(95.5)MN组262.0±1.0b20(76.9)bMCD组241.5±0.7b18(75.0)bF(χ2)值8.2507.025aP值0.0010.030
注:HOMA-IR=稳态模型的胰岛素抵抗指数,IR=胰岛素抵抗;a为χ2值;与IgAN组比较,bP<0.05
表3IgAN组HOMA-IR和各临床指标及病理指标之间的相关性分析
Table 3Correlation analysis of HOMA-IR with clinical and pathological parameters in IgAN group
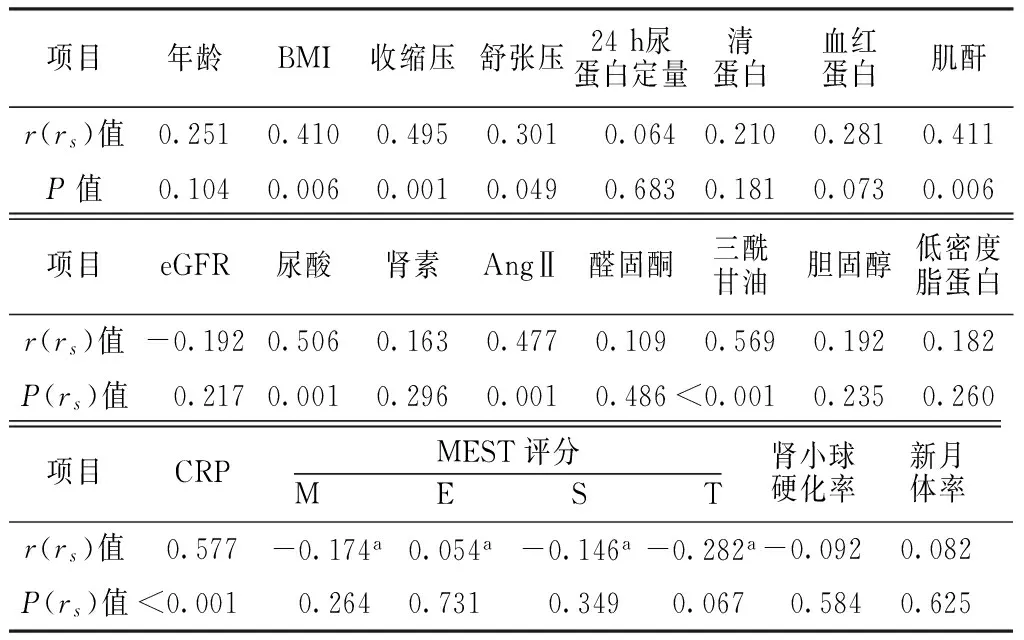
项目年龄BMI收缩压舒张压24h尿蛋白定量清蛋白血红蛋白肌酐r(rs)值0.2510.4100.4950.3010.0640.2100.2810.411P值0.1040.0060.0010.0490.6830.1810.0730.006项目eGFR尿酸肾素AngⅡ醛固酮三酰甘油胆固醇低密度脂蛋白r(rs)值-0.1920.5060.1630.4770.1090.5690.1920.182P(rs)值0.2170.0010.2960.0010.486<0.0010.2350.260项目CRPMEST评分M E S T肾小球硬化率新月体率r(rs)值0.577-0.174a0.054a-0.146a-0.282a-0.092 0.082 P(rs)值<0.0010.2640.7310.3490.0670.584 0.625
注:M=系膜细胞增殖积分,E=毛细血管内增生性病变积分,S=节段硬化或粘连积分,T=间质纤维化或小管萎缩积分;a为rs值
表4IgAN组HOMA-IR和与之有相关关系的指标的线性回归分析
Table 4The linear regression analysis of HOMA-IR with the co-relative indicators in IgAN group
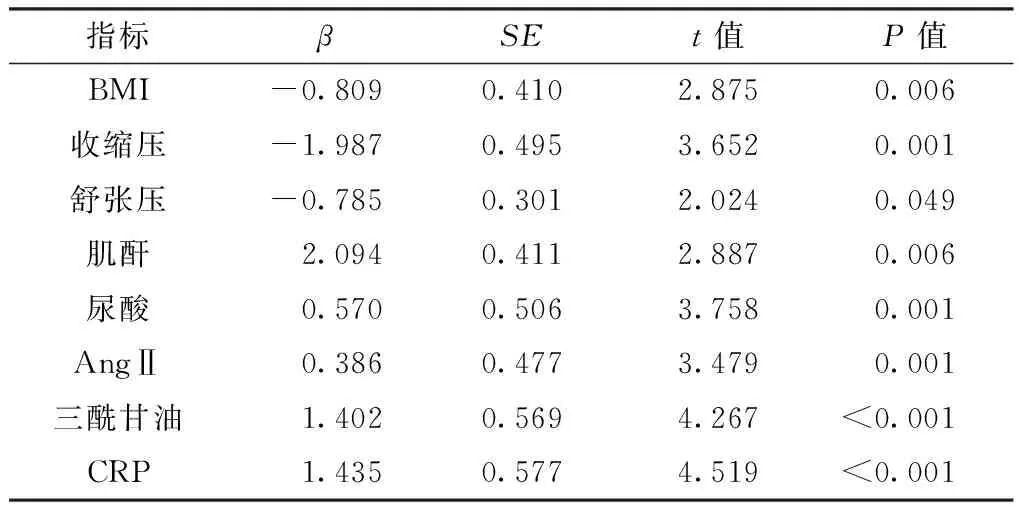
指标βSEt值P值BMI-0.8090.4102.8750.006收缩压-1.9870.4953.6520.001舒张压-0.7850.3012.0240.049肌酐2.0940.4112.8870.006尿酸0.5700.5063.7580.001AngⅡ0.3860.4773.4790.001三酰甘油1.4020.5694.267<0.001CRP1.4350.5774.519<0.001
研究显示,BMI是发生IR的独立危险因素,提示肥胖对肾功能的影响可能是通过IR这一途径[10]。EIRO等[11]研究显示,IR并不直接导致肾功能减退,而可能与IgAN患者的血压升高相关,由于高血压是IgAN进展的独立危险因素,故IR可能间接导致IgAN进展。而脂代谢异常在IgAN中,可能通过对肾小球血管的损伤以及引起IR而对肾脏产生损害[12]。超重和肥胖的IgAN患者易并发血管内皮功能失调、血脂异常、高血压,同时影响肾血流动力学而出现肾小球内高压力、高灌注、高滤过,引起肾损害[13]。研究显示,IgAN患者脂代谢异常主要引起肾小球硬化和肾小管损伤,其机制尚不完全清楚,可能与血脂异常引起动脉硬化有关[14]。本研究结果显示,HOMA-IR与BMI、收缩压、舒张压、三酰甘油呈正相关,HOMA-IR与BMI、收缩压、舒张压、三酰甘油存在回归关系,与上述报道结果[10-11,13]相符。
CRP是机体炎性反应的非特异性且敏感的指标[15]。IR或胰岛素敏感性降低时胰岛素生理活性下降,从而使CRP合成水平增高[16]。IgAN患者存在慢性炎性反应,其可能与IR程度相关[17],当CRP水平升高时,体内的免疫系统被激活,并发生炎性反应,形成恶性循环[17]。本研究结果显示,HOMA-IR与CRP呈正相关,HOMA-IR与CRP存在回归关系,与上述研究结果[15-17]一致。CRP也是冠心病的危险因素之一,其存在是IgAN患者发生心血管并发症的不良信号[18],所以在对IgAN患者治疗时检测CRP水平、IR的意义重大。
高尿酸血症是影响IgAN预后的独立危险因素,伴有高尿酸血症的IgAN患者发生不良预后的危险性为血尿酸水平正常患者的2.4倍[19]。高尿酸血症也能诱发炎性氧化应激,刺激炎性递质释放[20]。CORRY等[21]的研究显示,在IgAN患者中,血尿酸水平增高使血管平滑肌细胞增殖及肾脏局部RAAS激活,而RAAS的激活和IR起互相促进作用,且CRP的释放也可进一步加重IR,故而造成肾脏损伤。本研究结果显示,HOMA-IR与尿酸呈正相关,HOMA-IR与尿酸存在回归关系,也支持上述观点。但在IgAN中两者是否有协同作用而引起肾脏损伤,还需要进一步研究证实。
AngⅡ是RAAS最重要的组成成分,在肾脏疾病的进展中也扮演着重要的角色。IR与RAAS相互作用,使IgA 聚合体更容易沉积于肾小球系膜区并对系膜细胞及基质产生损伤,导致IgAN的发病与进展;IR还可加重肾小球局部高滤过、高灌注状态,并加重足细胞损伤,继而出现大量蛋白尿,这些因素最终导致IgAN进展[22]。本研究结果显示,HOMA-IR与AngⅡ呈正相关,HOMA-IR与AngⅡ存在回归关系,支持上述结论,IR可能通过与RASS系统相互作用而对肾脏产生损害。
YANG等[8]的研究发现,系膜细胞增殖是与IR相关的因素,故推断其可能是IgAN患者发生IR的机制。此外,IR还能通过直接损伤、诱导凋亡和加速肾小球硬化对肾小球造成损害。但是,本研究结果显示,HOMA-IR与MEST评分、肾小球硬化率、新月体率无直线相关关系、回归关系,原因可能和本研究收集的样本量小有关。若将肾脏病理改变进行详细分级,例如仅对肾间质损害情况就分为多个亚组进行研究,肾脏病理损害则可能与IR存在相关关系,而本研究利用的是Oxford-MEST评分系统,对肾小球及肾间质损害分级较粗略,因此进一步研究IgAN的IR水平和肾脏病理严重程度的关系,特别是利用Oxford-MEST评分系统进行病理评分尚需增加样本量。
本研究受收集资料时间以及地域限制,样本量较小,可能对结果有一定影响。
综上所述,大部分IgAN患者存在IR,且与基础临床指标(BMI、收缩压、舒张压、肌酐、尿酸、三酰甘油、CRP)、RAAS活性呈正相关,但与病理严重程度无关。若早期对IgAN患者IR以及其相关的危险因素进行检测及干预可能会延缓IgAN的进展。
作者贡献:林子淇进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;李鹂鸥、云扬进行试验实施、评估、资料收集;孙广萍、李德天、张蓓茹、王艳秋进行质量控制及审校。
本文无利益冲突。
[1]MORIYAMA T,TANAKA K,IWASAKI C,et al.Prognosis in IgA nephropathy:30-year analysis of 1,012 patients at a single center in Japan[J].PLoS One,2014,9(3):e91756.
[2]GUTIERREZ E,MORENO J A,PRAGA M,et al.Persistent microhaematuria with negative or low proteinuria[J].Nefrologia,2014,34(1):110-114.
[3]CHENG G Y,LIU D W,ZHANG N,et al.Clinical and prognostic implications of serum uric acid levels on lgA nephropathy:a cohort study of 348 cases with a mean 5-year follow-up[J].Clin Nephrol,2013,80(1):40-46.
[4]CUI M J,ZHANG B H,XIAO Q F,et al.The relationship between hyperuricaemia and clinic pathology of IgA nephropathy[J].Zhonghua Nei Ke Za Zhi,2011,50(8):659-663.
[5]KATAOKA H,OHARA M,SHIBUI K,et al.Overweight and obesity accelerate the progression of IgA nephropathy:prognostic utility of a combination of BMI and histopathological parameters[J].Clin Exp Nephrol,2012,16(5):706-712.
[6]SHI Y,CHEN W,JALAL D,et al.Clinical outcome of hyperuricemia in IgA nephropathy:a retrospective cohort study and randomized controlled trial[J].Kidney Blood Press Res,2012,35(3):153-160.
[7]Working Group of the International IgA Nephropathy Network and the Renal Pathology Society,CATTRAN D C,COPPO R,et al.The Oxford classification of IgA nephropathy:rationale,clinicopathological correlations,and classification[J].Kidney Int,2009,76(5):534-545.
[8]YANG Y,WEI R B,WANG Y D,et al.Higher HOMA-IR index and correlated factors of insulin resistance in patients with IgA nephropathy[J].Clin Nephrol,2012,78(5):353-358.
[9]DEFRONZO R A.Insulin resistance,lipotoxicity,type2 diabetes and atherosclerosis:the missing links.The Claude Bernard Lecture 2009[J].Diabetologia,2010,53(7):1270-1287.
[10]宋颖,李启富.不同种族胰岛素抵抗状态比较及相关影响因素[J].中国糖尿病杂志,2013,21(1):91-92.
[11]EIRO M,KATOH T,SAKUMA Y,et al.Insulin resistance highly associates with hypertension in IgA nephropathy[J].Clin Nephrol,2003,2(11):71-78.
[12]ROSS W R,MCGILL J B.Epidemiology of obesity and chronic kidney disease[J].Adv Chronic Kidney Dis,2006,13(4):325-335.
[13]NAKAMURA T,FUJIKURA Y,SUGA N,et al.An IgA nephropathy case with highly reduced urinary protein concomitant with reduced obesity[J].Nihon Jinzo Gakkai Shi,2006,48(7):675-679.
[14]MUNTNER P,CORESH J,SMITH J C,et al.Plasma lipids and risk of developing renal dysfunction:the atherosclerosis risk in communities study[J].Kidney Int,2000,58(1):293-301.
[15]胡芳芳.C-反应蛋白对慢性肾功能衰竭患者预后的影响[J].临床医学,2011,31(4):15-17.
[16]PICKUP J C,MATTON M B,CHUANEY G D,et al.NIDDM as a disease of the innate immune system:association of acute-phase reactants and interleukin-6 eith metabolic syndrome X[J].Diabetologia,1997,40(11):1286-1292.
[17]蒙庆旭,唐毓启.IgA肾病患者脂联素和C反应蛋白与胰岛素抵抗的临床研究[J].中国现代药物应用,2012,6(20):37-38.
[18]SMITH N L,PSATY B M,FURBERG C D,et al.Temporal trends in the use of anticoagulants among older adults with altial fibrillation[J].Arch Intem Med,1999,159(14):1574-1578.
[20]KANG D H,PARK S K,LEE I K,et al.Uric acid-induced C-reactive protein expression:implication on cell proliferation and nitric oxide production of human vascular cells[J].J Am Soc Nephrol,2005,16(12):3553-3562.
[21]CORRY D B,ESLAMI P,YAMAMOTO K,et al.Uric acid stimulates vascular smooth muscle cell proliferation and oxidative stress via the vascular renin-angiotensin systen[J].J Hypertens,2008,26(2):269-275.
[22]杨悦,魏日胞.胰岛素抵抗在IgA 肾病中作用的研究进展[J].中国中西医结合肾病杂志,2011,12(4):361-362.
(本文编辑:崔丽红)
Factors Related to Insulin Resistance in IgA Nephropathy
LINZi-qi,SUNGuang-ping,LILi-ou,YUNYang,LIDe-tian,ZHANGBei-ru,WANGYan-qiu.
RenalDepartmentofInternalMedicine,ShengjingHospitalofChinaMedicalUniversity,Shenyang110004,ChinaCorrespondingauthor:SUNGuang-ping,RenalDepartmentofInternalMedicine,ShengjingHospitalofChinaMedicalUniversity,Shenyang110004,China;E-mail:sunguangping@hotmail.com
BackgroundInsulin resistance (IR) is the central link and the pathogenic basis of metabolic syndrome as well as the independent risk factor leading to kidney damage and eventually renal failure.ObjectiveTo discuss the occurrence of IR and the relationship between IR and basic clinical indexes of IgAN,activity of renin-angiotensin-aldosterone system (RAAS) and pathological severity.Methods94 patients who met inclusion criteria and visited the First Nephrology Department of Shengjing Hospital of China Medical University from June 2013 to December 2014 were retrospectively selected as objects of study.According to the results of final diagnosis,they were divided into IgAN group (44 cases),membranous nephropathy (MN) group (26 cases) and minimal change disease (MCD) group (24 cases).General data of patients were collected,including gender,age,body mass index (BMI),systolic pressure,diastolic pressure,24 h urinary protein quantitative,albumin,hemoglobin,creatinine,glomerular filtration rate (eGFR),uric acid,fasting blood glucose (FBG),fasting insulin (FINS),rennin,AngⅡ,aldosterone,triglycerides,cholesterol,low density lipoprotein,c-reactive protein(CRP).The HOMA-IR was calculated and the incidence of IR was recorded.The pathological severity of IgAN was evaluated,including MEST score,glomerular sclerosis rate and crescent rate.ResultsMN group was significantly higher in the levels of BMI,24 h urinary protein quantitative,eGFR,triglycerides,cholesterol and low density lipoprotein and lower in the levels of albumin,creatinine and AngⅡ than those of IgAN group (P<0.05).MCD group was significantly higher in the levels of 24 h urinary protein quantitative,eGFR,triglycerides,cholesterol and low density lipoprotein and lower in the levels of albumin,creatinine and AngⅡthan those of IgAN group (P<0.05).The HOMA-IR and incidence rate of IR in MN group and MCD group were lower than those of IgAN group (P<0.05).There was no linear correlation between HOMA-IR and age,24 h urinary protein quantitative,albumin,hemoglobin,eGFR,renin,aldosterone,cholesterol,low density lipoprotein,MEST score,glomerular sclerosis rate and crescent rate (P>0.05).HOMA-IR was positively correlated with BMI,systolic pressure,diastolic pressure,creatinine,uric acid,AngⅡ,triglycerides and CRP (P<0.05).The results of linear regression analysis showed that there was a linear regression relationship between HOMA-IR and BMI,systolic pressure,diastolic pressure,creatinine,uric acid,AngⅡ,triglycerides and CRP (P<0.05).ConclusionMost IgAN patients have IR,which is positively correlated with basic clinical indexes (BMI,systolic pressure,diastolic pressure,creatinine,uric acid,triglycerides,CRP) and the activity of RAAS,but has nothing to do with pathological severity.
Glomerulonephritis,IGA;Insulin resistance;Renin-angiotensin system
辽宁省博士启动基金资助项目(20101143)
110004 辽宁省沈阳市,中国医科大学附属盛京医院肾内科
孙广萍,110004 辽宁省沈阳市,中国医科大学附属盛京医院肾内科;E-mail:sunguangping@hotmail.com
R 692.31
A
10.3969/j.issn.1007-9572.2016.27.003
2015-12-21;
2016-05-29)

