启膈散对食管癌细胞间同质黏附力的影响
史会娟,高 静,石冬璇,李 晶
·论著·
·中医·中西医结合研究·
启膈散对食管癌细胞间同质黏附力的影响
史会娟,高 静,石冬璇,李 晶
背景食管癌的发病率有明显的地理特征,每年约有50%的新诊断病例发生在中国。目的研究启膈散对食管癌细胞间同质黏附力的影响,并探讨其作用机制。方法2015年3—6月,体外培养Eca109、TE13、TE1,采用机械法检测不同剂量启膈散(0、50、100 μg/ml)(分别为对照组、低剂量组、高剂量组)干预后Eca109、TE13、TE1同质黏附值,Western blotting法检测不同剂量启膈散(0、50、100 μg/ml)(分别为对照组、低剂量组、高剂量组)干预后Eca109、TE13、TE1中Cx32表达水平,免疫细胞化学法检测不同剂量启膈散(0 μg/ml和100 μg/ml)(分别为对照组、启膈散组)干预后Eca109、TE13、TE1中E-cadherin表达情况,划痕实验检测不同剂量启膈散(0、50、100 μg/ml)(分别为对照组、低剂量组、高剂量组)干预后Eca109、TE13、TE1迁移能力。结果低剂量组、高剂量组Eca109、TE13、TE1同质黏附值大于对照组(P<0.05);高剂量组Eca109、TE13、TE1同质黏附值大于低剂量组(P<0.05)。低剂量组TE1中Cx32表达水平高于对照组(P<0.05);高剂量组Eca109、TE13、TE1中Cx32表达水平高于对照组、低剂量组(P<0.05)。对照组、启膈散组Eca109、TE1、TE13中E-cadherin表达均为阴性,未见表达增强。低剂量组、高剂量组12 h、24 h时Eca109、TE13、TE1划痕宽度大于对照组(P<0.05);高剂量组12 h时Eca109划痕宽度大于低剂量组,12 h、24 h时TE13、TE1划痕宽度大于低剂量组(P<0.05)。结论启膈散能够增加Cx32表达水平,从而提高食管癌细胞间同质黏附力,进而抑制食管癌细胞的迁移。
食管肿瘤;细胞黏附;细胞运动;启膈散
史会娟,高静,石冬璇,等.启膈散对食管癌细胞间同质黏附力的影响[J].中国全科医学,2016,19(27):3317-3321.[www.chinagp.net]
SHI H J,GAO J,SHI D X,et al.Effect of Qigesan on the cell-cell adhesion of esophageal cancer[J].Chinese General Practice,2016,19(27):3317-3321.
食管癌发病有明显的地域性差别,我国是世界上食管癌发病率和病死率最高的国家,河南林州、河北磁县及涉县、山西阳城是食管癌高发区,发病率达到世界平均水平的10倍[1]。转移是恶性肿瘤的基本生物学特征,是最终导致食管癌患者死亡的主要原因[2]。作为食管癌高发区,寻求抑制其转移的有效方法十分重要。
启膈散出自程国彭(清)的《医学心悟》[3],其认为前人以大小半夏汤等燥烈止吐之品治疗噎膈,实属医家之误,不应盲从,提出“凡噎膈症,不出胃脘干槁四字”,应用启膈散甘润濡养以治噎膈。启膈散为“甘润濡养”的代表方,能够针对食管癌“胃脘干槁”的病理机制进行治疗,进而抑制食管癌细胞转移[4],但其具体机制仍不明确。本研究旨在探讨启膈散对食管癌细胞间同质黏附力的影响,并探讨其作用机制,以期为启膈散治疗食管癌提供免疫学依据。
1 材料与方法
1.1实验材料人食管癌细胞株Eca109、TE13、TE1由河北省肿瘤研究所提供,购自中国科学院上海细胞生物学研究所;RPMI 1640培养基购自美国Corning公司;胎牛血清购自美国Biological公司;兔抗人E-cadherin、Cx32抗体购自美国Bioworld Technology,Inc.公司。
1.2实验方法
1.2.1细胞培养2015年3—6月,低分化人食管癌细胞株TE13及高分化人食管癌细胞株Eca109、TE1均用含10%胎牛血清的RPMI 1640培养基,在37 ℃、5% CO2的饱和湿度条件下培养。倒置显微镜下观察,待细胞贴壁生长至融合度达90%时,用0.25%胰蛋白酶消化并传代。
1.2.2启膈散提取物制备将郁金75 g、沙参75 g、丹参50 g、浮小麦15 g、浙贝30 g、茯苓30 g、砂仁30 g、荷叶15 g采用水提法制备提取物,分装并储存于-80 ℃冰箱,用完全培养基配置1 mg/ml储存液,并用滤器过滤,保存于无菌离心管中,用封口膜封口,储存于4 ℃冰箱备用。
1.2.3机械法检测细胞同质黏附值[5]采用机械法测定细胞同质黏附值,96孔板中分别加入Eca109、TE13、TE1(105个/ml),每孔100 μl,置于37 ℃ 5% CO2培养箱中培养,当细胞铺至70%~80%时,加不同剂量启膈散(0、50、100 μg/ml)(分别为对照组、低剂量组、高剂量组)培养24 h。当细胞单层长满96孔板底层,每孔加入105个/ml的同种细胞100 μl,每组设6个复孔。将细胞置于37 ℃ 5% CO2培养箱中分别孵育60 min后吸出未结合的细胞悬液。在光镜下计数,加入细胞数和吸出细胞数之差为细胞同质黏附值,取其均值。实验重复3次。
本研究背景:
河北是食管癌的高发地区,本研究组能够接触到大量食管癌患者,通过长期的临床观察发现,多数食管癌患者存在口干、便秘、消瘦、舌质红、脉细等阴虚症候,即使食管癌术后的患者,这种阴虚体质仍然没有改善,而应用启膈散治疗食管癌患者能够明显抑制肿瘤转移,可能延长患者生存期。《医学心悟》中也指出“凡噎膈症,不出胃脘干槁四字”,应用启膈散“甘润濡养”以治噎膈。结合临床所见患者症候,笔者认为,启膈散为“甘润濡养”的代表方,能够针对食管癌“胃脘干槁”的病理机制进行干预治疗,从而抑制食管癌的转移。
1.2.4Western blotting法检测Cx32表达水平[6]收集不同剂量启膈散(0、50、100 μg/ml)(分别为对照组、低剂量组、高剂量组)培养24 h的Eca109、TE13、TE1,冷磷酸盐缓冲液(PBS)洗涤细胞3次后,刮下细胞,4 ℃条件下10 000 r/min离心5 min(离心半径6 cm),弃上清液,加入全细胞裂解液100 μl,放置冰上30 min。4 ℃条件下10 000 r/min离心30 min(离心半径6 cm),取上清液即为细胞总蛋白,按照BCA蛋白浓度测定试剂盒的操作步骤进行蛋白定量检测。将Cx32与5×上样缓冲液混合均匀,100 ℃水浴加热5 min使蛋白变性,冷却后,-80 ℃保存备用。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、封闭,一抗(兔抗人Cx32抗体)结合过夜,洗膜,二抗(Donkey Anti-Rabbit IgG H&L preadsorbed)结合。TBST室温洗膜3次,10 min/次,采用成像分析软件对Western blotting法显色区带的信号强度进行相对定量分析,扫描结果用灰度值表示。实验重复3次。
1.2.5免疫细胞化学法检测E-cadherin表达情况收集不同剂量启膈散(0 μg/ml和100 μg/ml)(分别为对照组、启膈散组)培养24 h的Eca109、TE1、TE13,爬片,多聚甲醛固定,3%甲醇过氧化氢中室温孵育20~25 min,以消除内源性过氧化物酶的活性,蒸馏水冲洗3次,3 min/次,在0.01 mol/L PBS中浸泡5 min;山羊血清封闭,37 ℃湿盒内孵育细胞45 min;倾去血清,滴加1∶200稀释的兔抗人E-cadherin一抗,4 ℃过夜,0.01 mol/L PBS冲洗3次,5 min/次;二抗(羊抗兔IgG抗体)37 ℃湿盒内孵育细胞30 min,0.01 mol/L PBS缓冲液冲洗3 次,5 min/次;辣根酶标记链霉卵白素工作液,37 ℃湿盒内孵育细胞30 min,0.01 mol/L PBS冲洗3次,5 min/次;DAB液显色,蒸馏水终止显色;苏木素复染1 min,自来水冲洗3次,盐酸溶液和乙醇溶液冲洗1次,自来水冲洗1次,氨水返蓝1 min,自来水冲洗1次,80%乙醇溶液浸泡5 min,95%乙醇溶液浸泡5 min,无水乙醇浸泡2次,5 min/次,中性树胶封固,显微镜下观察。结果由病理科主任医师独立阅片。判定标准:参照文献[7]中的方法,每张切片随机观察10个高倍视野,每个视野计数100个细胞。按染色强度和染色阳性细胞百分率综合评分:无染色为0分,染色较弱为1分,中等强度为2分,强染色为3分;染色阳性细胞百分率<6%为0分,6%~<26%为1分,26%~50%为2分,>50%为3分。每张切片平均染色强度得分与染色阳性细胞百分率得分相乘,结果≤1分为阴性(-),2~3分为阳性(+),4~6分为弱阳性(++),>6分为强阳性(+++)。实验重复3次。
1.2.6划痕实验检测细胞迁移能力参照ZHANG等[8]的方法,将Eca109、TE13、TE1以5×106/ml密度接种于12孔板培养24 h,并给予不同剂量启膈散(0、50、100 μg/ml)(分别为对照组、低剂量组、高剂量组)继续培养24 h,待细胞达90%汇合时,用100 μl无菌枪头划痕,PBS清洗3次,去除划痕处划下的悬浮细胞,放入37 ℃ 5% CO2培养箱中培养。在0、12、24 h拍照,显微镜下测量划痕的宽度,以0 h时划痕宽度为标准对照。实验重复3次。划痕宽度越大,表明细胞迁移能力越弱。
2 结果
2.1同质黏附值比较对照组、低剂量组、高剂量组Eca109、TE13、TE1同质黏附值比较,差异均有统计学意义(P<0.05);其中,低剂量组、高剂量组Eca109、TE13、TE1同质黏附值大于对照组,差异有统计学意义(P<0.05);高剂量组Eca109、TE13、TE1同质黏附值大于低剂量组,差异有统计学意义(P<0.05,见表1)。
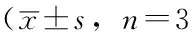
Table 1Comparison of cell-cell adhesion of Eca109,TE13 and TE1 among control group,low dose group and high dose group
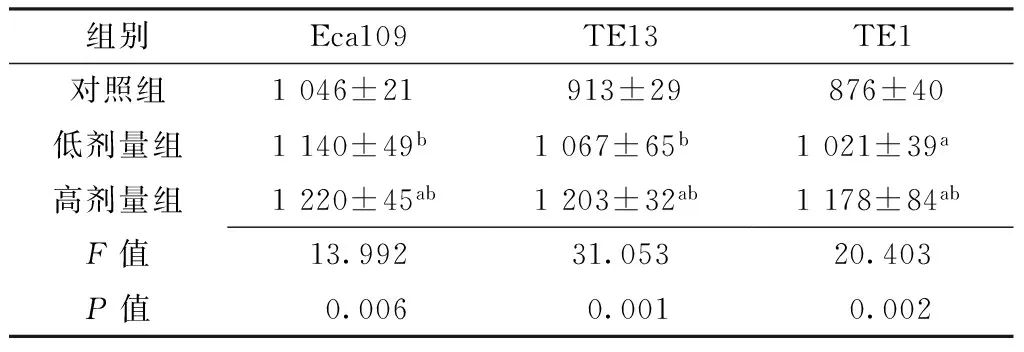
组别Eca109TE13TE1对照组1046±21 913±29 876±40低剂量组1140±49b1067±65b1021±39a高剂量组1220±45ab1203±32ab1178±84abF值13.99231.05320.403P值0.0060.0010.002
注:与对照组比较,aP<0.05;与低剂量组比较,bP<0.05
2.2Cx32表达水平比较对照组、低剂量组、高剂量组Eca109、TE13、TE1中Cx32表达水平比较,差异有统计学意义(P<0.05);其中,低剂量组TE1中Cx32表达水平高于对照组,差异有统计学意义(P<0.05);高剂量组Eca109、TE13、TE1中Cx32表达水平高于对照组、低剂量组,差异有统计学意义(P<0.05,见图1、表2)。
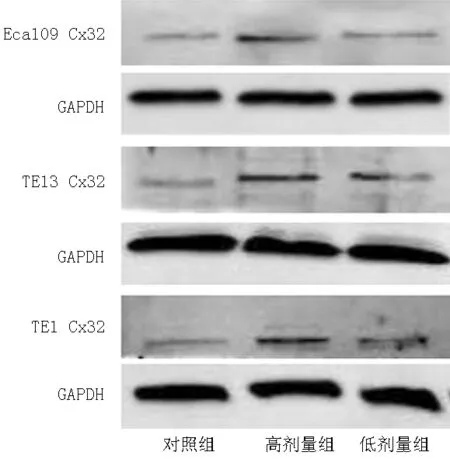
图1 Western blotting法检测Cx32表达水平的SDS-PAGE图
Figure 1SDS-PAGE of measurement of Cx32 expression level by Western blotting method
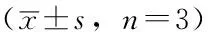
Table 2Comparison of expression level of Cx32 in Eca109,TE13 and TE1 among control group,low dose group and high dose group
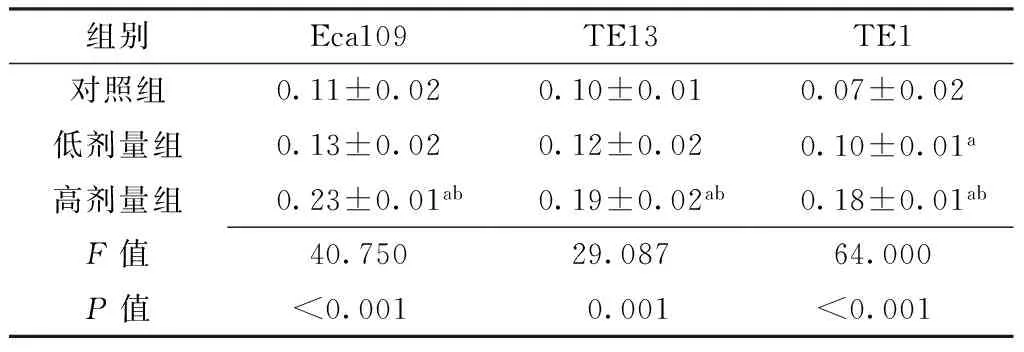
组别Eca109TE13TE1对照组0.11±0.020.10±0.010.07±0.02低剂量组0.13±0.020.12±0.020.10±0.01a高剂量组0.23±0.01ab0.19±0.02ab0.18±0.01abF值40.75029.08764.000P值<0.0010.001<0.001
注:与对照组比较,aP<0.05;与低剂量组比较,bP<0.05
2.3E-cadherin表达情况比较对照组、启膈散组Eca109、TE1、TE13中E-cadherin表达均为阴性,未见表达增强(见图2,本文图2彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.4划痕宽度比较对照组、低剂量组、高剂量组12 h、24 h时Eca109、TE13、TE1划痕宽度比较,差异有统计学意义(P<0.05);低剂量组、高剂量组12 h、24 h时Eca109、TE13、TE1划痕宽度大于对照组,差异有统计学意义(P<0.05);高剂量组12 h时Eca109划痕宽度大于低剂量组,12 h、24 h时TE13、TE1划痕宽度大于低剂量组,差异有统计学意义(P<0.05,见图3、表3)。
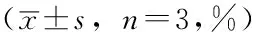
表3 对照组、低剂量组、高剂量组Eca109、TE13、TE1划痕宽度比较
注:与对照组比较,aP<0.05;与低剂量组比较,bP<0.05
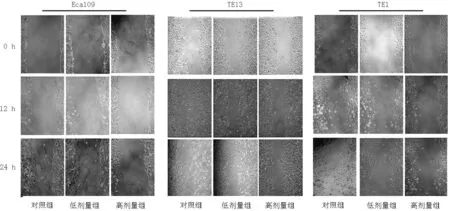
图3 划痕实验检测细胞迁移能力
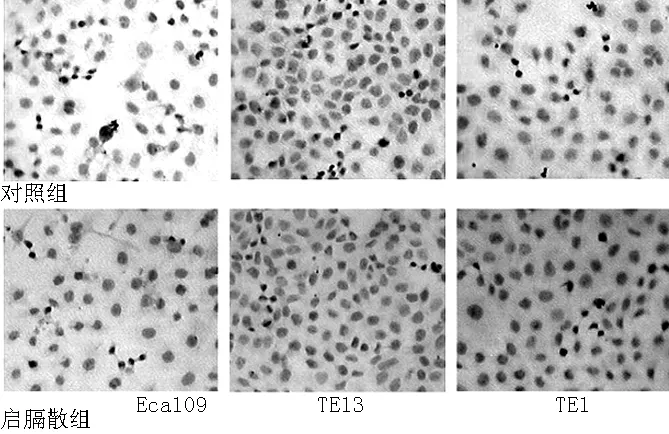
图2 免疫组化法检测Eca109、TE13、TE1中E-cadherin表达情况
Figure 2Measurement of E-cadherin expression in Eca109,TE13 and TE1 by immunocytochemistry
3 讨论
转移是个多因素、多环节的复杂病理过程。在肿瘤转移的各个环节中均涉及细胞黏附作用[9]。肿瘤细胞从原发灶脱离,与同质黏附力减弱有关,是发生转移的第一步。有实验证实,肿瘤细胞间同质黏附值比正常细胞低,有利于肿瘤细胞离开原发灶[10],从而发生转移。因此,增强肿瘤细胞间同质黏附力将有可能防止肿瘤细胞转移。启膈散是针对食管癌的古方,其能否增强食管癌细胞间同质黏附力,目前仍未见相关报道。本研究从同质黏附力着眼,研究启膈散对食管癌细胞的作用,以期为启膈散的临床应用提供依据。
本研究结果显示,低剂量组、高剂量组Eca109、TE13、TE1同质黏附值大于对照组,高剂量组Eca109、TE13、TE1同质黏附值大于低剂量组,提示启膈散能够增强食管癌细胞间同质黏附力,且100 μg/ml启膈散作用更明显。E-cadherin作为被研究得最为透彻的细胞黏附分子,对维持正常上皮细胞形态和结构的完整性起重要作用,其主要介导细胞间同质黏附力从而使细胞密切接触[11]。因此,本研究进一步检测了人食管癌细胞Eca109、TE13、TE1的粘连蛋白E-cadherin和间隙连接蛋白Cx32的水平。
细胞间隙连接(GJ)是细胞间直接进行信息交换的重要通道,癌变过程中多伴随GJ功能的减弱[12]。连接蛋白是GJ的物质基础,肿瘤细胞中均存在间隙连接蛋白Cx32的表达降低,Cx32基因被认为是一类肿瘤抑制基因[6]。有研究证实,食管癌细胞转移常伴有Cx32的异常定位和表达[13]。本研究结果显示,高剂量组Eca109、TE13、TE1中Cx32表达水平高于对照组、低剂量组,提示启膈散能够增强食管癌细胞Cx32的表达。
E-cadherin是黏附素家族的主要成员,是维持细胞间同质黏附力的主要因素之一,且其通过介导Ca2+依赖性间隙连接形成途径从而促进间隙连接蛋白向细胞膜转运和调节其磷酸化[14]。本研究结果显示,对照组、启膈散组Eca109、TE1、TE13中E-cadherin表达均为阴性,未见表达增强。证实启膈散增强细胞间同质黏附力并不是通过增强E-cadherin的表达来实现的。
有研究证实,同质黏附力的增强能够抑制肿瘤细胞的运动能力[10],所以本研究继续进行了划痕试验观察启膈散对食管癌细胞迁移能力的影响,进一步验证细胞间同质黏附力的变化,结果显示,低剂量组、高剂量组12 h、24 h时Eca109、TE13、TE1划痕宽度大于对照组,高剂量组12 h时Eca109划痕宽度大于低剂量组,12 h、24 h时TE13、TE1划痕宽度大于低剂量组,提示低剂量组、高剂量组细胞迁移能力弱于对照组,高剂量组细胞迁移能力弱于低剂量组,说明启膈散能够增强细胞间同质黏附力,从而抑制食管癌细胞的迁移,且100 μg/ml启膈散作用更明显。
本研究为体外细胞研究阶段,所有实验结果有待体内试验的进一步证实。而且有大量研究显示,间隙连接与肿瘤细胞间的同质黏附力、细胞骨架、上皮细胞间质转化均有密切联系[15]。因此,今后将从肿瘤细胞间同质黏附力和上皮细胞间质转化等方面进一步揭示启膈散抑制食管癌转移的机制,并指导临床治疗应用。
综上所述,启膈散能够增加Cx32表达水平,从而增强食管癌细胞间同质黏附力,进而抑制食管癌细胞的迁移。
作者贡献:史会娟进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;高静进行实验实施、评估、资料收集;石冬璇负责资料收集整理、实验实施、数据统计;李晶进行质量控制及审校。
本文无利益冲突。
[1]LIU P,GAO Y,HUAN J,et al.Upregμlation of PAX2 promotes the metastasis of esophageal cancer throμgh interleukin-5[J].Cell Physiol Biochem,2015,35(2):740-754.
[2]WESTERP M,KOPPERT L B,BUSKENS C J.Outcome of surgical treatment for early adenocarcinoma of the esophagus or gastro-esophageal junction[J].Virchows Archiv,2005,446(5):497-504.
[3]程钟龄.医学心悟[M].北京:科学技术文献出版社,2003:138.
[4]李晶,史会娟.以甘润濡养立法的启膈散治疗食管癌概况[J].中国全科医学,2015,18(18):2198-2120.
LI J,SHI H J.Treating esophageal cancer with qigesan based on theory of ganrun ruyang:a literature review[J].Chinese General Practice,2015,18(18):2198-2120.
[5]宋仕茂,陈珺.p27mt基因对大肠癌Lovo细胞粘附作用的影响[J].肿瘤防治研究,2006,33(5):346-348.
SONG S M,CHEN J.The adhesion effect of colorectal carcinoma Lovo cells by human mutant p27mt gene[J].Cancer Research on Prevention and Treatment,2006,33(5):346-348.
[6]ZHAO L,YAN X,SHI J,et al.Ethanol extract of Forsythia suspensa root induces apoptosis of esophageal carcinoma cells via the mitochondrial apoptotic pathway[J].Mol Med Rep,2015,11(2):871-880.
[7]李德旭,王扬,金俊硕,等.十二指肠乳头癌中埃兹蛋白和钙黏蛋白的表达与预后关系研究[J].中国全科医学,2012,15(12):1352-1355.
LI D X,WANG Y,JIN J S,et al.Relationship among expressions of Ezrin,E-cadherinherin protein and surviving prognosis in duodenal papilla neoplasm[J].Chinese General Practice,2012,15(12):1352-1355.
[8]ZHANG N,KONG X,YAN S,et al.Huaier aqueous extract inhibits proliferation of breast cancer cells by inducing apoptosis[J].Cancer Sci,2010,101(11):2375-2383.
[9]NAIR K S,NAIDOO R,CHETTY R.Expression of cell adhesion moleeules in oesophageal careinoma and its prognostic value[J].J Clin Pathol,2005,58(4):343-351.
[10]MA L,YOUNG J,PRABHALA H,et al.miR-9,a MYC/MYCN-activated microRNA,regulates E-cadherinherin and cancer metastasis[J].Nat Cell Biol,2010,12(3):247-256.
[11]霍西茜,王宁.钙粘素蛋白-E与肿瘤发生及生物学行为相关性的研究进展[J].现代肿瘤医学,2013,21(8):1879-1882.
[12]DEL MONTE U,STATUTO M.Drop of connexins:a possible link between aging and cancer?[J].Exp Gerontol,2004,39(2):273-275.
[13]MAURO V,CARETTE D,PONTIER-BRES R,et al.The anti-mitotic drμg griseofμlvin induces apoptosis of human germ cell tumor cells throμgh a connexin 43-dependent molecμlar mechanism[J].Apoptosis,2013,18(4):480-491.
[14]BAO B,JIANG J,YANASE T,et al.Connexon-mediated cell adhesion drives microtissue self-assembly[J].FASEB J,2011,25(1):255-264.
[15]KANCZUGA-KODA L,WINCEWICZ A,FUDALA A,et al.E-cadherinherin and β-catenin adhesion proteins correlate positively with connexins in colorectal cancer[J].Oncol Lett,2014,7(6):1863-1870.
(本文编辑:崔丽红)
Effect of Qigesan on the Cell-cell Adhesion of Esophageal Cancer
SHIHui-juan,GAOJing,SHIDong-xuan,LIJing.
DepartmentofTraditionalChineseMedicine,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,ChinaCorrespondingauthor:LIJing,DepartmentofTraditionalChineseMedicine,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China;E-mail:lijingtiger@163.com
BackgroundThe incidence of esophageal cancer has distinct geographical characteristics,with approximately 50% of all newly diagnosed cases occurring in China annually.ObjectiveTo investigate the effects and mechanism of Qigesan on the cell-cell adhesion of esophageal carcinoma.MethodsFrom March to June in 2015,the human esophageal carcinoma cell lines Eca109,TE13 and TE1 were cultured in vitro.Eca109,TE13 and TE1 were treated with the different dose of Qigesan (0 μg/ml in control group,50 μg/ml in low dose group,100 μg/ml in high dose group),the cell-cell adhesion was tested by mechanical method,the expression level of Cx32 in Eca109,TE13 and TE1 was detected by Western blotting method.The expression of E-cadherin in Eca109,TE13 and TE1 with different dose of Qigesan (0 μg/ml in control group,100 μg/ml in Qigesan group) was detected by SP immunohistochemistry method.The metastatic abilities of Eca109,TE13 and TE1 with different dose of Qigesan (0 μg/ml in control group,50 μg/ml in low dose group,100 μg/ml in high dose group) were detected by scratch-wound assays.ResultsThe cell-cell adhesion of Eca109,TE13 and TE1 in low dose group and high dose group was higher than that in control group respectively (P<0.05);the cell-cell adhesion of Eca109,TE13 and TE1 in high dose group was higher than that in low dose group (P<0.05).The expression level of Cx32 of TE1 in low dose group was higher than that in control group (P<0.05);the expression level of Cx32 of Eca109,TE13 and TE1 in high dose group was higher than that in control group and low dose group respectively (P<0.05).The expression of the E-cadherin was negative in control group and Qigesan group.At 12 h and 24 h,the scratch of Eca109,TE13 and TE1 in low dose group and high dose group was wider than that in control group respectively (P<0.05).At 12 h,the scratch of Eca109 in high dose group was wider than that in low dose group (P<0.05).At 12 h and 24 h,the scratch of TE13 and TE1 in high dose group was wider than that in low dose group (P<0.05).ConclusionQigesan can improve the expression level of Cx32,then improve the cell-cell adhesive ability and reduce the migratory ability of esophageal carcinoma cells.
Esophageal neoplasms;Cell adhesion;Cell movement;Qigesan
国家自然科学基金资助项目(81403310);河北省科技厅资助项目(13277718D)
050011 河北省石家庄市,河北医科大学第四医院中医科(史会娟,高静,李晶);河北医科大学研究生学院(石冬璇)
李晶,050011 河北省石家庄市,河北医科大学第四医院中医科;E-mail:lijingtiger@163.com
R 735.1
A
10.3969/j.issn.1007-9572.2016.27.012
2016-01-03;
2016-06-27)

