帕立骨化醇抑制糖尿病肾病小鼠肾组织炎性反应研究
卢从群,刘章锁,张方兴,郭 佳
·论著·
帕立骨化醇抑制糖尿病肾病小鼠肾组织炎性反应研究
卢从群,刘章锁,张方兴,郭 佳
目的利用2型糖尿病肾病db/db小鼠模型,探讨维生素受体激动剂帕立骨化醇对糖尿病肾病小鼠肾组织炎性反应的抑制作用。方法2015年1—11月,将60只雄性5周龄SPF级C57BLKS/J db/db小鼠采用随机数字表法分为db/db-对照组(N组,n=20)、db/db-二甲基亚砜组(D组,n=20)、db/db-帕立骨化醇组(P组,n=20),同窝出生的db/m小鼠作为正常对照组(C组,n=20)。10周龄时P组小鼠腹腔注射0.3 μg/kg帕立骨化醇,隔日1次,D组小鼠腹腔注射与P组等量的二甲基亚砜+0.9%氯化钠溶液,N组和C组小鼠不做处理。干预12周后测定小鼠体质量、空腹血糖、24 h尿蛋白定量;留取肾组织并进行肾组织病理学检查。应用实时荧光定量PCR、Western blotting和免疫组化检测炎性因子白介素(IL)-6、肿瘤坏死因子α(TNF-α)mRNA及其蛋白的表达水平。结果干预12周后,4组小鼠体质量、空腹血糖水平、24 h尿蛋白定量比较,差异均有统计学意义(P<0.01);其中N组、D组和P组小鼠体质量、空腹血糖水平和24 h尿蛋白定量高于C组,P组小鼠24 h尿蛋白定量低于N组和D组(P<0.05)。病理学检查显示:C组肾小球及肾小管结构完整清晰;N组和D组可见肾小管间质局部炎性细胞浸润,与C组比较,炎性反应明显;P组肾脏病理改变较N组和D组减轻,炎性反应减轻。4组IL-6、TNF-α mRNA及其蛋白表达水平比较,差异均有统计学意义(P<0.01);其中N组、D组、P组IL-6、TNF-α mRNA及其蛋白表达水平均高于C组,P组IL-6、TNF-α mRNA及其蛋白表达水平均低于N组和D组(P<0.05)。免疫组化结果显示,与C组比较,N组和D组肾组织IL-6、TNF-α表达上调;而P组肾组织IL-6、TNF-α表达较N组和D组下调。结论帕立骨化醇可减轻糖尿病肾病小鼠肾组织炎性反应,且该作用可能不依赖于降糖。
糖尿病肾病;帕立骨化醇;白细胞介素6;肿瘤坏死因子α
卢从群,刘章锁,张方兴,等.帕立骨化醇抑制糖尿病肾病小鼠肾组织炎性反应研究[J].中国全科医学,2016,19(27):3275-3280.[www.chinagp.net]
LU C Q,LIU Z S,ZHANG F X,et al.Reaction of paricalcitol inhibition on kidney tissue inflammation in mice with diabetic nephropathy[J].Chinese General Practice,2016,19(27):3275-3280.
糖尿病肾病(diabetic nephropathy)是糖尿病的微血管并发症,也是导致终末期肾病(end-stage renal disease,ESRD)最常见的疾病之一[1]。糖尿病肾病发病机制复杂,目前认为其是一种炎性疾病[2]。研究已证实,白介素(IL)-6、IL-18是参与糖尿病肾病的关键炎性因子[3]。近年研究发现,抗炎治疗可以延缓糖尿病肾病的进展[4]。因此,从“抗炎”的角度研究糖尿病肾病的发病机制并寻找新的治疗靶点已成为热点。
帕立骨化醇是选择性维生素D受体激动剂,开始时主要用于治疗慢性肾脏病(chronic kidney disease)引起的继发性甲状旁腺功能亢进。目前研究显示,帕立骨化醇可以抑制糖尿病肾病患者炎性反应[4]。在链脲佐菌素(STZ)诱导的糖尿病小鼠模型中,帕立骨化醇能抑制肾脏单核细胞趋化因子1(MCP-1)表达、肾小球的硬化及肾小球巨噬细胞的浸润[5]。目前维生素D受体激动剂的抗炎作用逐渐引起人们的重视,但是帕立骨化醇在糖尿病肾病中的抗炎研究不多。本研究以2型糖尿病db/db小鼠为研究对象,探讨帕立骨化醇对糖尿病肾病炎症的抑制作用。
1 材料与方法
1.1实验动物雄性5周龄SPF级C57BLKS/J db/db小鼠和同窝出生的db/m小鼠由南京大学模式动物中心提供,于河南省实验动物中心动物房分笼饲养,4~5只/笼,室温18~24 ℃,实验期间自由进食饮水,喂养普通饲料,不使用胰岛素和其他降糖药物。
1.2主要实验仪器和试剂安稳血糖仪(三诺生物传感股份有限公司),超低温冰箱(日本SANYO公司),液氮容器(北京恒奥生物科技有限公司),电子天平(ARI530型,美国OHAUS公司),干式恒温器(GL.150B型,海门市其林贝尔仪器),公司制冰机(IEC-25型,苏州雪尼),数显恒压恒流电泳仪(EPS.300型)、转移电泳槽(VE.186型)〔天能(Tanon)公司〕,核酸提取仪(西安天隆科技有限公司),帕立骨化醇(货号:P126516-1 mg,CAS号:131918-61-1,上海阿拉丁有限公司),4%多聚甲醛、二甲基亚砜(北京鼎国昌盛有限公司),兔抗鼠单克隆抗体IL-6、肿瘤坏死因子α(TNF-α)(Abcam),实时荧光定量PCR利用cDNA合成试剂盒(FSQ-101,日本东洋纺公司),KAPA SYBR快速定量PCR试剂盒(KR-0389,美国Kapa公司),康为总RNA提取试剂盒(康为公司)。
1.3实验动物分组及标本收集2015年1—11月,小鼠经检疫及适应性饲养1周,将60只db/db小鼠采用随机数字表法分为3组:db/db-对照组(N组,n=20)、db/db-二甲基亚砜组(D组,n=20)、db/db-帕立骨化醇组(P组,n=20),db/m小鼠20只作为正常对照组(C组)。于10周龄时分别进行如下药物干预:P组小鼠腹腔注射帕立骨化醇0.3 μg/kg(1 mg帕立骨化醇溶于5 ml二甲基亚砜中,用0.45 μm滤纸一次性小滤器过滤后装入10 ml无菌管中常温避光保存,每次使用前在无菌操作室取1 μl原液溶于5 ml无菌0.9%氯化钠溶液中,使其终浓度为0.96×10-11nmol/L),隔日1次,D组小鼠腹腔注射与P组等量的二甲基亚砜+0.9%氯化钠溶液,N组和C组小鼠不做处理。干预12周后,腹腔注射5%水合氯醛0.1 ml/10 g麻醉小鼠,分离两侧肾脏,剥离肾包膜并留取肾脏,将肾皮质切成绿豆大小,在2 ml光镜液中固定;剩余肾组织置于液氮中1 h后保存在-80 ℃冰箱备用。
1.4实验方法
1.4.1体质量、空腹血糖检测、24 h尿蛋白定量测量干预12周后,采用电子秤称量小鼠体质量;小鼠禁食8 h后,采用剪尾法,利用安稳血糖仪测量空腹血糖水平;采用代谢笼收集小鼠24 h尿液,利用全自动分析仪测量24 h尿蛋白定量。
1.4.2肾组织病理学检查肾组织石蜡切片(厚4 μm),进行常规HE染色,光镜下观察肾组织形态结构的变化。
1.4.3实时荧光定量PCR采取液氮冻存的肾组织,取100 mg加入Trizol试剂1 ml,参照康为总RNA提取试剂盒说明书提取总RNA。1 μg RNA在10 μl反转录体系(RNA template 1 μg、5×RT Master Mix 2 μl、RNase free ddH2O 7 μl)经37 ℃ 15 min、50 ℃ 5 min、98 ℃ 5 min扩增合成cDNA。将制备好的cDNA进行PCR扩增,扩增体系如下:KAPA SYBR快速定量PCR Master Mix 10 μl,引物(10 nmol/L)2 μl,双蒸水6 μl,稀释后的cDNA(5 mg/L)2 μl。反应体系为20 μl。PCR扩增条件:95 ℃酶激活3 min,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸35 s,共45个循环。引物均购于GeneCopoeia:GAPDH(Mm-QRP-20043),IL-6(Mm-QRP-20563),TNF-α(Mm-QRP-20147)。采用2-ΔΔct法计算IL-6、TNF-α mRNA表达水平。
1.4.4Western blotting采取液氮冻存的肾组织,加适量裂解液后充分研磨,4 ℃裂解组织,以12 000 r/min低温离心2 min,离心半径7 cm,取上清液,BCA法测蛋白浓度;99 ℃加热变性5 min后上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并湿转至聚偏氟乙烯(PVDF)膜;5%脱脂牛奶室温封闭2 h,加入IL-6(1∶1 000)、TNF-α(1∶2 000)一抗,4 ℃孵育过夜;加荧光标记的二抗(1∶5 000)37 ℃孵育1 h后TBST洗膜5 min×3次,采用红外激光成像系统扫描成像,以GAPDH为内参,采用Image J分析条带并计算IL-6、TNF-α mRNA表达水平。
1.4.5免疫组化肾组织石蜡切片(厚4 μm),脱蜡、水化,3% H2O2阻断内源性过氧化物酶,微波修复抗原,山羊血清封闭;分别滴加IL-6(1∶100)、TNF-α(1∶100)一抗,4 ℃孵育过夜;滴加辣根过氧化物酶(HRP)标记的二抗,显微镜下控制DAB显色;苏木素复染,脱水并封固。用磷酸盐缓冲液(PBS) 替代一抗作阴性对照。免疫组化判断标准:IL-6阳性细胞为深褐色颗粒,TNF-α阳性细胞为棕色部分。
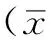
2 结果
2.1各组小鼠体质量、空腹血糖、24 h尿蛋白定量比较干预12周后,C组、N组、D组、P组小鼠体质量、空腹血糖水平、24 h尿蛋白定量比较,差异均有统计学意义(P<0.01);其中N组、D组和P组小鼠体质量、空腹血糖水平和24 h尿蛋白定量高于C组,P组小鼠24 h尿蛋白定量低于N组和D组,差异均有统计学意义(P<0.05,见表1)。
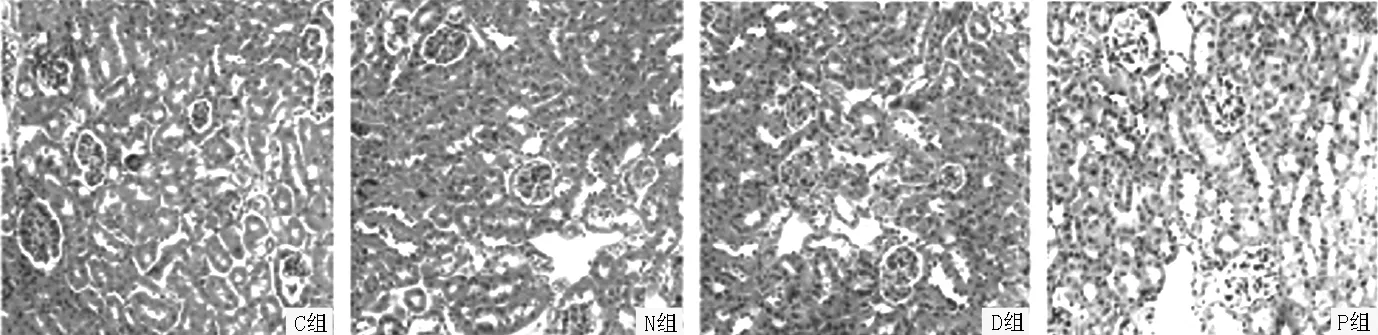
2.2各组小鼠肾组织病理学检查结果C组肾小球及肾小管结构完整清晰,无明显病理改变;N组和D组可见肾小管间质局部炎性细胞浸润,与C组比较,炎性反应明显;P组肾组织病理改变较N组和D组减轻,炎性反应减轻(见图1,本文图1、3彩图详见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.3各组小鼠肾组织IL-6、TNF-α mRNA表达水平比较C组、N组、D组、P组IL-6、TNF-α mRNA表达水平比较,差异均有统计学意义(P<0.01);其中N组、D组、P组IL-6、TNF-α mRNA表达水平均高于C组,P组IL-6、TNF-α mRNA表达水平均低于N组和D组,差异均有统计学意义(P<0.05,见表2)。
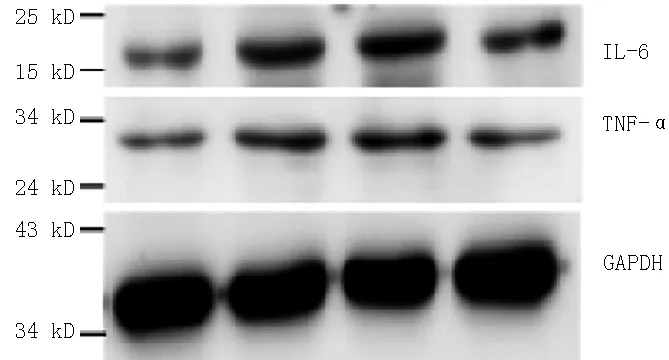
2.4各组小鼠肾组织IL-6、TNF-α表达水平比较C组、N组、D组、P组IL-6、TNF-α表达水平比较,差异均有统计学意义(P<0.01);其中N组、D组、P组IL-6、TNF-α表达水平均高于C组,P组IL-6、TNF-α表达水平均低于N组和D组,差异有统计学意义(P<0.05,见表3、图2)。
2.5各组小鼠肾组织免疫组化结果免疫组化结果显示,与C组比较,N组和D组肾组织褐色颗粒和棕色部分增多,说明IL-6、TNF-α表达上调;而P组较N组和D组褐色颗粒和棕色部分减少,说明IL-6、TNF-α表达下调(见图3)。
Table 1Comparison of BMI,the fasting blood-glucose,24 hour urine protein quantitation of mice in each group after 12-week intervention
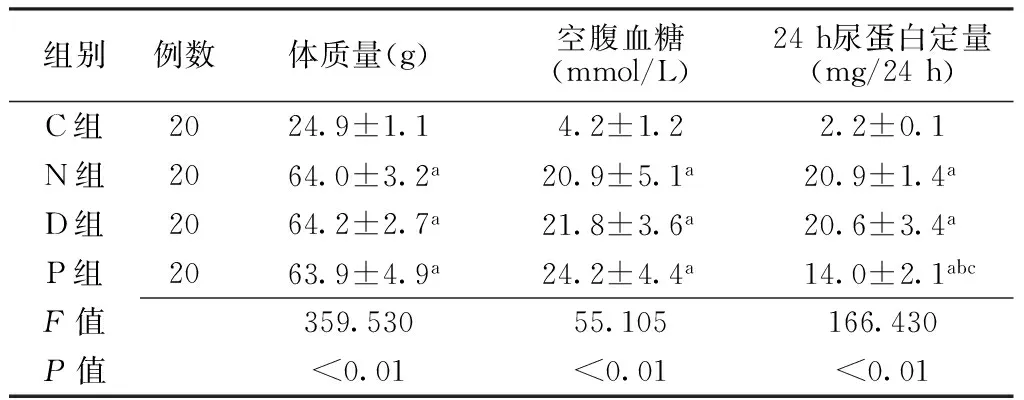
组别例数体质量(g)空腹血糖(mmol/L)24h尿蛋白定量(mg/24h)C组2024.9±1.14.2±1.22.2±0.1N组2064.0±3.2a20.9±5.1a20.9±1.4aD组2064.2±2.7a21.8±3.6a20.6±3.4aP组2063.9±4.9a24.2±4.4a14.0±2.1abcF值359.53055.105166.430P值<0.01<0.01<0.01
注:C组=正常对照组,N组=db/db-对照组,D组= db/db-二甲基亚砜组,P组= db/db-帕立骨化醇组;与C组比较,aP<0.05;与N组比较,bP<0.05;与D组比较,cP<0.05
注:C组=正常对照组,N组= db/db-对照组,D组= db/db-二甲基亚砜组,P组= db/db-帕立骨化醇组
图1各组小鼠肾组织病理学检查(HE染色,×200)
Figure 1Histopathological examination of renal tissue in each group
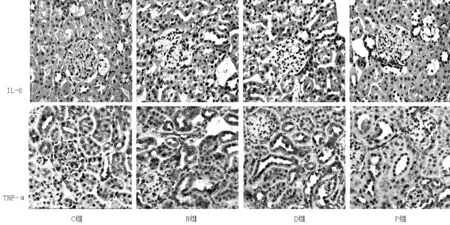
图3 各组小鼠肾组织IL-6和TNF-α免疫组化结果(苏木素染色,×200)
注:IL-6=白介素6,TNF-α=肿瘤坏死因子α
图2各组小鼠肾组织IL-6、TNF-α表达情况
Figure 2Expression of IL-6 and TNF-α of renal tissue in each group
Table 2Comparison of expression level of IL-6 and TNF-α mRNA of renal tissue in each group
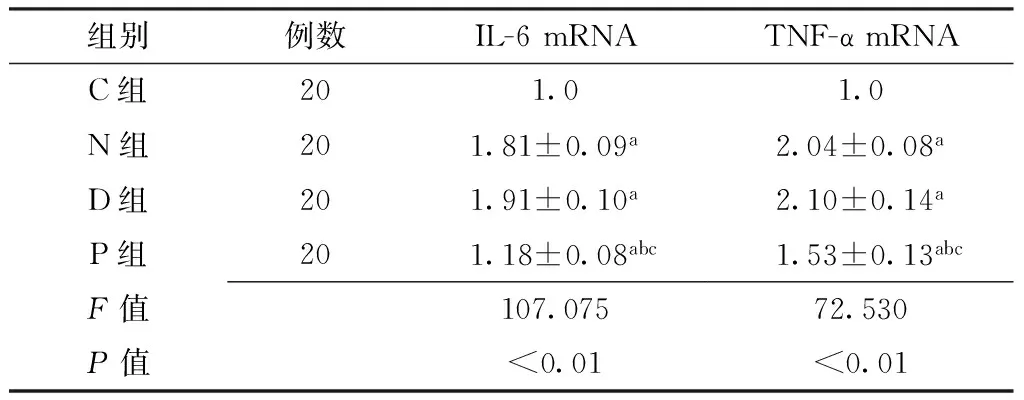
组别例数IL-6mRNATNF-αmRNAC组201.01.0N组201.81±0.09a2.04±0.08aD组201.91±0.10a2.10±0.14aP组201.18±0.08abc1.53±0.13abcF值107.07572.530P值<0.01<0.01
注:IL-6=白介素6,TNF-α=肿瘤坏死因子α;与C组比较,aP<0.05;与N组比较,bP<0.05;与D组比较,cP<0.05
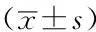
Table 3Comparison of expression of IL-6 and TNF-α of renal tissue in each group
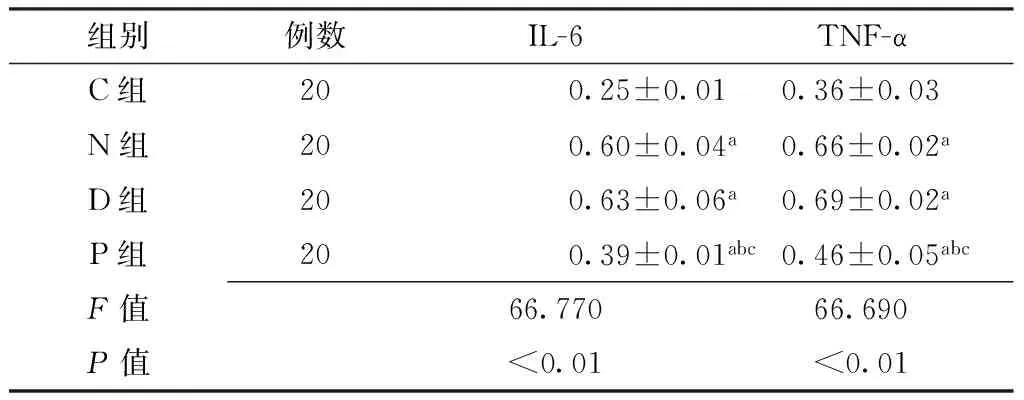
组别例数IL-6TNF-αC组200.25±0.010.36±0.03N组200.60±0.04a0.66±0.02aD组200.63±0.06a0.69±0.02aP组200.39±0.01abc0.46±0.05abcF值66.77066.690P值<0.01<0.01
注:与C组比较,aP<0.05;与N组比较,bP<0.05;与D组比较,cP<0.05
3 讨论
糖尿病肾病是糖尿病引起的较常见的微血管并发症,已成为导致ESRD的主要病因[6]。近年来研究认为,糖尿病肾病是一种代谢因素引发的慢性炎性反应疾病[7]。研究发现,在糖尿病动物模型及患者的肾脏中均有单核/巨噬细胞浸润、T淋巴细胞激活及前炎性因子过表达,而且循环中炎性标志物及前炎性因子水平与肾损害密切相关[8]。糖尿病肾病的肾细胞,包括内皮细胞、系膜细胞、肾小球和肾小管上皮细胞均可合成炎性因子,进行性加重肾损害。
db/db小鼠是早期糖尿病肾病模型,由于db基因编码的来普汀受体G到T位点突变导致缺损性受体的形成,这种缺失导致小鼠出现多食、肥胖、高胰岛素血症、胰岛素耐受等症状,并逐渐发展为肾病,适用于长期研究[9]。本研究结果显示,db/db小鼠体质量、空腹血糖水平、24 h尿蛋白定量较db/m小鼠明显升高,说明db/db小鼠造模成功。
IL-6、TNF-α是体内多种细胞产生的一种具有广泛生物活性的炎性因子,参与机体的各种病理生理过程。多种因素能够诱导肾脏固有细胞如肾小球细胞、内皮细胞、小管细胞及系膜细胞合成、分泌一系列炎性因子,如IL-6、IL-18和肿瘤坏死因子等[10]。已有研究证实,IL-6、TNF-α是参与炎性反应的主要因子,也是参与糖尿病肾病的关键炎性因子[10]。糖尿病肾病的肾小球系膜、肾间质、肾小管及浸润的炎性细胞均高表达IL-6[11]。TNF-α可通过对肾细胞的直接损伤,活化细胞凋亡和坏死途径,改变肾小球的血流动力学及减少肾小球滤过率(GFR)等介导糖尿病肾病的发生。动物实验发现,糖尿病大鼠肾小球和近端小管上皮细胞中TNF-α mRNA及其蛋白表达水平增加[12]。本研究结果显示,N组、D组小鼠肾组织IL-6、TNF-α mRNA及其蛋白表达水平均较C组升高;HE染色显示,N组和D组小鼠肾组织见肾小管间质局部炎性细胞浸润,与C组比较,炎性反应明显;免疫组化结果也提示N组和D组小鼠肾组织IL-6、TNF-α表达上调,表明在糖尿病肾病中有炎性因子参与,与上述研究结果保持一致。
目前关于帕立骨化醇抑制炎性反应机制并不十分清楚。已有研究报道,维生素D受体激动剂对ESRD患者外周循环的单核细胞有生物学作用并可能改变炎性细胞表型[13]。GUO[14]发现活性维生素D可通过抑制TNF-α的表达、减轻炎性浸润、减少蛋白尿,进而缓解肾损伤。本研究结果显示,帕立骨化醇治疗后,P组小鼠24 h尿蛋白定量减少,炎性因子IL-6、TNF-α mRNA及其蛋白表达水平较N组、D组降低,HE染色可见P组肾组织炎性浸润减轻;免疫组化亦显示P组IL-6、TNF-α表达下调。说明帕立骨化醇可以通过抑制糖尿病肾病的炎性反应,减少蛋白尿。此外,ZOU等[15]发现帕立骨化醇可降低糖尿病肾病小鼠肾组织促炎因子核因子(NF)-κB、MCP-1的活性,对炎性反应有抑制作用,且对血糖无明显影响。因此,推测帕立骨化醇对肾组织炎症状态的抑制作用与血糖水平无关,具体机制有待研究。
综上所述,帕立骨化醇可以通过抑制糖尿病肾病肾组织炎症状态,减少蛋白尿,进而保护肾脏,该作用可能不依赖于降糖。目前关于帕立骨化醇抑制炎性反应的机制有待进一步研究。
作者贡献:卢从群进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;张方兴、郭佳进行实验评估、资料收集;刘章锁进行质量控制及审校。
本文无利益冲突。
[1]REUTENS A T,ATKINS R C.Epidemiology of diabetic nephropathy[J].Contrib Nephrol,2011,170(170):1-7.DOI:10.1159/000324934.
[3]EL MESALLAMY H O,AHMED H H,BASSYOUNI A A,et al.Clinical significance of inflammatory and fibrogenic cytokines in diabetic nephropathy[J].Clinical Biochemistry,2012,45(45):646-650.DOI:10.1016/j.clinbiochem.2012.02.021.
[4]OGAWA S,KOBORI H,OHASHI N,et al.Angiotensin Ⅱ type 1 receptor blockers reduce urinary angiotensinogen excretion and the levels of urinary markers of oxidative stress and inflammation in patients with type 2 diabetic nephropathy[J].Biomark Insights,2009,4:97-102.
[5]AGARWAL R,ACHARYA M,TIAN J,et al.Antiproteinuric effect of oral paricalcitol in chronic kidney disease[J].Kidney Int,2005,68(6):2823-2828.DOI:10.1111/j.1523-1755.2005.00755.x.
[6]MEHDI U F,ADAMS-HUET B,RASKIN P,et al.Addition of angiotensin receptor blockade or mineralocorticoid antagonism to maximal angiotensin-converting enzyme inhibition in diabetic nephropathy[J].J Am Soc Nephrol,2009,20(12):2641-2650.DOI:10.1681/ASN.2009070737.
[7]LIM A K,TESCH G H.Inflammation in diabetic nephropathy[J].Mediators Inflamm,2012,2012:146-154.DOI:10.1155/2012/146154.
[8]KING G L.The role of inflammatory cytokines in diabetes and its complications[J].J Periodontol,2008,79(8 Suppl):1527-1534.DOI:10.1902/jop.2008.080246.
[9]CHUA S J,LIU S M,LI Q.Differential beta cell responses to hyperglycaemia and insulin resistance in two novel congenic strains of diabetes(FVB-Leprdb)and obese(DBA-Lepob)mice[J].Diabetologia,2002,45(7):976-990.DOI:10.1007/s00125-002-0880-z.
[11]SUZUKI D,MIYAZAKI M,NAKA R.In situ hybridization of interleukin 6 in diabetic nephropathy[J].Diabetes,1995,44(10):1233-1238.DOI:10.2337/diab.44.10.1233.
[12]KOIKE N,TAKAMURA T,KANEKO S.Induction of reactive oxygen species from isolated rat glomeruli by protein kinase C activation and TNF-α stimulation,and effects of a phosphodiesterase inhibitor[J].Life Sci,2007,80(18):1721-1728.DOI:10.1016/j.lfs.2007.02.001.
[13]STUBBS J R,IDICULLA A,SLUSSER J,et al.Cholecalciferol supplementation alters calcitriol-responsive monocyte proteins and decreases inflammatory cytokines in ESRD[J].J Am Soc Nephrol,2009,21(2):353-361.DOI:10.1681/ASN.2009040451.
[14]GUO Y F.Active vitamin D prevents podocyte injury via regulation of macrophage M1 and M2 phenotype in diabetic nephropathy rats[J].China Medical Abstracts:Internal Medicine,2014(3):183.DOI:10.3760/cma.J.issn.1001-7097.2014.06.006.
[15]ZOU M S,YU J,NIE G M,et al.Renoprotective mechanism of paricalcitol in diabetic rats[J].Pharm J Chin PLA,2011,27(6):475-479.DOI:10.3969/j.issn.1008-9926.2011.06.02.
(本文编辑:贾萌萌)
Reaction of Paricalcitol Inhibition on Kidney Tissue Inflammation in Mice with Diabetic Nephropathy
LUCong-qun,LIUZhang-suo,ZHANGFang-xing,GUOJia.
DepartmentofNephrology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,ChinaCorrespondingauthor:LIUZhang-suo,DepartmentofNephrology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China;E-mail:zhangsuoliu@sina.com
ObjectiveTo investigate the inhibiting effects of vitamin receptor agonist-parlicalcitol on the inflammatory reaction of kidney tissue in diabetic nephropathy mice by exploiting the db/db mouse model of type 2 diabetic nephropathy.MethodsFrom January to November in 2015,under the method of random number table,we divided the 60 male five-week C57BLKS/J db/db mice of SPF level into three groups:db/db-control group(N group,n=20),db/db-dimethyl sulfoxide group(D group,n=20),and db/db-paricalcitol group(P group,n=20),and we enrolled db/m mice of littermate as the normal control group(C group,n=20).At the age of 10 weeks,mice in P group were given intraperitoneal injection of paricalcitol at a dose of 0.3 μg/kg qod,the same amount of dimethyl sulfoxide as P group plus 0.9% sodium chloride solution were injected into D group,N and C group were not intervened.After 12-week intervention,we measured the body mass index,the fasting blood-glucose,24-hour urine protein quantitation;we retained the kidney tissue to make a renal histopathological examination.The expression of real-time fluorescent quantitative PCR,Western blotting,and immunohistochemical detection of inflammatory factor interleukin(IL)-6,and tumor necrosis factor-α(TNF-α)mRNA and the protein expression levels were applied.ResultsAfter 12-week medical intervention,the comparison of body mass,fasting blood-glucose,and the 24-hour urine protein quantitation in the four groups showed significant differences(P<0.01);the body mass,fasting blood-glucose,the 24-hour urine protein quantitation of N group,D group and P group were higher than those of C group,the 24-hour urine protein quantitation of P group was lower than that of N group and D group(P<0.05).Pathological examination showed that the structure of the glomerulus and the renal tubular of C group was complete and clear;while there was partially inflammatory cell infiltration in renal tubulointerstitial in subjects of N group and D group,the inflammatory reaction was evident compared with C group;compared with N group and D group,the renal pathologic changes of P group reduced,and the inflammatory reaction alleviated.The IL-6,TNF-α mRNA and the protein expression level of the four groups were significantly different(P<0.01);the expression levels of IL-6,TNF-α mRNA and protein of N group,D group and P group were all higher than those of C group,and the expression levels of IL-6,TNF-α mRNA and protein of P group were lower than those of N group and D group(P<0.05).Immunohistochemical results showed that compared with C group,the renal tissue expression of IL-6,TNF-α of N group and D group increased,and those of P group decreased compared with N group and D group.ConclusionParicalcitol can alleviate the inflammatory reaction in diabetic nephropathy mice kidney tissue,and the effect may not rely on reducing blood glucose.
Diabetic nephropathies;Paricalcitol;Interleukin-6;Tumor necrosis factor-alpha
国家自然科学基金资助项目(81400726)
450052 河南省郑州市,郑州大学第一附属医院肾内科,河南省高校临床医学重点学科开放实验室
刘章锁,450052 河南省郑州市,郑州大学第一附属医院肾内科,河南省高校临床医学重点学科开放实验室;E-mail:zhangsuoliu@sina.com
R 587.24
A
10.3969/j.issn.1007-9572.2016.27.004
2015-12-26;
2016-05-16)

