白介素10、E26转录因子1和肿瘤相关巨噬细胞在宫颈癌中的表达研究
张 琪,马 冬,常凌雅,张丽杰,闫錫钊,王 洋,陈丽蓉,李 鸥
·论著·
·专题研究·
白介素10、E26转录因子1和肿瘤相关巨噬细胞在宫颈癌中的表达研究
张 琪,马 冬,常凌雅,张丽杰,闫錫钊,王 洋,陈丽蓉,李 鸥
背景宫颈癌是女性高发的恶性肿瘤之一。白介素10(IL-10)作为一种具有免疫抑制作用的细胞因子对宫颈癌变的发生、发展具有重要作用。肿瘤相关巨噬细胞(TAM)、E26转录因子1(Ets1)均可促进肿瘤的生长、侵袭和迁移。目的探讨宫颈癌组织中IL-10、Ets1和TAM的表达情况及其与宫颈癌的关系。方法选取2014年9月—2016年3月唐山工人医院住院部收治的宫颈上皮内瘤变(CIN)患者72例为CIN组,宫颈鳞癌患者76例为鳞状细胞癌(SCC)组,行全子宫切除术的子宫良性病变患者40例为正常组。采用简单随机抽样法选取3例SCC组宫颈组织及3例正常组宫颈组织进行基因芯片杂交测序;采用RT-qPCR法检测所有患者宫颈组织中IL-10、Ets1 mRNA表达水平,免疫双荧光共定位法检测宫颈组织中TAM情况及表达IL-10、Ets1的TAM(IL-10+TAM、Ets1+TAM)水平,分析IL-10+TAM、Ets1+TAM水平与SCC组患者临床资料的关系。结果与正常组宫颈组织比较,IL-10在SCC组宫颈组织中表达上调3.4倍,Ets1表达上调2.9倍(P<0.05)。CIN组、SCC组IL-10、Ets1 mRNA表达水平高于正常组(P<0.05);SCC组IL-10、Ets1 mRNA表达水平高于CIN组(P<0.05)。CIN组、SCC组IL-10 mRNA表达水平与Ets1 mRNA表达水平均呈正相关(r=0.453,P<0.01;r=0.456,P<0.01)。正常组、CIN组、SCC组宫颈组织中TAM逐渐增多。CIN组、SCC组IL-10+TAM、Ets1+TAM水平高于正常组(P<0.05);SCC组IL-10+TAM、Ets1+TAM水平高于CIN组(P<0.05)。SCC组患者IL-10+TAM、Ets1+TAM水平与年龄、肿瘤大小无关(P>0.05);SCC组患者IL-10+TAM、Ets1+TAM水平与分化程度、临床分期、淋巴结转移有关(P<0.05)。结论IL-10、Ets1和TAM表达水平随宫颈病变进展而升高,TAM及其分泌的IL-10、Ets1可能与宫颈癌及临床预后有关。
宫颈肿瘤;白细胞介素10;E26转录因子1;巨噬细胞
张琪,马冬,常凌雅,等.白介素10、E26转录因子1和肿瘤相关巨噬细胞在宫颈癌中的表达研究[J].中国全科医学,2016,19(27):3306-3310.[www.chinagp.net]
ZHANG Q,MA D,CHANG L Y,et al.Expression of interleukin-10,E26transformation factor-1 and tumor-associated macrophages in cervical cancer[J].Chinese General Practice,2016,19(27):3306-3310.
【Abstract】BackgroundCervical cancer is one of the women malignant tumors with high incidence.Interleukin 10 (IL-10),as a kind of cytokine with immunosuppressive effects,plays an important role in the occurrence and development of cervical cancer.Both tumor-associated macrophages (TAM) and E26transcription factor 1 (Ets1) can promote tumor growth,invasion and migration.ObjectiveTo investigate the expression of IL-10,Ets1 and TAM in cervical carcinoma tissues and their correlation with cervical cancer.Methods72 cervical intraepithelial neoplasia (CIN) patients,76 cervical squamous cell carcinoma (SCC) patients and 40 benign uterine lesion patients underwent total hysterectomy,who were under treatment in Inpatient Department of Tangshan Gongren Hospital from September 2014 to March 2016,were selected into CIN group,SCC group and normal group separately.3 subjects with cervical tissues in SCC group and 3 with cervical tissues in normal group were selected to make microarray hybridization sequencing by simple random sampling method;the expression levels of IL-10 and Ets1 mRNA in cervical tissues were detected by RT-qPCR method in all patients,the status and expression of TAM and TAM that IL-10 and Ets1 levels expressed by TAM (IL-10+TAM,Ets1+TAM) were detected by double immunofluorescence colocalization method,and the relationship between levels of IL-10+TAM,Ets1+TAM and clinical data was analyzed.ResultsComparing with cervical tissues of normal group,the expression of IL-10 in cervical tissues of SCC group upregulated 3.4 times,and Ets1 upregulated 2.9 times (P<0.05).Expression levels of IL-10 and Ets1 mRNA in CIN group and SCC group were higher than those in normal group (P<0.05);expression levels of IL-10 and Ets1 mRNA in SCC group were higher than those in CIN group (P<0.05).The expression level of IL-10 mRNA in CIN group and SCC group was positively correlated with the expression level of Ets1 mRNA (r=0.453,P<0.01;r=0.456,P<0.01).TAM increased gradually in cervical tissues in normal group,CIN group and SCC group.The levels of IL-10+TAM and Ets1+TAM in CIN group and SCC group were higher than those in normal group (P<0.05);the levels of IL-10+TAM and Ets1+TAM in SCC group were higher than those in CIN group (P<0.05).The levels of IL-10+TAM and Ets1+TAM in patients of SCC group were not related to age and tumor size (P>0.05);the levels of IL-10+TAM and Ets1+TAM in patients of SCC group were related to differentiated degree,clinical stage of cervical cancer and lymph node metastasis (P<0.05).ConclusionThe expression level of IL-10,Ets1 and TAM increases with the progression of cervical lesions,TAM and its secreted IL-10 and Ets1 may be related to cervical cancer and clinical prognosis.
近年来宫颈癌的发病呈现低龄化趋势[1]。白介素10(IL-10)作为一种与宫颈癌的发生、发展密切相关的免疫抑制因子,其表达调控主要发生在转录期间。因此,研究参与IL-10转录调控的转录因子进而对转录因子干预进行抗炎治疗[2]。E26转录因子1(Ets1)是一种癌基因,其参与细胞生长和细胞外基质侵袭,在肿瘤细胞的增殖、迁移、侵袭中起重要作用[3]。研究报道,在宫颈癌、卵巢癌、乳腺癌、胃癌、肺癌等多种恶性肿瘤中,Ets1通过高表达在肿瘤浸润、转移中发挥重要作用[4]。另外,在肿瘤微环境中,肿瘤相关巨噬细胞(TAM)很少发挥抗原提呈和吞噬作用,而是通过自分泌、旁分泌多种细胞因子,诱导肿瘤周围微血管和淋巴管的生成,进而促进肿瘤细胞附着于血管表面,催化肿瘤外基质的降解和重建,对肿瘤的生长、侵袭和迁移发挥重要作用[5]。尽管已有研究报道,鳞状细胞癌(SCC)组织中TAM高表达高迁移率族蛋白1(HMGB1)促进淋巴管的生成[6],但是TAM相关免疫调节基因的表达是否促进宫颈肿瘤细胞的免疫逃逸和侵袭的研究尚未见报道。因此,本研究通过基因芯片杂交测序及RT-qPCR法检测免疫调节相关基因IL-10和Ets1在宫颈组织中的表达水平,通过免疫双荧光共定位法检测宫颈组织中TAM情况及表达IL-10、Ets1的TAM(IL-10+TAM、Ets1+TAM)水平,并分析宫颈癌患者IL-10+TAM、Ets1+TAM水平与临床资料的关系,旨在为宫颈癌的预防、诊断和治疗提供分子靶点和实验依据。
1 对象与方法
1.1研究对象选取2014年9月—2016年3月唐山工人医院住院部收治的宫颈上皮内瘤变(CIN)患者72例为CIN组,宫颈鳞癌患者76例为SCC组,行全子宫切除术的子宫良性病变患者40例为正常组。CIN组及SCC组纳入标准:(1)临床资料完整;(2)病理明确诊断为CIN、SCC;(3)术前未接受过放、化疗。排除标准:(1)术前3个月内曾行宫颈治疗,如阴道用药、激光治疗等;(2)患者为妊娠状态;(3)同时合并其他妇科恶性肿瘤,如子宫内膜癌、卵巢癌等;(4)同时合并其他脏器肿瘤,如肠道、乳腺肿瘤等。正常组纳入标准:宫颈薄层液基细胞学检查未见非典型鳞状细胞或癌细胞。排除标准与CIN组及SCC组相同。所取标本均经本院病理科主任医师证实,且取材前均未行放、化疗或免疫治疗。标本收集后于-80 ℃冰箱保存。所有患者知情同意,本研究经唐山工人医院伦理委员会批准。按宫颈癌国际妇产科联盟(FIGO)(2000年)临床分期标准分期,病理类型及分级按WHO标准[7]。
1.2研究方法
1.2.1基因芯片杂交测序采用简单随机抽样法选取3例SCC组宫颈组织及3例正常组宫颈组织,采用Trizol试剂提取组织总RNA(总含量>100 ng),送康成生物公司进行mRNA芯片筛查。
1.2.2RT-qPCR法检测宫颈组织中IL-10、Ets1 mRNA表达水平将液氮保存的宫颈组织按Trizol试剂盒说明书提取组织总RNA,以RNA为模板,采用反转录试剂盒(美国Invitrogen公司)合成cDNA,然后以cDNA为模板进行qPCR反应,采用甘油醛-3-磷酸脱氢酶(GAPDH)作为内参。IL-10上游引物序列为5′-ACAAAGGAAGGAGGGGTTCAC-3′,下游引物序列为5′-AGAAGTGGACTCAGCATGGG-3′;Ets1上游引物序列为5′-GATCTGCTCTCCGGCAAAGT-3′,下游引物序列为5′-GTGTTGCTAGGTCCTTGCCT-3′;GAPDH上游引物序列为5′-GAAAGCCTGCCGGTGACTAA-3′,下游引物序列为5′-AGGAAAAGCATCACCCGGAG-3′。扩增反应条件:95 ℃ 2 min,95 ℃ 15 s,72 ℃ 35 s,共40个循环。采用2-△△Ct法计算目的基因mRNA表达水平,每组实验重复3次。
1.2.3免疫双荧光共定位法检测宫颈组织中TAM情况及IL-10+TAM、Ets1+TAM水平组织切片二甲苯脱蜡至水后进行高压抗原修复,10%山羊血清室温下封闭1 h,随后共孵育鼠抗人多克隆抗体CD68(1∶50稀释)和兔抗人单克隆抗体IL-10(1∶50稀释)及鼠抗人多克隆抗体CD68(1∶50稀释)和兔抗人多克隆抗体Ets1(1∶50稀释),4 ℃孵育过夜,Fluorescein标记的抗鼠二抗(anti-CD68,1∶100稀释,绿色)和Rhodamine标记的抗兔二抗(anti-IL-10、anti-Ets1,1∶100稀释,红色),室温孵育45 min,二脒基苯基吲哚(DAPI)染核呈蓝色。anti-CD68确定TAM(绿色),同时anti-IL-10及anti-Ets1共染色确定IL-10、Ets1表达情况(黄色)。荧光显微镜下观察宫颈组织中TAM情况及IL-10+TAM、Ets1+TAM荧光强度,采用Image Pro-Plus 6.0定量分析IL-10+TAM、Ets1+TAM水平。
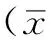
2 结果
2.1基因芯片杂交测序结果与正常组宫颈组织比较,免疫调节相关基因(Tnf、IL-10、Prox1、Rad23a、Tarbp2、Hpn、Ccl4、Stat3、Ccl20、Il2rg、Ets1)在SCC组宫颈组织中表达上调,其中IL-10表达上调3.4倍,Ets1表达上调2.9倍(P<0.05,见图1、表1,本文图1、2彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.2IL-10、Ets1 mRNA表达水平比较正常组、CIN组、SCC组IL-10、Ets1 mRNA表达水平比较,差异有统计学意义(P<0.01);其中CIN组、SCC组IL-10、Ets1 mRNA表达水平高于正常组,差异有统计学意义(P<0.05);SCC组IL-10、Ets1 mRNA表达水平高于CIN组,差异有统计学意义(P<0.05,见表2)。
2.3相关性分析CIN组、SCC组IL-10 mRNA表达水平与Ets1 mRNA表达水平均呈正相关(r=0.453,P<0.01;r=0.456,P<0.01)。
注:IL-10=白介素10,,Ets1=E26转录因子1
图1正常组宫颈组织与SCC组宫颈组织基因芯片杂交测序结果
Figure 1Results of gene chip hybridization sequencing of cervical tissues between normal group and SCC group
表1正常组宫颈组织与SCC组宫颈组织基因表达差异分析
Table 1Differential analysis of gene expression of cervical tissues between normal group and SCC group
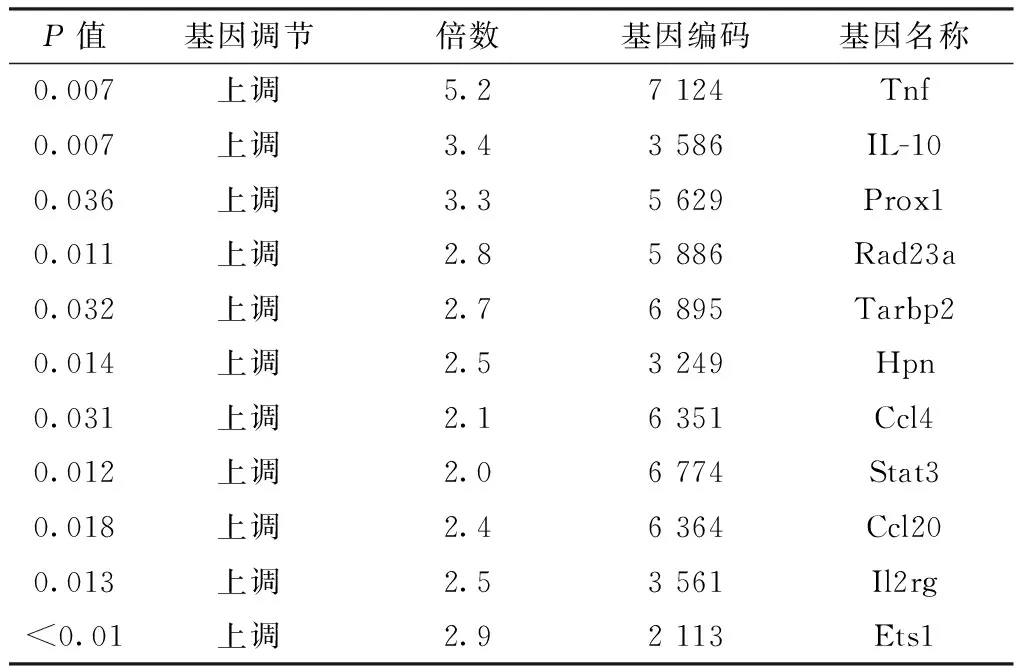
P值基因调节倍数基因编码基因名称0.007上调5.27124Tnf0.007上调3.43586IL-100.036上调3.35629Prox10.011上调2.85886Rad23a0.032上调2.76895Tarbp20.014上调2.53249Hpn0.031上调2.16351Ccl40.012上调2.06774Stat30.018上调2.46364Ccl200.013上调2.53561Il2rg<0.01上调2.92113Ets1
Table 2Comparison of expression level of IL-10 and Ets1 mRNA in normal group,CIN group and SCC group
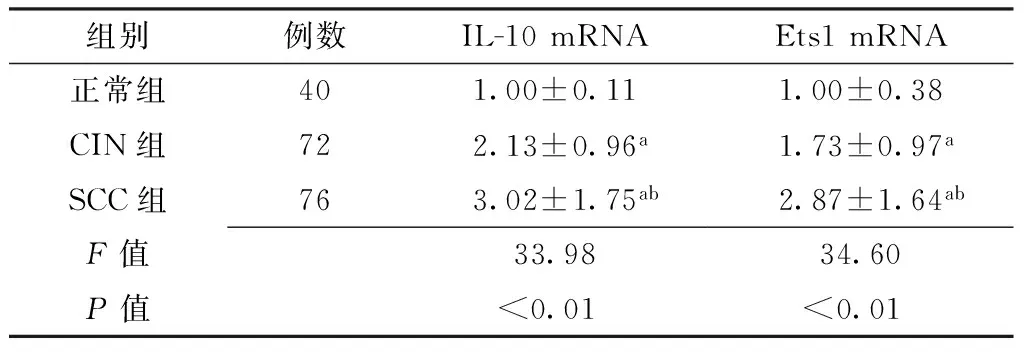
组别例数IL-10mRNAEts1mRNA正常组401.00±0.111.00±0.38CIN组722.13±0.96a1.73±0.97aSCC组763.02±1.75ab2.87±1.64abF值33.9834.60P值<0.01<0.01
注:CIN=宫颈上皮内瘤变组,SCC=鳞状细胞癌,IL-10=白介素10,Ets1=E26转录因子1;与正常组比较,aP<0.05;与CIN组比较,bP<0.05
2.4宫颈组织中TAM情况及IL-10+TAM、Ets1+TAM水平比较正常组、CIN组、SCC组宫颈组织中TAM逐渐增多(见图2)。正常组、CIN组、SCC组IL-10+TAM、Ets1+TAM水平比较,差异有统计学意义(P<0.01);其中CIN组、SCC组IL-10+TAM、Ets1+TAM水平高于正常组,差异有统计学意义(P<0.05);SCC组IL-10+TAM、Ets1+TAM水平高于CIN组,差异有统计学意义(P<0.05,见表3)。
2.5SCC组患者IL-10+TAM、Ets1+TAM水平与临床资料的关系SCC组患者IL-10+TAM、Ets1+TAM水平与年龄、肿瘤大小无关(P>0.05);SCC组患者IL-10+TAM、Ets1+TAM水平与分化程度、临床分期、淋巴结转移有关(P<0.05,见表4)。
3 讨论
宫颈癌具有较强的转移能力,给临床治疗和患者预后带来巨大挑战。已有研究显示,肿瘤细胞转移与TAM分泌炎性细胞因子有关[8]。肿瘤微环境一直处于复杂的慢性炎症状态,其周围充满丰富的炎性递质和炎性细胞。TAM作为一种关键的炎性细胞在肿瘤相关炎症中扮演极其重要的角色,其分泌多种细胞因子帮助肿瘤细胞生长,促进新生血管生成,同时还能抑制机体的获得性免疫,从而为肿瘤细胞的浸润和转移创造条件[9-10]。IL-10处于免疫调节的中心环节,通过多种途径抑制机体免疫系统对肿瘤的杀伤作用,进而促进肿瘤发生、发展及转移[11]。IL-10基因的表达主要是通过启动子区一系列转录因子的结合进行调控,这些转录因子包括Ets1、猴病毒40(SV40)基因启动子区(SP1)、CCA AT/增强子结合蛋白β和信号传导与转录激活因子3(STAT3)[12]。Ets1在肿瘤的浸润、转移中,参与降解途径基因的调节,同时也可调节更为广泛的细胞外基质(ECM)的相关靶基因,包括基质蛋白以及其他参与细胞-基质反应的细胞成分[13]。由此看出,TAM、IL-10、Ets1在细胞的增殖、变异、凋亡和淋巴细胞的发展、转化、侵袭中均起作用,而三者间的相互关系及其与临床预后的关系尚未见报道。
Table 3Comparison of IL-10+TAM,Ets1+TAM levels in normal group,CIN group,and SCC group
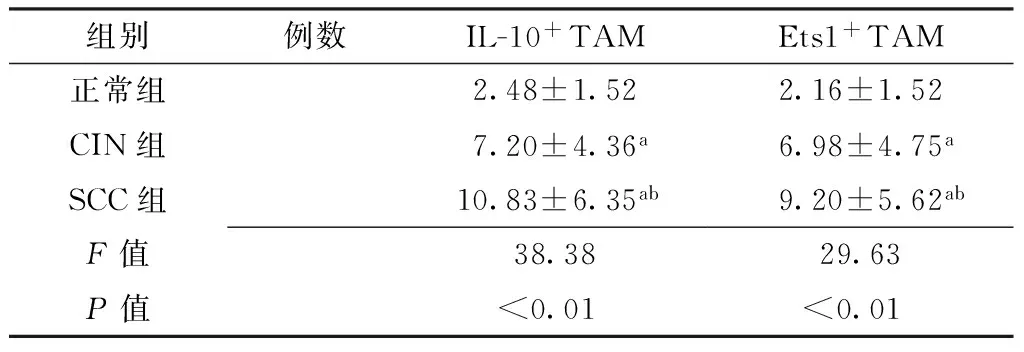
组别例数IL-10+TAMEts1+TAM正常组2.48±1.522.16±1.52CIN组7.20±4.36a6.98±4.75aSCC组10.83±6.35ab9.20±5.62abF值38.3829.63P值<0.01<0.01
注:与正常组比较,aP<0.05;与CIN组比较,bP<0.05
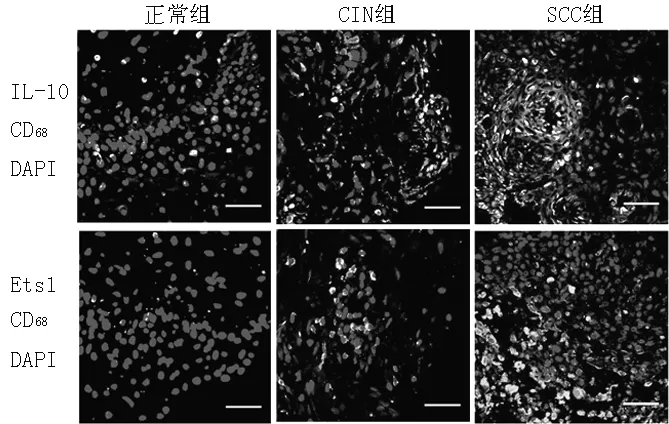
注:CIN=宫颈上皮内瘤变,SCC=鳞状细胞癌,DAPI=二脒基苯基吲哚;DAPI染核呈蓝色,IL-10、Ets1阳性表达呈红色,CD68阳性表达呈绿色,IL-10+TAM、Ets1+TAM呈黄色
图2宫颈组织中TAM情况及IL-10+TAM、Ets1+TAM荧光强度(免疫双荧光染色,×200)
Figure 2TAM in cervical tissues and fluorescence intensity of IL-10+TAM,Ets1+TAM
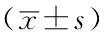
表4 SCC组患者IL-10+ TAM、Ets1+ TAM水平与临床资料的关系
本研究结果显示,与正常组宫颈组织比较,IL-10在SCC组宫颈组织中表达上调3.4倍,Ets1表达上调2.9倍;CIN组、SCC组IL-10、Ets1 mRNA表达水平高于正常组,SCC组IL-10、Ets1 mRNA表达水平高于CIN组。提示IL-10、Ets1的表达水平随着宫颈病变进展而升高,说明IL-10、Ets1与宫颈病变的进展有关。CIN组、SCC组IL-10 mRNA表达水平与Ets1 mRNA表达水平均呈正相关,提示IL-10、Ets1在宫颈恶性病变进展中有协同作用。正常组、CIN组、SCC组宫颈组织中TAM逐渐增多,CIN组、SCC组IL-10+TAM、Ets1+TAM水平高于正常组,SCC组IL-10+TAM、Ets1+TAM水平高于CIN组,提示TAM与宫颈病变进展有关。SCC组患者IL-10+TAM、Ets1+TAM水平与分化程度、临床分期、淋巴结转移有关,提示TAM及其分泌的IL-10、Ets1对宫颈癌的临床预后有影响,可以为宫颈癌的预防、诊断和治疗提供分子靶点和实验依据。研究显示,IL-10是肿瘤的危险指标和预后的影响因子[14];在不同病理宫颈组织中,Ets1转录和翻译水平与肿瘤恶性程度和生物学行为如淋巴结转移和远处转移密切相关[15],本研究结果与之相似。
本研究仅局限在临床组织水平,未深入探讨分子机制,这是本研究的一个限制。因此本课题组后续将进一步从细胞水平研究转录因子Ets1是否调控IL-10及其促进宫颈病变的分子机制。另外,本研究只证实了TAM是IL-10表达升高促使肿瘤细胞免疫抑制的来源之一,而其他免疫细胞如自然杀伤细胞、树突状细胞也可能是其来源,这有待进一步证实。
综上所述,IL-10、Ets1和TAM表达水平随宫颈病变进展而升高,TAM及其分泌的IL-10、Ets1可能与宫颈病变及临床预后有关。本研究结果为课题组进一步研究免疫细胞中Ets1调控表达IL-10的分子机制及以TAM作为治疗靶点的研究提供线索。
作者贡献:张琪进行试验实施、样本收集、资料整理、撰写论文;常凌雅、张丽杰、闫錫钊、王洋、陈丽蓉进行资料收集、数据处理;马冬、李鸥进行试验设计、质量控制及审校。
本文无利益冲突。
[1]杨艳艳,马冬,刘桂艳,等.细胞因子DNA甲基化导致免疫失衡与宫颈癌关系的研究进展[J].中国妇幼保健,2014,29(5):812-814.
[2]HEDRICH C M,BREAM J H.Cell type-specific regulation of IL-10 expression in inflammation and disease[J].Immunol Res,2010,47(1/2/3):185-206.
[3]YORDY J S,LI R,SEMENTCHENKO V I,et al.SP100 expression modulates ETS1 transcriptional activity and inhibits cell invasion[J].Oncogene,2004,23(39):6654-6665.
[4]WATANABE D,TAKAGI H,SUZUMA K,et al.Transcription factor Ets-1 mediates ischemia- and vascular endothelial growth factor-dependent retinal neovascularization[J].Am J Pathol,2004,164(5):1827-1835.
[5]POLLARD J W.Tumour-educated macrophages promote tumor progression and metastasis[J].Nat Rev Cancer,2004,4(1):71-78.
[6]李妍,郝权.高迁移率族蛋白1和肿瘤相关巨噬细胞与宫颈癌淋巴管密度的相关性研究[J].中国肿瘤临床,2014,41(4):222-226.
LI Y,HAO Q.Correlation of lymphatic vessel density with a high mobility group Box-1 protein and tumor-associated macrophages in cervical carcinoma[J].Chinese Journal of Clinical Oncology,2014,41(4):222-226.
[7]DING H,CAI J,MAO M,et al.Tumor-associated macrophages induce lymphangiogenesis in cervical cancer via interaction with tumor cells[J].APMIS,2014,122(11):1059-1069.
[8]JI R C.Macrophages are important mediators of either tumor- or inflammation-induced lymphangesis[J].Cell Mol Life Sci,2012,69(6):897-914.
[9]TANG X.Tumor-associated macrophages as potential diagnostic and prognostic biomarkers in breast cancer[J].Cancer Lett,2013,332(1):3-10.
[10]KIM S,CHO S W,MIN H S,et al.The expression of tumor-associated macrophages in papillary thyroid carcinoma[J].Endocrinol Metab,2013,28(3):192-198.
[11]MUMM J B,EMMERICH J,ZHANG X,et al.IL-10 elicits IFNy-dependent tumor immune surveillance[J].Cancer Cell,2011,20(6):781-796.
[12]王艳,李鸥,白娣斯,等.白介素-10基因的表观遗传与宫颈癌研究进展[J].中国妇幼保健,2012,27(3):462-464.
[13]ROTHHAMMER T,HAHNE J C,FLORIN A,et al.The Ets-1 transcription factor is involved in the development and invasion of malignant melanoma[J].Cell Mol Life Sci,2004,61(1):118-128.
[14]HAMIDULLAH,CHANGKIJA B,KONWAR R.Role of interleukin-10 in breast cancer[J].Breast Cancer Res Treat,2012,133(1):11-21.
[15]王晓燕,邵淑丽,赵虹,等.ETS1与宫颈癌发生发展的相关性研究[J].中国药物与临床,2009,9(7):582-585.
WANG X Y,SHAO S L,ZHAO H,et al.The role of ETS1 in development and progression of cervical cancer[J].Chinese Remedies & Clinics,2009,9(7):582-585.
(本文编辑:崔丽红)
Expression of Interleukin-10,E26Transformation Factor-1 and Tumor-associated Macrophages in Cervical Cancer
ZHANGQi,MADong,CHANGLing-ya,ZHANGLi-jie,YANXi-zhao,WANGYang,CHENLi-rong,LIOu.
GraduateSchool,NorthChinaUniversityofScienceandTechnology,Tangshan063000,ChinaCorrespondingauthor:MADong,SchoolofPublicHealth,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China;E-mail:mamamadong@163.comLIOu,DepartmentofObstetricsandGynecology,TangshanGongrenHospital,Tangshan063000,China;E-mail:tsliou@163.com
Uterine cervical neoplasms;Interleukin-10;Ets1 transcription factor;Macrophages
国家自然科学基金资助项目(81541149);河北省自然科学基金(青年科学基金)资助项目(H 2016209046)
063000 河北省唐山市,华北理工大学研究生学院(张琪,常凌雅,张丽杰,闫錫钊),公共卫生学院(马冬,王洋);迁西县中医院(陈丽蓉);唐山工人医院妇产科(李鸥)
马冬,063000 河北省唐山市,华北理工大学公共卫生学院;E-mail:mamamadong@163.com
李鸥,063000 河北省唐山市,唐山工人医院妇产科;E-mail:tsliou@163.com
R 737.33
A
10.3969/j.issn.1007-9572.2016.27.010
2016-06-12;
2016-08-03)

