苯磺酸左旋氨氯地平片的制备及体外溶出研究
傅行弟
(安徽先求药业有限公司,安徽 宣城 242131)
苯磺酸左旋氨氯地平片的制备及体外溶出研究
傅行弟
(安徽先求药业有限公司,安徽 宣城242131)
目的研制苯磺酸左旋氨氯地平片,并以原研药为对照,考察其体外溶出性能。方法以溶出度为考察指标,优选苯磺酸左旋氨氯地平片干粉直接压片的处方工艺,在四种溶出介质下考察仿制药的溶出,以确定处方工艺的合理性。结果处方组成除活性成分苯磺酸左旋氨氯地平外,优选微晶纤维素、甘露醇和磷酸氢钙为填充剂,交联聚维酮为崩解剂,硬脂酸镁为润滑剂,并采用粉末直接压片工艺。结论优选的处方工艺可行,在四种溶出介质下,仿制药与原研药溶出基本一致。
氨氯地平;药物调剂;崩解度
左旋氨氯地平(levamlodipine,L-AD)为钙拮抗剂类降压药,由消旋体氨氯地平经拆分制得。实验证明氨氯地平主要药效成分为左旋氨氯地平(左旋为右旋疗效1000倍),由于其疗效及不良反应均优于氨氯地平,临床应用受到患者的欢迎[1]。施慧达药业集团(吉林)有限公司研制的苯磺酸左旋氨氯地平片(2.5 mg,以左旋氨氯地平计)于1999年获得首家上市,商品名为施慧达®。按仿制药研究技术要求,我们以原研药(施慧达®)为对照,经处方筛选和制备工艺研究,参考日本厚生省药品体外溶出信息库中苯磺酸氨氯地平片的四种溶出介质,重点考察仿制药与原研药的体外溶出曲线对比,结合制剂的其他特性进行研究,最终研制了本品。
1 仪器和试药
1.1仪器压片机(ZP-33,上海天凡)、电子天平(AG285型,梅特勒)、智能溶出仪(ZRS-8G,天津天发)、紫外分光光度计(UV-1102,上海天美)。
1.2试药苯磺酸左旋氨氯地平(威海迪素制药有限公司,批号101207),苯磺酸左旋氨氯地平对照品(中国药品生物制品检定所,批号100546-201103),苯磺酸左旋氨氯地平片原研药[施慧达药业集团(吉林)有限公司,批号110302],苯磺酸左旋氨氯地平片仿制药(安徽先求药业有限公司,批号110601);微晶纤维素PH102(德国瑞登梅父子公司)、无水磷酸氢钙(湖州展望药业有限公司)、甘露醇(法国罗盖特公司)、羧甲基淀粉钠、交联羧甲基纤维素钠、交联聚维酮、硬脂酸镁(均为安徽山河药用辅料股份有限公司);盐酸、醋酸钠、柠檬酸、磷酸二氢钾和氢氧化钠均为分析级。
2 方法与结果
苯磺酸左旋氨氯地平对高温和强光较敏感,原料易吸湿黏稠性较大,稳定性较苯磺酸旋氨氯地平差。原研药施慧达®专利处方工艺采用将稀释剂和崩解剂加入黏合剂后,采用湿法混合制粒,干燥,整粒,再喷入苯磺酸左旋氨氯地平乙醇溶液,外加辅料,混合,常温干燥,压片制备。鉴于该制备工艺较繁琐,我们参考了美国辉瑞公司苯磺酸氨氯地平片(商品名:络活喜®)的辅料组成,重点控制仿制药与原研药的体外四种介质中溶出曲线一致,采用干粉直接压片工艺,进行处方工艺筛选。
2.1处方辅料的筛选按络活喜®(苯磺酸氨氯地平片)的处方辅料组成,以1 000片的原辅料比例进行试制。制法:将苯磺酸左旋氨氯地平和硬脂酸镁混合,研磨过80目筛,先加入1/4量的羧甲基淀粉钠,混匀,再加入剩余的羧甲基淀粉钠、微晶纤维素和磷酸氢钙,充分混匀,压制成1 000片(φ6.5 mm),具体见表1。溶出度测定:溶出介质900 mL[①水;②盐酸(pH 1.2);③醋酸盐(pH 4.0);④磷酸盐(pH 6.8)],转数为50 r·min-1,依法操作,用高效液相法测定,结果见表2。试验结果表明:处方R1在四种介质中溶出与原研药相比,溶出速度偏慢,可能与崩解剂用量不足有关;处方R2在偏酸性介质中(pH 1.2和pH 4.0)溶出曲线与原研药较相似(f2>50),但在水和磷酸盐(pH 6.8)中相似性较差,可能与水不溶性辅料填充剂用量偏多有关;处方R3在四种介质中溶出曲线与原研药较相似(f2>50),但本品采用粉末直接压片,由于羧甲基淀粉钠为细粉状,流动性较差且在处方中所占比例较大,易使粉末直接压片的混合粉末流动性变差,导致片重差异较大,因此,拟对崩解剂种类和用量进一步筛选。

表1 不同预试处方组成/g
2.2不同崩解剂的筛选分别以羧甲基淀粉钠、低取代羟丙纤维素、交联羧甲基纤维素钠和交联聚维酮4种常用崩解剂进行处方配比研究,结果见表3。从表4,5统计结果看出:4种崩解剂对本品片剂的崩解及溶出效果差异有统计学意义(P<0.05):崩解速度依次为交联羧甲基纤维素钠羧>交联聚维酮≈甲基淀粉钠>低取代羟丙纤维素,溶出效果为交联聚维酮>羧甲基淀粉钠>低取代羟丙纤维素>交联羧甲基纤维素钠,虽然交联羧甲基纤维素钠崩解效果较好,但其在水中易形成凝胶颗粒而吸附活性成分苯磺酸左旋氨氯地平,在溶出滤液过滤过程中被滤膜截留丢失,结合在酸和盐中崩解和溶出情况,本品拟定优选崩解剂为交联聚维酮。
综合各处方溶出度试验结果及其片剂成型工艺,优选本品处方组成除活性成分苯磺酸左旋氨氯地平外,主要辅料种类为填充剂为微晶纤维素、甘露醇和磷酸氢钙,崩解剂为交联聚维酮,润滑剂硬脂酸镁。

表3 不同崩解剂的筛选/g

表2 不同处方R1、R2、R3溶出曲线与原研药比较
2.3仿制药与原研药的溶出曲线比较在上述处方R7原辅料种类组成不变的基础上,采用粉末直接压片工艺,进行多批次试验,结合片剂成型工艺中压片压力及压片转速等调试确定参数后,进行3批批量为50万片的放大验证,并以第一批次(110601)的仿制药和原研药进行体外溶出度曲线考查,其中溶出曲线考察结果见表6,7。从表7看出:仿制药与原研药在4种溶媒中3种拟合曲线均较相似,其中一级方程和Higuchi方程均适合于两者体外溶出动力学曲线拟合。见图1,2。

表4 4种崩解剂在水中崩解和溶出性能比较
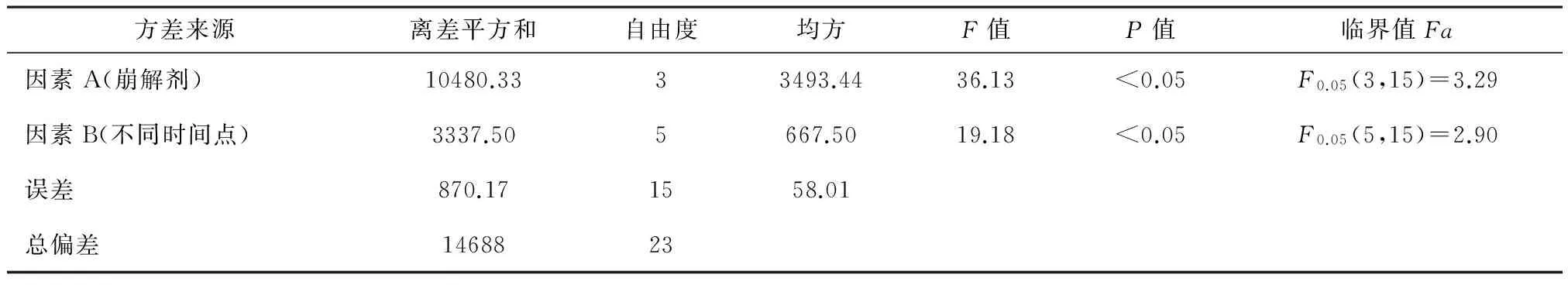
表5 4种崩解剂对水中不同时间点累积溶出量的两因素方差分析结果

表6 仿制药与原研药的不同介质溶出曲线比较
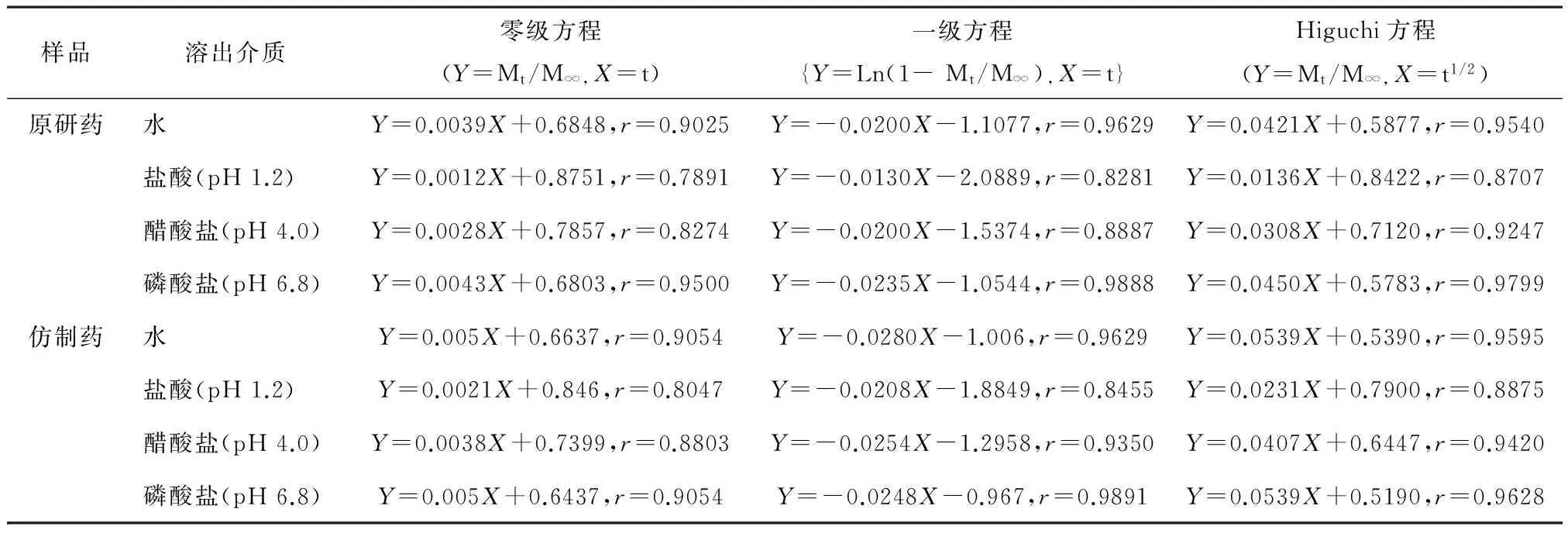
表7 仿制药与原研药的不同介质溶出曲线拟合

图1 原研药在4种溶媒下的溶出曲线

图2 仿制药在4种溶媒下的溶出曲线
3 讨论
溶出度是固体口服制剂内在质量的一个重要指标,发达国家均以多种pH溶出介质下考查仿制药与原研药的溶出对比,来评价仿制药固体口服制剂的内在质量。据文献检索,苯磺酸左旋氨氯地平片的制备有湿法制粒工艺[2-3],有干粉直接压片工艺[4-5],为了保证仿制药与原研药的生物等效,我们以日本厚生省药品体外溶出信息库中苯磺酸氨氯地平片的四种溶出介质为条件,考查仿制药的溶出,进行处方、工艺筛选,最终在四种溶出介质中,仿制药与原研药溶出曲线的相似因子f2均大于75以上,且三种拟合曲线均较相似,表明仿制药的拟定处方组成及制备工艺较合理,两者体外溶出曲线较一致。
[1]侯丽萍,赵红玲,英俊岐.苯磺酸左旋氨氯地平的临床应用进展[J].医学综述,2011,17(20):3129-3133.
[2]吴雯君,郭江萍,李鹏.苯磺酸左旋氨氯地平片的制备和质量控制[J].上海医药,2013 34(11):57-61.
[3]彭红,黄丽芸,付建武,等.苯磺酸左旋氨氯地平口崩片质量考查[J].江西中医学院学报,2010,22(4):55-57.
[4]李源,冉庆斌,王书娟.苯磺酸左旋氨氯地平片的制备工艺及质量控制[J].机电信息,2013,12(35):54-56.
[5]朱建坤.苯磺酸左旋氨氯地平原料药与片剂制备[D].青岛:山东大学,2010.
Preparation of levamlodipine besylate tablets and its vitro dissolution
FU Xingdi
(AnhuiXianqiuPharmaceuticalCo.,Ltd,Xuancheng,Anhui242131,China)
ObjectiveTo make preparation of Levamlodipine Besylate Tablets,and with original products as reference,to make investigation on its vitro dissolution.MethodsIn accordance with the evaluation standards based on dissolution,and with the view to verify the viability of formulation,the formulation and preparation of Levamlodipine Besylate Tablets were optimized by direct powder compression,and its vitro release tests had been done in 4 different dissolution media.ResultsLevamlodipine Besylate Tablets should be made by direct powder compression,with microcrystalline cellulose,mannitol,and calcium hydrogen phosphate as filler,polyvinypyrrolidone as disintegrant,and magnesium stearate as lubricant.ConclusionsThe optimized formulation and preparation prove rational.The dissolution rate of self-made Levamlodipine Besylate Tablets is basically as much as that of original products in four different dissolution media.
Amlodipine;Drug compounding;Disintegration
10.3969/j.issn.1009-6469.2016.08.012
2016-05-03,
2016-06-21)

