白花丹素抑制肾小球系膜细胞增殖及促纤维化相关因子的表达
谢议凤,王站旗,苏佩玲
(广西中医药大学第三附属医院肾病科,广西 柳州 545001)
白花丹素抑制肾小球系膜细胞增殖及促纤维化相关因子的表达
谢议凤,王站旗,苏佩玲
(广西中医药大学第三附属医院肾病科,广西 柳州545001)
目的探讨白花丹素对人肾小球系膜细胞株HMC细胞增殖及转化生长因子-β1(TGF-β1)、结缔组织生长因子(CTGF)、纤维连接蛋白(FN)表达的影响。 方法1~10 μmol·L-1白花丹素分别处理HMC细胞后,MTT法检测细胞增殖活性;RT-PCR和细胞免疫荧光法分别检测TGF-β1、CTGF、FN mRNA和蛋白的表达。结果1~10 μmol·L-1白花丹素作用后,HMC细胞呈时间、浓度依赖性生长抑制,TGF-β1、CTGF、FN mRNA和蛋白的表达下降。结论白花丹素通过降低HMC细胞TGF-β1、CTGF、FN的表达,抑制HMC细胞增殖。
白花丹;转化生长因子β1;结缔组织生长因子;连接蛋白类
白花丹素(plumbagin,PL)是我国广西、云南等地出产的常见草药白花丹的主要活性成分,具有抗真菌、抗肿瘤、抗细菌、抗凝等多种药理作用[1]。近来有文献报道白花丹提取物具有抗小鼠肝纤维化的作用[2],但是白花丹素是否是其抗纤维化的主要活性物质,其对肾纤维化的影响仍未见报道。本研究拟通过探讨白花丹素对人肾小球系膜株HMC细胞的作用,为临床防治肾脏纤维化提供新的思路。
1 材料与方法
1.1实验材料
1.1.1细胞株HMC细胞是正常人肾小球细胞细胞株,为T-SV40及H-ras原癌基因转染的永生系,它保持正常人肾系膜细胞基本的形态学和生物学特征,由南京中大医院肾内科刘必成教授、江苏省中医院肾内科王钢教授惠赠。
1.1.2试剂白花丹素以二甲基亚砜(DMSO)配制成0.1 mol·L-1存储液备用,使用时以1640培养液(Gibco)稀释至相应浓度。DMSO实验终质量浓度小于0.1%,经预实验已经证实对HMC细胞无影响。胎牛血清购于武汉三利生物公司。二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)均购自Sigma公司。兔抗人转化生长因子-β1(TGF-β1)多克隆抗体(Santa Cruz)、兔抗人结缔组织生长因子(CTGF)多克隆抗体(Santa Cruz)、兔抗人纤维连接蛋白(FN)多克隆抗人抗体(Santa Cruz)均购于北京中杉金桥生物公司。SABC免疫组织化学检测试剂盒、FITC标记羊抗兔IgG(Pierce)购于武汉博士德生物有限公司。Trizol试剂(Invitrogen)购于武汉凌飞生物有限公司。逆转录扩增试剂盒(Fermentas)购于武汉兴华生物公司。
1.2实验方法
1.2.1细胞培养及分组人肾小球系膜细胞株HMC在含有10%胎牛血清、青霉素100 U·mL-1及链霉素100 mg·L-1的1640培养基中,37 ℃、5% CO2条件下培养。1~2 d换液一次,3~4 d传代一次。设置空白对照组(不加药组)、DMSO对照组(溶剂对照组);不同浓度(1.0、2.5、5.0、7.5、10.0 μmol·L-1)白花丹素药物作用组。
1.2.2细胞体外增殖活性检测采用MTT比色法。 取3×104·mL-1人肾小球系膜细胞株HMC接种于96孔培养板,每孔100 μL,每组6个复孔。待各药物分别作用于HMC细胞24、48、72 h后,每孔加入0.5% MTT 20 μL,继续培养4 h,弃去上清,加DMSO 每孔100 μL,振荡至结晶溶解,酶标仪490 nm 波长处测定吸光度A值。
1.3RT-PCR检测TGF-β1、CTGF、FN的表达将接种于6孔板内经不同浓度白花丹素或溶剂作用24 h后的HMC细胞弃去细胞培养液,PBS漂洗后用Trizol试剂盒提取RNA,DNA/RNA测量仪测得RNA浓度,用RT-PCR扩增TGF-β1、CTGF、FN,1.5%琼脂糖凝胶电泳、凝胶图像分析仪(Gene Genius)紫外光下采集图像并分析。以GAPDH做为内参照,以目的基因与同一标本的GAPDH的RT-PCR产物条带的吸光度比值来表示其相对含量。见表1。
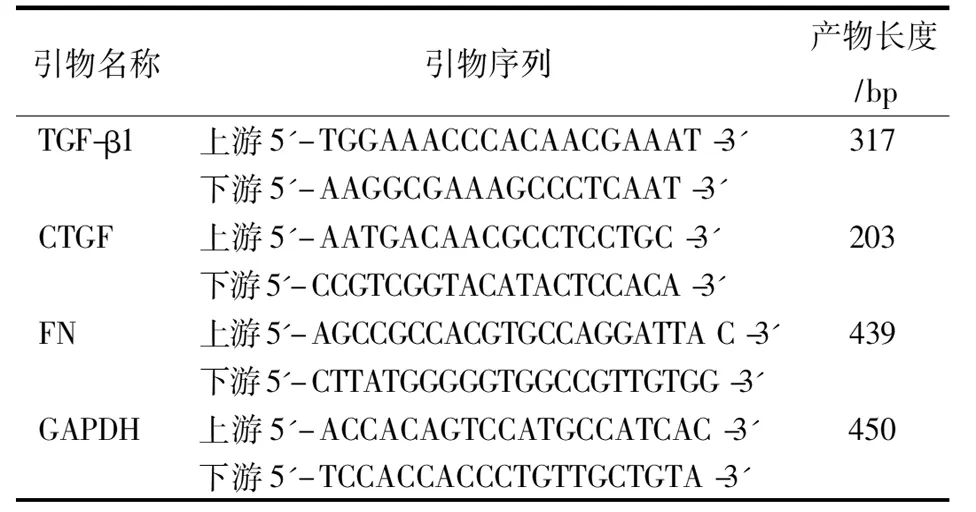
表1 PCR引物序列
1.4细胞免疫荧光检测TGF-β1、CTGF、FN 的表达将1×105每孔 HMC接种于24板上,待细胞生长至60%左右加入不同浓度白花丹素或溶剂,24 h后弃去培养基,PBS漂洗,4%多聚甲醛固定,0.2%Triton X-100破膜,正常山羊血清封闭,一抗过夜,PBS漂洗后加入FITC标记羊抗兔IgG,室温孵育30 min后荧光显微镜下观察结果并照相,以PBS作空白对照。结果用Imagepro-plus5.0生物图像系统在显微镜下(200×)随机观察5个区域,进行平均吸光度测定。
1.5统计学方法所有数据采用SPSS 12.0统计学软件进行t检验及方差分析,P<0.05为差异有统计学意义。
2 结果
2.1白花丹素对体外培养HMC细胞增殖的影响如图1所示,与空白对照组比较,经各浓度白花丹素处理24、48、72 h后,HMC 细胞呈时间、浓度依赖性生长抑制,不同浓度药物与不同作用时间组之间差异有统计学意义 (P<0.05) ;DMSO对照组细胞生长活性未见明显抑制 (P>0.05)。
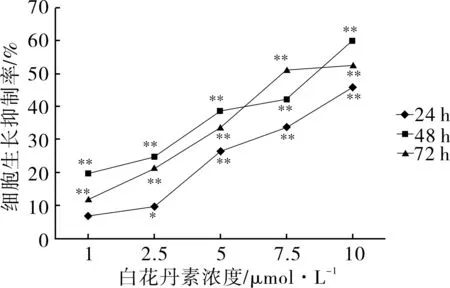
注:与对照组比较,*P<0.05;**P<0.01。
图1不同白花丹素浓度和作用时间对HMC细胞生长抑制率的影响
2.2白花丹素对HMC细胞TGF-β1、CTGF、FN mRNA的表达的影响如表2和图2所示,不同浓度的白花丹素处理24 h后, TGF-β1、CTGF、FN mRNA的表达抑制,并呈一定的浓度依赖性(P<0.05)。

表2 白花丹素对HMC细胞TGF-β1、CTGF、FN mRNA的表达的影响
注:与对照组比较,aP<0.01,bP<0.05。

注:A:TGF-β1;B:CTGF;C:FN;D:GAPDH;A~D图中1.对照组;2~6.白花丹素1.0、2.5、5.0、7.5、10.0 μmol·L-1组。
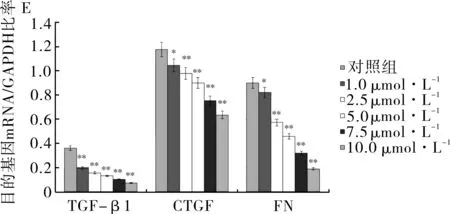
注:E.目的基因mRNA/GAPDH的柱状图。与对照组比较,*P<0.05,**P<0.01。
图2白花丹素对HMC细胞TGF-β1、CTGF、FN mRNA表达的影响
2.3白花丹素对HMC细胞TGF-β1、CTGF、FN 表达的影响如图3和表3所示,不同浓度的白花丹素处理24 h后, HMC细胞免疫荧光显示TGF-β1、CTGF、FN 的表达受抑制,并呈浓度依赖性,不同浓度药物组之间差异有统计学意义(P<0.05)。
3 讨论
肾小球系膜细胞是一种维持正常肾小球结构和功能所必须的肾脏固有细胞。系膜细胞在分泌细胞因子、调节肾小球血流、维持基质的正常代谢等方面发挥重要的生理作用。在病理情况下,损伤后的系膜细胞由静止状态转而表现为细胞增殖活跃,通过自分泌或旁分泌形式释放多种细胞因子,使细胞外基质产生增加,降解减少,系膜基质聚集[3-4]。过量聚积的系膜基质可以导致毛细血管被挤压、闭塞、滤过面积减少,最终导致肾小球硬化的发生及肾功能衰退[4-5]。我们的实验证明首次白花丹素能够抑制人肾小球细胞细胞株HMC增殖,其抑制增殖作用呈量效依赖关系。

注:1A.TGF-β1空白对照组;1B.5 μmol·L-1白花丹素干预组;1C.10 μmol·L-1白花丹素干预组 (100×)。2A.CTGF空白对照组;2B.5 μmol·L-1白花丹素干预组;2C.10 μmol·L-1白花丹素干预组 (100×)。3A.FN空白对照组;3B.5 μmol·L-1白花丹素干预组;3C.10 μmol·L-1白花丹素干预组 (200×)。

图3 白花丹素对HMC细胞TGF-β1、CTGF、FN 表达的影响
注:与对照组比较,aP<0.05,bP<0.01。
TGF-β1是作用最强的致肾纤维化细胞因子,肾脏固有细胞及炎细胞均可分泌。TGF-β1是引起肾小球硬化主要介质,可能是通过促进系膜细胞合成细胞外基质,并促进其在系膜区沉积而起作用,是肾损害导致纤维化的最后的和共同的重要中介因子。CTGF是TGF-β1的下游蛋白因子,主要介导TGF-β1促细胞外基质积聚,参与各种组织器官纤维化形成过程[6]。TGF-β1是一个有广泛生物学活性的蛋白因子,而CTGF具有较特异的促纤维化效应[7]。在增生性成纤维化肾脏病变中,毛细血管外系膜增生病损区、肾小球周围纤维化区、肾间质纤维化区均有CTGF的强烈表达。CTGF的表达量增加不仅是一种普遍现象,而且它与肾纤维化严重程度和进展密切相关。研究表明CTGF可刺激体外培养的人肾小球系膜细胞增生及大量合成FN。FN是具有多种生物性作用重要的细胞外基质成分,通常认为组织/细胞FN表达量的增加与组织的纤维化有着密切的关系[8-9]。研究表明,传统中药在防治肾脏损害方面发挥重要作用[10],探索传统中药保护肾脏功能的作用机制为中药疗法的临床推广提供了实验基础。 我们的实验结果表明白花丹素可以下调TGF-β1、CTGF、FN水平的表达。
白花丹是我国西南地区的常见植物,为多民族药材,民间应用广泛。广西壮医称为“颠邦”或“裸端”;瑶医称为“猛老虎”或“三钱三”;云南傣医称为“比比篙”。民间已有将白花丹用于肝脏疾病的应用[11]。动物实验证明白花丹提取物具有抗四氯化碳所致小鼠肝纤维化的作用,但其抗纤维化机制及其有效成分仍不清楚[2]。白花丹素是白花丹主要有效成分,为一种相对分子量为188.18的小分子萘醌化合物。目前发现有抗肿瘤、抗细菌、真菌、螨虫等多种药理作用[1,12-15]。白花丹素是否具有抗纤维化作用国内外仍未见报道。通过我们的实验结果显示白花丹素在体外能有效的抑制HMC细胞增殖,并抑制肾纤维化相关因子TGF-β1、CTGF、FN的表达,这一作用呈量效依赖关系。
本研究结果提示我们白花丹素可能在体内也具有抑制HMC细胞增殖及TGF-β1、CTGF、FN的表达,减少细胞外基质的积聚,从而发挥延缓肾脏纤维化、保护肾功能的作用。白花丹素在体内对肾纤维化的作用需要我们下一步的动物实验模型来证明。
[1]彭岳,苗维纳,赵铁建,等.白花丹醌对人肝星状细胞的细胞毒性及其机制的研究[J].时珍国医国药,2016,27(1):5-7.
[2]赵铁建,钟振国,方卓.白花丹提取物抗小鼠肝纤维化作用的研究[J].广西中医药,2005,28(4):50-52.
[3]Wunsche C,Koch A,Goldschmeding R,et al.Transforming growth factor beta2 (TGF-beta2)-induced connective tissue growth factor (CTGF) expression requires sphingosine 1-phosphate receptor 5(S1P5) in human mesangial cells[J].Biochimica et biophysica acta,2015,1851(5):519-526.
[4]Borza CM,Pozzi A.The role of cell-extracellular matrix interactions in glomerular injury[J].Experimental Cell Research,2012,318(9):1001-1010.
[5]Holmes D.Glomerular disease:increased complexity of the glomerular extracellular matrix[J].Nat Rev Nephrol,2014,10(3):126.
[6]Hinz B.The extracellular matrix and transforming growth factor-beta1:Tale of a strained relationship[J].Matrix Biology:Journal of the International Society for Matrix Biology,2015,47:54-65.
[7]Wang B,Jha JC,Hagiwara S,et al.Transforming growth factor-beta1-mediated renal fibrosis is dependent on the regulation of transforming growth factor receptor 1 expression by let-7b[J].Kidney International,2014,85(2):352-361.
[8]Yokoi H,Mukoyama M,Sugawara A,et al.Role of connective tissue growth factor in fibronectin expression and tubulointerstitial fibrosis[J].American Journal of Physiology,2002,282(5):933-942.
[9]Ren Y,Du C,Yan L,et al.CTGF siRNA ameliorates tubular cell apoptosis and tubulointerstitial fibrosis in obstructed mouse kidneys in a Sirt1-independent manner[J].Drug Design,Development and Therapy,2015,9:4155-4171.
[10] 韦敏,刘丽敏,刘华钢,等.白花丹素的体外肾毒性及酸性成纤维细胞生长因子对白花丹素所致肾损伤的保护作用[J].药学服务与研究,2009,9(4):272-274.
[11] 赵铁建,方卓.白花丹的药学研究与临床应用概述[J].中医文献杂志,2006(4):51-54.
[12] 杜泽乡,孙情,乔伟,等.白花丹素对人舌癌Tca细胞增殖及凋亡作用的探讨[J].时珍国医国药,2011,22(4):942-944.
[13] 徐雅玲,黄巨恩,刘华钢.白花丹素致体外培养肝细胞的损伤及改构型酸性成纤维细胞生长因子对肝细胞的保护作用[J].中国药理学通报,2011,27(6):786-790.
[14] 杨铁嵘,申素霞,许景月,等.白花丹素对结核分枝杆菌H37RV基因表达谱的影响[J].时珍国医国药,2012,23(4):820-823.
[15] 李欣燃,唐旭东,陈志宝.白花丹素体外抗细菌、真菌及其生物被膜活性研究[J.黑龙江八一农垦大学学报,2012,24(5):41-45.
Inhibition effect of plumbagin on proliferation of human glomerular mesangial cell and the mechanisms
XIE Yifeng,WANG Zhanqi,SU Peiling
(DepartmentofNephropathy,TheThirdAffiliatedHospitalofGuangxiUniversityofChineseTraditionalMedicine,Liuzhou,Guangxi545001,China)
ObjectiveTo investigate the effects of plumbagin (PL) on the proliferation of human mesangial cell (HMC) cultured in vitro and the expression of TGF-β1,CTGF,FN in mRNA and protein level.MethodsThe experiment subjects were randomized into control group and five PL groups with different concentrations (1.0,2.5,5.0,7.5,10.0 μmol·L-1),which were treated with DMSO and PL respectively.The proliferation activity of mesangial cells was observed by MTT assay after 24,48,72 hours.The expressions of TGF-β1,CTGF,FN mRNA and protein were detected by RT-PCR and immunofluorescence after 24 hours.ResultsAbsorbance recorded at 490 nm wavelength at different time in PL group was lower than that of control group(P<0.05).Electrophoresis strip density of PCR product and absorbance of immunofluorescence in PL group was significantly lower than that of control group(P<0.05),and a dose and time response relationship was shown in results.ConclusionsPlumbagin can inhibit the proliferation of glomerular mesangial cell by downregulating the expressions of TGF-β1,CTGF,FN in mRNA and protein level.
Plumbago zeylanica;Transforming growth factor beta1;Connective tissue growth factor;Connexins
10.3969/j.issn.1009-6469.2016.08.007
2016-05-18,
2016-07-05)

