葡甘聚糖酶高产菌株Q1发酵条件优化及酶的分离纯化
王 强,李 旭,张旭姣,张庆芳,窦少华,金连豆,迟乃玉*
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116622;3.大连市生产力促进中心,辽宁大连116025)
葡甘聚糖酶高产菌株Q1发酵条件优化及酶的分离纯化
王强1,2,李旭3,张旭姣1,2,张庆芳1,2,窦少华1,2,金连豆1,2,迟乃玉1,2*
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116622;3.大连市生产力促进中心,辽宁大连116025)
该研究以海洋来源的枯草芽孢杆菌(Bacillus subtilis)Q1为出发菌株,通过单因素实验对葡甘聚糖酶产生菌Q1发酵条件进行优化,并将菌株Q1发酵所得上清液经硫酸铵沉淀、透析、超滤离心和Sephadex G-100凝胶过滤层析,得到电泳纯的葡甘聚糖酶,并研究其部分酶学性质。结果表明,最佳发酵条件为魔芋粉添加量0.75%、牛肉膏添加量为0.2%,蛋白胨添加量为0.4%、氯化钠添加量0.4%、培养温度26℃、转速160 r/min、接种量5%、初始pH 7.0、装液量100 m L/250 m L。在此条件下,葡甘聚糖酶酶活为241.61 U/m L。葡甘聚糖酶相对分子质量为41.3 ku;酶最适作用底物为葡甘聚糖。
葡甘聚糖酶;发酵条件;优化;分离纯化
葡甘聚糖酶(glucomannanase)是一种能将葡甘聚糖降解为葡甘低聚糖的外泌酶。葡甘聚糖是魔芋的主要成分,由甘露糖和葡萄糖单元按1.6∶1.0的摩尔比通过β-1,4-糖苷键相连的天然多糖高分子[1-2]。葡甘低聚糖是由葡萄糖和甘露糖组成的杂聚寡糖,最初从酵母的细胞壁中提取获得[3]。生物酶法降解葡甘聚糖可通过两种途径:一种是采用微生物代谢产生的葡甘聚糖酶酶解;另一种是从魔芋块茎中直接提取葡甘聚糖酶酶解。目前常采用的方法是微生物酶解葡甘聚糖,因为酶在微生物中普遍存在,具有极佳的催化活性,可显著提高反应速度1×106~1×1010倍[4],并且微生物具有分布广、种类齐全、易于大量制取等特点[5]。
目前国内外对于葡甘聚糖酶的研究仍处于起步阶段,葡甘聚糖酶产量低,酶活不高[6],对葡甘聚糖酶产生菌筛选、分离、鉴定及酶学性质研究得到的产葡甘聚糖酶微生物大多来源于土壤[7-10],海洋葡甘聚糖酶的研究在国内鲜现。
本研究从海泥和海水样品中筛选出一株葡甘聚糖酶高产枯草芽孢杆菌(Bacillus subtilis)Q1,以Q1为出发菌株,通过单因素实验优化Q1产酶条件,粗酶液经硫酸铵盐析、透析和超滤、Sephadex G-100凝胶柱层析进行分离纯化,并进行酶学性质的研究。目的是增加葡甘聚糖酶产量,提高酶催化效率,降低生产成本,为葡甘聚糖酶的工业化应用奠定基础。
1 材料与方法
1.1材料与试剂
1.1.1菌种
枯草芽孢杆菌(Bacillus subtilis)Q1:筛选自大连周边海域的海泥、海水样品,现由辽宁省海洋微生物工程技术研究中心保藏。
1.1.2培养基
保藏培养基:蛋白胨1%,牛肉膏0.3%,NaCl 0.5%,琼脂2%,pH 7.0,121℃灭菌20 min。
种子培养基:蛋白胨1%,牛肉膏0.3%,NaCl 0.5%,pH 7.0,121℃灭菌20 min。
发酵培养基:蛋白胨0.1%,牛肉膏0.3%,NaCl 0.5%,魔芋粉0.5%,pH 7.0,121℃灭菌20 min。
1.1.3主要试剂
蛋白Marker:加拿大Fermentas公司;魔芋粉:大连凯美化工工程配套有限公司;葡甘聚糖:合肥博美生物科技有限责任公司;其余试剂均为国产分析纯。
1.2仪器与设备
LDZX-40BI立式压力蒸汽灭菌器:上海申安医疗器械厂;LTI-700恒温培养箱:上海爱朗仪器有限公司;HZP-250全温振荡培养箱:上海精宏实验设备有限公司;HD-1360超净工作台:北京东联哈尔仪器制造有限公司;DYY-6C电泳仪:立德泰勀(上海)科学仪器有限公司;AL-204电子天平:梅特勒-托利多仪器有限公司;GelDoc XR+凝胶成像系统:广州市龙煜生物科技有限公司。
1.3方法
1.3.1培养方法
菌株活化:将保存于4℃条件下的斜面菌株接种到保藏培养基中,28℃培养24 h,以备后续实验使用。
种子液制备:将已经活化好的菌株接种到种子培养基中,28℃、150 r/min振荡培养24 h,作为一级种子液;
将一级种子液以5%接种量,接种到种子培养基中,28℃、150 r/min振荡培养24 h,作为二级种子液。
1.3.2甘露糖标准曲线的制作
称取100 mg无水甘露糖(105℃干燥至恒质量),用适量蒸馏水将其溶解,并定容至100 m L。取25 m L具塞试管10支,分别加入质量浓度1 mg/m L甘露糖溶液0、0.1 m L、0.2 m L、0.3 m L、0.4 m L、0.5 m L、0.6 m L、0.7 m L、0.8 m L、0.9 m L,并加蒸馏水补足至1.0 m L,加入3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)试剂[11],混合均匀。100℃水浴显色5 min,冷却至室温后,用蒸馏水定容至20 m L,于波长540 nm处测定其吸光度值。以甘露糖质量浓度(x)为横坐标,OD540nm值(y)为纵坐标绘制甘露糖标准曲线,线性回归方程为y=0.561 5x,R2=0.999 1。
1.3.3葡甘聚糖酶酶活测定方法[12]
0.9m L 0.4%葡甘聚糖底物中,加入适当稀释的酶液0.1 m L,30℃水浴10 m in,立即放入100℃水浴5 m in,终止反应,然后加入2.0 m L DNS试剂,100℃显色5 m in,冷却至室温后,用蒸馏水定容至20 m L,于波长540 nm处测定吸光度值,根据甘露糖标准曲线及酶活公式计算酶活。葡甘聚糖酶活定义:在上述反应条件下,葡甘聚糖底物每分钟释放1 μmol甘露糖的酶量为1个酶活单位(U)[13]。相对酶活为样品酶活与同组最高酶活之比。
1.3.4发酵条件优化
(1)不同碳源对酶活的影响
分别选用0.5%的不同碳源(魔芋粉、可溶性淀粉、蔗糖、瓜尔豆胶、比目糖、木聚糖),将二级种子液以5%接种量,接种到发酵培养基中,28℃、150 r/m in振荡培养55 h后测定酶活,每次做3组平行实验,下同。
(2)魔芋粉添加量对酶活的影响
以魔芋粉为碳源,改变培养基中魔芋粉添加量(0.25%、0.50%、0.75%、1.00%),将二级种子液以5%接种量,接种到发酵培养基中,28℃、150 r/min振荡培养55 h后测定酶活。
(3)不同氮源对酶活的影响
以复合氮(牛肉膏+蛋白胨、酵母膏+蛋白胨、氯化铵+蛋白胨、氯化铵+硝酸钠)作为氮源,将二级种子液以5%接种量,接种到发酵培养基中,28℃、150 r/min振荡培养55 h后测定酶活。
(4)牛肉膏与蛋白胨配比对酶活的影响
改变牛肉膏与蛋白胨配比(0.1%∶0.4%、0.1%∶0.3%、0.1%∶0.2%、0.2%∶0.4%、0.2%∶0.3%、0.3%∶0.3%、0.3%∶0.4%、0.1%∶0.1%),将二级种子液以5%接种量,接种到发酵培养基中,28℃、150 r/min振荡培养55 h后测定酶活。
(5)氯化钠添加量对酶活的影响
氯化钠添加量分别为(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%),将二级种子液以5%接种量,接种到发酵培养基中,28℃、150 r/min振荡培养55 h后测定酶活。
(6)初始pH对酶活的影响
初始pH分别设置为5.0、6.0、7.0、8.0、9.0,将二级种子液以5%接种量,接种到发酵培养基中,28℃、150 r/m in振荡培养55 h后测定酶活。
(7)培养温度对酶活的影响
在24℃、26℃、28℃、30℃、32℃、37℃的恒温摇床中,将二级种子液以5%接种量,接种到发酵培养基中,150 r/min振荡培养55 h后测定酶活。
(8)转速对酶活的影响
在不同转速(130 r/m in、140 r/m in、150 r/m in、160 r/m in、170 r/min)恒温摇床中,将二级种子液以5%接种量,接种到发酵培养基中,26℃振荡培养55 h后测定酶活。
(9)装液量对酶活的影响
分别按不同装液量(50 m L/250 m L、75 m L/250 m L、100 m L/250 m L、125 m L/250 m L、150 m L/250 m L、175 m L/ 250 m L)装入发酵培养基,将二级种子液以5%接种量接种到发酵培养基中,26℃、160 r/min振荡培养55h后测定酶活。
(10)接种量对酶活的影响
分别设置不同接种量(3%、4%、5%、6%、7%)的发酵培养基,26℃、160 r/m in振荡培养55 h后测定酶活。
1.3.5酶的分离纯化
(1)粗酶液制备
将菌株Q1二级种子液以5%接种量接种到装液量为100 m L/250 m L的发酵培养基中,26℃、160 r/min振荡培养55 h,发酵液经4℃、6 000 r/min离心20 min,上清液即为粗酶液。
(2)硫酸铵沉淀
参照硫酸铵盐析溶解度表,向粗酶液中加入硫酸铵固体,使硫酸铵饱和度分别为30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、90%,置于4℃冰箱中过夜,10 000 r/min离心20 min,沉淀分别用1 m L磷酸缓冲液(pH 6.0)进行溶解。取每个饱和度的上清和沉淀分别测定酶活,并绘制盐析曲线。
(3)透析和超滤
将盐析得到的样品装入预先处理好的透析袋(截留分子质量14 000 u)中,4℃条件下透析,期间更换透析液,直至透析液中检测无SO42-为止;将完成透析的样品转移到10 ku超滤管中,4℃、4 000 r/min离心10 min,测定酶活。
(4)Sephadex G-100凝胶过滤层析
将凝胶柱、蛋白检测仪、自动收集器和电脑正确连接,保持蛋白检测仪T值为100;待基线平衡以后,将超滤后的浓缩酶液2m L加入SephadexG-100凝胶柱(Ф1.6 cm×60 cm)中,使洗脱速度保持在0.3 m L/min;调节自动收集器,使每个试管的收集时间为4 m in,根据显示器上的洗脱峰,收集相应试管洗脱液,测定酶活。
1.3.6部分酶学性质
(1)最适作用底物
在酶最适作用条件下,分别以0.4%的淀粉、葡甘聚糖、瓜尔豆胶、魔芋粉作为底物,测定酶活,每次做3组平行实验。
(2)相对分子质量确定
通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylam ide gel electrophoresis,SDSPAGE)确定葡甘聚糖酶相对分子质量。电泳条件为:12%分离胶浓度,5%浓缩胶浓度,30 mA恒流电泳2.5 h,考马斯亮蓝R-250染色1 h,乙醇醋酸脱色6 h,期间需要更换脱色液,直至凝胶变透明,出现清晰的条带。
2 结果与分析
2.1发酵条件优化
2.1.1不同碳源对酶活的影响
由图1可知,当用魔芋粉作为碳源时,葡甘聚糖酶相对酶活达到100%,瓜尔豆胶次之为69%,而以可溶性淀粉、蔗糖、木聚糖、比目糖作为碳源时,相对酶活几乎为零。因此,该菌产生的葡甘聚糖酶为一种魔芋粉特异性诱导酶[15],故选择魔芋粉为最适碳源。

图1 碳源种类对酶活的影响Fig.1 Effect of carbon source types on enzym e activity
2.1.2魔芋粉添加量对酶活的影响
魔芋粉主要成分是葡甘聚糖,葡甘聚糖具有凝胶性,浓度过高,会导致葡甘聚糖成为凝胶小球,不利于菌株Q1利用,影响酶的合成,而魔芋粉浓度过低则不利于酶的大量合成。由图2可知,当魔芋粉添加量为0.75%时,相对酶活达到100%;魔芋粉添加量为0.25%、0.50%、1.00%时,葡甘聚糖酶相对酶活均不足80%,由于不同研究中使用的魔芋粉黏度以及纯度各不相同,且不同菌株利用魔芋粉的能力有差别[16-17]。因此,选择魔芋粉最适添加量为0.75%。

图2 魔芋粉添加量对酶活的影响Fig.2 Effec t of konjaku flour addition on enzym e activity
2.1.3复合氮源对酶活的影响
本研究中适合菌株Q1产酶的氮源组合为复合氮源,实验过程中牛肉膏与蛋白胨添加量分别为0.1%与0.3%,酵母膏与蛋白胨的添加量分别为0.1%与0.3%,氯化铵与蛋白胨的添加量分别为0.1%与0.3%,氯化铵与硝酸钠的添加量分别为0.1%与0.3%。由图3可知,以牛肉膏与蛋白胨为复合氮源时,葡甘聚糖酶相对酶活达到100%;酵母膏与蛋白胨为复合氮源时,相对酶活次之,为79%,氯化铵与蛋白胨作为复合氮源时,相对酶活最低,仅为67%。因此,选择牛肉膏与蛋白胨复合氮源为最适氮源。
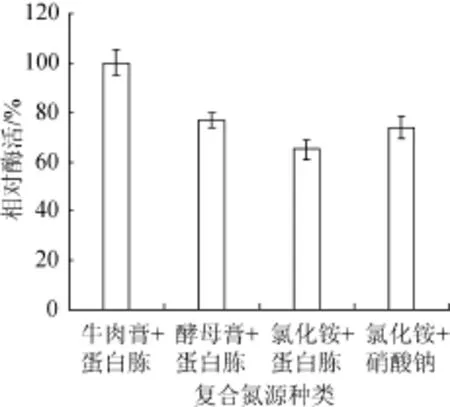
图3 复合氮源种类对酶活的影响Fig.3 Effect of com pound nitrogen source types on enzym e ac tivity
2.1.4牛肉膏与蛋白胨配比对酶活的影响
由图4可知,当牛肉膏与蛋白胨配比为0.2%∶0.4%时,葡甘聚糖酶相对酶活达到100%;当牛肉膏与蛋白胨配比分别为0.1%∶0.4%、0.1%∶0.3%、0.1%∶0.2%时,相对酶活均不足60%;当牛肉膏与蛋白胨质量比分别为0.2%∶0.3%、0.1%∶0.1%、0.3%∶0.4%、0.3%∶0.3%时,相对酶活也呈下降趋势,说明氮源浓度过低不利于酶的大量合成,氮源浓度过高对菌体生长有一定抑制作用,影响酶的合成[18]。因此,当牛肉膏与蛋白胨的配比为0.2%∶0.4%时,最适合菌体生长。

图4 牛肉膏与蛋白胨质量比对酶活的影响Fig.4 Effect of beef extract and peptone m ass ratio on enzyme activity
2.1.5氯化钠添加量对酶活的影响
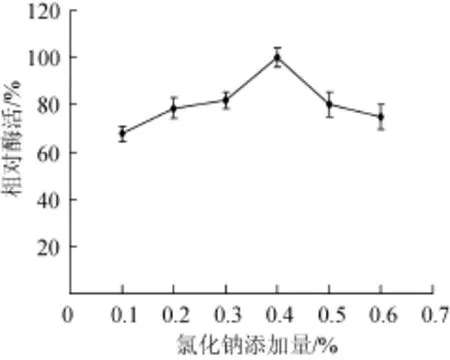
图5 氯化钠添加量对酶活的影响Fig.5 Effect of sodium chloride addition on enzyme activity
由图5可知,氯化钠添加量在0.1%~0.4%时,葡甘聚糖酶相对酶活呈上升趋势,氯化钠添加量为0.4%时,相对酶活达到100%,氯化钠添加量>0.4%时,相对酶活呈下降趋势。说明浓度过高或过低都不利于菌株产酶,适量氯化钠对Q1产酶有促进作用。因此,氯化钠最适添加量为0.4%。
2.1.6初始pH对酶活的影响
菌株生长需要适合的pH,产物合成也需要适宜的pH[19]。由图6可知,初始pH值为7.0时,相对酶活达到100%;初始pH值为6.0时,Q1产酶相对酶活达到80%,pH 5.0、pH 8.0、pH 9.0时,相对酶活不高,均在60%左右,说明该菌具有一定的耐酸性。因此,菌株发酵最适初始pH值为7.0。
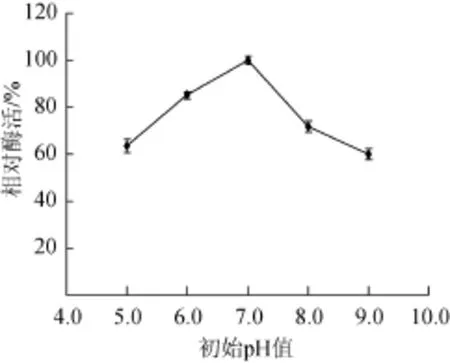
图6 初始pH对酶活的影响Fig.6 Effec t of initial pH on enzym e ac tivity
2.1.7培养温度对酶活的影响
由图7可知,在26℃时,葡甘聚糖酶相对酶活为100%,此后,随着温度的升高,相对酶活越来越低,说明菌株Q1是低温菌,高温条件会影响其生长,进而影响其产酶。本实验优化的培养温度低于熊郃等[20-21]研究所得的培养温度,可能是因为菌株Q1是从海洋样品中筛选得来,海洋环境温度较低。因此,最适培养温度为26℃。

图7 培养温度对酶活的影响Fig.7 Effect of culture tem perature on enzyme activity
2.1.8转速对酶活的影响
转速主要调节发酵过程中的通氧量,转速过低,通气量小,发酵液溶氧不够,不利于菌体生长繁殖及酶的合成;转速过快,会导致菌体自溶[22]。由图8可知,转速在130~160 r/min之间时,相对酶活逐渐增加;转速为160 r/m in时,相对酶活达到100%;转速>160 r/min时,相对酶活开始下降。因此,最适转速为160 r/m in。
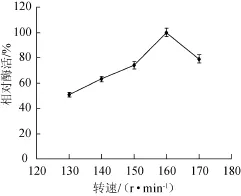
图8 转速对酶活的影响Fig.8 Effec t of rotate speed on enzym e activity
2.1.9装液量对酶活的影响
由图9可知,装液量为100 m L/250 m L时,葡甘聚糖酶相对酶活达到100%;装液量为50~75 m L/250 m L时,相对酶活为70%左右,说明此时溶氧量相对适宜,对菌体产酶有较好的促进作用。装液量为100~175 m L/250 m L时,酶活呈现下降趋势,说明此时溶氧量较少,影响菌株产酶。因此,最适装液量为100 m L/250 m L。
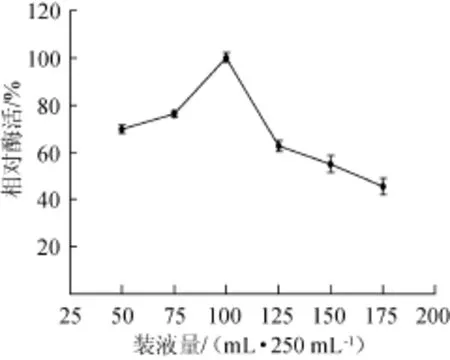
图9 装液量对酶活的影响Fig.9 Effect of liquid volume on enzyme activity
2.1.10接种量对酶活的影响
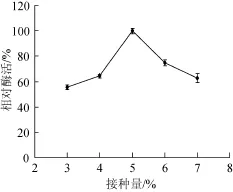
图10 接种量对酶活的影响Fig.10 Effect of inoculum on enzyme activity
由图10可知,当接种量为3%~4%时,葡甘聚糖酶相对酶活较低,均不足60%;接种量为5%时,相对酶活达到100%,之后随着接种量的增加,相对酶活反而下降,由于通气量和营养物质等因素的限制,所以发酵液中的菌体数量不宜过多。因此,最适接种量为5%。
2.2酶的分离纯化
2.2.1硫酸铵盐析曲线
从图11可知,当硫酸铵的饱和度达到45%的时候,沉淀中开始测得葡甘聚糖酶酶活,而上清液中的葡甘聚糖酶酶活开始下降,当硫酸铵的饱和度达到75%的时候,上清液中几乎没有葡甘聚糖酶的活性,而沉淀中的葡甘聚糖酶酶活达到最高,因此可以确定硫酸铵分段盐析沉淀葡甘聚糖酶的范围为45%~75%。

图11 硫酸铵盐析曲线Fig.11 Curve of ammonium sulfate salting-out
2.2.2Sephadex G-100凝胶过滤层析
由图12可知,超滤后的酶液经过Sephadex G-100凝胶过滤层析,出现5个蛋白吸收峰,但经过酶活测定发现,仅在16#~34#管的收集液中有葡甘聚糖酶活性。将收集的葡甘聚糖酶液保存于4℃冰箱中,进行后续酶学性质的研究。

图12 Sephadex G-100凝胶过滤层析Fig.12 Gel filtration chrom atogram of Sephadex G-100
2.2.3酶部分性质
(1)酶最适作用底物
魔芋粉和瓜尔豆胶的主要成分都是葡甘聚糖,但葡甘聚糖含量不同,导致葡甘聚糖酶对其水解程度不同。由图13可知,以葡甘聚糖作用底物时,葡甘聚糖酶相对酶活达到100%,魔芋粉次之为83%,可溶性淀粉作为底物时,相对酶活最低,仅为8%,故葡甘聚糖酶最适作用底物为葡甘聚糖。
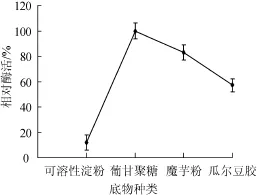
图13 酶最适作用底物Fig.13 The optimum substra te of glucomannanase
(2)相对分子质量
将粗酶液、盐析酶液和纯化后的葡甘聚糖酶取样进行SDS-PAGE电泳。结果如图14所示,根据分子量和相对迁移率的关系,计算出葡甘聚糖酶的分子质量为41.3 ku。

图14 SDS-PAGE电泳图Fig.14 Electrophoretogram of SDS-PAGE
3 结论
本文通过单因素实验,优化了海洋来源的枯草芽孢杆菌Q1的发酵条件,目的是获得更高活性的葡甘聚糖酶,并对葡甘聚糖酶进行分离纯化,研究其部分酶学性质。结果表明,优化发酵条件为:魔芋粉添加量0.75%、牛肉膏与蛋白胨添加量分别为0.2%与0.4%,氯化钠添加量0.4%、培养温度26℃、转速160 r/min、接种量5%、初始pH 7.0、装液量100 m L/250 m L。酶最适作用底物为葡甘聚糖;酶的相对分子质量为41.3 ku。发酵条件经过优化后,测得Q1产葡甘聚糖酶酶活为241.61 U/m L。
[1]RATCLIFFE I,WILLIAMS P A,VIEBKE C,et al.Physicochemical characterization of konjac glucomannan[J].Biomacromolecules,2005,6(4):1977-1986.
[2]钟燕,索化夷.魔芋葡甘聚糖的功能及在食品领域的应用[J].中国酿造,2014,33(8):6-9.
[3]李春松,戴晋军,李彪.酵母细胞壁多糖对免疫功能的作用机制[J].饲料研究,2012(2):22-23.
[4]STEWART K K,EBEL R E.Chemical measurements in biological systems[M].Beijing:W iley-Interscience,2000:32-33.
[5]董桂清.产葡甘聚糖酶菌株的筛选及酶的分离纯化[D].南宁:广西大学硕士论文,2007.
[6]周海燕,杨三东,周大寨,等.发酵生产魔芋葡甘聚糖酶[J].中国生物工程杂志,2005,25(3):65-68.
[7]曲丽娜.β-甘露聚糖酶的发酵优化和性质研究[D].济南:齐鲁工业大学硕士论文,2013.
[8]邬建国,吴风,刘峰,等.乳白耙菌β-葡甘聚糖酶产酶条件优化[J].食品工业科技,2009,37(7):88-90.
[9]王静.β-甘露聚糖酶的制备与分离纯化的研究[D].南京:南京林业大学硕士论文,2012.
[10]廖婷婷,翟磊,高成华,等.一株产甘露聚糖酶菌株的分离鉴定及酶的纯化与性质[J].微生物学报,2011,51(11):1520-1526.
[11]张居作,李志波,徐君飞.产酸性甘露聚糖酶菌株的筛选、鉴定及酶活性研究[J].中国酿造,2014,33(11):63-66.
[12]冯娜,赵君,赵敏.β-甘露聚糖酶产生菌DY-14的发酵条件及分离纯化[J].黑龙江医药,2011(3):397-401.
[13]李江华,房俊,邬显章.黑曲霉酸性β-甘露聚糖酶的摇瓶发酵条件[J].江苏食品与发酵,2002,12(4):16-18.
[14]陈思洋.发酵法生产魔芋葡甘聚糖酶[D].长沙:湖南农业大学硕士论文,2012.
[15]许剑,孙学哲,陈强,等.一株产常温葡甘聚糖酶的芽孢杆菌的分离、鉴定及产酶发酵条件的研究[J].基因组学与应用生物学,2012,31(5):422-429.
[16]周海燕.酶法生产魔芋葡甘低聚糖研究[D].长沙:湖南农业大学硕士论文,2004.
[17]陈一平,龙剑儿,廖连华,等.芽孢杆菌M 50产生β-甘露聚糖酶的条件研究[J].微生物学报,2000,40(1):62-68.
[18]孙子羽,迟乃玉,李兵,等.响应面法优化产低温生淀粉糖化酶发酵培养基[J].中国酿造,2010,29(7):110-114.
[19]吴鹏,王知龙,吴秀.黑曲霉HS-5高产β-葡聚糖酶发酵条件优化[J].中国酿造,2015,34(3):54-57.
[20]熊郃,干信.β-甘露聚糖酶产生菌R10发酵条件研究[J].湖北工学院学报,2004,19(1):17-19.
[21]成莉凤,戴小阳,冯湘沅,等.Bacillus subtilis BE-91生长及其胞外表达β-甘露聚糖酶的发酵条件优化[J].微生物学通报,2015,42(12):2300-2307.
[22]孙倩,陈复生,丁长河,等.地衣芽孢杆菌产碱性蛋白酶发酵条件优化[J].食品工业科技,2012,33(13):174-177.
Optimization of fermentation conditions of high glucomannanase-producing strain Q1 and separation and purification of the enzyme
WANG Qiang1,2,LI Xu3,ZHANG Xujiao1,2,ZHANG Qingfang1,2,DOU Shaohua1,2,JIN Liandou1,2,CHI Naiyu1,2*
(1.College of Life Science and Technology,Dalian University,Dalian 116622,China;2.Liaoning Technology of Marine M icrobiological Engineering Research Center,Dalian 116622,China;3.Dalian Productivity Promote Center,Dalian 116025,China)
Using Bacillus subtilis Q1 from marine as original strain,the fermentation conditions of the glucomannanase-producing strain Q1 were optim ized by single factor experiments.The glucomannanase from the supernatant liquor was purified using ammonium sulfate precipitation,dialysis,ultrafiltration and gel filtration chromatogram of Sephadex G-100,and its enzymatic properties were researched.The results showed that the optimum fermentation conditions were as follows:konjaku flour 0.75%,beef extract 0.2%,peptone 0.4%,sodium chloride 0.4%,culture temperature 26℃,rotate speed 160 r/m in,inoculum 5%,initial pH 7.0,liquid volume 100 m l/250 m l.Under the conditions,the enzyme activity was up to 241.61 U/m l. The relative molecular mass of the glucomannanase was determ ined to be 41.3 ku.The optimum substrate of the enzyme was glucomannan.
glucomannanase;fermentation conditions;optim ization;separation and purification
TQ925
0254-5071(2016)05-0086-06
10.11882/j.issn.0254-5071.2016.05.018
2016-02-23
国家高技术研究发展计划‘863计划’项目(2007AA021306)
王强(1990-),女,硕士研究生,研究方向为微生物酶制剂研究。
迟乃玉(1965-),男,教授,博士,研究方向为微生物酶制剂研究。

