miR-497靶向Bcl-2调控肝癌细胞增殖及凋亡的研究
张猛 张全 谭雨莎
miR-497靶向Bcl-2调控肝癌细胞增殖及凋亡的研究
张猛张全谭雨莎
目的:探讨miR-497靶向Bcl-2对肝癌细胞增殖、凋亡的调控作用。方法:选取肝癌组织及相应远癌正常组织,分别采用逆转录PCR(reverse transcriptton PCR,RT-PCR)、Western blot检测组织中miR-497及Bcl-2蛋白表达;选取肝癌细胞系HepG2,分别转染miR-497 mimics及对照寡核苷酸,采用RT-PCR、Western blot检测组织中miR-497及Bcl-2蛋白表达,采用MTT法检测各组细胞增殖活性,采用流式细胞仪检测各组细胞凋亡,采用双荧光素酶报告基因检测细胞荧光酶活性。结果:1)与远癌正常组织相比,肝癌组织中miR-497表达明显降低(P<0.05),Bcl-2蛋白表达明显增高(P<0.05);2)与转染对照寡核苷酸相比,转染miR-497可使HepG2中miR-497表达增高(P<0.05),Bcl-2蛋白表达降低(P<0.05);3)与转染对照寡核苷酸相比,共转染miR-497与Bcl-2-WT可使HepG2荧光素酶活性降低(P<0.05);4)转染miR-497后,HepG2增殖活性较转染对照寡核苷酸明显降低(P<0.05),而转染miR-497+Bcl-2后,HepG2增殖活性较单纯转染miR-497明显提高(P<0.05);5)转染miR-497后,HepG2总凋亡比例较转染对照寡核苷酸明显增高(P<0.05);而转染miR-497+Bcl-2后,HepG2总凋亡比例较单纯转染miR-497明显降低(P<0.05)。结论:miR-497可通过靶向Bcl-2抑制肝癌细胞增殖同时促进细胞凋亡。
miR-497Bcl-2肝癌细胞增殖细胞凋亡
肝癌是临床常见恶性肿瘤,致死率较高[1]。由于难以早期发现,故仅有少部分患者可行手术治疗[2-3]。放化疗是晚期肝癌常用的辅助治疗手段,但不良反应较大,且无法获得长期生存。因此,寻求更安全、高效的治疗方案是临床亟待解决的问题。微小RNA(miRNA)属于内源性非编码小分子RNA,其可通过5'-种子区与调控一个或多个靶基因mRNA的3'-非翻译区(3'-untranslated region,3'-UTR)碱基互补配对,从而调控靶基因表达,进而起到类似抑癌或促癌基因的作用[4]。miR-497定位于人类17p13.1,是近年来研究较广泛的miRNA[5]。有研究证实,miR-497可能在肝癌进程中起到类似抑癌基因的作用,而靶向Bcl-w可能是其调控肝癌细胞增殖活性的主要机制[6]。但miR-497是否还可通过靶向其他下游靶基因参与肝癌的发生发展仍不明确。本研究通过检测miR-497及其下游潜在靶点Bcl-2在肝癌组织及肝癌细胞系HepG2中的表达,分析miR-497靶向Bcl-2对肝癌细胞增殖及凋亡的调控作用及分子机制,旨在为肝癌的临床治疗提供新思路。
1 材料与方法
1.1材料
1.1.1试剂RNA提取试剂盒、PCR试剂盒、质粒提取试剂盒、LipofectamineTM2000转染试剂盒、反转录试剂盒(均购于美国ABI公司);miR-497 mimics、对照寡核苷酸、Bcl-2 3'-UTR质粒(均购于美国Invitrogen公司);MTT、链霉素、青霉素(均购于美国Sigma公司);相关抗体(购于大连Santa Cruz公司);ECL化学发光试剂盒、BCA蛋白浓度测定试剂盒(购于上海碧云天生物技术有限公司);miR-497、U6引物(由上海生工生物工程有限公司合成);无水乙醇等试剂均为国产分析纯。
1.1.2细胞及标本肝癌细胞系HepG2(购于美国ATCC细胞库);选取河北大学附属医院50例肝癌组织及远癌正常组织,均为手术切除的新鲜样本,并经病理学检测证实为原发性肝细胞癌,所有患者术前均未接受过化疗。本研究获得患者知情同意且得到医院伦理委员会批准。
1.2方法
1.2.1细胞培养常规复苏HepG2,用DMEM培养液(10%胎牛血清+1%双抗)重悬浮细胞,并置于恒温培养箱(37℃、5%CO2)中培养,每天换液1次,收集对数生长期细胞,提取细胞总RNA及总蛋白待后续实验。
1.2.2细胞转染用DMEM培养液(10%胎牛血清+1%双抗)将上述对数生长期的HepG2细胞密度调节至2× 105cells/well,并接种于6孔板中,1 mL/孔,将细胞置于恒温培养箱(37℃、5%CO2)中培养24 h;将细胞随机分为对照寡核苷酸组、miR-497 mimics组及miR-497 mimics+Bcl-2组,利用LipofectamineTM2000分别转染miR-497 mimics(50 nmol/L)、对照寡核苷酸(50 nmol/L)及Bcl-2表达质粒(50 nmol/L);转染后将细胞置于恒温培养箱(37℃、5%CO2)中继续培养48 h;常规收集细胞总RNA及总蛋白待后续实验。
1.2.3双荧光素酶报告基因检测分别构建含有野生型Bcl-2 3'-UTR序列的荧光素酶报告基因质粒(Bcl-2-WT)和含有突变型Bcl-2 3'-UTR序列的荧光素酶报告基因质粒(Bcl-2-Mut)。收集对数生长期的HepG2,调节细胞密度至2×105cells/well,并接种于24孔板中,将Bcl-2-WT质粒、Bcl-2-Mut质粒与miR-497 mimics或对照寡核苷酸共转染至HepG2,每组设3个复孔,将细胞置于置于恒温培养箱(37℃、5% CO2)中继续培养48 h;以海肾质粒荧光值作为内参,检测各组细胞荧光素酶活性。
1.2.4MTT法检测细胞增殖转染结束后将细胞置于恒温培养箱(37℃、5%CO2)中继续培养4 h,培养结束后,800 r/min离心10 min,弃上清每孔加入MTT溶液(5 mg/mL)20 μL,继续置于恒温培养箱(37℃、5%CO2)培养4 h,后吸弃孔内培养上清液,加入DMSO (100 μL/孔),振荡10 min,使结晶物充分溶解,采用全自动酶标仪测测OD490nm吸光值。
1.2.5流式细胞仪检测细胞凋亡转染结束后将细胞置于恒温培养箱(37℃、5%CO2)中继续培养48 h,采用凋亡试剂盒(Annexin-V/PI)进行避光染色,1 h后上流式细胞仪检测细胞凋亡情况。细胞总凋亡=早期凋亡细胞(Annexin-V+/PI-)+晚期凋亡细胞(Annexin-V+/PI+)。
1.2.6实时定量荧光(Real-time PCR)检测miR-497表达收集HepG2、肝癌组织标本及远癌正常组织样本,参照Trizol试剂盒说明书提取细胞或组织中的总RNA,利用反转录试剂盒逆转录总RNA至cDNA,取逆转录产物加入SYBR Green法行RT-PCR,以U6为内参,引物序列见表1。
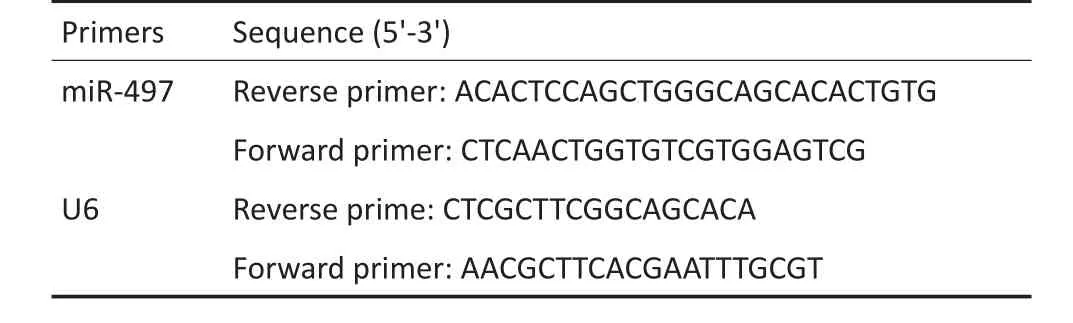
表1 引物序列Table 1 Primer sequence
1.2.7Western blot法检测Bcl-2蛋白表达常规提取细胞/组织蛋白,BCA蛋白定量试剂盒检测样品蛋白浓度,取适量样品行SDS-PAGE凝胶电泳,转至硝酸纤维膜,5%封闭液4℃封闭4 h,后依次加入一抗(1:2 000)、二抗(1:500)孵育,按ECL试剂盒说明书行电化学发光检测。
1.3统计学分析
2 结果
2.1肝癌组织及远癌正常组织中miR-497、Bcl-2表达及相关性分析
RT-PCR检测结果显示,肝癌组织中miR-497表达显著低于远癌正常组织(P<0.05,图1)。Western blot检测结果显示,肝癌组织中Bcl-2蛋白表达显著高于远癌正常组织(P<0.05,图2)。Pearson相关性分析结果显示,肝癌组织中miR-497与Bcl-2蛋白表达呈负相关(r=-0.315,P=0.018)。
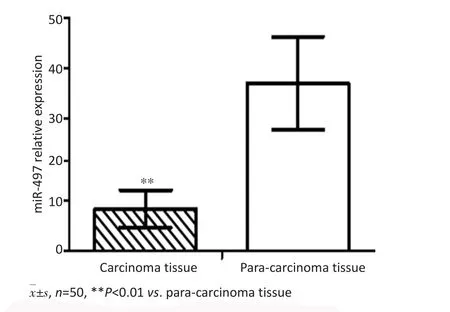
图1 肝癌组织及远癌正常组织中miR-497表达Figure 1 Expression of miR-497 in liver carcinoma tissue and para-carcinoma tissue
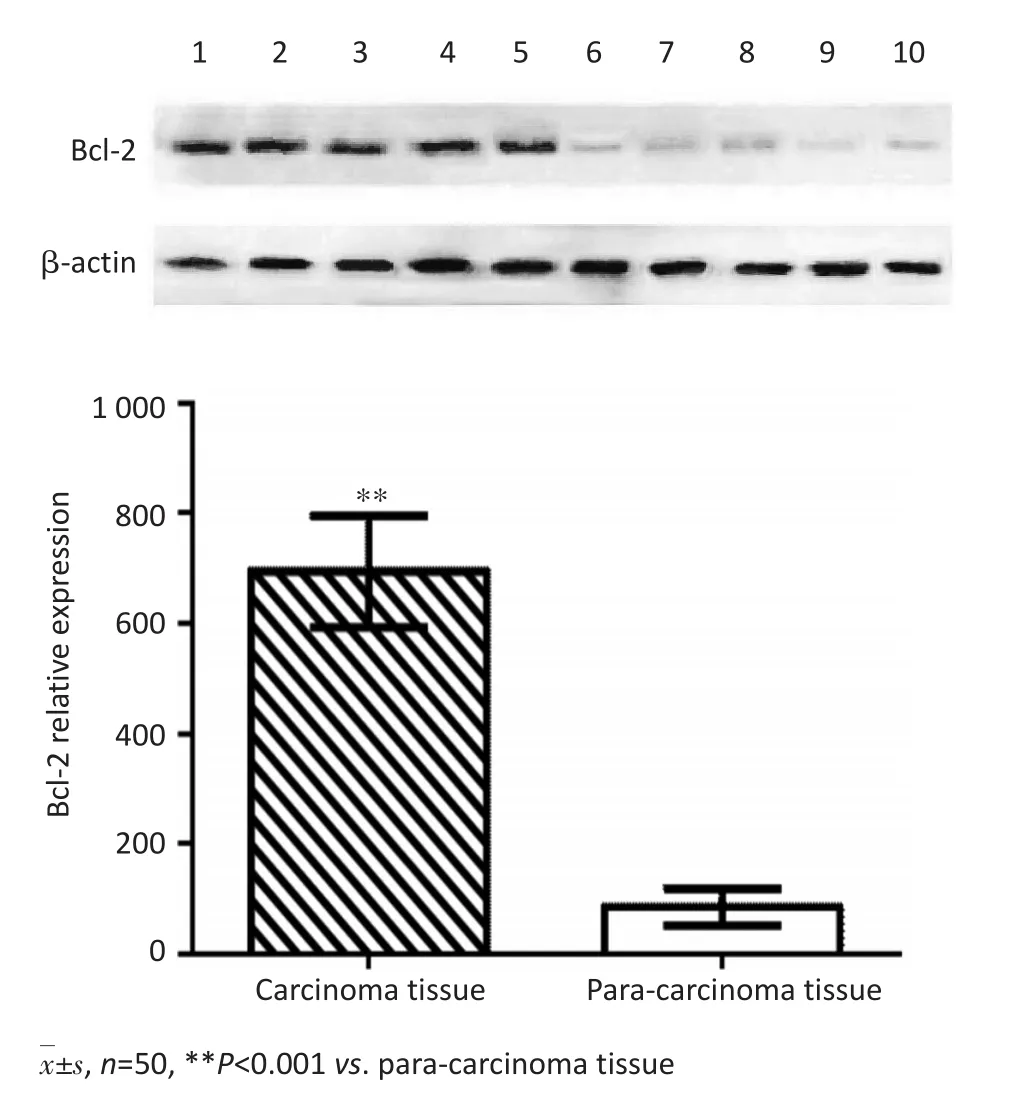
图2 肝癌组织及远癌正常组织中Bcl-2蛋白表达Figure 2 Protein expression of Bcl-2 in liver carcinoma tissue and paracarcinoma tissue
2.2转染miR-497 mimics对HepG2中miR-497、Bcl-2表达的影响
逆转录PCR(reverse transcription PCR,RT-PCR)检测结果显示,与转染对照寡核苷酸相比较,转染miR-497 mimics可使HepG2中miR-497表达增高(P<0.05,图3)。Western blot检测结果显示,与转染对照寡核苷酸相比较,转染miR-497 mimics可使HepG2中Bcl-2表达降低(P<0.05,图4)。
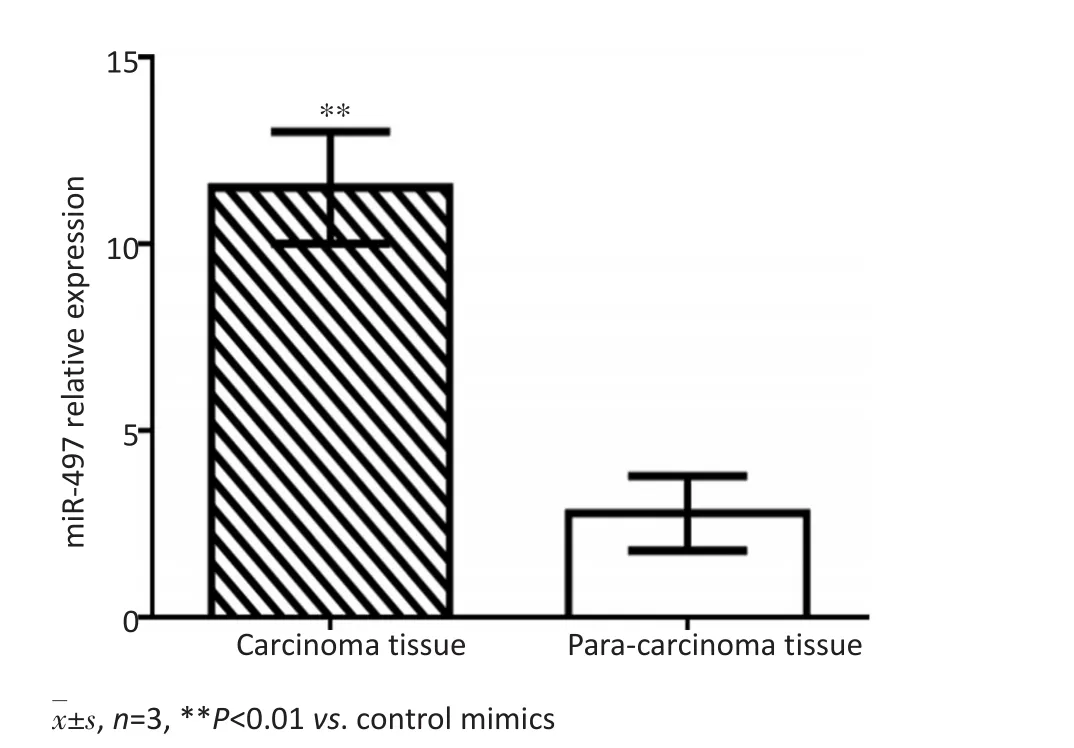
图3 转染miR-497mimics对HepG2中miR-497表达的影响Figure 3 Expression of miR-497 in HepG2 after transfection with miR-497 mimics
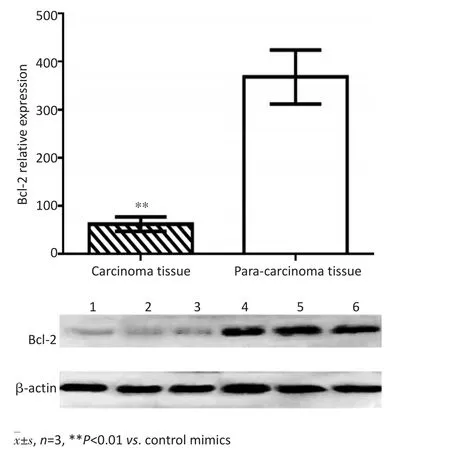
图4 转染miR-497mimics对HepG2中Bcl-2蛋白表达的影响Figure 4 Protein expression of Bcl-2 in HepG2 after transfection with miR-497 mimics
2.3miR-497对Bcl-2 3'-UTR的靶向作用
双荧光素酶活性实验结果显示,共转染miR-497 mimics与Bcl-2 3'-UTR野生质粒后,HepG2荧光素酶活性较转染control miRNA组显著降低(P<0.05);共转染miR-497mimics与Bcl-2 3'-UTR突变质粒后,HepG2荧光素酶活性无显著性差异(P>0.05)(图5)。
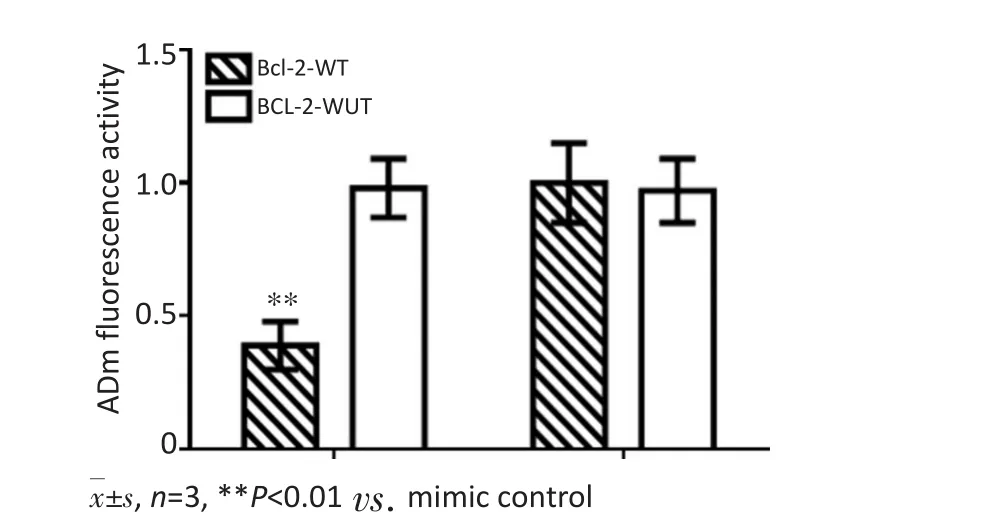
图5 HepG2中miR-497与Bcl-2 3'-UTR结合情况Figure 5 Combination condition of miR-497 and Bcl-2 3′-UTR in HepG2
2.4转染miR-497 mimics、Bcl-2对HepG2增殖活性的影响
MTT法检测结果显示,转染miR-497 mimics后24、48、72 h后HepG2增殖活性较转染对照寡核苷酸显著降低(P<0.05);而共转染miR-497 mimics、Bcl-2后,HepG2增殖活性较单纯转染miR-497 mimics显著提高(P<0.05),但仍显著低于转染对照寡核苷酸组(P<0.05)(图6)。
2.5转染miR-497 mimics、Bcl-2对HepG2凋亡的影响
转染miR-497 mimics后HepG2早期凋亡细胞比例、晚期凋亡细胞比较及总凋亡细胞比例均显著高于转染对照寡核苷酸(P<0.05)。而共转染miR-497 mimics+Bcl-2后,HepG2早期凋亡细胞比例、晚期凋亡细胞比较及总凋亡细胞比例较单纯转染miR-497 mimics均显著降低(P<0.05),但仍显著高于转染对照寡核苷酸组(P<0.05)(表2)。
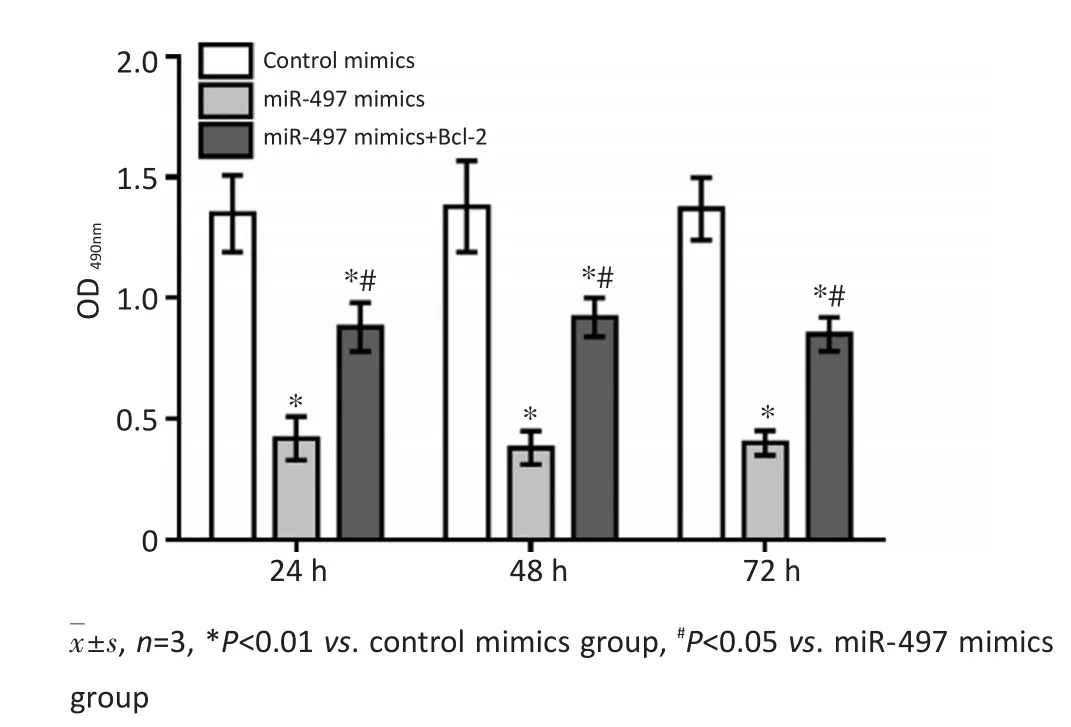
图6 转染miR-497、Bcl-2对HepG2增殖活性的影响Figure 6 Effect of transfection miR-497 and Bcl-2 on the proliferation of HepG2
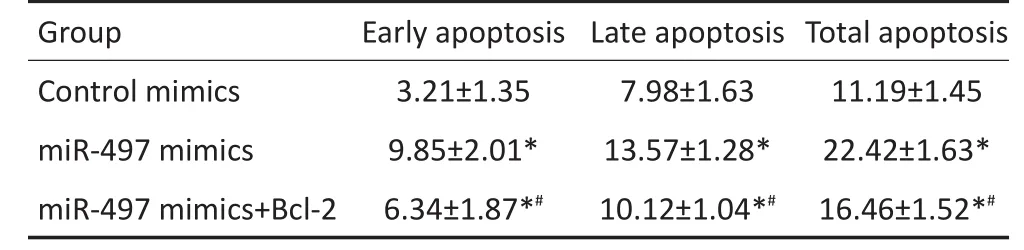
表2 转染miR-497、Bcl-2对细胞凋亡的影响 (%)Table 2 Effect of transfection miR-497 and Bcl-2 on cell apoptosis(%)
3 讨论
miRNA属于高度保守的非编码小分子单链RNA,并广泛存在于真核生物中。正常生理状态下,机体内miRNA表达遵守严格的组织、时序特异性;但在肿瘤环境下,不同miRNA则表现出不同的生物学活性,并起到类似癌基因或抑癌基因的作用[7]。miR-497在多种恶性肿瘤中均表达缺失或下调,如结肠癌[8]、胃癌[9]、宫颈癌[10]、骨肉瘤[11]及脑胶质瘤[12]等,而过表达miR-497则可使上述恶性肿瘤细胞增殖能力得到抑制,提示miR-497在恶性肿瘤发生与发展过程中发挥着抑癌基因的功能。本研究结果显示,肝癌组织中miR-497表达显著低于远癌正常组织(P<0.05),与丁文周等[13]研究结果一致;而转染miR-497 mimics可使肝癌细胞HepG2中miR-497表达上调,同时明显抑制肝癌细胞HepG2增殖活性,提示miR-497在肝癌中同样起着类似抑癌基因的作用。
原癌基因Bcl-2定位于18q21,长约230 kb,含2个内含子和3个外显子,主要存在于细胞核膜、线粒体及内质网膜中。Bcl-2可通过调节胞内Ca2+浓度、与bax结合形成异构二聚体、活化R-ras信号通路等多种途径发挥抑凋亡作用,从而参与恶性肿瘤细胞的生长与演变。研究证实,Bcl-2在宫颈癌[14]、乳腺癌[15]等恶性肿瘤组织中高表达,且其高表达水平与肿瘤分化程度、淋巴转移及临床预后密切相关。本研究结果显示,肝癌组织中Bcl-2蛋白表达显著高于远癌正常组织(P<0.05);转染miR-497 mimics可使HepG2中Bcl-2蛋白表达降低,Pearson相关性分析结果进一步提示HepG2中miR-497表达与Bcl-2表达呈负相关(P<0.05),而这种相关性很可能是由miR-497负向调控Bcl-2表达所致。双荧光素酶活性检测显示,miR-497可与Bcl-2 3'-UTR特异性结合,从而降低细胞荧光酶活性,进一步印证上述研究提出的miR-497靶向Bcl-2的观点。
细胞增殖活性检测及凋亡测定结果显示,转染miR-497可使HepG2增殖活性降低、细胞凋亡比例增加,而共转染miR-497及Bcl-2则可实现miR-497对HepG2增殖抑制作用及凋亡促进作用的部分逆转,提示miR-497可通过靶向Bcl-2调控HepG2增殖及凋亡。但值得注意的是,转染Bcl-2无法完全逆转miR-497对HepG2增殖及凋亡的调控作用。其原因可能与miR-497靶向基因众多有关,目前已知的miR-497下游靶基因包括CCNEl、Bcl-w等,由于miR-497可能通过同时靶向多个下游靶基因发挥作用,故仅研究其Bcl-2靶向作用并无法完全阐述其对肝癌细胞增殖、凋亡的调控机制。
综上所述,miR-497与Bcl-2存在靶向关系,miR-497可通过靶向调控Bcl-2表达抑制肝癌细胞增殖,同时促进其凋亡。此外,miR-497还可能通过靶向其他下游基因参与肝癌的发生与演变过程。
[1]European association for the study of the liver.EASL-EORTC clinical practice guidelines:management of hepatocellular carcinoma[J].J Hepatol,2012,56(4):908-943.
[2] Raza A,Sood GK.Hepatocellular carcinoma review:current treatment,and evidence-based medicine[J].World J Gastroenterol,2014,20(15):4115-4127.
[3]Klein J,Dawson LA.Hepatocellular carcinoma radiation therapy:review of evidence and future opportunities[J].Int J Radiat Oncol Biol Phys,2013,87(1):22-32.
[4] Lorio MV,Croce CM.microRNA dysregulation in cancer:diagnostics,monitoring and therapeutics.A comprehensive review[J].EMBO J,2012,4(3):143-159.
[5]Furuta M,Kozaki K,Tanimoto K,et al.The tumor-suppressive miR-497-195 cluster targets multiple cell-cycle regulators in hepatocellular carcinoma[J].PloS one,2013,8(3):e60155.
[6] Xie HB,Sun JJ,Xia YZ.microRNA-497 expression in hepatocellular carcinoma and its significance[J].Chin J Gen Surg,2013,22(7):895-899.[解寒冰,孙建军,夏云展.microRNA-497在肝细胞癌中的表达及意义[J].中国普通外科杂志,2013,22(7):895-899.]
[7] Xu X,Yang X,Xing C,et al.miRNA:The nemesis of gastric cancer (Review)[J].Oncol Lett,2013,6(3):631-641.
[8]Wang XQ,Shi QL,Wang JD,et al.Study on expression and clinicopathologic characteristics of miR-195 and miR-497 in colorectal cancers[J].J Med Postgra,2012,25(11):1163-1167.[王雪晴,石群立,王建东,等.结直肠癌组织中miR-195和miR-497的表达差异及临床病理学意义[J].医学研究生学报,2012,25(11):1163-1167.]
[9]Sun YF,Zhou JP.Expression of MicroRNA-497 in Gastric Cancer and Its Biological Signifi cance[J].Chin J Bass Clin General Surg,2014,5 (1):22-23.[孙叶飞,周建平.胃癌组织中miR-497表达及其生物学意义[J].中国普外基础与临床杂志,2014,5(1):22-23.]
[10]Luo M,Shen D,Zhou X,et al.microRNA-497 is a potential prognostic marker in human cervical cancer and functions as a tumor suppressor by targeting the insulin-like growth factor 1 receptor[J]. Surgery,2013,153(6):836-847.
[11]Shao X,Miao M,Xue J,et al.The down-regulation of microRNA-497 contributes to cell growth and cisplatin resistance through PI3K/ Akt pathway in osteosarcoma[J].Cell Physiol Biochem 2015,36(5): 2051-2062.
[12]Lan J,Xue Y,Chen H,et al.Hypoxia-induced miR-497 decreases glioma cell sensitivity to TMZ by inhibiting apoptosis[J].FEBS Lett,2014,588(18):3333-3339.
[13]Ding WZ,Lu YT,Tan LW,et al.miR-497 Reduces invasion and migration of hepatocellular carcinoma[J].Acta Univ Med NJ,2015,7(2): 14-15.[丁文周,卢叶挺,谭龙威,等.miR-497抑制肝癌细胞的侵袭与转移[J].南京医科大学学报,2015,7(2):14-15.]
[14]Zhu Y,Yang QC,Liu HB,et al.Expression and Significance of Osteopontin,survivin and bcl-2 in Cervical Neoplasms[J].Cancer Res Prev Treat,2013,40(1):83-86.[朱燕,杨其昌,刘宏斌,等.骨桥蛋白,survivin及bcl-2在宫颈病变中的表达及临床意义[J].肿瘤防治研究,2013,40(1):83-86.]
[15]Nadler Y,Camp RL,Giltnane JM,et al.Expression patterns and prognostic value of Bag-1 and Bcl-2 in breast cancer[J].Breast Cancer Res,2008,10(2):1-12.
(2016-04-05收稿)
(2016-08-11修回)
(编辑:武斌校对:杨红欣)

张猛专业方向为肝胆胰脾疾病的治疗。
E-mail:soulsinger@126.com
miR-497 regulates cell proliferation and apoptosis by targeting Bcl-2 in liver cancer cells
Meng ZHANG,Quan ZHANG,Yusha TAN
Correspondence to:Quan ZHANG;E-mail:soulsinger@126.com
Department of Hepatobiliary Surgery of Affiliated Hospital of Hebei University,Baoding 071000,China
Objective:To evaluate the effect of miR-497 on regulating cell proliferation and apoptosis by targeting Bcl-2 in liver cancer cells. Methods:We tested liver cancer tissue and para-carcinoma tissue and used RT-PCR or Western blot to detect the expression of miR-497and Bcl-2 protein.We also tested the liver cancer cell HepG2 transfected with miR-497 mimics and mimic control.The expressions of miR-497and Bcl-2 protein were detected by RT-PCR or Western blot.Cell proliferation activity was detected by the MTT method,cell apoptosis was detected by flow cytometry,and cell luciferase activity was detected by the dual-luciferase reporter gene experiment.Results:1)Compared with para-carcinoma tissue,the miR-497 expression of liver cancer tissue significantly decreased(P<0.05),whereas the Bcl-2 protein expression of liver cancer tissue significantly increased(P<0.05).2)Compared with transfection mimic control,transfection miR-497 mimics couldincreasethemiR-497expressionof liver cancer cell HepG2(P<0.05)anddecreasetheBcl-2proteinexpressionof liver cancer cell HepG2 (P<0.05).3)Compared with transfection mimic control,co-transfection with miR-497 mimics and Bcl-2-WT could significantly decrease the luciferase activity of liver cancer cell HepG2(P<0.05).4)Compared with transfection mimic control,the proliferative activity of liver cancer cell HepG2 significantly decreased after transfection with miR-497 mimics(P<0.05).Compared with transfection miR-497 mimics,the proliferative activity of liver cancer cell HepG2 significantly increased after transfection with miR-497 mimics+Bcl-2(P<0.05).5)Compared with transfection mimic control,the total apoptosis rate of liver cancer cell HepG2 significantly increased after transfection with miR-497 mimics(P<0.05).Compared with transfection miR-497 mimics,the total apoptosis rate of liver cancer cell HepG2 significantly decreased after transfection with miR-497 mimics+Bcl-2(P<0.05).Conclusion:In liver cancer cells,miR-497 could target Bcl-2 to inhibit cell proliferation and enhance cell apoptosis.
miR-497,Bcl-2,liver cancer,cell proliferation,cell apoptosis
10.3969/j.issn.1000-8179.2016.16.381
河北大学附属医院肝胆外科(河北省保定市071000)
张全soulsinger@126.com

